La trombocitopenia inmune (PTI) es una entidad relativamente frecuente en pediatría. Aunque su evolución suele ser favorable en la mayoría de los casos, el manejo de aquellos pacientes en los que la enfermedad persiste es muy controvertido. Este artículo pretende, a través de una revisión de la literatura más reciente, responder a aspectos relacionados con el tratamiento de la PTI persistente, crónica y refractaria durante la infancia, haciendo especial énfasis en el papel del rituximab, la esplenectomía y los análogos de la trombopoyetina (ar-TPO) en la infancia. La aparición de los ar-TPO (eltrombopag y romiplostim) amplía el arsenal terapéutico de la PTI pediátrica. Además, tras haber demostrado un perfil de seguridad adecuado en ensayos clínicos, retrasa la indicación de esplenectomía o el uso de tratamientos asociados a mayor riesgo de complicaciones, como rituximab. No obstante, se recomienda que su manejo sea supervisado por centros con experiencia de cara a monitorizar complicaciones potenciales a medio y largo plazo ya descritas en el paciente adulto.
Immune thrombocytopenia (ITP) is a relatively common disorder in childhood. Although it usually achieves spontaneous remission at this age, the management of persistent or chronic ITP in children is still controversial. The aim of this article is to address current controversies related to the treatment of persistent, chronic, and refractory ITP in children, including the role of rituximab and splenectomy, as well as focusing on a new approach with thrombopoietin receptor agonists (TPO-RAs). Eltrombopag and romiplostim are safe and useful drugs for paediatric ITP. These two TPO-RAs might delay surgery and other treatments such as rituximab. However, the potential side effects described in adult patients should be considered. Paediatric patients with refractory ITP, undergoing new treatments, should be supervised in specialised centres.
La trombocitopenia inmune (PTI) es un trastorno autoinmune adquirido caracterizado por una trombocitopenia aislada secundaria a la presencia de anticuerpos antiplaquetarios. A diferencia del adulto, la mayoría de los pacientes pediátricos presenta un curso clínico favorable, con poca tendencia al sangrado y una evolución limitada en el tiempo. Sin embargo, la enfermedad puede persistir hasta en un 20% de los pacientes. Para diferenciarlos según el tiempo de evolución, la PTI se clasifica como de reciente diagnóstico (menos de 3 meses de evolución), persistente (de 3 a 12 meses) o crónica (más de 12 meses)1.
A pesar de que la PTI es una entidad relativamente frecuente en pediatría, las guías de recomendaciones diagnósticas y terapéuticas publicadas hasta el momento1-3 no son capaces de aportar luz sobre la actitud más adecuada en algunos puntos del tratamiento. De todos, los más controvertidos son los referentes al manejo de pacientes con una PTI persistente o crónica y los de aquellos niños refractarios a los tratamientos de primera línea (independientemente del tiempo de evolución).
La aparición de nuevos fármacos con indicación en edad pediátrica ha motivado la redacción de este artículo, que pretende abordar diversos aspectos relacionados con el tratamiento de la PTI persistente, crónica y refractaria al tratamiento durante la infancia, así como la posición de estas nuevas moléculas en el algoritmo terapéutico.
¿Cuál es la definición y el abordaje diagnóstico de la trombocitopenia inmune persistente, crónica y refractaria en Pediatría?La PTI se define como persistente cuando la trombocitopenia se prolonga entre los 3 y los 12 meses tras el diagnóstico inicial2,4. Sin embargo, no existe un consenso tan claro para definir la PTI refractaria. En adultos se considera como refractario al paciente que no responde o recae tras la esplenectomía, un concepto que no es aplicable a la población pediátrica puesto que, en muchos casos, la cirugía no es una opción terapéutica de segunda línea5. Por lo tanto, se propone ampliar esta definición a aquellos casos de niños con clínica hemorrágica que no respondan a los tratamientos de primera línea o a aquellos en los que, sin presentar sangrados relevantes, el objetivo principal del tratamiento sea mejorar su calidad de vida.
En ambos casos es importante destacar que, independientemente de que el paciente haya alcanzado o no la remisión espontánea en algún momento, todavía existe una alta probabilidad de que lo haga antes del año tras el diagnóstico6. Su importancia radica en que la aproximación terapéutica de estos pacientes deberá evitar, en la medida de lo posible, tratamientos quirúrgicos (esplenectomía) o asociados a mayor número de complicaciones, como la inmunodeficiencia secundaria asociada a rituximab.
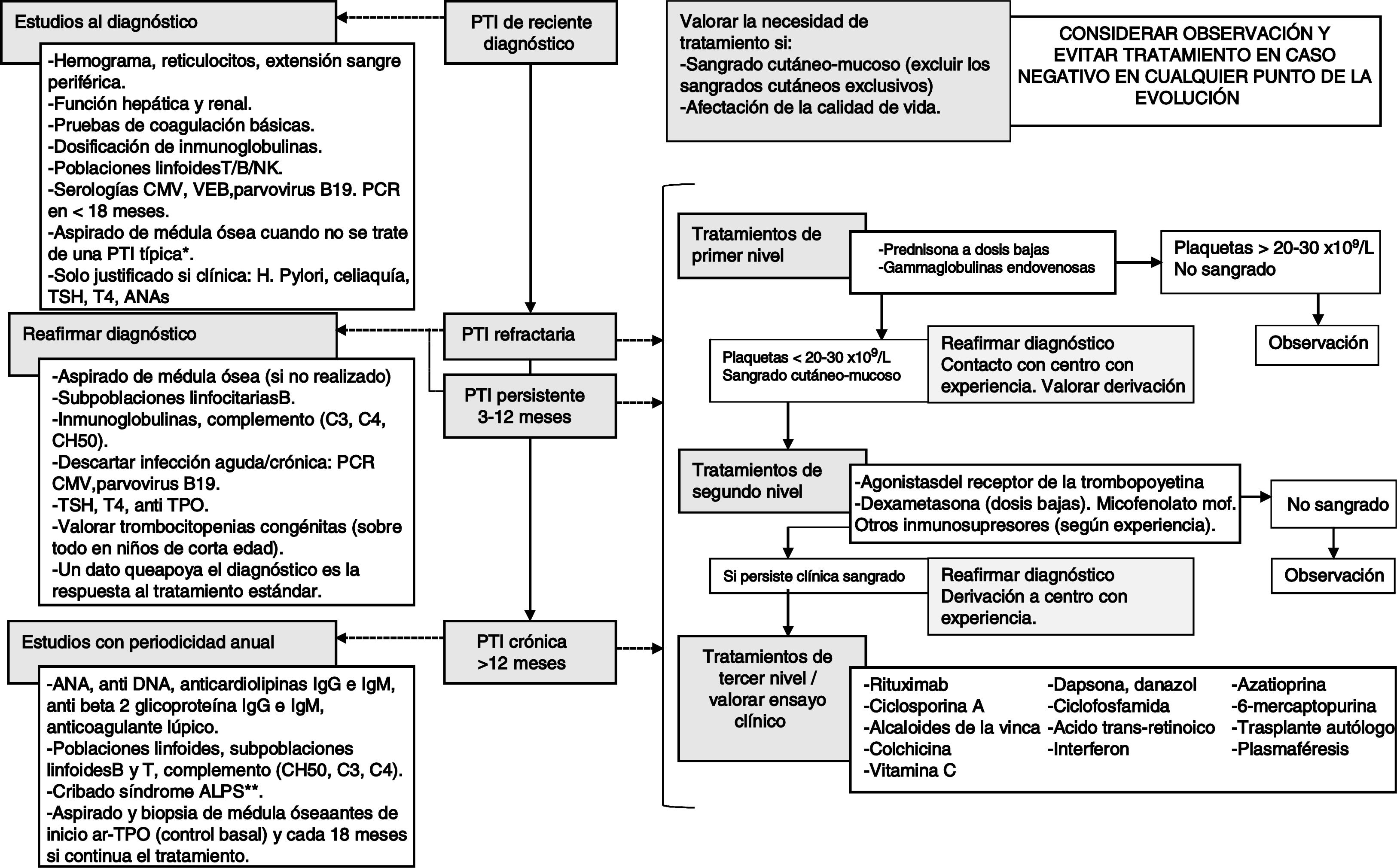
Sin embargo, antes de establecer un plan terapéutico en este grupo de pacientes es obligatorio que confirmemos el diagnóstico5 (fig. 1). En niños menores de un año no debemos olvidar la posibilidad de que nos encontremos ante una trombocitopenia congénita o una PTI secundaria a una inmunodeficiencia de base. Una historia de infecciones de repetición o la coexistencia de otras citopenias inmunes ha de hacer sospechar una inmunodeficiencia primaria, por lo que se recomienda la valoración realizada por un inmunólogo clínico. También es importante recordar que la PTI puede ser secundaria a otras enfermedades autoinmunes. Así, debemos descartar el lupus eritematoso sistémico, el síndrome antifosfolípido y otras enfermedades autoinmunes del tejido conectivo en todos aquellos pacientes que presenten una clínica sugestiva (en cualquier momento de la evolución) y una vez al año, como mínimo, en todos aquellos pacientes afectos de una PTI crónica (en especial en adolescentes de sexo femenino o con una evolución tórpida)1,3.
Actitud diagnóstica y terapéutica ante el diagnóstico de una PTI no candidato a esplenectomía (o refractario al tratamiento quirúrgico).
CMV: citomegalovirus, VEB: virus Epstein Barr.
*PTI típica: paciente de 1 a 10 años, con sintomatología de aparición brusca, afebril, con un antecedente infeccioso o vacunación en las 2 semanas previas que presenta una trombocitopenia aislada en ausencia de otros hallazgos en la exploración física diferentes a la clínica hemorrágica.
**ALPS: síndrome linfoproliferativo autoinmune. Solo es necesario descartarlo en una ocasión mediante el estudio de doble población T CD4/CD8 negativa.
En un paciente pediátrico afecto de PTI, ya sea de reciente diagnóstico, persistente, crónica o refractaria, lo más importante antes de iniciar un tratamiento es valorar si la clínica hemorrágica lo justifica. Así, este debería reservarse únicamente para aquellos casos que presenten un sangrado activo (sin que las hemorragias exclusivamente cutáneas sean consideradas como tal). Por otro lado, la prevención del sangrado en un paciente asintomático únicamente estaría justificada ante intervenciones quirúrgicas, o si el facultativo considerara que existe un riesgo hemorrágico real secundario a la actividad física del niño. Otros datos como las circunstancias familiares que rodean al paciente (ansiedad en los progenitores o su estatus social, entre otros) o la calidad de vida del paciente también pueden tenerse en cuenta a la hora de plantear una intención terapéutica, buscando siempre equilibrar los beneficios del tratamiento con sus potenciales efectos secundarios7.
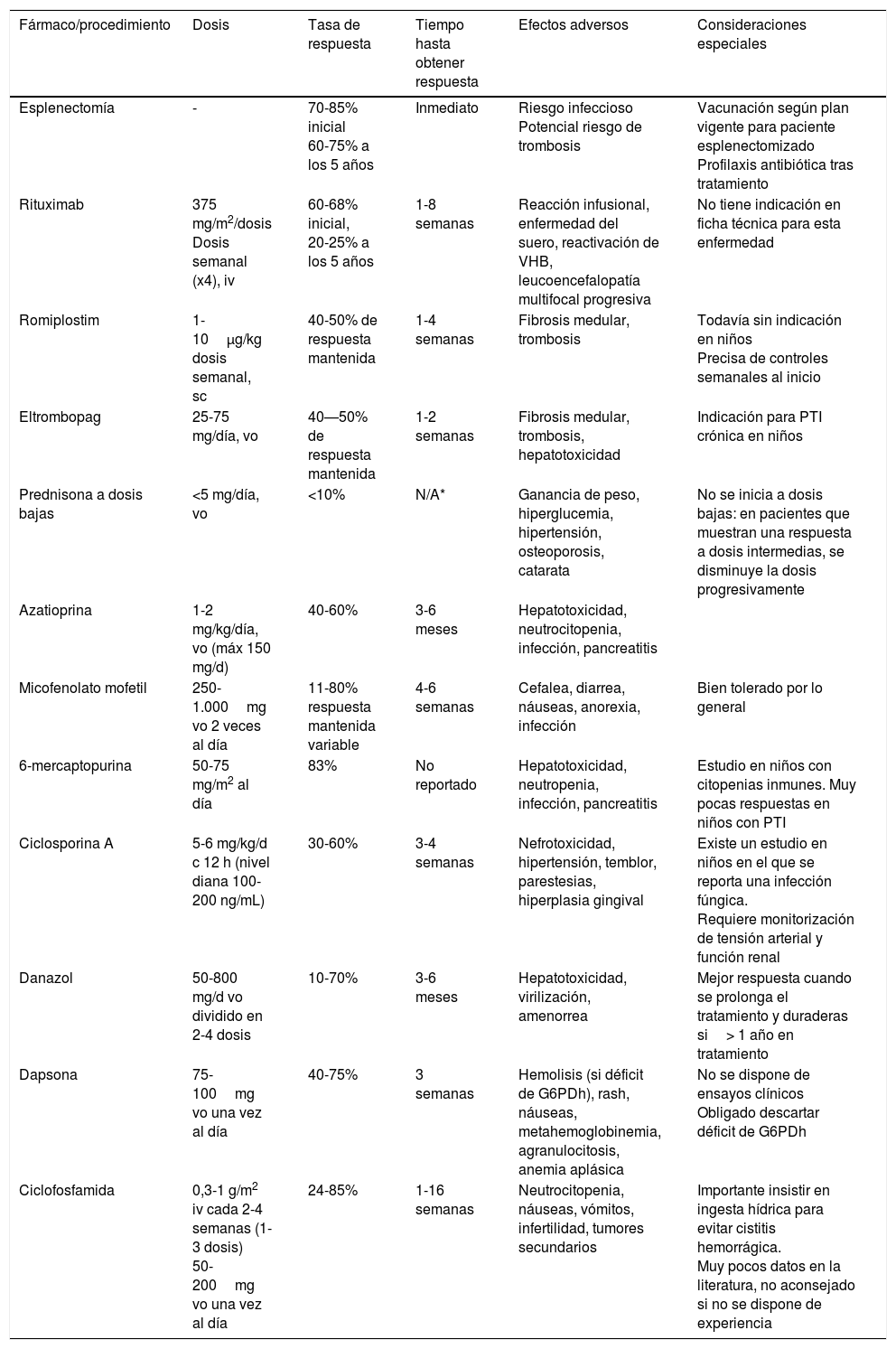
Si tras la valoración del paciente hay indicación de tratar, la administración de fármacos de primera línea (gammaglobulinas y prednisona) continúa siendo la primera opción terapéutica, evitando administrar corticoides durante periodos superiores a 7-10 días. Tampoco se aconseja la inmunoglobulina anti-D en virtud de los casos de anemia hemolítica grave descritos tras su uso1. Por lo tanto, los fármacos de segunda línea se deben limitar a aquellos pacientes no respondedores, o cuando se necesita prolongar el tratamiento esteroideo para mantener una respuesta adecuada3,4. Aquí se incluyen los inmunosupresores, el rituximab, los agonistas del receptor de la trombopoyetina (ar-TPO) y la esplenectomía. La tabla 1 resume los principales tratamientos utilizados en la PTI persistente y refractaria, así como las dosis utilizadas y su tasa de respuesta. Por otro lado, la figura 1 también resume los tres niveles de tratamiento médico que se recomendarían en la PTI5.
Principales tratamientos y procedimientos utilizados en la PTI persistente y refractaria
| Fármaco/procedimiento | Dosis | Tasa de respuesta | Tiempo hasta obtener respuesta | Efectos adversos | Consideraciones especiales |
|---|---|---|---|---|---|
| Esplenectomía | - | 70-85% inicial 60-75% a los 5 años | Inmediato | Riesgo infeccioso Potencial riesgo de trombosis | Vacunación según plan vigente para paciente esplenectomizado Profilaxis antibiótica tras tratamiento |
| Rituximab | 375 mg/m2/dosis Dosis semanal (x4), iv | 60-68% inicial, 20-25% a los 5 años | 1-8 semanas | Reacción infusional, enfermedad del suero, reactivación de VHB, leucoencefalopatía multifocal progresiva | No tiene indicación en ficha técnica para esta enfermedad |
| Romiplostim | 1-10μg/kg dosis semanal, sc | 40-50% de respuesta mantenida | 1-4 semanas | Fibrosis medular, trombosis | Todavía sin indicación en niños Precisa de controles semanales al inicio |
| Eltrombopag | 25-75 mg/día, vo | 40—50% de respuesta mantenida | 1-2 semanas | Fibrosis medular, trombosis, hepatotoxicidad | Indicación para PTI crónica en niños |
| Prednisona a dosis bajas | <5 mg/día, vo | <10% | N/A* | Ganancia de peso, hiperglucemia, hipertensión, osteoporosis, catarata | No se inicia a dosis bajas: en pacientes que muestran una respuesta a dosis intermedias, se disminuye la dosis progresivamente |
| Azatioprina | 1-2 mg/kg/día, vo (máx 150 mg/d) | 40-60% | 3-6 meses | Hepatotoxicidad, neutrocitopenia, infección, pancreatitis | |
| Micofenolato mofetil | 250-1.000mg vo 2 veces al día | 11-80% respuesta mantenida variable | 4-6 semanas | Cefalea, diarrea, náuseas, anorexia, infección | Bien tolerado por lo general |
| 6-mercaptopurina | 50-75 mg/m2 al día | 83% | No reportado | Hepatotoxicidad, neutropenia, infección, pancreatitis | Estudio en niños con citopenias inmunes. Muy pocas respuestas en niños con PTI |
| Ciclosporina A | 5-6 mg/kg/d c 12 h (nivel diana 100-200 ng/mL) | 30-60% | 3-4 semanas | Nefrotoxicidad, hipertensión, temblor, parestesias, hiperplasia gingival | Existe un estudio en niños en el que se reporta una infección fúngica. Requiere monitorización de tensión arterial y función renal |
| Danazol | 50-800 mg/d vo dividido en 2-4 dosis | 10-70% | 3-6 meses | Hepatotoxicidad, virilización, amenorrea | Mejor respuesta cuando se prolonga el tratamiento y duraderas si> 1 año en tratamiento |
| Dapsona | 75-100mg vo una vez al día | 40-75% | 3 semanas | Hemolisis (si déficit de G6PDh), rash, náuseas, metahemoglobinemia, agranulocitosis, anemia aplásica | No se dispone de ensayos clínicos Obligado descartar déficit de G6PDh |
| Ciclofosfamida | 0,3-1 g/m2 iv cada 2-4 semanas (1-3 dosis) 50-200mg vo una vez al día | 24-85% | 1-16 semanas | Neutrocitopenia, náuseas, vómitos, infertilidad, tumores secundarios | Importante insistir en ingesta hídrica para evitar cistitis hemorrágica. Muy pocos datos en la literatura, no aconsejado si no se dispone de experiencia |
iv: intravenoso; G6PDh: glucosa-6 fosfato deshidrogenasa5-7; sc: subcutáneo; VHB: virus de la hepatitis B; vo: vía oral.
El tratamiento con inmunosupresores como la ciclosporina, dapsona, dexametasona o micofenolato es bien tolerado y no parece presentar complicaciones de interés, pero ninguno ha demostrado tener una tasa de respuesta mejor que el resto5. Además, aunque la experiencia clínica pueda avalar su uso, estos fármacos no disponen de indicación en la PTI de las agencias reguladoras debido a que la información disponible en la literatura surge de estudios observacionales y, en la mayoría de los casos, retrospectivos. Por otra parte, la administración de algunos agentes quimioterápicos como ciclofosfamida, mercaptopurina o vincristina está cada vez menos recomendada, aunque se pueden encontrar referencias en series más antiguas.
Rituximab tampoco ha demostrado tener una eficacia superior al resto de los tratamientos. De hecho, es incluso menor en algunas series. Además, a pesar de haber demostrado ser un fármaco útil en adultos y de la existencia de pacientes con respuestas mantenidas a largo plazo, se ha de tener en cuenta que, en niños, su uso puede conllevar efectos adversos importantes7.
Los ar-TPO (eltrombopag y romiplostim) también han sido utilizados en pacientes con PTI persistente o refractaria. La experiencia en pediatría es todavía escasa, pero tanto romiplostim como eltrombopag han demostrado su utilidad en el tratamiento de la PTI persistente con una buena tolerancia y muy pocos efectos secundarios8,9. El porcentaje de respuestas mantenidas en el tiempo es similar al publicado para ciclosporina, dapsona o micofenolato, en torno al 45%, pero los ar-TPO sí que han demostrado obtener estos resultados en el seno de ensayos clínicos aleatorizados10-13. A este respecto, es importante señalar que, aunque la indicación aprobada para el uso de los ar-TPO en niños es la PTI crónica, en el momento de llevar a cabo los ensayos con estos fármacos el concepto de la PTI crónica incluía a los pacientes con una evolución superior a los 6 meses del diagnóstico. Por lo tanto, siendo estrictos, su utilidad en la PTI persistente ya ha sido probada. Por otra parte, se ha descrito que, entre los pacientes que obtienen respuesta a los ar-TPO, algunos son capaces de suspender el tratamiento sin presentar recaídas8. Este hecho podría responder a dos posibilidades: que estos fármacos sean capaces de modificar el curso natural de la enfermedad, o bien que sirvan como terapia puente hasta una eventual curación. Independientemente del motivo, el resultado final implica un beneficio para el paciente que inclina la balanza hacia su uso frente a otras posibilidades terapéuticas. Además, todavía quedan muchos temas por explorar, como el uso de ar-TPO en tratamientos combinados (con corticoides a dosis bajas, inmunoglobulinas o incluso micofenolato), o si la respuesta clínica puede ser considerada suficiente para continuar el tratamiento sin tener en cuenta la cifra de plaquetas. No obstante, los posibles efectos secundarios a medio y largo plazo de estos fármacos (que se comentarán más adelante), unido a su alto impacto económico, obligan a un uso racional que sería preferible limitar a centros pediátricos especializados.
La esplenectomía continúa siendo el tratamiento con mayor número de respuestas. La seguridad de este procedimiento quirúrgico ha mejorado en los últimos años gracias al uso profiláctico de tratamiento antibiótico, al empleo de vacunas y al mejor reconocimiento de los eventos tromboembólicos que estos pacientes pueden presentar a medio y largo plazo7. Sin embargo, tras la aparición de los ar-TPO, cuyo perfil de seguridad es mayor, parece adecuado iniciar este tratamiento antes de la esplenectomía en un intento por retrasar la cirugía.
¿Es rituximab una opción terapéutica de segunda línea en la población infantil?La indicación de rituximab en el tratamiento de la PTI se basa en su capacidad para controlar la respuesta inmune humoral, al ser capaz de eliminar los linfocitos CD20 positivos. También ha sido demostrado que podría regular la respuesta celular al aumentar el número de linfocitos T reguladores y prevenir la actividad de los linfocitos T autorreactivos5.
A pesar de que este fármaco no dispone de indicación en la ficha técnica para su uso en PTI pediátrica, su administración ha sido ampliamente descrita en la bibliografía. Una serie prospectiva valoró el papel de rituximab en 36 pacientes pediátricos y concluyó que este tratamiento podría ser beneficioso en algunos pacientes afectos de PTI crónica14. Entre los predictores de una buena respuesta estarían la calidad de la respuesta a otros tratamientos, la depleción B prolongada15, la buena respuesta a esteroides y que se trate de una PTI secundaria16. Otro estudio, este retrospectivo, describió la evolución durante 5 años tras la administración de rituximab a niños y adultos afectos de PTI. Destaca que, aunque la respuesta inicial fue del 57%, las respuestas mantenidas en el tiempo fueron mucho menores: alrededor del 26%15. Esta pérdida de respuesta podría estar justificada por la persistencia de clones autorreactivos en los centros germinales y en la médula ósea7.
En pacientes adultos, el nivel de evidencia actual todavía no permite recomendar el uso de rituximab como sustituto de la esplenectomía en segunda línea. De hecho, aunque existe un metaanálisis que propone que rituximab debería utilizarse antes de la esplenectomía17, diversos estudios muestran respuestas similares antes y después de la cirugía18. Por lo tanto, su uso podría recomendarse como segunda línea tan solo en pacientes con un elevado riesgo quirúrgico o que rechacen someterse a la esplenectomía.
Mientras tanto, en la edad pediátrica, el uso de rituximab como segunda línea es aún más controvertido. Ya antes de la aparición de los ar-TPO, eran varias las publicaciones que recomendaban la esplenectomía en la PTI refractaria (aunque retrasándola, en la medida de lo posible, hasta los 12 meses de evolución)3,19. Además, aunque proponían que rituximab podría ser una alternativa a la esplenectomía en niños con PTI refractaria o crónica, hacían hincapié en los efectos secundarios potenciales: la enfermedad del suero, el riesgo de infección vírica, la reactivación del virus de la hepatitis B y la hipogammaglobulinemia, así como otras peculiaridades que rodean su administración, como la necesidad de postergar la administración de vacunas durante los 6 meses siguientes al tratamiento.
Las guías actuales4,5,7,20, redactadas tras la aparición de los ar-TPO, abogan por la individualización del tratamiento, aunque la ausencia de ensayos clínicos aleatorizados hace que no tengan un nivel de evidencia superior a la opinión de expertos. Para algunos, rituximab continúa siendo una de las opciones terapéuticas de segunda línea (junto a los ar-TPO), pero otros autores muestran una clara preferencia por los ar-TPO. Esto se debe principalmente a que, a pesar de la ausencia de seguimiento a largo plazo, parece demostrado que las respuestas a los ar-TPO son más duraderas y presentan pocos efectos secundarios. De hecho, incluso pacientes esplenectomizados que no hayan respondido previamente a estos tratamientos se podrían beneficiar de su uso tras el fracaso de la esplenectomía21. Por último, es importante destacar que, a diferencia de rituximab, eltrombopag sí recoge en su ficha técnica la indicación para el tratamiento de la PTI crónica en pacientes pediátricos.
En definitiva, a día de hoy, rituximab no es probablemente un fármaco utilizable en la segunda línea de tratamiento de los pacientes pediátricos afectos de PTI refractaria, persistente o crónica. Sin embargo, de cara a individualizar el tratamiento, es necesario que este tipo de decisiones sean tomadas por facultativos expertos en el tema que dispongan de una amplia experiencia en este campo.
¿Cuál es el papel de la esplenectomía en pacientes pediátricos tras la aparición de los ar-TPO?Hasta hace unos años, la esplenectomía ha sido uno de los tratamientos clásicos de la PTI en adultos y niños mayores de 5 años de edad. Tras la aparición de rituximab, el tratamiento médico comenzó a imponerse sobre la cirugía como segunda línea del tratamiento3,19. Actualmente, muchos expertos ya recomiendan el uso de los ar-TPO si no existe respuesta inicial a corticoides e inmunoglobulinas, antes de la administración de rituximab y de la cirugía20. No obstante, todavía no existen estudios comparativos entre dichas opciones terapéuticas.
En general, aunque la mayoría de las guías no recomiendan la esplenectomía hasta que la PTI se prolongue un mínimo de 12 meses6, su indicación continúa siendo controvertida. De entrada, hay pacientes que no son candidatos a la cirugía, como los menores de 5 años, otros cuyos padres o tutores legales rechazan el procedimiento, y algunos cuyo tratamiento se establece de cara a mejorar su calidad de vida (casos en los que el tratamiento médico estaría, en principio, por encima del quirúrgico).
Para el resto de los pacientes, aquellos que sí sean potenciales candidatos a la esplenectomía, se han de tener en cuenta los riesgos derivados de un procedimiento quirúrgico que, además, será irreversible. Así, a pesar de la buena respuesta inicial (en un 70-85% de los casos) y de que la mayoría de los pacientes mantienen la cifra de plaquetas a los 5 años (60-70% de los casos), no hay que obviar la morbilidad asociada7,22,23: riesgo de infección en esplenectomizados hasta del 11-16% a pesar de la vacunación apropiada y la administración de profilaxis antibiótica; una tasa de trombosis entre el 1,6 y el 4,3% tras la cirugía y riesgo de hemorragia grave, durante y tras el procedimiento, del 0,78%24.
Por lo tanto, y puesto que el beneficio de la esplenectomía en niños no parece superar las desventajas, este procedimiento debería realizarse solo en casos seleccionados: aquellos pacientes que presenten intolerancia o sean refractarios al tratamiento médico incluyendo corticoides, inmunoglobulinas, ar-TPO e incluso inmunosupresores. También, y aunque se trate de un hecho extremadamente inusual, su indicación está clara ante un episodio de sangrado vital. Por último, también se podría considerar en aquellos casos en los que el paciente presente una mala calidad de vida a pesar de otros tratamientos o bajo petición familiar7.
Si se decide optar por la esplenectomía (siempre en mayores de 5 años), esta se ha de realizar en centros con experiencia y preferiblemente por vía laparoscópica, el paciente ha de recibir las vacunas pertinentes antes del procedimiento según las guías vigentes y se ha de asegurar la administración de profilaxis antibiótica adecuada en el postoperatorio7. Es importante destacar que, desafortunadamente, no existe ningún marcador pronóstico que permita establecer qué pacientes responderán a la cirugía.
En resumen, las recomendaciones actuales abogan por apurar las múltiples opciones de tratamiento médico en niños con PTI crónica antes de indicar una esplenectomía, especialmente en cuanto al uso de ar-TPO (fig. 1).
¿Es seguro el uso de ar-TPO a largo plazo en niños?Tras demostrar su seguridad y eficacia a corto y largo plazo en el tratamiento de la PTI de más de 6 meses de evolución, el uso de los ar-TPO ha aumentado en los últimos años. Sin embargo, aunque sabemos que estos fármacos no están exentos de efectos secundarios, la información a este respecto todavía es escasa en niños.
El uso de eltrombopag ha sido relacionado con la aparición de alteraciones hepáticas (elevación de las enzimas hepáticas), pero se sabe que esta situación mejora tras la supresión del tratamiento, por lo que no constituiría un problema a largo plazo25.
La fibrosis medular ha sido descrita en pacientes adultos bajo tratamiento con los dos tipos de ar-TPO, pero todavía no se conoce el riesgo real de esta complicación en la población pediátrica. Así, aunque los ensayos clínicos realizados en niños con eltrombopag no analizaron esta variable, sí que se han descrito algunos casos en la literatura26. Romiplostim, por su parte, está valorando la aparición de fibrosis y la evolución posterior en los ensayos clínicos que todavía están en marcha de cara a demostrar si, tal como ocurre en adultos, las alteraciones observadas remiten tras la suspensión del tratamiento27.
En definitiva, a falta de datos concluyentes y aunque en niños no se ha descrito ningún caso de fibrosis significativa (máximo I-II)9,26,28, la recomendación de algunos grupos es la realización de biopsias periódicas cada 18 meses para monitorizar los posibles cambios en la médula ósea26. También es apropiado recordar que la revisión periódica de las extensiones de sangre periférica por un hematólogo experto puede ayudar a descartar la existencia de datos indirectos de fibrosis medular: anisocitosis, poiquilocitosis, dacriocitos, hematíes nucleados y policromasia.
El tratamiento con ar-TPO también se ha relacionado con la trombosis en pacientes adultos. Sin embargo, todavía no está claro si el riesgo trombótico se asocia con el tratamiento o con la propia enfermedad25. Para empezar, se conoce que los pacientes diagnosticados de PTI presentan un perfil procoagulante secundario a cambios generados por la propia enfermedad29, lo que parece conllevar un riesgo relativo de trombosis arteriales y venosas de 1,5 y 1,9, respectivamente25. Además, no se pueden obviar otros factores de riesgo independientes para la aparición de trombosis como la edad, la diabetes mellitus, la hipercolesterolemia, la hipertensión arterial, el tabaquismo, la fibrilación auricular, la enfermedad valvular o coronaria, la esplenectomía y el tratamiento con corticoides, que asocian muchos de los pacientes en edad adulta30. Sin embargo, parece demostrado que el tratamiento con ar-TPO es un factor de riesgo independiente para la aparición de un evento tromboembólico en pacientes adultos (riesgo relativo de 1,8)27. Mientras tanto, en niños, solo se han descrito dos casos de trombosis relacionados con el tratamiento con ar-TPO en una serie americana de reciente publicación9, por lo que el riesgo real de este tratamiento en la edad pediátrica está por determinar.
En la actualidad, la única recomendación pasa por mantener un alto índice de sospecha para no retrasar el diagnóstico de posibles complicaciones trombóticas, así como considerar otros factores de riesgo como la obesidad, el uso de anticonceptivos hormonales en las adolescentes o los antecedentes familiares de trombosis antes de iniciar el tratamiento.
ConclusionesDado que la PTI es un diagnóstico de exclusión, el hecho de que la enfermedad persista en el tiempo o no responda a los tratamientos convencionales obligará a reafirmar la presunción diagnóstica. Por otra parte, el abordaje terapéutico de pacientes pediátricos afectos de PTI en cualquier momento de su evolución pasa por la necesidad de mantener una conducta expectante ante la ausencia de clínica hemorrágica que lo justifique.
La aparición de los ar-TPO no solo amplía las opciones terapéuticas de la PTI pediátrica sino que también abre la puerta a un cambio de paradigma a la hora de enfrentarnos a pacientes con una PTI persistente, crónica o refractaria a los tratamientos de primera línea, postergando el uso de tratamientos más agresivos como rituximab o la esplenectomía. Sin embargo, y a pesar de haber demostrado su utilidad y un perfil de seguridad adecuado en ensayos clínicos aleatorizados, su reciente aparición obliga a que su indicación sea supervisada por expertos en el tema que, además, mantengan un elevado índice de sospecha de las complicaciones potenciales que, en la edad pediátrica, sean probablemente menos frecuentes que en pacientes adultos.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.