Estudiar la prevalencia de esteatosis hepática no alcohólica (EHNA) en una población pediátrica obesa y su relación con parámetros clinicoanalíticos de resistencia a la insulina (RI) y con niveles de adiponectina.
Pacientes y métodosSe estudió a 290 niños (4–18 años) con obesidad. Se analizó el índice de masa corporal (IMC) y la desviación estándar (DE), la acantosis nigricans, la presión arterial, el perfil lipídico, las aminotransferasas y la adiponectina. Se realizó un test de sobrecarga oral de glucosa y se definió la RI mediante el homeostasis model assessment (HOMA) y la esteatosis hepática por ecografía. Definimos el síndrome metabólico (SM) como la presencia de 3 o más de los siguientes criterios: obesidad, hipertensión, hipertrigliceridemia, colesterol ligado a lipoproteínas de alta densidad (cHDL) bajo y alteración hidrocarbonada.
ResultadosCincuenta y dos (18%) pacientes presentaban EHNA en la ecografía, 22 (8%) pacientes tenían elevación de alanin-aminotransferasa (ALT) (≥40U/l). Los pacientes con EHNA fueron significativamente mayores (12,2±2,4 frente a 11,1±2,9 años), más obesos (IMC±DE: 4,5±1,5 frente a 3,8±1,3), y presentaron niveles más elevados de HOMA (3,7±1,5 frente a 2,4±1,4) que los pacientes con ecografía normal. No se encontró diferencia significativa en sexo, raza y estadio puberal. La prevalencia del SM y la acantosis nigricans fue significativamente mayor en los niños con EHNA. Encontramos una correlación inversa entre los niveles séricos de adiponectina y edad, HOMA, ALT y ácido úrico, y encontramos una correlación directa con cHDL. En el análisis de regresión múltiple, las variables que se asociaron de forma independiente con la EHNA fueron IMC±DE, HOMA y adiponectina (odds ratio: 1,4 [1,1-1,9]; 1,3 [1,1-1,6] y 0,9 [0,8-0,9], respectivamente).
ConclusionesLa obesidad y la RI son factores de riesgo de la EHNA en niños y adolescentes. Los niveles bajos de adiponectina están fuertemente asociados al desarrollo de EHNA en dichos pacientes.
To study the clinical and laboratory relationships of fatty liver disease in a group of obese children and to investigate whether circulating adiponectin is related to fatty liver disease.
Patients and methodsTwo hundred-ninety obese patients (age 4–18 years) were studied. Baseline body mass index-standard deviation score (BMI-SDS), acanthosis nigricans, blood pressure, plasma lipids, uric acid, alanine aminotransferase (ALT) and adiponectin were assessed, and a standard oral glucose tolerance test was performed. Insulin resistance (RI) was estimated by the homeostasis model assessment (HOMA) and liver steatosis was assessed by ultrasound (US). Children were classified as having metabolic syndrome if they met three or more of the following criteria: obesity, hypertension, hypertriglyceridemia, low HDL-cholesterol and impaired glucose metabolism.
ResultsFifty-two subjects (18%) had fatty liver by US and 22 (8%) had elevated ALT levels (≥40U/L). Subjects with steatosis were significantly older (12.2±2.4 frente a 11.1±2.9yr), heavier (BMI-SDS: 4.5±1.5 frente a 3.8±1.3), and more RI (HOMA: 3.7±1.5 frente a 2.4±1.4), but were comparable in gender, pubertal status and racial distribution to those with normal US. The prevalence of metabolic syndrome and acanthosis nigricans were also higher in the steatosis frente a the normal US group. Serum adiponectin concentration was inversely correlated with age, HOMA, ALT and uric acid and directly correlated with HDL-cholesterol. In a multiple logistic regression analysis, BMI-SDS, HOMA and serum adiponectin, but not age, uric acid or triglycerides, were the covariates independently associated with the presence of steatosis (odds ratio 1.4 [1.1-1.9]; 1.3 [1.1-1.6] and 0.9 [0.8-0.9], respectively).
ConclusionsObesity and RI are risk factors for liver steatosis in children and adolescents. Decreased serum adiponectin is closely and independently associated with steatosis.
La prevalencia de la obesidad y sus consecuencias metabólicas está aumentando rápidamente a nivel mundial1. La esteatosis hepática, así como la diabetes de tipo 2, la dislipidemia y otros parámetros de resistencia a la insulina (RI) están fuertemente asociados a la obesidad. La esteatosis hepática no alcohólica (EHNA), incluso, se ha considerado como el componente hepático del síndrome metabólico (SM). Abarca un amplio espectro de anomalías histológicas como resultado de la acumulación grasa en los hepatocitos, que engloba desde la esteatosis asintomática hasta la esteatohepatitis y fibrosis-cirrosis hepática. La prevalencia de la EHNA no es bien conocida y probablemente esté infravalorada debido a que la mayoría de los pacientes permanecen asintomáticos, a la ausencia de marcadores serológicos precisos y a la necesidad de realizar biopsia para el diagnóstico definitivo. Se estima que esta enfermedad afecta al 20–30% de la población adulta2 y su prevalencia se eleva hasta el 57,5% en los pacientes con obesidad3.
El conocimiento sobre esta enfermedad en la edad pediátrica es limitado4–10 y la prevalencia de la enfermedad, en este grupo de edad, es todavía desconocida. La evolución de la EHNA, a largo plazo, es incierta. En los pacientes obesos, la EHNA asintomática sería el primer estadio de daño hepático y la ganancia de peso facilitaría la progresión a mayor daño celular. Por tanto, es esencial la detección precoz de los estadios iniciales y el fomento de hábitos saludables.
La fisiopatología de la EHNA no está totalmente esclarecida. Tiene una naturaleza multifactorial en la que participan factores metabólicos y de estrés oxidativo, y la RI desempeña un papel fundamental en su desarrollo11,12. La adiponectina está relacionada con la RI y el desarrollo del SM13.
Los objetivos del presente estudio son establecer la relación entre la EHNA y los parámetros clínicos y analíticos de RI en un grupo de niños y adolescentes con obesidad, y estudiar si la adiponectina sérica se relaciona con la EHNA, independientemente de la RI, en dichos pacientes.
Pacientes y métodosRealizamos un estudio prospectivo en niños y adolescentes remitidos a nuestra unidad por obesidad. El estudio incluyó 290 pacientes y el Comité Ético de nuestro centro lo aprobó. Los criterios de inclusión fueron los siguientes: edad entre 4 y 18 años y un índice de masa corporal (IMC)±desviación estándar (DE) superior a 2DE según las tablas de Hernández et al14. Los pacientes con diabetes conocida, tratamiento hipoglucemiante, tratamiento con corticoides, consumo de alcohol u otras enfermedades hepáticas previas se excluyeron del estudio.
Valoración clínicaEl IMC (peso [kg]/altura2 [m2]) se calculó en global y en DE. Se realizó una exploración completa y se valoró la presencia de acantosis nigricans en el cuello, las axilas y la región inguinal. La pubertad se valoró según los estadios de Tanner. La presión arterial (PA) se midió mediante el aparato Dynamap con el paciente sentado en reposo, se cogió como dato la cifra más baja de 3 mediciones y se tomó como referencia los percentiles (P) de la Task Force15. Definimos hipertensión arterial (HTA) como una PA diastólica o sistólica ≥P95 para edad, sexo y talla, y definimos SM como el cumplimiento de al menos 3 de los siguientes criterios16: obesidad (IMC≥2DE), HTA (PA sistólica o diastólica ≥P95), hipertrigliceridemia (≥110mg/dl), colesterol ligado a lipoproteínas de alta densidad (cHDL) bajo (≤40mg/dl) y alteración hidrocarbonada17.
Diagnóstico de esteatosisLa ecografía es una técnica sensible y no invasiva que resulta muy útil para determinar el daño hepático y su evolución5. El estudio ecográfico se realizó en todos los sujetos por el mismo radiólogo, con ecógrafo (TOSBEE TOSHIBA) equipado con sonda convexa de 3,5 y 5MHz. Se realizaron proyecciones longitudinal, subcostal, ascendente y oblicua.
La ecografía muestra un incremento homogéneo y difuso en la ecogenicidad del hígado cuando existe acúmulo intrahepático de grasa, el hígado aparece más brillante que los riñones y se identifican con dificultad las venas hepáticas y porta. Para el diagnóstico de la EHNA el radiólogo se basó en los criterios: discrepancia hígado-riñones, penetrancia en profundidad hepática y claridad de venas hepáticas. Los pacientes se clasificaron en 2 grupos: presencia de esteatosis hepática o ecografía normal.
Como la EHNA es un diagnóstico de exclusión, fue necesario realizar una historia y una exploración detallada, así como pruebas complementarias para descartar consumo de alcohol en adolescentes y otras enfermedades hepáticas (infecciones virales o enfermedad de Wilson).
Estudio metabólicoSe obtuvieron muestras en ayunas para bioquímica completa con glucosa, insulina, perfil lipídico y hepático, ácido úrico y adiponectina sérica. Además, se realizó a todos los pacientes un test de sobrecarga oral de glucosa.
Se utilizó un método enzimático para la dosificación de lípidos, AEROSET/ARCHITECT c8000 (Abbott). Definimos dislipidemia con cHDL ≤40mg/dl o triglicéridos (TG) ≥110mg/dl18.
Las determinaciones de alanin-aminotransferasa (ALT), aspartato-aminotranferasa (AST) y gamma-glutamil transferasa (GGT) se realizaron con sistema AEROSET/ARCHITECT c8000 (Abbott) y definimos alteración enzimática con ALT ≥40U/l6,19,20.
La adiponectina sérica se midió por radioinmunoensayo (RIA) (Linco Research, Inc., St. Charles, Missouri, EE. UU.). Las muestras se diluyeron (500 veces) previo al análisis. La sensibilidad del método es de 2ng/ml. Los coeficientes de variación intraensayo e interensayo fueron inferiores al 5%.
Para la determinación de la glucosa plasmática se utilizó el método de glucosa oxidasa del analizador AEROSET c8000. La insulina se midió mediante inmunoanálisis (Immunolite 2000), sin reacción cruzada significativa con proinsulina.
La alteración en el metabolismo hidrocarbonado se definió según los últimos criterios de la Asociación Americana de Diabetes17. El índice HOMA se calculó mediante la fórmula: glucosa basal (mmol/l)×insulina basal (μU/ml)/22,521. Clasificamos a los pacientes como resistentes a la insulina cuando el HOMA o la insulina basal fue mayor del P95 para nuestra población16.
Métodos estadísticosSe utilizó el paquete estadístico SPSS 12.0 para Windows (SPSS, Inc., Chicago, Illinois, EE. UU.) para realizar el análisis estadístico. Se presentan los datos como media±DE para las variables continuas. El Z-score se calculó como valor-media/DE. Se utilizó el test de la t de Student, el test de la U de Mann-Witney, la prueba de la χ2 y el test de Fisher cuando correspondía. Se analizaron las correlaciones entre variables (Spearman) y se realizó un análisis de regresión múltiple para estudiar los factores predictores de la EHNA. Se incluyeron en el modelo máximo las siguientes variables: edad, IMC±DE, HOMA, ácido úrico, TG y adiponectina. Se analizó la colinearidad por los criterios de Belsley. Todos los valores de p son para 2 colas; se consideró significancia estadística valores de p<0,05.
ResultadosSe estudió a un total de 290 pacientes (147 varones/143 mujeres), con una edad media de 11±3 años (el 91% de raza caucásica y el 9% eran hispanos). Cincuenta y dos pacientes mostraron esteatosis en la ecografía hepática (18%). Los datos clínicos y bioquímicos de la población se resumen en la tabla 1.
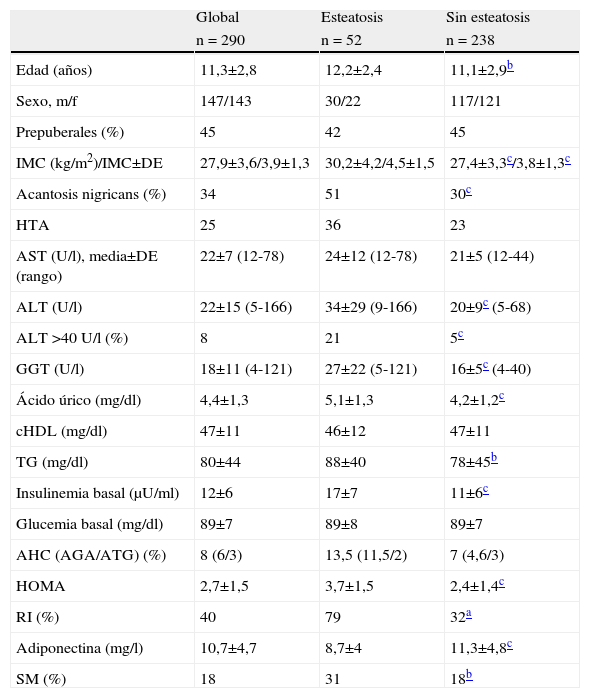
Datos antropométricos, clínicos y bioquímicosa de la población obesa global y según los resultados de la ecografía hepática
| Global | Esteatosis | Sin esteatosis | |
| n = 290 | n = 52 | n = 238 | |
| Edad (años) | 11,3±2,8 | 12,2±2,4 | 11,1±2,9b |
| Sexo, m/f | 147/143 | 30/22 | 117/121 |
| Prepuberales (%) | 45 | 42 | 45 |
| IMC (kg/m2)/IMC±DE | 27,9±3,6/3,9±1,3 | 30,2±4,2/4,5±1,5 | 27,4±3,3c/3,8±1,3c |
| Acantosis nigricans (%) | 34 | 51 | 30c |
| HTA | 25 | 36 | 23 |
| AST (U/l), media±DE (rango) | 22±7 (12-78) | 24±12 (12-78) | 21±5 (12-44) |
| ALT (U/l) | 22±15 (5-166) | 34±29 (9-166) | 20±9c (5-68) |
| ALT >40U/l (%) | 8 | 21 | 5c |
| GGT (U/l) | 18±11 (4-121) | 27±22 (5-121) | 16±5c (4-40) |
| Ácido úrico (mg/dl) | 4,4±1,3 | 5,1±1,3 | 4,2±1,2c |
| cHDL (mg/dl) | 47±11 | 46±12 | 47±11 |
| TG (mg/dl) | 80±44 | 88±40 | 78±45b |
| Insulinemia basal (μU/ml) | 12±6 | 17±7 | 11±6c |
| Glucemia basal (mg/dl) | 89±7 | 89±8 | 89±7 |
| AHC (AGA/ATG) (%) | 8 (6/3) | 13,5 (11,5/2) | 7 (4,6/3) |
| HOMA | 2,7±1,5 | 3,7±1,5 | 2,4±1,4c |
| RI (%) | 40 | 79 | 32a |
| Adiponectina (mg/l) | 10,7±4,7 | 8,7±4 | 11,3±4,8c |
| SM (%) | 18 | 31 | 18b |
AGA: alteración de la glucosa en ayunas; AHC: alteración hidrocarbonada; ALT: alanin-aminotransferasa; AST: aspartato-aminotransferasa; ATG: alteración de la tolerancia a la glucosa; cHDL: colesterol ligado a lipoproteínas de alta densidad; GGT: gamma-glutamil transferasa; HOMA: homeostatic model assessment; HTA: hipertensión arterial; RI: resistencia a la insulina; SM: síndrome metabólico; TG: triglicéridos.
Todos los pacientes con EHNA estaban clínicamente asintomáticos y sin hepatomegalia. Veintidós pacientes (8%) tenían niveles plasmáticos de ALT elevados. La frecuencia de hiperaminotransferasemia fue significativamente mayor en los pacientes con EHNA que en los pacientes con ecografía normal (el 21 frente al 5%; p<0,005). Se encontraron diferencias significativas en ALT y GGT, pero no en AST, entre los 2 grupos (tabla 1).
Características de los pacientes con esteatosis hepática no alcohólicaComo muestra la tabla 1, los pacientes con EHNA tenían mayor IMC global y en DE que los sujetos sin esteatosis (30±4kg/m2 frente a 27±3 y 4,5±1,5 frente a 3,8±1,3, respectivamente, ambos p<0,005). Encontramos también diferencia significativa en la edad, pero no en sexo, estadio puberal o raza. La acantosis nigricans y los parámetros bioquímicos de RI fueron significativamente más frecuentes en el grupo con esteatosis. En la población global estudiada se encontró un 40% de pacientes con RI, frecuencia que aumentaba a un 70% en el grupo con EHNA. Asimismo, la frecuencia del SM fue mayor en los pacientes con esteatosis (31%) que en aquéllos con ecografía normal (18%) (p<0,05). Los pacientes con EHNA tuvieron niveles significativamente más bajos de adiponectina que el grupo sin EHNA (8,7±4μg/ml frente a 11,3±4,7μg/ml; p<0,005).
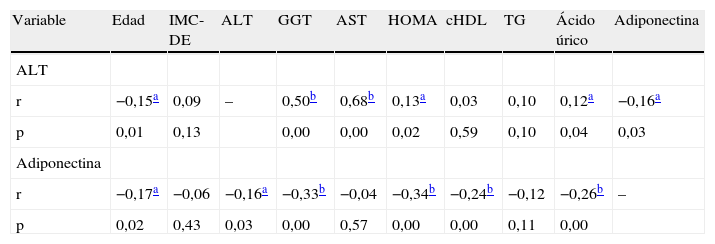
Correlaciones y análisis de regresión logísticaNo encontramos correlación significativa entre ALT y el grado de obesidad (tabla 2), pero sí con parámetros de RI y ácido úrico (p<0,05). Los niveles de adiponectina se correlacionaron de forma directa con cHDL, y negativamente con edad, ALT, GGT, ácido úrico y HOMA (p<0,005).
Coeficientes de correlación (Spearman)
| Variable | Edad | IMC-DE | ALT | GGT | AST | HOMA | cHDL | TG | Ácido úrico | Adiponectina |
| ALT | ||||||||||
| r | −0,15a | 0,09 | – | 0,50b | 0,68b | 0,13a | 0,03 | 0,10 | 0,12a | −0,16a |
| p | 0,01 | 0,13 | 0,00 | 0,00 | 0,02 | 0,59 | 0,10 | 0,04 | 0,03 | |
| Adiponectina | ||||||||||
| r | −0,17a | −0,06 | −0,16a | −0,33b | −0,04 | −0,34b | −0,24b | −0,12 | −0,26b | – |
| p | 0,02 | 0,43 | 0,03 | 0,00 | 0,57 | 0,00 | 0,00 | 0,11 | 0,00 |
ALT: alanin-aminotransferasa; AST: aspartato-aminotransferasa; cHDL: colesterol ligado a lipoproteínas de alta densidad; DE: desviación estándar; GGT: gamma-glutamil transferasa; IMC: índice de masa corporal; HOMA: homeostatic model assessment; TG: triglicéridos.
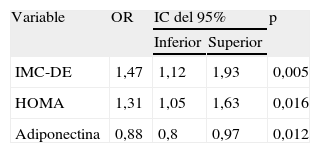
En el análisis de regresión logística múltiple (tabla 3) solamente se asociaron a EHNA, de forma significativa e independiente, IMC±DE, HOMA y adiponectina ((odds ratio: 1,4 [1,1-1,9]; 1,3 [1,1-1,6] y 0,9 [0,8-0,9], respectivamente).
Factores asociados a esteatosis hepática no alcohólica (análisis de regresión logística múltiple)
| Variable | OR | IC del 95% | p | |
| Inferior | Superior | |||
| IMC-DE | 1,47 | 1,12 | 1,93 | 0,005 |
| HOMA | 1,31 | 1,05 | 1,63 | 0,016 |
| Adiponectina | 0,88 | 0,8 | 0,97 | 0,012 |
DE: desviación estándar; IC: intervalo de confianza; HOMA: homeostatic model assessment; IMC: índice de masa corporal; OR: odds ratio.
Los resultados de este estudio ponen de manifiesto la relación entre la esteatosis hepática, en niños y adolescentes obesos, y el grado de obesidad y de RI. Además, indican una relación estrecha entre los niveles de adiponectina y el riesgo en el desarrollo de la EHNA en dicha población.
La EHNA se ha relacionado con la obesidad en varios estudios pediátricos20,22–26. La frecuencia de dicha enfermedad en nuestra cohorte (18%) es menor que en otros estudios5,7,9,27–30, probablemente porque nuestros pacientes no alcanzaban el grado de obesidad de otras poblaciones y por la variabilidad en los criterios diagnósticos utilizados. Aunque el gold standard para el diagnóstico sigue siendo la biopsia hepática, no se realizó en nuestro estudio por ser invasiva y de mayor coste. Actualmente se están desarrollando otras pruebas no invasivas, como el test del aliento con metacolina, pero se precisan estudios en la población infantil para establecer su indicación y seguridad. En nuestra muestra realizamos el diagnóstico ecográfico por su fácil acceso, inocuidad y excelente sensibilidad para el diagnóstico de esteatosis31,32.
En los niños obesos la elevación de ALT se ha utilizado como indicador del depósito de grasa hepática33. La elevación de ALT puede ser el único hallazgo bioquímico en pacientes con EHNA34 aunque suele ocurrir en casos de mayor acúmulo graso y no de esteatosis leve. En nuestra población estudiada existió hiperaminotransferasemia en el 8%; Strauss et al35 han encontrado una frecuencia similar en 2.450 adolescentes con sobrepeso y obesidad. En algunos estudios la frecuencia de hiperaminotransferasemia alcanza el 25%9,5. La hiperaminotransferasemia fue significativamente mayor en el grupo de EHNA que en el grupo con ecografía normal (p<0,005), pero sólo alcanzó el 21%, por tanto, la determinación aislada de aminotransferasas no es indicador suficiente de EHNA y es recomendable realizar ecografía en pacientes de riesgo para su diagnóstico.
Al contrario de otras publicaciones5,6,35, no encontramos diferencias significativas en el daño hepático según el sexo.
Numerosos factores se han asociado al desarrollo de la EHNA3. En nuestra experiencia, la prevalencia de EHNA se incrementa con la edad y con el grado de obesidad, sobre todo cuando asocian otros datos de SM, como la RI; otros autores11 también han evidenciado este hecho. La frecuencia de EHNA fue del 28% en los pacientes que cumplían criterios de SM frente al 15% en aquéllos sin criterios del SM (p<0,005). Hay que resaltar que estos datos se deben interpretar con cautela, dado que las distintas definiciones del SM pueden ser la causa de las diferencias en los resultados con respecto a otros trabajos.
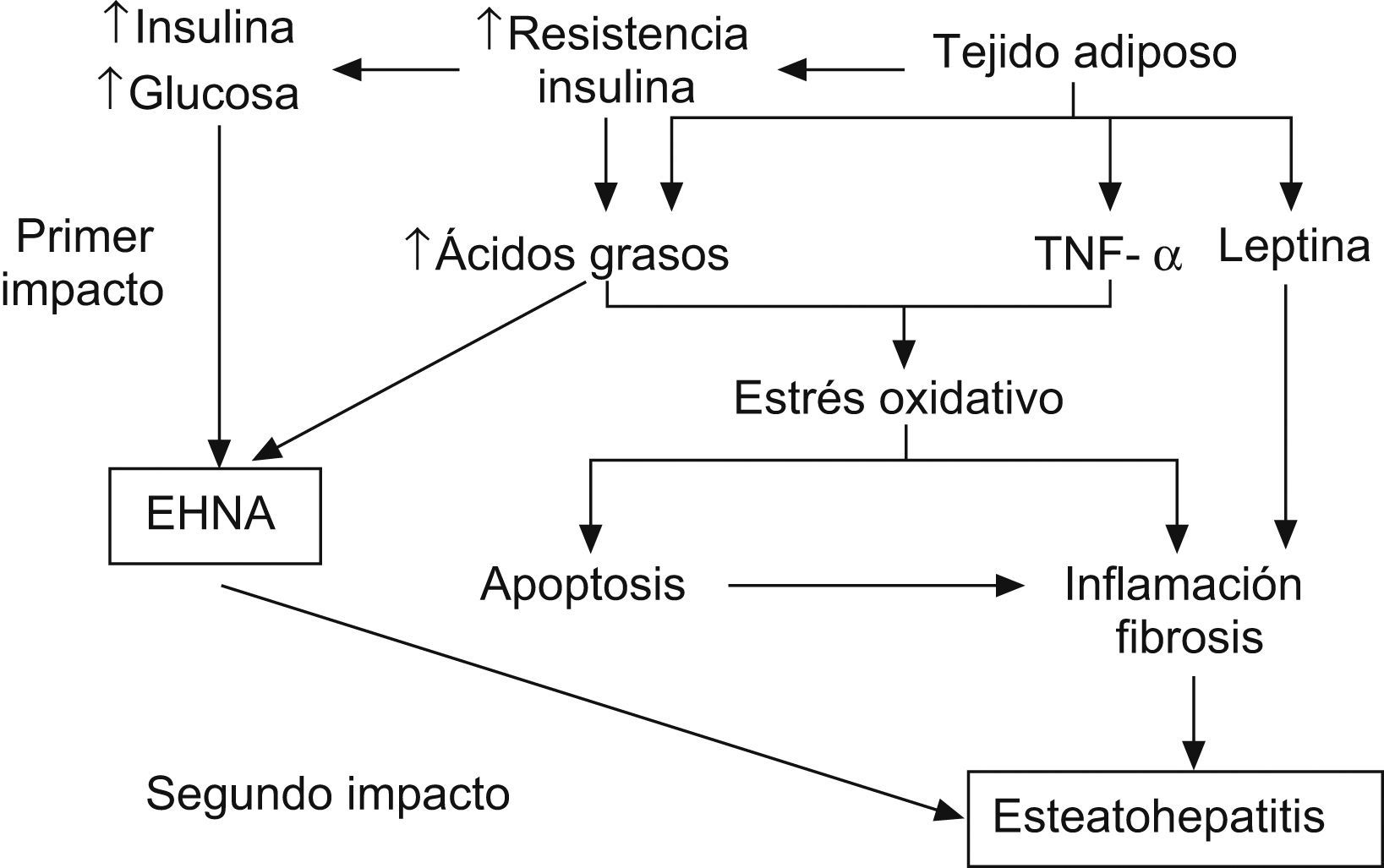
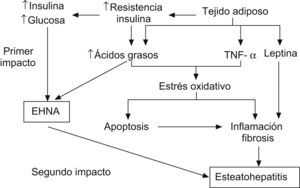
La RI parece desempeñar un papel fundamental en el desarrollo de la esteatosis, tanto en los adultos11,36,37 como en la población pediátrica6,26,38–40. La teoría patogénica más aceptada es la del doble impacto41 (fig. 1). Estudios recientes indican que el hiperinsulinismo produce alteraciones en las vías de captación, síntesis, degradación y secreción de ácidos grasos libres en forma de TG. Esto conlleva una mayor susceptibilidad hepática a los cambios inflamatorios y al daño tisular42. El mayor estrés oxidativo resultante de la disfunción mitocondrial y de las citoquinas proinflamatorias participa en la progresión de la simple esteatosis a la esteatohepatitis y cirrosis. Sin embargo, además de la obesidad y de la RI se requieren otros factores ambientales o genéticos para la progresión a esteatohepatitis.
Esquema de la patogenia de las esteatosis hepática no alcohólica41. Factor de necrosis tumoral alfa (TNF-α).
En los últimos años se ha destacado el papel de la adiponectina como regulador del metabolismo lipídico y de la acción de la insulina43, incluso en estudios pediátricos44. La adiponectina recientemente ha sido considerada como un importante regulador del daño tisular en la EHNA11,45. En nuestra serie, los niveles de adiponectina se correlacionaron negativamente con HOMA, AST, ALT y ácido úrico, y de forma positiva con los niveles de cHDL. Estudios previos han asociado niveles bajos de adiponectina con el desarrollo de los componentes del SM, tanto en adultos46 como en niños y en adolescentes13,44. Nuestros datos, coincidentes con los de otros estudios27, indican un papel protector de la adiponectina en el desarrollo de la EHNA en los niños obesos.
Los ácidos grasos libres inducen directamente la expresión de factor de necrosis tumoral alfa (TNF-α) en el hepatocito y promueven la esteatosis y el daño hepático47. Recientemente se ha identificado a la apoptosis del hepatocito como componente clave en la progresión de la esteatohepatitis. La adiponectina podría prevenir el daño hepático por la modulación de TNF-α48,49.
En conclusión, la obesidad y la RI son factores de riesgo para el desarrollo de la EHNA en niños y adolescentes. Los niveles disminuidos de adiponectina sérica están fuertemente asociados con la esteatosis hepática en los niños con obesidad.