La infección nosocomial (IN) es un problema frecuente en las Unidades de Cuidados Intensivos Pediátricas (UCIP), con una mortalidad atribuible hasta del 11%.
ObjetivoDescribir la epidemiología de la IN en las UCIP españolas. Iniciar una estrategia estandarizada de control de la IN para disponer de tasas de incidencia pediátricas en nuestro medio.
PAcientes y métodoEstudio multicéntrico y prospectivo del 1 al 31 de marzo de 2007. Se utilizaron los criterios diagnósticos y la metodología de cálculo de incidencia de IN del Centers for Disease Control and Prevention. Se estudió especialmente la IN relacionada con dispositivos invasivos: catéter venoso central (CVC), ventilación mecánica (VM), sondaje vesical (SV).
ResultadosSe estudiaron 300 pacientes en 6 UCIP, diagnosticándose 17 episodios en 16 pacientes (5,3% de los ingresados). La tasa de IN fue de 13,8 infecciones/1.000 pacientes-día. La edad media de los infectados fue de 2,31 años (± 3,43), 9 fueron varones. Existieron factores de riesgo en 7 casos. Las localizaciones fueron: bacteriemia relacionada con catéter en 7 pacientes (6,7/1000 días CVC), neumonía asociada a VM en 4 (9,4/1.000 días VM), infección urinaria asociada a SV en 4 (5,5/1000 días SV), un caso de bacteriemia primaria y una infección de herida quirúrgica. Los microorganismos aislados fueron: 9 bacilos gramnegativos, 4 Candidas, 2 estafilococos plasmocoagulasa negativos, 1 Haemophilus y 1 Staphylococcus aureus. Siete aislamientos fueron de microorganismos resistentes. No hubo ningún exitus atribuible a la IN.
ConclusionesLa epidemiología de la IN fue similar a la publicada en otros países de nuestro entorno. La vigilancia de la IN es esencial para un correcto manejo y para ello es fundamental tener un patrón de análisis y referencia común.
Nosocomial infection (NI) is a common complication in paediatric critical care units (PICU), with an associated mortality up to 11%.
ObjectiveTo describe NI epidemiology in the national PICU. To initiate an standard NI control measures to obtain paediatric incidence rates.
Patients and methodMulticentre prospective study from 1 to 31 march 2007. Centre Disease Control diagnosis and methodological criteria were used. It was specially analyzed NI related to invasive devices: central venous catheter (CVC), mechanical ventilation (MV), urinary catheter (UC).
ResultsThere were recruited 300 patients from 6 PICU, with 17 NI episodes in 16 patients (5,3% from admitted). NI rates resulted in 13,8 infections/1000 patients-day. Middle age from infected patients was 2,31 years (± 3,43), 9 males. Risk factors were found in 7 cases. NI location was: catheter-related bloodstream infection in 7 patients (6,7/1000 days CVC), ventilator associated pneumonia in 4 (9,4/1000 MV days), urinary-tract infection associated with UC in 4 (5,5/1000 UC days), one case of primary bloodstream infection and one surgical site infection. Isolated microorganisms were: 9 gram negatives bacillus, 4 Candida, 2 plasmocoagulase negative staphylococcus, 1 Haemophilus and 1 Staphylococcus aureus. Seven isolations were resistant microorganisms. There weren’t any died related to NI.
ConclusionsNI epidemiology was similar to published data in our near countries. NI surveillance, with a standardized method of analysis is essential to the NI correct manage.
La infección nosocomial (IN) es un problema frecuente en las Unidades de Cuidados Intensivos Pediátricas (UCIP) y se asocia a una elevada morbimortalidad y a un incremento notable de los costes. La bacteriemia relacionada con catéter venoso central (BRC) suele ser la primera causa de IN en pacientes pediátricos críticos, seguida de la neumonía relacionada con la ventilación mecánica (NR-VM) y de la infección del tracto urinario relacionada con el sondaje vesical (ITU-SV)1. El seguimiento sistemático de la IN es una medida necesaria para su prevención y control que debería implementarse en todas las UCIP2-4. La IN es además uno de los principales indicadores de calidad en dichas unidades.
Los registros de las tasas de IN en España son cada vez más numerosos, pero suelen reflejar de forma aislada un tipo concreto de IN, o la tasa de IN en un grupo de pacientes determinado5,6. Por este motivo, desde el Grupo de Enfermedades Infecciosas de la Sociedad Española de Cuidados Intensivos Pediátricos (SECIP), se priorizó la necesidad de realizar un estudio multicéntrico sobre IN en UCIP, que aunara los esfuerzos que ya se estaban realizando en las diferentes unidades para controlar la IN.
Los objetivos principales del trabajo fueron dos. En primer lugar, iniciar una estrategia de control de la IN, común para todas las UCIP, con la finalidad de disponer de estándares propios de diagnóstico y de medida de la IN, comunes a todos los centros y con una continuidad en el tiempo. En segundo lugar, describir la epidemiología de la IN en las UCIP españolas. No se contempló la instauración de medidas de prevención destinadas a prevenir la IN, dado que lo prioritario fue implementar el sistema de recogida de datos y su estandarización.
MetodologíaEstudio multicéntrico, prospectivo, descriptivo y observacional.
Lugar de estudioSeis UCIP de los hospitales españoles que formaban parte del comité permanente del grupo de Enfermedades Infecciosas de la Sociedad Española de Cuidados Intensivos Pediátricos. Estos centros fueron: Hospital General Universitario Gregorio Marañón (Madrid), Hospital Universitario Central de Asturias (Oviedo), Hospital de Cruces (Baracaldo, Vizcaya); Hospital Sant Joan de Deu (Barcelona), Hospital Son Dureta (Palma de Mallorca) y Hospital Virgen de la Arrixaca (Murcia).
Período de estudioDurante un mes (del 1 al 31 de marzo de 2007) se recogieron los pacientes que ingresaron en UCIP y se siguieron en planta hasta 72 horas después del alta de UCIP.
PacientesCriterios de inclusiónPacientes desde los 7 días hasta los 18 años de edad, que requirieran ingreso en la UCIP durante más de 24 horas, que cumplieran los criterios del Centers for Disease Control and Prevention (CDC) revisados en 20047,8 y que requirieran alguna de las siguientes intervenciones:
- -
Ventilación mecánica (VM).
- -
Catéter venoso central (CVC): de acceso central o periférico.
- -
Sondaje vesical (SV).
Pacientes fuera de los rangos de edad establecidos o con alguno de los siguientes criterios:
- -
Ingreso en UCIP por episodio de IN acaecido fuera de la unidad de intensivos.
- -
Catéter venoso periférico o catéter central permanente (port-a-cath, Broviach, etc).
Se recogieron las siguientes variables para cada episodio de IN:
- -
Edad, sexo, Pediatric Risk of Mortality Score-II (PRISM-II) inicial (primeras 24 horas), motivo de ingreso en UCI (respiratorio, cardiaco, infeccioso, trauma, neurológico, quirúrgico, otros), exitus atribuible a la IN.
- -
Factores de riesgo intrínsecos: inmunodepresión primaria o secundaria1, insuficiencia renal o hepática, desnutrición, ingreso previo el mes anterior.
- -
Factores de riesgo extrínsecos: portador de CVC, necesidad de VM y tipo de intubación (nasofaríngea, orofaríngea, traqueotomía), portador de SV, nutrición parenteral.
- -
Días totales de hospitalización, días de hospitalización en planta (pre-UCIP), días de ingreso en UCIP, número total de ingresos y estancias en la unidad, número de días total de exposición a CVC, VM y SV, número total de pacientes sometidos a CVC, VM y SV. Estos datos se utilizaron como denominadores para calcular las tasas.
- -
Tipo de IN: bacteriemia relacionada con el CVC (BRC); neumonía relacionada con la VM (NR-VM); infección urinaria relacionada con la SV (ITU-SV); bacteriemia primaria; infección de la herida quirúrgica; otras. Se recogieron todos los microorganismos aislados y su patrón de resistencias.
Las variables se recopilaron en una base de datos en Microsoft Access®. Se analizaron los pacientes expuestos a algún dispositivo externo y se calcularon las tasas de infección nosocomial mediante las siguientes definiciones:
- -
Tasa de densidad de incidencia: número de episodios de IN por 1000 pacientes-día.
- -
Tasa de BRC: número de episodios de BRC por 1000 días de CVC.
- -
Tasa de NR-VM: número de episodios de NR-VM por 1000 días de VM.
- -
Tasa de ITU asociada a SV: número de episodios de ITU-SV por 1000 días de SV.
Durante el período de estudio se recogieron los datos de 300 pacientes. La edad media de los pacientes fue de 2,31 (± 3,43) años (rango 30 días-14 años). Nueve fueron varones (56,25%). Tuvieron factores de riesgo 7 pacientes (43,7%): dos desnutridos, dos alimentaciones parenterales, un tratamiento crónico con corticoides, un paciente oncológico y un portador de un catéter central tunelizado. El PRISM fue de 9,7 (± 7,1), con un rango entre 2 y 24. Las causas de ingreso más frecuentes fueron cardiaca (cinco casos), neurológica (cuatro pacientes) y respiratoria (tres casos); dos traumáticos y dos estaban ingresados por sepsis.
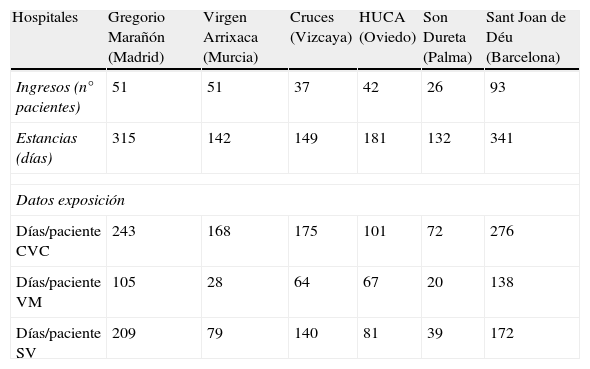
Los pacientes se repartieron en las diferentes unidades como se muestra en la tabla 1; todos habían requerido algún tipo de dispositivo externo. Dieciséis pacientes sufrieron una IN, con 17 episodios de IN, lo que supone un 5,3% de los pacientes ingresados y una tasa de IN de 13,8 infecciones/1000 pacientes-día.
Distribución de los pacientes en los diferentes hospitales y datos de exposición del total de los pacientes recogidos.
| Hospitales | Gregorio Marañón (Madrid) | Virgen Arrixaca (Murcia) | Cruces (Vizcaya) | HUCA (Oviedo) | Son Dureta (Palma) | Sant Joan de Déu (Barcelona) |
| Ingresos (n° pacientes) | 51 | 51 | 37 | 42 | 26 | 93 |
| Estancias (días) | 315 | 142 | 149 | 181 | 132 | 341 |
| Datos exposición | ||||||
| Días/paciente CVC | 243 | 168 | 175 | 101 | 72 | 276 |
| Días/paciente VM | 105 | 28 | 64 | 67 | 20 | 138 |
| Días/paciente SV | 209 | 79 | 140 | 81 | 39 | 172 |
CVC: catéter venoso central; SV: sonda vesical; VM: ventilación mecánica.
Los datos de exposición a dispositivos externos, del total de los 300 pacientes recogidos, se especifican en la tabla 1. Hubo un total de 1.035 días/paciente CVC, 422 días/paciente VM y 720 días/paciente SV. La tasa más alta de IN fue para la NR-VM (9,4/1.000 días VM), seguida de la BRC (6,7/1.000 días CVC), y la ITU-SV (5,5/1.000 días SV).
En la tabla 2 se especifica la localización de los microorganismos en relación con tipo de infección. Los micoorganismos aislados fueron 9 BGN, 4 Candidas, 2 estafilococos plasmocoagulasa negativos y 1 Haemophilus. Siete gérmenes fueron resistentes (41,2%): tres BLEE, un MARSA, una Pseudomonas resistente a ceftazidima y otra a carbapenems y un E. coli resistente a cefalosporinas de tercera generación.
Tipo y localización de la infección y microorganismos en 17 episodios de IN.
| BRC (n=7) | 3 Candida (2 Candida albicans, 1 Candida parapsilosis) |
| 3 BGN (Enterobacter cloacae, Pseudomonas aeruginosa, Escherichia coli) | |
| 1 SPCN (Staphylococcus epidermidis) | |
| NR-VM (n=4) | 2 BGN (Klebsiella BLEE, Stenotrophomonas maltophilia) |
| 1 Staphylococcus aureus | |
| 1 Haemophilus influenzae | |
| ITU-SV (n=4) | 3 BGN (Escherichia coli, Pseudomonas aeruginosa, Klebsiella oxytoca), |
| 1 Candida albicans | |
| Bacteriemia Primaria (n=1) | 1 SPCN (Staphylococcus epidermidis) |
| Infección herida quirúrgica (n=1) | 1 BGN (Citrobacter freundii) |
BGN: bacilos gramnegativos; BLEE: beta lactamasas de expectro extendido; BRC: bacteriemia relacionada con catéter venoso central; NR-VM: neumonía relacionada ventilación mecánica; SPCN: Estafilococo plasmocoagulasa negativo; ITU-SV: infección tracto urinario asociada a sonda vesical.
La media de días ingreso en UCIP fue 16,9 (± 9,1) y la media de días totales de ingreso de 39,9 (± 18,8). No hubo ningún exitus atribuible a la IN.
DiscusiónEl hecho de iniciar un estudio multicéntrico sobre IN en las diferentes UCIP planteó el problema inicial de la homogeneidad de los criterios diagnósticos de IN. Cada unidad adaptó los protocolos propios de diagnóstico de IN a los consensuados por el CDC7,8 para evitar sesgos de inclusión de los pacientes. Otro aspecto metodológico importante fue el disponer de plantillas comunes de recogida del número de pacientes sometidos a VM, CVC y SV y del número de días de exposición al dispositivo para evitar pérdida de denominadores. La recogida de casos se realizó durante un mes con el objetivo de poder realizar un estudio de incidencia.
Respecto a los resultados, es difícil disponer de datos de incidencia comparables. Las citas en el área de los intensivos pediátricos siguen siendo escasas y con resultados muy dispares6,9. Algunas publicaciones son de países en vías de desarrollo, otras reflejan datos de unidades que no atienden a determinado tipo de pacientes, como post-operados de cirugía cardíaca, pacientes que precisan de transplante de médula ósea, etc. Esta circunstancia apoya la pertinencia del estudio, en el que se pretende estandarizar el diagnóstico y el registro de las IN asociadas a dispositivos invasivos en las UCIP, siguiendo la metodología y los criterios utilizados en la bibliografía y en los organismos de referencia reconocidos, con el objetivo de disponer de datos incidencia comparables. La medición de la IN es el primer paso en el establecimiento de estrategias de mejora encaminados a progresar en una asistencia de calidad.
La tasa global de IN, de 13,8, resultó superior a la de otros estudios publicados10,11. El motivo fundamental podría ser secundario a la mayor tasa de neumonía asociada a la VM que se detectó, como se detalla a continuación.
En el caso de la BRC, al comparar con los datos del National Nosocomial Infections Surveillance System (NNISS) observamos que la tasa de BRC es de 7,3 comparada con 6,7 en nuestro estudio10,11. Costello et al reportan unas tasas de BRC en UCIP muy similares, con una tasa de 7,8, que mejoró tras la aplicación de protocolos de prevención a 4,712. Las tasas de la literatura ascienden cuando se trata de referencias de grupos de pacientes concretos como los post-operados de cirugía cardíaca 5,6,13. El control de la BRC es clave, dado el gran volumen que representa y la morbimortalidad atribuible.
Respecto a la NR-VM, los datos del NNISS reflejan una tasa media de 2,9 comparada con el 9,4 del presente estudio10,11. En el trabajo nacional de Guardia, realizado en pacientes post-operados de cirugía cardíaca, la NR-VM representó hasta un 60% de las IN de la UCIP14. Los datos europeos recogidos en la bibliografía son algo distintos, y reflejan un 5-9% de pacientes con NR-VM15-18. En nuestro trabajo, un factor de sesgo de sobreestimación de la tasa de NR-VM pudiera ser la n total de pacientes recogidos: entre los pacientes infectados había 3 niños con estancia en UCIP superior a 2 meses. Dada la elevada tasa de NR-VM de nuestro estudio, se deriva la necesidad de la disminución de la tasa de NR-VM, ya que en diferentes publicaciones se ha demostrado que la NR-VM aumenta de forma significativa los días de ventilación mecánica, la mortalidad, y los costes19-21.
La ITU-SV debe ser considerada otro ítem clave en el control de la IN en UCIP. En un estudio multicéntrico la tasa media de ITU era de 4,7, cercana a la de 5,5 de nuestro estudio22,23. Probablemente las cifras sean más similares debido a que el manejo de la sonda urinaria está mucho más consensuado. La utilización de dispositivos cerrados y su retirada precoz son aspectos universalmente aceptados24-26.
Las tasas de infección de la herida quirúrgica y de bacteriemia primaria fueron más bajas que las del resto de IN, de forma similar a lo que ocurre en la literatura27.
Respecto a los microorganismos implicados, cabe destacar el elevado número de aislamientos de bacilos gramnegativos, en 9 casos, así como la preponderancia de Candida en la BRC. En el trabajo de Fuster et al6 (España 2007) también se evidenció dicho fenómeno, con un papel etiológico mayor de los BGN28. Sin embargo, en la mayor parte de la bibliografía los bacilos grampositivos están a la cabeza de la etiología de la IN, seguidos también por Candida29-34. Este hecho y el alto índice de resistencias antibióticas reportados, especialmente para BLEE, podrían ser debidos a políticas antibióticas poco adecuadas. Por este motivo en futuros estudios, los datos referentes a la antibioterapia deberían ser un dato a analizar más exhaustivamente.
Una limitación del estudio es el número limitado de la muestra, ya que sólo existen 17 pacientes con infección, de un total de 300 pacientes recogidos. Pese a que la sistemática de recogida es paralela a la de otros estudios publicados, los resultados son difíciles de extrapolar, como ya se ha comentado en cada tipo de infección nosocomial.
ComentariosNuestro trabajo describe las tasas de IN en UCIP españolas, similares a las referidas en la bibliografía de otros países, aunque pone de manifiesto la elevada prevalencia de NR-VM, de IN por BGN y Candida, así como el alto índice de resistencias. La vigilancia de la IN es esencial para un correcto manejo y seguimiento de la misma, por lo que sería deseable la extensión de este estudio al resto de UCIP nacionales y aumentar la población analizada. Como objetivos a medio plazo, impera la necesidad de establecer unos protocolos comunes de prevención de la infección nosocomial y su evaluación mediante estudio de la evolución de las tasas en años posteriores a la implementación de dichos protocolos, a nivel nacional.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
La definición de inmunodepresión secundaria incluye neutropenia menor de 500/μl, durante más de 10 días en los 60 días previos; necesidad de corticoides más de 3 semanas a dosis superiores a 1mg/kg/día en los 30 días previos; necesidad de fármacos inmunosupresores en los 60 días previos o quilotórax.