Introducción
El uso del oxígeno se introdujo en la práctica neonatal en ausencia de estudios de distribución aleatoria. La dosis no se cuantificó bien y así continúa en algunos lugares. Además, los niveles de oxigenación del recién nacido no se midieron sistemáticamente hasta que pudo disponerse de análisis para los gases en sangre arterial, muestras capilares, presión parcial de oxígeno (PO2) transcutánea (TcPO2) y, más recientemente, monitorización de la saturación de oxígeno (SaO2) con pulsioximetría (SpO2). Sin embargo, es uno de los tratamientos que se emplean con más frecuencia en las unidades de cuidados intensivos neonatales (UCIN), muchas veces sin límites o controles, como se ha mencionado repetidamente en libros, editoriales y artículos, algunos muy recientes, en diciembre de 2003 y febrero de 20041,2. La relación entre presión parcial arterial de oxígeno (PaO2) y saturación es "cambiante", como se describió hace muchos años. La relación entre prematuridad, oxígeno y retinopatía del prematuro (retinopathy of prematurity, ROP) ha sido estudiada por muchos autores3-8. Sin embargo, durante los últimos 63 años, la historia de este proceso y sus interrelaciones sigue evolucionando. Nuestro objetivo consiste en actualizar algunos de los temas de interés en estas relaciones cambiantes. En esta revisión se incluye, con más o menos detalle, la definición de retinopatía del prematuro, sus grados de intensidad, los temas no resueltos de su tratamiento, algunos aspectos históricos, la población de riesgo y los factores de riesgo asociados. También se debaten las dificultades de establecer estadísticas precisas en la retinopatía del prematuro (tasas y variabilidad entre los distintos centros y naciones), el significado del problema y la fisiopatología de la retina en desarrollo. Terminaremos aportando los datos más precisos disponibles acerca de la relación entre los diferentes niveles de oxigenación (PaO2, TcPO2, SpO2) y los cambios rápidos y la "fluctuación" de la oxigenación sobre la retinopatía del prematuro. También se describe cómo un proceso de educación y puesta en práctica de guías para modificar la práctica clínica se asocia con una influencia clínicamente significativa en la prevención de algunos de los casos más graves de retinopatía del prematuro. Por último, se presentan brevemente los comentarios finales y algunos estudios futuros que en la actualidad se hallan en fase de planificación.
¿Qué es la retinopatía del prematuro?
Definición y grados de severidad
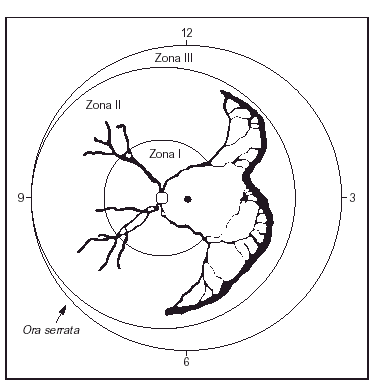
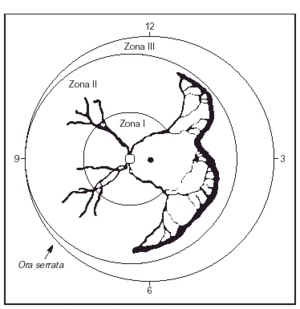
La retinopatía del prematuro es una anomalía del desarrollo de la retina y del vítreo que ocurre en niños prematuros. Se debe a una angiogénesis anormal, en la que los vasos sanguíneos retinianos dejan de crecer y desarrollarse normalmente en recién nacidos prematuros, lo que a veces conduce a trastornos visuales graves y ceguera. La enfermedad se asocia con las tasas de supervivencia y con la gravedad del proceso sistémico y se ve influida por estos factores. Su gravedad es variable y se clasifica mediante un examen detallado del fondo de ojo con oftalmoscopia indirecta. Durante muchos años ha estado en vigor una Clasificación Internacional de la retinopatía del prematuro (ICROP)9. Los estadios clásicos descritos en la ICROP son de gravedad creciente (estadios 1-4). El ojo se divide en zonas, según el área afectada. La zona I retinopatía del prematuro ocurre cuando se observa retinopatía del prematuro al menos en una hora del reloj (sector horario) dentro de un círculo imaginario cuyo radio es el doble del diámetro desde el disco óptico hasta la mácula; se trata de la zona más central, cercana al nervio óptico, y de mayor importancia para la visión central. Por este motivo es la peor zona para presentar una neoformación vascular anormal. La zona II retinopatía del prematuro, zona intermedia, se observa cuando la maduración de los vasos retinianos no ha ocurrido dentro de 1 diámetro de disco de la ora serrata nasal. La zona III retinopatía del prematuro (periférica) ocurre cuando la maduración de los vasos retinianos se produce dentro de un disco de diámetro de la ora serrata en el lado nasal, al menos en dos sectores horarios. La figura 1 es una representación esquemática, donde se representan también las "horas del reloj" del área afectada. Además, se utilizan términos como umbral, preumbral y enfermedad "plus". El umbral se utiliza cuando está indicado el tratamiento. El preumbral indica el niño con muy alto riesgo para el tratamiento. La enfermedad plus requiere al menos dos cuadrantes de dilatación y tortuosidad de los vasos retinianos del polo posterior, iguales o superiores a los de una fotografía estándar publicada. Además, el estudio ETROP, publicado en diciembre de 200310, adelantó el concepto de que la neovascularización plana en la zona I, incluso sin una verdadera cresta, debe considerarse como un estadio 3, y propuso dos tipos (I y II) para decidir sobre los casos más graves y su tratamiento10, basándose en la zona y en la presencia o ausencia de enfermedad plus, del modo siguiente:
Figura 1.Viñeta de retinopatía del prematuro en zona II con extensión de más de 5 h contiguas. (Tomada de Reynolds JD et al. N Engl J Med 1998;338: 1572.)
1.Tipo 1 (el más grave):
a) Zona I: cualquier estadio ROP con enfermedad plus.
b) Zona I: estadio 3 ROP, con o sin enfermedad plus.
c)Zona II: estadios 2 o 3 ROP con enfermedad plus.
2. Tipo 2:
a) Zona I: estadios 1 o 2 ROP sin enfermedad plus.
b)Zona II: estadio 3 ROP sin enfermedad plus.
El tratamiento y su eficacia
Lamentablemente, hasta la fecha no existe ninguna "curación" completamente eficaz de la retinopatía del prematuro, ni tampoco ningún tratamiento para detener su progresión hacia las formas más graves. La crioterapia se utilizó en épocas anteriores para el tratamiento, pero el método preferido en la actualidad es la terapia con láser.
El ensayo a mayor escala publicado hasta hoy sobre la historia natural de una cohorte para investigar la incidencia de la retinopatía del prematuro es el estudio CRYO-ROP11, aunque con la iniciativa ETROP se dispondrá en breve de datos más recientes sobre dicha incidencia. Los niños del estudio CRYO-ROP nacieron en Estados Unidos entre enero de 1986 y noviembre de 1987, y la incidencia descrita en niños de menos de 1.251 g de peso fue del 66 %. Los resultados mostraron que la crioterapia era beneficiosa, pero a pesar de ello muchos niños quedaron con una pérdida visual significativa.
En el estudio ETROP10 se investigó a 6.998 niños de menos de 1.251 g en 26 centros de Estados Unidos. Los niños con alto riesgo de retinopatía del prematuro preumbral se distribuyeron aleatoriamente para recibir tratamiento precoz o convencional. Los resultados muestran que el tratamiento más precoz con láser se asocia a una disminución de los resultados visuales desfavorables a los 9 meses de edad posconcepcional: 14,5 % frente a 19,5 %. Sin embargo, no hubo diferencia estadística con respecto a la ceguera. Y hubo más "complicaciones" durante el procedimiento precoz. Al analizar los datos puede estimarse cuántos se trataron innecesariamente. El 37 % de los casos con retinopatía del prematuro tipo I en la cohorte, no llegó nunca a alcanzar el estadio umbral. Ello significa que si se trata a todos los niños con retinopatía del prematuro tipo I, de cada tres tratados con láser hay uno que no hubiera requerido el procedimiento.
En dos recientes ensayos controlados, de carácter ciego y distribución aleatoria, se ha valorado en lactantes de más de un mes si una estrategia de "oxígeno adicional" reduce la progresión del daño retiniano, una vez que el proceso patológico está ya muy avanzado. En el ensayo "Supplemental Therapeutic Oxygen for Prethreshold ROP" (STOP-ROP)12 se incluyeron recién nacidos de unas 26 semanas al nacimiento que desarrollaron retinopatía del prematuro preumbral en, al menos, un ojo y que no podían mantener SpO2 > 94 % en aire ambiente. Una vez realizado el diagnóstico de retinopatía del prematuro umbral, hacia las 6 semanas de vida, los niños se distribuyeron aleatoriamente en dos grupos: a) con oxígeno suplementario para mantener niveles más elevados de SpO2 (SpO2, 96-99 %), y b) SpO2 convencional (SpO2, 89-94 %). En el estudio no se observaron beneficios significativos con el oxígeno suplementario. La progresión de la retinopatía del prematuro preumbral a retinopatía del prematuro umbral se redujo en el 28 %, pero la diferencia no alcanzó significación estadística (odds ratio [OR], 0,72; intervalo de confianza del 95 % [IC 95 %], 0,58-1,01). Un análisis post hoc de un subgrupo de retinopatía del prematuro preumbral sin enfermedad plus, reveló un menor riesgo de progresión al umbral en los niños de menos peso del grupo con suplemento de oxígeno (46 % a 32 %; p = 0,004)12. Sin embargo, los efectos secundarios observados fueron mucho peores en el grupo con SaO2 más elevada, a saber: neumonía, exacerbación de la displasia broncopulmonar, fenómenos pulmonares adversos hasta los 3 meses de edad corregida, necesidad prolongada de oxígeno suplementario a las 50 semanas de edad posmenstrual (EPM) y empleo significativamente mayor de furosemida. En el ensayo australiano Benefits of Oxygen Saturation Targeting (BOOST)13 se distribuyeron aleatoriamente a 358 lactantes con edades gestacionales de menos de 30 semanas que se hallaban en situación de dependencia del oxígeno a las 32 semanas de EPM. El objetivo de SaO2 fue de 91-94 % en el grupo "estándar", y de 95-98 % en el grupo de alta saturación. Se observó una tendencia uniforme, aunque sin significación estadística, hacia una menor necesidad de ablación retiniana en el grupo de SpO2 más elevada, en comparación con el grupo de SpO2 más baja (OR, 0,5; IC 95 %, 0,3-1,1; p = 0,09). En los niños nacidos con < 28 semanas de gestación (n = 256), la ablación se redujo un 48 % en el grupo con SpO2 más alta (OR, 0,52; IC 95 %, 0,26-1,03). No hubo ninguna evidencia de cambio en varias evoluciones (estancia hospitalaria, crecimiento, anomalías importantes del desarrollo, neurodesarrollo a los 12 meses de edad corregida, estrés parental y temperamento de los niños). La duración de la oxigenoterapia y de la ventilación mandatoria intermitente no mejoró tampoco. En realidad, la displasia broncopulmonar (oxígeno a las 36 semanas) fue más frecuente en el grupo de alta saturación (64 % frente a 46 %), y una mayor proporción requirió oxígeno domiciliario (30 % frente a 17 %). Hubo también más muertes de causa respiratoria en el grupo con SpO2 más elevada13. En estos dos estudios no se hallaron diferencias en el crecimiento, la mortalidad o los principales parámetros de la evolución del desarrollo.
Por lo tanto, en el estudio STOP-ROP12 no se hallaron pruebas convincentes de que, al administrar oxígeno adicional, se redujera significativamente la progresión de las lesiones retinianas, una vez que éstas se hallaban muy avanzadas; y el ensayo BOOST13 sugiere que intentar mantener cifras más elevadas de SpO2 tardíamente en el curso neonatal puede tener un cierto papel para reducir la progresión de la retinopatía del prematuro existente en algunos niños prematuros. Como hecho de mayor importancia, ambos ensayos ilustran sobre las potenciales complicaciones en seguridad y eficacia de determinadas gamas de SpO2 para diferentes evoluciones (es decir, respiratoria frente a visual). Con pequeños incrementos de la fracción inspiratoria de oxígeno (FiO2), hubo evidencia de un aumento de secuelas pulmonares, sin beneficio detectable en el crecimiento y el neurodesarrollo.
En resumen, sigue siendo necesario hallar un remedio e identificar el "momento ideal para tratar", de modo que no se pierdan oportunidades y que, al mismo tiempo, ningún niño sea tratado innecesariamente. Como hecho importante, una vez efectuado el diagnóstico no existe ningún tratamiento que detenga con eficacia el progreso hacia formas más graves. Y, por encima de todo, no se dispone de ninguna medida definitiva y completamente preventiva, aparte de la de evitar los nacimientos prematuros. Los datos obtenidos en STOP-ROP y BOOST son importantes, pero no son relevantes para conseguir un nivel óptimo de SpO2 precozmente en el curso neonatal que dé lugar a retinopatía del prematuro con menos frecuencia y gravedad y que origine menos neumopatía crónica. Al igual que otros autores, nosotros hemos señalado que la monitorización cuidadosa de la administración y la SaO2, evitando fluctuaciones amplias y saturaciones elevadas de oxígeno poco después del nacimiento y durante las primeras semanas de vida, se asocia con una menor incidencia de retinopatía del prematuro grave, menos necesidad de tratamiento con láser, menos ceguera y menos displasia broncopulmonar7,8,14,15. (Más adelante se amplían los detalles sobre esta cuestión.)
Algunos aspectos históricos
El oxígeno se descubrió hace más de 200 años16,17. Scheele, en 1773, y Priestley, el 1 de agosto de 1774, lo descubrieron de manera independiente. Priestley desconocía los trabajos anteriores de Scheele, dado que no se publicaron hasta 1777. Debido a su publicación anterior, el 8 de marzo de 1775, y a los detallados experimentos posteriores sobre la naturaleza de este nuevo gas, además de estar influido directamente por Lavoisier (que fue quien realmente lo denominó "oxígeno", que significa formador de ácido, y quien inició la "revolución química"), suele atribuirse a Priestley el descubrimiento del oxígeno16. Hasta donde se sabe, Priestley fue también la primera persona que inhaló aire con una concentración de oxígeno mayor a la normal. Parece ser que en 1780 Chaussier18 administró oxígeno a recién nacidos, y desde entonces se ha administrado en neonatos de todo el mundo más que cualquier otro tratamiento. Curiosamente, en realidad Priestley nunca supo que había descubierto el oxígeno, e insistió hasta su muerte en que había descubierto "aire desflogisticado". En realidad, se hallaba inmerso en una teoría errónea y no dejó de aconsejar a los demás que se ciñeran a la evidencia y no se dejaran llevar por los prejuicios. Claude Bernard escribió 100 años más tarde: "Son las cosas que sabemos las que nos impiden conocer las que no sabemos"16. En 1917 se recomendó la administración intragástrica de oxígeno, práctica que se mantuvo hasta 1950, y en 1928 Flagg describió un método para reanimar a los recién nacidos asfícticos mediante el uso de oxígeno y anhídrido carbónico18.
En Estados Unidos y otras naciones industrializadas, la oxigenoterapia para los recién nacidos se introdujo en los años 1930 y comienzos de 1940. Su uso se ha generalizado luego en todo el mundo. En febrero de 1941, el Dr. Clifford, pediatra de Boston, y el Dr. Chandler, oftalmólogo, vieron un niño con nistagmo rotatorio, opacidades oculares y una "lámina fibrovascular en el cristalino". Al cabo de una semana, los dos médicos y el Dr. Terry vieron otro niño similar. Estos dos lactantes pesaron al nacer 1.020 y 1.810 g y fueron los precursores de una epidemia de ceguera, con 117 casos entre 1942 y 1945. En 1944, el Dr. Messenger (oftalmólogo y becario de latín y griego) acuñó el término fibroplasia retrolental (FRL). A comienzos de la década de 1950 se descubrió la relación entre la oxigenoterapia y la FRL (denominación utilizada entonces para la retinopatía del prematuro). En 1953 se identificaron 10.000 niños ciegos por FRL (7.000 nacidos en EE.UU.). Estas cuestiones y otras fueron descritas con pruebas fácticas y elegancia por el Dr. Silverman en su obra Retrolental Fibroplasia: A Modern Parable, disponible en: http://www.neonatology.org/classics/parable/default.html19. El conocimiento de la obra es obligado para todo aquel que ocupe puestos de relevancia en medicina neonatal-perinatal, y también es instructivo y estimulante para cualquier pediatra que se preocupe del tema. En suma, la concentración de oxígeno se rebajó en muchas incubadoras, con lo que disminuyó la retinopatía del prematuro, pero aumentaron la morbilidad y la mortalidad. En las décadas de 1950 y 1960 ocurrió una tragedia19-21 cuando se generalizó una nueva norma asistencial, que se basaba en evidencia incompleta y que finalmente resultó dañina. Por ejemplo, McDonald informó en Inglaterra que cuando el oxígeno se restringió a 2-6 días, la prevalencia de la diplejía espástica fue elevada, de hasta el 25 %, pero no había FRL. Cuando el oxígeno se mantuvo durante 17-25 días, o más, se observó FRL en más del 25 %, pero la diplejía espástica fue sólo del 4-5 %, aproximadamente. Cross20 informó sobre el coste en vidas en 1973, y Bolton y Cross aportaron nuevos detalles en 197421. Estos autores observaron que tras la restricción de oxígeno, recomendada por consenso, la tasa de mortalidad en las primeras 24 h de vida por 1.000 nacidos vivos no seguía la mejoría significativa y la tendencia a la baja que se había constatado en Estados Unidos, Inglaterra y Gales desde los años 1950 a 1960. Además, basándose en el exceso del número de muertes en el primer día de vida, estimaron que "cada niño cuya visión se ha logrado conservar puede haber costado la muerte de otros 16". Durante aquellos días, la dosis de oxígeno no se cuantificaba con exactitud, y era imposible medir los niveles de oxigenación. Hoy en día la relación es diferente, y todavía está evolucionando.
Desde aquellos primeros días se sabe que la proporción de alteraciones visuales graves y ceguera debidas a la FRL/retinopatía del prematuro en los niños de 0-15 años de edad en las escuelas para ciegos es inversamente proporcional a la tasa de mortalidad infantil, y es mucho más elevada en los países industrializados que en los que se encuentran en vías de desarrollo. En datos recogidos entre 1991 y 1996 en naciones en vías de desarrollo, Gilbert et al22 informaron que la proporción de alteraciones visuales graves y ceguera por retinopatía del prematuro en niños de 0-15 años en escuelas para ciegos era del 30 % en Cuba, el 18 % en Chile y sólo el 4 % en Guatemala, de nuevo asociado inversamente a mejores tasas de mortalidad infantil.
Naturalmente, durante estos últimos 25-40 años han ocurrido muchas cosas. Pudo disponerse de mezcladores y de analizadores de oxígeno, precisos y sencillos de utilizar, lo que ofreció a los clínicos la posibilidad de controlar y conocer la dosis de oxígeno (FiO2). A fines de los años 1960 y comienzos de 1970 se pudo disponer de las mediciones de la PaO2, así como de micrométodos para analizar los gases en sangre arterial. Esta historia de la monitorización del oxígeno y de los gases en sangre es también muy interesante y nosotros la hemos resumido recientemente23. La medición incruenta de TcPO2 se introdujo a mediados de los años 1970 y comienzos de 1980 y, a pesar de lo útil que fue, se ha dejado de usar de forma progresiva. La medición de la SaO2 con monitores de SpO2 fue posible en la década de 1980, pero su historia todavía está evolucionando.
En los últimos 3-4 años se han escrito diversos comentarios editoriales sobre el tema1,2,24-27 y se han publicado diversos artículos originales en los últimos 18 meses7,14. Sin embargo, todavía no es posible prevenir la retinopatía del prematuro, en forma verdaderamente eficaz, ni brindar una asistencia "ideal y perfecta" en lo que respecta a oxigenoterapia y niveles de PaO2 y SpO2 basándose en revisiones sistemáticas de evidencia obtenida en estudios controlados de distribución aleatoria.
Población en riesgo y factores de riesgo asociados
Los cuatro factores principales que se asocian a la retinopatía del prematuro son: la prematuridad, el uso de oxígeno, el sexo masculino y la raza blanca. Naturalmente, el problema tiende a ser más frecuente y grave en los niños nacidos con edades gestacionales extremadamente bajas (24-27 semanas) y con muy bajo peso de nacimiento (MBPN) (< 800 g). Sin embargo, la enfermedad todavía persiste en muchas partes del mundo en recién nacidos con de más de 32 semanas de gestación y más de 1.750 g de peso. Esto ocurría hace 30-40 años en las naciones industrializadas, donde ahora la retinopatía del prematuro es inexistente en esa edad gestacional y con ese peso de nacimiento. Estos hechos prestan más apoyo al impacto de las prácticas clínicas sobre el desarrollo de la retinopatía grave del prematuro.
Otros muchos factores se han postulado como factores de riesgo asociados, pero no se han confirmado claramente ni demostrado en estudios bien realizados a gran escala. Su discusión detallada cae fuera del ámbito de esta revisión, en la que sólo se citarán y algunos se debatirán brevemente. Los muchos factores investigados relacionados con la retinopatía del prematuro son: hipoxemia, tratamiento con indometacina, déficit de vitaminas E y A, inositol, persistencia del conducto arterioso, falta de alimentación al pecho, esteroides posnatales, exposición a la luz, sepsis a Candida, transfusiones sanguíneas numerosas, administración precoz de hierro, utilización de eritropoyetina e hipercapnia.
La administración posnatal de dexametasona puede asociarse a retinopatía grave del prematuro28-31. En un ensayo de distribución aleatoria realizado en niños con MBPN (750 g) que se mantenían dependientes del respirador a los 15-25 días de edad, la dexametasona se asoció a una mayor proporción de retinopatía del prematuro grave (56 % frente al 45 %) y de necesidad de ablación (35 % frente al 20 %)30. La reducción de la luz no se asoció a la prevención de la retinopatía del prematuro32. Diversos informes clínicos asocian la sepsis a Candida con una proporción significativamente mayor de retinopatía grave del prematuro y tratamiento quirúrgico31,33-35. El efecto de las transfusiones sanguíneas sobre la retinopatía del prematuro se discute todavía36-38. En un estudio prospectivo de distribución aleatoria donde se combinaron los datos de ambos grupos, no se observó asociación entre las cifras de hemoglobina y hematocrito o el protocolo de transfusiones y la incidencia o la gravedad de la retinopatía del prematuro36. Dani et al38 han descrito el papel potencial de las transfusiones sanguíneas y la administración de hierro. En informes preliminares presentados en reuniones de investigación, se ha sugerido que el uso de eritropoyetina para la anemia de la prematuridad puede asociarse a una mayor incidencia de retinopatía del prematuro39,40. Respecto a la hipercapnia y las apneas y su posible función en la retinopatía del prematuro, nos remitimos a la sección de fisiopatología, que se expone más adelante.
"Estadísticas" de retinopatía del prematuro (tasas y variabilidad entre los centros y las naciones), examen ocular y significado del problema
Lamentablemente, en muchas UCIN de todo el mundo aún se desconocen las tasas de retinopatía del prematuro, o las estadísticas sobre este proceso son inexactas. Ello puede deberse a diversos motivos. Ante todo, si la mortalidad neonatal por MBPN es elevada, las tasas serán "bajas", especialmente en las unidades que informan de los casos de retinopatía del prematuro respecto a los ingresos. En segundo lugar, con cualquier tasa de mortalidad de niños MBPN, los datos de la retinopatía del prematuro no deben informarse según los niños MBPN ingresados en la unidad. El numerador debe ser el número de niños con retinopatía del prematuro, y el denominador debe incluir sólo los niños sometidos a cribado, esto es, evaluaci&oacut se muestra un resumen del modo en que deben informarse los datos para que se puedan establecer comparaciones válidas. Finalmente, para que las estadísticas sobre este proceso sean exactas, hay que examinar y someter a cribado a todos los niños de riesgo antes de dar el alta, y relacionar este dato con la tasa de cribado conocida en la UCIN (tabla 1). Si no se hace así, no se conocerán con precisión los porcentajes reales de retinopatía del prematuro en una determinada unidad, que podrían ser falsamente bajos, y las comparaciones entre las distintas unidades no serán válidas.
Los temas antes citados están relacionados con la variabilidad que existe entre los centros y, naturalmente, entre las regiones o las naciones. Sin embargo, aunque se sigan todos los pasos descritos aquí y en la tabla 1 existe todavía una variabilidad significativa entre los centros. En varias bases de datos de gran volumen se observa que las tasas de retinopatía del prematuro grave (III-IV) varían desde el 2 hasta más del 12 % en recién nacidos de 500 a 1.500 g al nacer, y la necesidad de tratamiento con láser, entre el 1 y el 4 %. Esta variabilidad entre los centros está relacionada con diferencias en la asistencia clínica con respecto a la administración de oxígeno y su monitorización, y con otros aspectos asistenciales. Estas diferencias de cuidado clínico pueden explicar también, al menos en parte, la variabilidad en un mismo centro entre una época y la siguiente.
Para lograr datos precisos, los niños que se consideran de riesgo deben someterse a cribado siguiendo un protocolo detallado, de modo que no se pase por alto (casi) ninguno. Además hay que realizar metódicamente la evaluación de fondo de ojo. Debe realizarse la dilatación pupilar (con ciclopentolato al 0,2 % y fenilefrina al 1,0 %; ciclomidril) para que la exploración sea completa. Si no se logra una buena dilatación se puede utilizar ciclopentolato al 0,5 % y/o fenilefrina al 2,5 %. En la exploración se utiliza un espéculo ocular estéril y depresores esclerales, para visualizar la retina periférica con un oftalmoscopio binocular indirecto, junto con una lupa manual. Hay que monitorizar cuidadosa y continuamente a los niños durante la evaluación debido a sus potenciales complicaciones. El primer examen ocular detallado se realiza a las 4-6 semanas de edad posnatal en los recién nacidos de riesgo.
Existen también recomendaciones para saber cuándo hay que repetir los exámenes de fondo de ojo de control. Si no se observa retinopatía del prematuro en el primer examen, es necesario explorar al niño hasta que se hayan desarrollado los vasos retinianos; cuando se aprecia, hay que registrar su localización y gravedad según la ICROP9. La zona I retinopatía del prematuro debe examinarse cada semana. El diagnóstico de zona III retinopatía del prematuro requiere al menos un seguimiento 2 semanas más tarde. La zona II se ha de controlar cada 1 o 2 semanas hasta alcanzar la plena madurez retiniana o un empeoramiento.
El significado y el impacto de la retinopatía del prematuro son cruciales. Cerca del 4-5 % de los supervivientes de menos de 1.000 g son legalmente ciegos. Un porcentaje más elevado sufre alteraciones visuales significativas. Si se acepta que cada año en Estados Unidos son supervivientes de las UCIN unos 2.000 niños de MBPN que quedan ciegos o con graves alteraciones visuales, y que la esperanza de vida de estos niños es de 70 años, puede calcularse que cada año se están incorporando a la sociedad 140.000 nuevos años de vida con ceguera. La retinopatía del prematuro grave no sólo da lugar a la ceguera, sino que también se asocia a graves trastornos del neurodesarrollo. Los niños con MBPN con retinopatía del prematuro grave cursan mucho peor que aquellos otros que no sufren alteraciones visuales. Al aumentar la gravedad de la retinopatía del prematuro, la tasa de discapacidad grave se incrementa desde cerca del 4 % hasta el 20 % cuando existe retinopatía del prematuro umbral. Más de la mitad de los niños con visión desfavorable sufren discapacidad grave. Con una visión desfavorable, las evoluciones funcionales son peores: el 77 % son incapaces de atender a su propio cuidado; el 50 % tienen problemas de continencia; el 43 %, discapacidades motoras, y el 66 %, alteración de la capacidad personal-social, unas 3 a 10 veces más que los controles con visión favorable41.
Finalmente, en casi todas las regiones donde se obtienen datos de las escuelas para niños o adultos ciegos, la proporción de alteraciones visuales graves y ceguera por FRL/retinopatía del prematuro es mucho mayor que por cualquier otra causa (o por muchas otras causas combinadas). En estos ámbitos, la retinopatía del prematuro es la causa más frecuente de ceguera. El significado de este problema se está experimentando ahora también en las naciones en vías de desarrollo, donde está aumentando la supervivencia de los niños de MBPN y un gran número de niños con retinopatía del prematuro grave y/o ceguera están incorporándose a la sociedad42,43. La parte más triste es que muchos de estos niños son "grandes" (es decir, mayores de 27 semanas de gestación, o mayores de 1.250 g de peso), de modo similar a lo que ocurrió, pero ha dejado de ocurrir, hace 30-55 años en las naciones industrializadas.
Fisiopatología y retina en desarrollo
Los dos factores desencadenantes son: una retina incompletamente vascularizada (recién nacidos pretérmino) y un aumento de la PaO2 con hiperoxia retiniana relativa. Esto conduce a una vasoconstricción y una disminución de los factores de crecimiento, como los factores de crecimiento semejante a la insulina (IGF-1) y endotelial vascular (VEGF). Esto da lugar a una detención de la vascularización y a obliteración capilar, con disminución de la perfusión y posterior isquemia e hipoxia retinianas. Como respuesta, se aumenta la expresión de diversos factores de crecimiento y angiogénicos (IGF-1, VEGF y otros). Si esta respuesta es intensa y los factores vasogénicos no disminuyen, la angiogénesis (neoformación de vasos sanguíneos) es anormal y desorganizada, con importante vasoproliferación, lo cual puede conducir finalmente a inflamación, retinopatía proliferativa, fibrosis significativa y desprendimiento de retina44-50.
Aunque la hiperoxia y la formación de especies de radicales de oxígeno son sin duda una parte importante de la patogenia, se han implicado otros factores: citoquinas proinflamatorias, ciclooxigenasa-2 (COX-2), neuropéptido Y, óxido nítrico (NO) y déficit de factores tróficos y antioxidantes. La COX-2 tiene efectos proangiogénicos mediados por las prostaglandinas (PGE2) y por la activación de receptores específicos (EP3). Ello induce la expresión de eNOS, la forma endotelial de la NO sintasa, lo cual incrementa la presencia de NO. Por este motivo, algunos investigadores están explorando la inhibición de COX-2 para atenuar la neovascularización intravítrea. El neuropéptido Y posee 36 aminoácidos y aumenta su expresión durante la exposición hiperóxica. Según el tiempo y la duración de la hiperoxia e hipoxia retinianas y la expresión del receptor específico Y2, puede producirse una neovascularización significativa46-48. Como hecho de interés, en un modelo genético knockout de receptores Y2, después de los 7 días de vida disminuyen significativamente la retinopatía, la formación de ovillos vasculares, las hemorragias retinianas y la tortuosidad de los vasos sanguíneos, a pesar de respirar en una FiO2 de 0,75 durante 5 días48. La ciclooxigenasa-2 (COX-2) interviene en los fenómenos neurodegenerativos en la retina de la rata49. El papel del receptor soluble de necrosis tumoral (sTNFR) se ha valorado recientemente en 14 niños de MBPN en un estudio piloto. Se observó que los niños que posteriormente desarrollaban retinopatía del prematuro grave presentaban concentraciones séricas más elevadas de sTNFR entre los 3 y los 5 días de vida50. Estos hallazgos están induciendo a los investigadores a estudiar diferentes formas de inhibición, para tratar de atenuar la revascularización anormal.
Con respecto a la hipercapnia, Holmes ha informado sobre la retinopatía inducida por el dióxido de carbono en la rata recién nacida51. Además, recientes trabajos en modelos animales y en cultivos tisulares muestran que la hipercapnia, aun sin ningún efecto hemodinámico, incrementa las isoformas de NO sintasa (NOS) en los vasos retinianos, con acción tóxica sobre éstos52,53. Cuando la hipercapnia coexiste con una elevación de NO en la retina, las lesiones retinianas son mucho peores. Además, se ha demostrado claramente que la hipercapnia induce el desarrollo de los vasos y prolonga la activación de la NOS endotelial52,53. Finalmente, en fecha reciente se ha descrito la función del VEGF y el IGF-1 en un modelo hipercárbico de retinopatía del prematuro inducida por el oxígeno en la rata54. La información clínica es incompleta y no concluyente55,56, pero ello no es sorprendente dados los múltiples factores que intervienen en la patogenia de la retinopatía del prematuro.
En nuestro papel como clínicos, tenemos la obligación de observar a nuestros pacientes y valorar si producimos algún impacto negativo sobre las evoluciones más importantes como resultado de la introducción de cambios en la práctica clínica antes de que existan "pruebas suficientes" de inocuidad y eficacia. Hoy en día, en muchas UCIN se permite que algunos recién nacidos muy graves permanezcan en presión positiva continua en las vías aéreas (CPAP) en épocas tempranas de la vida, incluso aunque presenten cifras elevadas de PaCO2 y altibajos significativos de oxígeno, debido a crisis de apnea de variable intensidad. En estos casos, sólo se pueden documentar esporádicamente unas pocas variables, como la PaO2 y la PaCO2, pero no es posible ver lo que sucede, si es que sucede algo, con NOS, NO, COX-2, IGF y VEGF, a nivel sistémico o en la retina. Como hecho de interés, recientemente se ha descrito que, además de la edad gestacional y el peso de nacimiento, las crisis de apnea y el tratamiento con factor tensioactivo (surfactante) son importantes factores de riesgo independientes para la retinopatía del prematuro. Por otra parte, la apnea no sólo puede aumentar el riesgo de desarrollar el proceso, sino que también puede empeorarlo si ya existe57.
Hasta que se disponga de más pruebas, si se modifican las prácticas clínicas es necesario monitorizar cuidadosa y exactamente las tasas de retinopatía del prematuro. Hoy en día se plantea la cuestión de cuáles son los factores que ejercen un mayor o menor impacto sobre la retinopatía del prematuro, entre la hipercapnia, la hiperoxia y las fluctuaciones de oxígeno rápidas y significativas. Todos ellos individualmente pueden modificar la expresión de algunos o todos los factores antes mencionados, y pueden ser más perjudiciales al combinarse cuando el niño es más inmaduro y la retina está hipodesarrollada de manera significativa. Lamentablemente, al parecer existen regiones y centros en el mundo industrializado que experimentan un aumento de la retinopatía del prematuro grave58-60, que no se asocia con una mayor supervivencia de los niños de menor peso. Ante esto, sólo cabe asombrarse y especular si la introducción de diversas nuevas prácticas guarda relación con lo anterior. La administración de surfactante se inició en la década de 1990 y se asocia a una rápida mejora de la oxigenación. Aproximadamente en la misma época se introdujeron los monitores de SpO2 y en muchos centros se permitieron valores elevados de SpO2 de forma sistemática. Por lo tanto, la falta de una respuesta lo bastante rápida frente a los cambios de oxigenación inducidos por el surfactante podría asociarse con niveles muy altos (desconocidos) de PaO2 durante períodos variables de tiempo en las primeras etapas de la vida posnatal. Ello, unido a los cambios rápidamente fluctuantes en la oxigenación relacionados con el uso de los monitores de SpO2, puede explicar en parte, el incremento y la variabilidad en las tasas de retinopatía del prematuro que se han descrito. La aplicación de CPAP con hipercapnia significativa y episodios frecuentes de niveles bajos y elevados de oxígeno en las primeras épocas de la vida puede ejercer también un impacto sobre la retinopatía del prematuro.
Administración de oxígeno, niveles de oxigenación, cambios rápidos y retinopatía del prematuro
El oxígeno se descubrió hace más de 200 años (v. anteriormente) y se ha administrado a más recién nacidos en el mundo que cualquier otro tratamiento neonatal. Sin embargo, todavía no sabemos definitivamente cuál es la dosis aconsejable, o cuántos niños realmente lo necesitan, en relación con las variaciones de la enfermedad y las edades gestacional y posnatal. Pero durante muchos años hemos sabido que "demasiado oxígeno" lesiona la retina3-6,61-64.
¿Por qué hay que elegir entre los "extremos" de las dosis de oxígeno: 21 % (aire ambiente) frente a 100 % ("oxígeno puro")?
En muchos lugares, e incluso en la literatura médica reciente, existe un debate persistente sobre el uso de oxígeno al 21 % (FiO2, 0,21) contra el uso de oxígeno al 100 %, o "puro" (FiO2, 1,0) durante la reanimación65-72. Esta práctica de elegir "uno u otro extremo" no puede ser correcta para muchos niños, dado que excluye o limita otra más razonable, basada en utilizar una dosis "adecuada" de oxígeno, valorando las necesidades de cada niño. El colocar un oxímetro de pulso, el tener como objetivo una SpO2 "aceptable" y el utilizar un mezclador para administrar la dosis de oxígeno necesaria para alcanzar el objetivo, constituyen medidas asistenciales sencillas y económicas, que se utilizan "día tras día" en todas las UCIN en muchas naciones. La medición de la FiO2 y de la SaO2 (y/o de los gases en sangre arterial) se lleva a cabo sistemáticamente en muchas UCIN. ¿Por qué no se realiza esto sistemáticamente desde el momento del nacimiento en los niños pretérmino tratados en muchos lugares de todo el mundo? ¿Por qué no se emplea de forma uniforme esta práctica durante la reanimación y en cualquier momento en la sala de partos, en el tránsito hospitalario o durante la ventilación con mascarilla? Su omisión no está avalada por la literatura médica ni por los datos fisiológicos.
Es bien sabido que la reanimación sin oxígeno es eficaz, como se describe en las referencias antes citadas. Además, en la reanimación boca a boca se aporta una concentración de oxígeno inferior a la del aire ambiente (FiO2: 0,18-0,20), y se ha empleado eficazmente durante décadas. La práctica neonatal de "uno u otro extremo" (21 % frente a 100 %) en la sala de partos puede ser comprensible en zonas pobres y subdesarrolladas, que carecen de tecnología cara y de UCIN. En estos lugares (y sólo en ellos), si se descarta o es improbable una neumopatía grave, parece que la mejor alternativa sería reanimar con aire ambiente, y cambiar a una FiO2 de 1,0 si el niño no responde de forma adecuada. O bien, en caso de duda, se puede comenzar con oxígeno al 100 % y cambiar a aire ambiente inmediatamente después de que aparezcan signos iniciales de recuperación. En cualquier otro lugar del mundo industrializado, así como en los centros de los países en vías de desarrollo que pueden permitirse el disponer de tecnologías costosas y UCIN, el practicar sólo con los dos extremos de las dosis de oxígeno (administración de oxígeno al 21 o al 100 %), es simplemente subóptimo.
Niveles de oxigenación y "malpraxis"
En la actualidad, el nivel de oxigenación en el recién nacido se mide de dos maneras: gases en sangre arterial (PaO2) y monitorización de la oximetría de pulso (SpO2). La historia de la monitorización del oxígeno tiene también sumo interés y la hemos resumido en un reciente trabajo23. Los electrodos de PO2 transcutánea (TcPO2) se utilizaron en la década de 1970 y, aunque fueron útiles en su época, quedaron reemplazados por la SpO2 a mediados o fines de los años 1980. Las determinaciones de oxígeno capilar (PcO2) no son fiables para medir la oxigenación, dado que una PcO2 de 45 mmHg puede corresponder a una PaO2 de 50 mmHg o de más de 80-100 mmHg. Los monitores de SpO2 se utilizan hoy día profusamente y este tema se halla todavía en evolución al ir incorporándose a la práctica nuevos avances tecnológicos. En otra revisión dedicada a la oximetría de pulso en medicina neonatal73 se describen los aspectos más importantes de la SpO2, las diferencias significativas entre los distintos monitores que existen en el mercado, y también lo que sabemos e ignoramos sobre la oxigenación. Baste señalar aquí que, tal como ocurre con cualquier dispositivo de medición, existe una variabilidad aceptada de ± 0,5 % a ± 3 % al establecer comparaciones con el parámetro de referencia (cooximetría). Además, los distintos monitores de SpO2 no son equivalentes entre sí. Muchos de ellos presentan un porcentaje elevado de falsas alarmas, no son exactos para eliminar el ruido, tienen "períodos de latencia" y son más sensibles a los artefactos lumínicos y de movimientos. En resumen, es posible que muchos monitores de SpO2 no funcionen bien cuando el clínico más los necesita. Además, algunos de ellos miden y exhiben la saturación funcional de oxígeno y otros la saturación fraccional73,74. Algunos monitores leen 1,5-4 % por encima o debajo de otros, incluso en las condiciones más estables. Así pues, esta información y otras descritas en detalle en nuestra publicación sobre oximetría de pulso73 ayudan a comprender que el valor de saturación "ideal" o más apto o conveniente en los niños pretérmino no es fácil de definir, y no puede ser simplemente un valor determinado.
En muchos lugares no se mide cuidadosamente la dosis de oxígeno (FiO2) durante todo el tiempo en que se administra a los niños prematuros, debido a la falta de mezcladores. La falta de utilización de los mezcladores en la sala de partos, con aporte de oxígeno al 100 % (FiO2: 1,0) y sin medir la SaO2, es inaceptable, como hemos descrito en un libro de texto de pediatría75. En estos casos, a menos que exista una grave afectación pulmonar, la PaO2 podría ser muy elevada (200-400 mmHg) y si se mide la saturación real de oxígeno arterial sería del 100 %, con una lectura de SpO2 > 95 % (hasta 100 %). Hasta disponer de evidencias más precisas, los neonatólogos podemos argumentar y discutir sobre cuál es el nivel de SpO2 más adecuado, y discrepar si el "objetivo de saturación" para el destete de la FiO2 es la SpO2 de 93 o de 96 % o cualquier otro porcentaje. Pero esto puede realizarse con humildad, sabedores de nuestra ignorancia acerca de qué es "lo mejor" y reconociendo los errores de medición en los monitores de SpO2 y las diferencias entre ellos73. Pero, sean cuales fueren las lagunas de nuestros conocimientos actuales, usando un mezclador de oxígeno y midiendo la oxigenación (monitor de SpO2) "aumentan las evidencias". De este modo, el niño no quedará expuesto a elevados niveles de oxigenación, decididamente anormales, y la FiO2 podrá disminuirse tan rápidamente como fuera necesario, según la tolerancia del niño.
Otra malpraxis es la de la ventilación manual en un niño intubado cuando se realiza con un gas inspiratorio que fluye directamente a una bolsa y mascarilla a través del caudalímetro mural (es decir, al 100 % o FiO2 1,0). Por muchos motivos puede ser necesaria la ventilación manual, como durante la intubación en la sala de partos, el "deterioro" en la UCIN, el cambio del tubo intratraqueal y otros. Sin embargo, debemos recordar que el gas "mural" es "oxígeno puro", frío y seco. Estas dos cuestiones modifican la dinámica del flujo e influyen sobre los pulmones y las vías respiratorias. Además, si el niño recibía previamente una FiO2 < 1,0 (es decir, 40, 60, 70 %) y se hallaba estable, y luego, con la ventilación manual con "oxígeno puro", sin emplear un calentador-humidificador y un mezclador, la saturación es del 100 %, es imposible saber el grado de elevación de la PaO2.
Otra malpraxis es la que se produce en muchos lugares cuando se modifica la dosis de oxígeno (FiO2) sin órdenes o documentación por escrito. Incluso hoy día, en muchos lugares y en muchos momentos en la UCIN, los proveedores sanitarios que asisten a los niños pretérmino modifican la FiO2 de manera significativa. En su mayor parte, no queda constancia de estas modificaciones en la historia clínica. Esta prestación asistencial con riesgo de cifras "anormalmente altas" de la FiO2 y de los niveles de oxigenación se describe en el siguiente ejemplo. Un niño pretérmino en la UCIN presenta un descenso en la SaO2 (SpO2 de 75-80 %) y suena la alarma del monitor. Algún miembro del equipo que cuida al recién nacido aumenta la FiO2 un 5-10-20-30 % o más. El niño entonces "se recupera", las lecturas de SpO2 son de 98-100 % y el niño se deja "en buen estado", dado que la SaO2 es "tan buena o mejor" que antes. Muchos recién nacidos se dejan así por algún tiempo, sin una comprobación exacta de lo que está sucediendo. Y muchas alarmas de monitores se dejan apagadas. En la mayoría de los niños, si no en todos, no se miden los gases en sangre arterial durante este período que hemos descrito, cuando se ha modificado significativamente la FiO2. Luego, minutos u horas más tarde, cuando otro proveedor sanitario se encuentra con el aumento de la FiO2 y una SpO2 de 97-100 %, una práctica frecuente es la de disminuir inmediatamente la FiO2 hasta los valores basales, o próxima a ellos. El niño puede quedar entonces "bien oxigenado", con una SaO2 del 93 % y una PaO2 de 45-60 mmHg, o "rebotar" a unas cifras bajas de SpO2. Por lo tanto, en los niños que respiran una FiO2 > 0,21 y se exponen (con demasiada frecuencia) a estas circunstancias, no sabemos qué elevación presentó la PaO2 durante el período en que ésta no se midió, pero la saturación era del 97-100 %. Además, el niño puede quedar sujeto a amplias fluctuaciones en la oxigenación. Esto es lo que hemos dado en llamar "una relación perdida". Una situación similar se observa con el uso de cánulas nasales. Un niño se encuentra con 0,5 l/min y una FiO2 de 0,30, aproximadamente; el niño "desatura" y/o sufre una crisis de apnea y suena la alarma del monitor de SpO2. Se aumenta entonces la FiO2 a 0,40 o más y/o se cambia el flujo de gas. La saturación se "recupera" y aumentan las cifras de SpO2. El niño se deja "en buen estado" con dicho tratamiento. ¿Cuál es la cifra de PaO2?
Si durante la vida fetal se produce el crecimiento y existe un buen estado de salud con saturaciones de 70-80 %, ¿por qué insistimos en mantener la SaO2 > 95 % en niños pretérmino que reciben oxígeno suplementario? Ello tiene un significado especial, dado que los pulsioxímetros no ofrecen suficiente información sobre la tensión de oxígeno en sangre arterial (PaO2), que puede ser muy elevada (> 200-350 mmHg) cuando un niño respira oxígeno suplementario.
Los monitores de la SaO2 se introdujeron en la práctica en la década de 1980, no sólo sin practicar previamente ensayos de distribución aleatoria, sino también, lo que es probablemente más importante, sin educar a los proveedores sanitarios de todo el mundo (enfermeras, terapeutas respiratorios y médicos) sobre la relación cambiante entre el oxígeno y la hemoglobina, la PaO2 y la SaO2. Cuando un niño pretérmino (y cualquier ser humano) respira un gas con suplementos de oxígeno y tiene una SaO2 del 100 %, no es posible predecir los niveles de oxigenación ni la PaO2, que puede ser "tan baja como" 60-70 mmHg o "tan alta como" 400 mmHg, o más. A pesar de todo ello, en muchos lugares se aceptaron los valores "fisiológicos" de SaO2 y se introdujeron en la práctica como el objetivo a lograr para los niños pretérmino de cualquier edad gestacional y posnatal que recibieran oxígeno suplementario, basándose en los niveles de SaO2 observados en niños sanos a término o en niños pretérmino que respiran aire ambiente (mediana de los valores del 96-99 %, como se describe en las referencias 76-79).
Se desconoce cuál es la SpO2 óptima o ideal para los niños pretérmino. Por lo tanto, es imposible la práctica clínica basada en la evidencia. Sin embargo, dado que tantos niños reciben oxígeno y se controlan con monitores de SpO2, debemos esforzarnos en identificar y tratar de erradicar malpraxis como las descritas.
¿Cuál es la evidencia de que los niveles de PaO2 y SpO2 elevados y con amplias fluctuaciones constituyen malpraxis?
En un estudio de cohortes realizado en el norte de Inglaterra sobre los niños nacidos entre 1990 y 19947, se encontró que los niños tratados con intención de mantener un objetivo de SpO22 del 88-98 %. Sin embargo, en el primer grupo sólo el 6 % sufrieron retinopatía del prematuro umbral, frente al 28 % en el otro grupo. Además, los recién nacidos con límites inferiores de SpO2 estuvieron menos días recibiendo oxígeno (40 frente a 96 días) e IMV (14 frente a 31 días), y su peso bajó mucho menos, pues sólo el 17 % tenían un peso por debajo del percentil 3 al ser dados de alta, en comparación con el 45 % en los niños con límites más altos de SpO2. Hubo 295 sobrevivientes, pero la conducta con respecto a la SpO2 se descubrió retrospectivamente, y se utilizaron cuatro tipos diferentes de monitores, con distintas técnicas.
En diversas encuestas se han revelado situaciones similares. En la más reciente14 se señaló que la gama de SpO2 para los niños de MBPN varió entre el 82 y el 100 %, entre todos los que respondieron a la encuesta. La cifra media de la SpO2 mínima fue del 90 % (± 3 %); la cifra media de la SpO2 máxima fue del 96 % (± 2 %). La proporción de recién nacidos con retinopatía del prematuro grave ($ 3) fue más baja si el objetivo de la SpO2 máxima era inferior al 92 % (2,3 % frente a 6 %). La cirugía retiniana en los niños de MBPN es menos frecuente cuando los límites de la SpO2 son inferiores al 98 % en las dos primeras semanas de vida (2,5 % frente a 5 %), y también es menos frecuente si la SpO2 es inferior al 92 % incluso después de las 2 semanas de vida.
Bornhorst y Poets80 han mostrado que al utilizar como límite superior de la alarma una saturación del 95 %, existe una sensibilidad del 95 % con un oxímetro Masimo® para detectar una PaO2 > 80 mmHg, que actualmente es el límite superior recomendado por la American Academy of Pediatrics81. Marlow, al comentar los futuros estudios clínicos, mencionó que debe evitarse el ascenso excesivo de la SpO2, que probablemente no sería aceptado por los comités de ética82. Después del trabajo intensivo de la Dra. Cole para tratar de iniciar el estudio Pulse Oximetry Saturation Target (POST-ROP), los límites de saturación propuestos para los dos grupos (85-89 y 91-95 %) no incluyen un grupo de "elevada SaO2" (> 95 %). Por último, nosotros hemos demostrado recientemente que una estricta política de administración de oxígeno y monitorización, con el objetivo de alcanzar una SaO2 de 88-93 %, se asocia a una disminución significativa de la retinopatía del prematuro8, lo cual se describe detalladamente más adelante. Todos los estudios actuales indican claramente que deben evitarse las saturaciones elevadas de oxígeno y la posibilidad de hiperoxia (elevada PO2). Aunque todavía no se sabe cuál es el nivel inferior seguro de la SpO2, sí sabemos que con saturaciones de 88-93-95 % se mantiene una PaO2 por encima de 45 mmHg y, habitualmente, por debajo de 75-80 mmHg. Queda por determinar si esta última PaO2 es demasiado elevada para algunos niños inmaduros, pero este temor es el que lleva a algunos clínicos a tratar de mantener la SpO2 < 92 % en la mayoría de niños con edades gestacionales extremadamente bajas.
El evitar la hiperoxia puede además ser beneficioso para procesos distintos de la retinopatía del prematuro, como la displasia broncopulmonar y la leucomalacia periventricular. Además, el estrés oxidativo influye sobre la apoptosis y el crecimiento celular83. Esto puede guardar cierta relación con las lesiones de la sustancia blanca y con las consecuencias a largo plazo sobre el crecimiento y el desarrollo, e incluso en la carcinogénesis. A este respecto, en un estudio sueco se ha señalado que la administración de oxígeno al nacer aumenta el riesgo de desarrollar leucemia linfocitaria infantil (OR, 2,3; IC 95 %, 1,5-3,6)84.
En relación con los niveles fluctuantes de oxígeno y la retinopatía del prematuro, diversos estudios en animales y en seres humanos apoyan la relación entre dicha fluctuación y la lesión retiniana85-91. Penn85-87 mostró que la gama de PaO2 y los valores alternativos empeoraban la retinopatía en un modelo de retinopatía del prematuro. Un ciclo de 12 h en la FiO2 (con cambio del 40 al 80 %) produjo neovascularización en el 72 % de los casos, pero cuando la FiO2 se mantuvo constante en 0,8, la neovascularización ocurrió en el 18 %. La gravedad fue de cinco sectores horarios en el primer grupo de animales, frente a 2,3 en el segundo. Saito et al88 encontraron que cuanto mayor era el coeficiente de variación de la PaO2, tanto peor era la retinopatía. Cunningham et al89 estudiaron la variabilidad de la TcPO2 (31 frente a 38 niños) y encontraron peores retinopatías cuando la variabilidad era mayor. Finalmente, York et al90 analizaron los gases en sangre arterial en 231 lactantes entre 1993 y 1995. Las mediciones se efectuaron por término medio cada 2,4 h y el coeficiente de variación estaba directamente relacionado con el riesgo de retinopatía del prematuro. Muy recientemente, McColm et al91 han mostrado los efectos de la fluctuación hiperóxica en un modelo en ratas.
En resumen, durante los últimos años, un cierto número de estudios han sugerido que la SaO2 "fisiológicamente normal" en los recién nacidos sanos que respiran aire ambiente, aceptada por muchos como objetivo de la SpO2 en las UCIN, puede ser demasiado elevada para el niño prematuro, y que permitir fluctuaciones significativas de la oxigenación puede ser perjudicial. Lamentablemente, el objetivo de una SaO2 "alta" (> 95 %) en los niños pretérmino tratados con oxígeno ha constituido una práctica clínica habitual, y todavía sigue siendo así en algunos lugares y en ciertos momentos, acompañada algunas veces de frecuentes "vaivenes" en la FiO2. Existe una "zona de confort", dentro de la cual se admite que, si la SaO2 es "alta", el niño pretérmino se encuentra en una buena situación. Esto debe modificarse, pero los valores y los rangos de SpO2 "más bajos" descritos en recientes estudios de cohortes no pueden ser la base para el tratamiento sistemático de todos los niños prematuros de cualquier edad gestacional y posnatal. Ningún rango debe convertirse en una práctica estándar hasta que se resuelvan las preguntas en torno a los riesgos y beneficios a corto y largo plazo, y hasta que (si alguna vez se logra) se utilice universalmente la misma tecnología de última generación para monitorizar la SpO2. Sin embargo, ello no equivale a afirmar que "nosotros seguiremos prestando la misma asistencia que siempre, porque es nuestro modo de actuar". La erradicación de algunas prácticas erróneas no equivale a poner en práctica sistemáticamente y de un modo estricto prácticas cuya eficacia no está demostrada. Deben incrementarse y propagarse los conocimientos ampliados y la educación de los hechos conocidos y demostrados, pues el hiato o la brecha entre los conocimientos y la práctica se asocian a morbilidad, y ésta a veces, puede ser letal.
Cambio de cultura en las UCIN: proceso de educación y puesta en práctica de las normas relativas a la administración y la monitorización de oxígeno
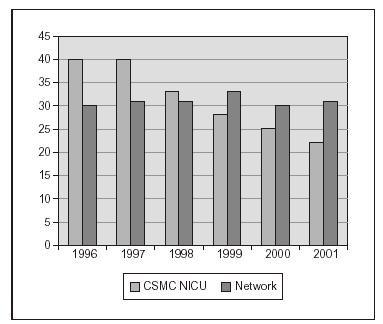
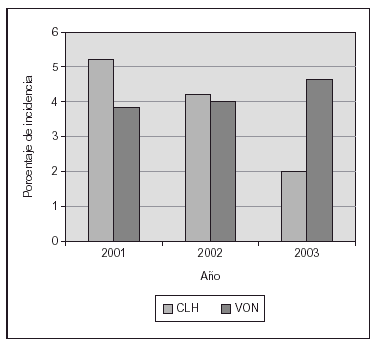
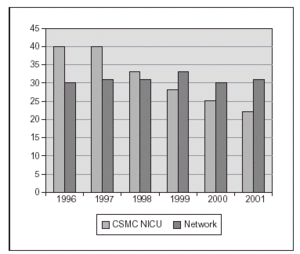
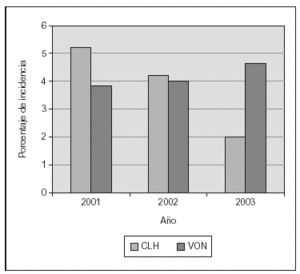
Nosotros hemos publicado recientemente un estudio sobre una práctica estricta con monitorización adecuada de SpO2 (Masimo®) y un proceso educativo continuo de mejoría de la calidad de atención y la aplicación de guías para lograr cambios en la práctica clínica, lo cual se asoció a un impacto clínicamente significativo en la prevención de los casos más graves de retinopatía del prematuro8. El cambio en las prácticas se produjo desde el momento del nacimiento, con empleo de mezcladores y monitorización de SpO2 en la sala de partos, y la aceptación de valores de SpO2 "más bajos de lo habitual" hasta que la retina madurara. El objetivo fue lograr una SpO2 de (85 %) 88-93 % (95 %), así como evitar cambios amplios en los valores de FiO2 y SpO2. En 238 niños de MBPN que sobrevivieron y a quienes se les practicó evaluación oftalmológica minuciosa, las tasas de retinopatía del prematuro grave disminuyeron desde el 12 al 2 % y no se requirieron intervenciones con láser. Ello incluyó la evaluación detallada de 148 recién nacidos supervivientes cuyos pesos de nacimiento oscilaban entre 500 y 1.250 g8. La tasa de displasia broncopulmonar también disminuyó significativamente (fig. 2). En los últimos 2 años hemos tenido una experiencia muy similar en un centro diferente (con un descenso del 13 al 3 % en las tasas de retinopatía grave) y una notable disminución en la necesidad de recurrir al láser (datos no publicados; fig. 3).
Figura 2.Proporción de niños con displasia broncopulmonar (O2 a las 36 semanas) después de poner en práctica unas guías sobre la administración y monitorización de oxígeno (un centro: CSMC y datos de Vermont Oxford Network, gran base de datos con > 25.000 niños < 1.500 g).
Figura 3.Proporción de intervenciones con láser en niños con peso de nacimiento de 500-1.500 g. Las prácticas educativas y el empleo de un monitor de SpO2 de última generación (Masimo®) se asoció con un notable descenso (centro único en Emory en comparación con base de datos de Vermont Oxford Network [VON]).
Para lograr estas modificaciones en la práctica clínica, fue necesario "cambiar la cultura". Para ello, estudiamos el fascinante tema del cambio de cultura en la asistencia sanitaria. Aprendimos que es importante conocer el significado de la cultura organizativa en la UCIN, dado que cada institución tiene su carácter, propio y peculiar, que influye poderosamente sobre la calidad asistencial y el ambiente global. Al intentar cambiar la cultura, se puede tratar de lograr una reforma o una transformación. Aprendimos que luchar a brazo partido con la cultura existente en cada UCIN es una empresa importante y necesaria si se ha de lograr una verdadera transformación. Para llevar a cabo la transformación, cada miembro del equipo de liderazgo, incluidos los directores médicos, debe estar preparado para emprender una ardua labor y emplear el tiempo necesario para cambiar la cultura organizativa. Un "cambio de primer orden" implica hacer lo que uno hace mejor, mediante reproducción cuantitativa y repetición (es decir, "cambio de cultura"). El "cambio de segundo orden", por otra parte, es un crecimiento cualitativo, algo diferente (es decir, "cambio de cultura"). Se afirma que ello es necesario cuando una cultura existente ha empezado a estancarse. También aprendimos que los valores profesionales, afirmados durante años y décadas, son lo suficientemente resistentes como para frustrar muchos intentos de lograr cambios. Este es el motivo por el cual las acciones a implementar no deberían sólo tratar de modificar la conducta habitual.
Un punto importante en este proceso fue el de recordarnos todos nosotros, en todo momento y con bastante frecuencia, que "más importante que lo que vemos es lo que no vemos", en relación con la oxigenación y los complejos cambios fisiológicos. Creemos que, a pesar de la utilidad que tienen los monitores de SpO2, no debemos quedarnos fijados en un determinado valor de SpO2 (que podemos ver) y luego perseguirlo. Nuestro enfoque es algo diferente: aprender y recapacitar sobre las curvas de SaO2, los monitores de SpO2, sus diferencias y los inconvenientes de algunos, y los cambios que pueden inducirse sobre VEGF, IGF-1 y las especies de radicales del oxígeno con elevaciones transitorias de la PaO2, los cuales no pueden verse. Otro punto importante en nuestra educación fue aceptar que no han existido nunca pruebas convincentes del uso "racional" del oxígeno suplementario en la asistencia de los niños pretérmino, pero existe evidencia fisiológica y conocimiento de la relación entre la SpO2 y la hemoglobina. En la tabla 2 se resumen los conceptos importantes en los que puede basarse el proceso educativo y que pueden lograr un cambio en la cultura.
Sobre la base de nuestros hallazgos, se puede concluir que mediante un equipo adecuado para monitorizar la SpO2 (Masimo Signal Extraction Technology®), acompañado de una estricta práctica clínica de administración y monitorización de oxígeno que evite las cifras "altas" de SpO2 y minimice las fluctuaciones amplias desde el momento del nacimiento y durante las primeras semanas de vida, se logra un descenso significativo de la retinopatía del prematuro grave. Esto no se acompaña de un aumento de la mortalidad, ni de un incremento de las anomalías del desarrollo, y se asocia a un descenso de la displasia broncopulmonar. También concluimos que la variabilidad intercentros (y también intracentros) descrita para las tasas de retinopatía del prematuro está relacionada, al menos en parte, con diferencias en las prácticas clínicas y en el manejo minuto a minuto de la administración y la monitorización del oxígeno. No concluimos que la ceguera pueda eliminarse completamente por esfuerzos estrictos para mantener la "FiO2 < 40 %", o para mantener la SpO2 en 85-93 %. Naturalmente, tampoco se puede concluir cuál es el nivel óptimo de SpO2 para los niños muy prematuros.
Evitar elevadas saturaciones (97-100 %) en los niños prematuros que respiran oxígeno suplementario (monitorizado) no es lo mismo que recomendar un rango fijo de "saturaciones de oxígeno más bajas". Sin embargo, el mantener una SaO2elevada y una FiO2elevada cuando no son necesarias constituye una práctica de alto riesgo que puede y debe evitarse. El dilema del clínico y de cualquier proveedor de cuidados asistenciales en la UCIN es entonces saber cuál de los rangos de SpO2 < 95 % es seguro y beneficioso para las diferentes edades gestacionales y posnatales. Esto no se sabe a ciencia cierta y se está en espera de ulteriores estudios. En nuestra práctica habitual se elige un rango como objetivo, con un abanico de unos 9 puntos porcentuales de saturación (85-93 %). Con ello no se pretende decir que éste sea el modo de manejar a todos los niños de MBPN desde el nacimiento hasta el alta, si respiran oxígeno suplementario. En los niños más pequeños, algunos especulan que incluso valores más bajos de SpO2 (82-83 % de mínima y 88-91 % de máxima) podrían ser suficientes, con la advertencia de que, cuando un niño con hipertensión pulmonar no es capaz de oxigenar, o cuando un niño de más edad tiene displasia broncopulmonar o retinopatía del prematuro grave, estos rangos y niveles de SpO2 se han de decidir de manera individual.
Nosotros recomendamos la educación y la expansión de los conocimientos y comprensión por parte de todos los proveedores de cuidado neonatal en UCIN de que lo que se sabe puede ser peligroso. Consideramos que, después de un proceso educativo adecuado, la mayoría estará de acuerdo con lo que es "malpraxis" en relación al oxígeno. La erradicación de prácticas asociadas con elevado riesgo y el cambio de un monitor con falsas lecturas y alarmas y períodos de latencia por otro sin esos problemas, sólo puede ser beneficioso en la práctica clínica.
Lo que recomendamos es "cambiar la cultura". Ello incluye lo siguiente: a) monitorización continua de FiO2 y SpO2; b) aumentar nuestro conocimiento de que cuando un niño respira una FiO2 > 0,21 y la SaO2 es superior al 95 % y de hasta el 100 %, puede perderse la relación entre la SaO2 y la PaO2; y, por lo tanto, no debemos buscar SaO2 elevadas cuando se utiliza una FiO2 > 0,21. Además, recomendamos: c) evitar los cambios cíclicos y amplios y los rápidos aumentos de la FiO2; d) documentación de los datos; e) quedarse al lado del niño cuando se ha "recuperado" de un episodio, y f) iniciar pronto el destete del oxígeno, pero lentamente. Además, recomendamos utilizar monitores de oximetría de pulso fiables, de última generación (Masimo® SET), para evitar responder a "falsas alarmas"; y mantener los límites de las alarmas mientras el niño reciba FiO2 > 0,21 durante los períodos de alto riesgo para el desarrollo, a partir del momento del nacimiento. Finalmente, recomendamos manejar al niño con SaO2 que, en virtud de las conocidas relaciones fisiológicas entre la hemoglobina y el oxígeno, estén relacionadas con una PaO2 "ni baja ni alta" según los estándares aceptados actualmente. Debemos aceptar con humildad la incertidumbre acerca de cuál es la gama de saturación "mejor" o "ideal" para todos los niños pretérmino, sean cuales sean sus edades gestacionales o posnatales. Para ello serán necesarios ulteriores estudios.
Finalmente, la peor incidencia y progresión de la retinopatía del prematuro observada en algunas regiones o unidades hace que uno se pregunte si cualquiera de los muchos cambios que han ocurrido en la asistencia clínica neonatal durante los últimos 12-15 años puede ser parcialmente responsable de ello. De todos los principales cambios terapéuticos que se han introducido en la práctica clínica, sólo uno se estudió adecuadamente: el uso de surfactante exógeno. Esta práctica se asoció con cambios más agudos en la oxigenación muy precozmente en el período posnatal. Lamentablemente, en torno a la época en que se inició el uso sistemático del surfactante exógeno, los monitores de TcPO2 se sustituyeron por los de SpO2. Algunas UCIN emplearon o emplean aún "estrategias de ajuste" de la FiO2 (subiendo y bajando la FiO2), potencialmente asociadas con grandes oscilaciones de la PaO2. Recientemente se están aceptando cifras "más altas" de PaCO2, y posiblemente se toleran más episodios apneicos, dado que el uso de CPAP es más prevalente. No se sabe bien el modo como estas combinaciones influyen sobre la retina en desarrollo.
Estudios actuales y futuros
El estudio AVIOX (Actual Versus Intended Oxygen saturation) se presentó en forma preliminar en una reunión de investigación92 en mayo de 2004. El estudio muestra que la proporción de valores de SpO2dentro del rango pretendido, variaba entre 16 y 71 % en los diferentes centros del estudio. La mayor parte de la falta de cumplimiento se situaba por encima del valor extremo superior del rango deseado, lo cual habla a favor del hecho de que la asistencia habitual de los niños prematuros de muy bajo peso que reciben oxígeno suplementario varía sustancialmente entre los diferentes centros.
La Dra. Cole y un gran grupo de investigadores están planificando extensamente el estudio POST-ROP, en el que se incluirá a niños prematuros de muy bajo peso. Para este ensayo propuesto de distribución aleatoria, controlado y de carácter ciego, el rango deseado de saturación desde el nacimiento oscila entre el 85 y el 89 % en un grupo, y entre el 91 y el 95 % en el otro. Es de esperar que los resultados ayuden al clínico a determinar más adecuadamente el nivel de saturación seguro y eficaz que debe perseguirse. En un editorial publicado en Pediatrics en diciembre de 20031 recomendando el ensayo POST-ROP, se afirmaba que "La evidencia de ventajas o inconvenientes netos en una determinada condición clínica deben considerarse en el contexto de lo que sucede en otras condiciones. Por ejemplo, sería inapropiado dar por finalizada la incorporación de niños al estudio si se observa una reducción del 3 % en la retinopatía del prematuro grave en el grupo con menos oxígeno, antes de que el ensayo hubiera alcanzado un poder suficiente para poder excluir científicamente un aumento del 6 % en la mortalidad o en alteraciones graves del neurodesarrollo en el mismo grupo. En este caso, si el ensayo se diera por finalizado prematuramente y la concentración más baja de oxígeno se aceptara como estándar clínico, por cada niño cuya vista se salvara habría dos que fallecerían o sobrevivirían con minusvalías importantes".
Además, se están iniciando otros ensayos a menor escala y estudios básicos con el fin de investigar nuevos fármacos potencialmente útiles para disminuir la angiogénesis retiniana anormal93-96. Entre ellos cabe citar los siguientes: exploración en un modelo murino con expresión del neuropéptido Y, análogos de la somatostatina, ibuprofeno y escualamina, entre otros, para inhibir la neovascularización retiniana neonatal y estimular la regresión de la retinopatía inducida por el oxígeno93-96. Esta innovadora labor espera confirmación y podría ser de importancia clínica en el futuro.
Comentarios finales
El oxígeno se introdujo en la práctica clínica neonatal en ausencia de estudios de distribución aleatoria. Además, no se ha medido bien ni de un modo sistemático, incluso hoy en día con monitores de SpO2. Sin embargo, el oxígeno es uno de los tratamientos que se emplean con más frecuencia en las UCIN, muchas veces sin límites ni control. Si ahora pasamos a recomendar "unas saturaciones de oxígeno más bajas" sin disponer de un ensayo controlado fidedigno, podemos estar condenando a la muerte o a minusvalías graves a un número mayor de niños de los que se podrán salvar de la ceguera. No obstante, evitar o erradicar errores no es simplemente utilizar "saturaciones de oxígeno más bajas". En la actualidad, la retinopatía del prematuro es un lamentable y creciente problema global, una complicación persistente con riesgo para la vista en los niños con una edad gestacional muy baja (EG < 28 semanas) en los países industrializados, y también en niños pretérmino de más peso y edad gestacional en los países en vías de desarrollo. La evolución visual tras la retinopatía del prematuro grave es desfavorable incluso si se trata, y la retinopatía constituye la causa más frecuente de ceguera. Es posible prevenir la retinopatía si se realizan esfuerzos en el campo de la investigación y también en el de la práctica clínica. Aunque es posible que en un futuro no demasiado lejano pueda utilizarse algún tratamiento preventivo, como los fármacos que modulan la angiogénesis (bloqueo de los receptores VEGF o NPY, inhibición de COX-2, escualamina) u otros como el inositol, en el momento actual nuestra cultura se puede modificar y cambiar la relación entre los conocimientos que poseemos y la asistencia que reciben los niños, modificando la práctica clínica para erradicar la malpraxis. No debemos ignorar las lecciones de la historia, para no repetir errores, al inmenso coste que pagan estos niños prematuros los pacientes más vulnerables y sus familias.
Nuestras observaciones nos han demostrado que, en muchos casos, más importante que lo que vemos en la práctica habitual es lo que no vemos. Esto puede aplicarse a lo que ocurre en muchos niños en las salas de partos o las UCIN de todo el mundo en relación con la dosis de oxígeno, la oxigenación y la retinopatía del prematuro.
"Lo esencial es invisible a los ojos", escribió Saint Exupéry en El Principito.