Las crisis prolongadas y el estado epiléptico son emergencias médicas neurológicas frecuentes y su tratamiento adecuado y precoz es fundamental para reducir su morbi-mortalidad. La mayoría de las crisis se inician en un medio extrahospitalario, lo que obliga a familiares y cuidadores a estar preparados en las medidas de actuación iniciales ante una crisis convulsiva. En su manejo, las benzodiacepinas (BZD) son los fármacos de primera línea, siendo el uso de diazepam rectal (DZPr) el más extendido en el ámbito prehospitalario en España. La Agencia Europea del Medicamento (EMA) autorizó en septiembre del 2011 el empleo de midazolam bucal (MDZb) para el manejo de las crisis epilépticas repetidas en pacientes entre los 3 meses y 18 años. Es un fármaco de acción rápida por evitar la metabolización hepática y con efecto de corta duración. MDZb ha demostrado al menos igual o mayor eficacia que el DZPr y la vía de administración bucal es más sencilla y mejor aceptada socialmente, sobre todo en adolescentes y adultos. Es un fármaco seguro, con efectos adversos similares a otras BZD. Estudios de farmacoeconomía demuestran un buen coste-efectividad global en el manejo de las crisis frente al DZPr, reduciendo traslados en ambulancia e ingresos hospitalarios.
Prolonged seizures and status epilepticus are common neurological medical emergencies. Early and appropriate treatment is essential to reduce morbidity and mortality. Most seizures occur in the community, so parents and caregivers must be prepared for their management. Benzodiazepines (BZD) are the first-line drugs used, with rectal diazepam (DZPr) being the most commonly used in pre-hospital treatment in Spain. In September 2011, the European Medicines Agency (EMA) authorized the use of oromucosal midazolam (MDZb) for the treatment of prolonged acute convulsive seizures in patients aged 3 months to <18 years. MDZb has a rapid onset, short duration of effect, and avoids first-pass hepatic metabolism. MDZb has shown to be at least as or more effective than DZPr to stop the seizures. Buccal administration is easier and more socially accepted, especially in adolescents and adults. It is a safe drug with similar effects to other BZD; MDZb improves the overall cost-effectiveness of seizures management.
Las crisis epilépticas prolongadas y el estado epiléptico (EE) son una de las emergencias médicas neurológicas más frecuentes. La Liga Internacional contra la Epilepsia (ILAE) define el EE como «una crisis que no muestra signos clínicos de detención después de una duración que abarca la gran mayoría de las crisis de ese tipo en la mayoría de los pacientes o crisis recurrentes sin recuperación del estado mental basal»1. La definición clásica de EE lo define como aquella crisis o sucesión de crisis a lo largo de 30 min o más, ya que este es el momento en que, en el modelo animal, se puede observar ya la muerte neuronal directamente atribuible a la crisis. Este criterio temporal es obviamente inapropiado para guiar el tratamiento, para lo cual se han establecido definiciones operativas de EE que lo definen como aquella crisis de duración superior a 5 min o la sucesión de crisis sin una recuperación del estado neurológico basal intercrítico. Esta definición se basa en la observación de que a partir de los 5-10 min es menos probable el cese espontáneo de la crisis y aumenta significativamente el riesgo de progresión a EE2.
La gran mayoría de EE se inician en el ámbito extrahospitalario, en presencia de familiares y cuidadores del entorno del paciente con epilepsia y, considerando la importancia de los minutos iniciales y su adecuado manejo para prevenir complicaciones, debemos tener unas guías explícitas y fármacos adecuados para su uso por la población general3. En el arsenal terapéutico de fármacos para frenar las crisis, además del diazepam rectal (DZPr), que hasta ahora era el fármaco estándar para el manejo de las convulsiones en el ámbito extrahospitalario, la Agencia Europea del Medicamento (EMA) ha aprobado en septiembre del 2011 el empleo del midazolam bucal (MDZb) para las crisis prolongadas en pacientes entre 3 meses y 18 años de edad.
Los objetivos de este trabajo son, por una parte, revisar los factores asociados al desarrollo del EE, su incidencia, fisiopatología y morbimortalidad. Por otra, revisar la evidencia sobre el uso de las benzodiacepinas (BZD) disponibles actualmente para el control de las crisis, tanto en el ámbito hospitalario como extrahospitalario, su eficacia, seguridad y vía de administración.
Epidemiología y fisiopatología del estado epilépticoFactores implicados en el desarrollo e incidencia del estado epilépticoSe estima que el 5-10% de la población experimentará una crisis a lo largo de su vida y, de ellos, el 20% tendrá crisis recurrentes. En sociedades desarrolladas, la incidencia de epilepsia varía entre 40-70 casos/100.000/año, ocurriendo la mitad aproximadamente en niños. En el informe de la Fundación Española de Enfermedades Neurológicas realizado en España, se observa que la epilepsia en nuestro país afecta a 31-57 casos/100.000/año, presentando 2 picos etarios, en la infancia y adolescencia —siendo más frecuente a menor edad— y en ancianos4,5. La incidencia de EE en niños es de 18-20/100.000/año, mientras que en adultos es de 4-6/100.000/año5. Chin et al. describen una incidencia máxima de EE en menores de un año, disminuyendo dicha incidencia a medida que aumenta la edad. Además, observan que la incidencia en neonatos y lactantes está particularmente marcada por ser crisis de origen sintomático agudo6.
La transformación de una crisis en EE depende de varios aspectos pero, además de la edad, entre los principales factores que aumentan el riesgo del desarrollo de un EE se encuentran:
Etiología de la crisisEs el principal determinante con evidencia científica para desarrollar crisis prolongadas y EE, y además es el principal factor de recurrencia de las mismas. Las crisis serán más prolongadas y recurrentes en las epilepsias de causa estructural/metabólica. Por grupos etarios, durante la infancia los EE más comunes son EE febriles, ocurriendo en un elevado porcentaje en niños con enfermedad neurológica previa. En los adultos, las principales etiologías son el ictus y el origen metabólico-alcohólico5.
Precocidad del tratamientoLa gran mayoría de los primeros EE ocurren en el ámbito extrahospitalario, en el que, a menudo, el tratamiento es subóptimo, no se trata o se hace con dosis bajas, según recogen diferentes estudios5. La no administración de tratamiento de urgencia duplica el riesgo de presentar un EE de duración superior a 60 min7 y es probable que un tratamiento precoz pudiera reducir el número de EE y la morbimortalidad asociada. Esto se relaciona con el concepto del punto de «no retorno», referido a un punto de inflexión durante la crisis tras el cual no cederá de manera espontánea5.
Mecanismo fisiopatológico del punto de «no retorno»Durante la crisis convulsiva, ocurre una primera fase compensada con una descarga excesiva hormonal y de neurotransmisores excitatorios —glutamato y aspartato— con efectos sistémicos y cerebrales (hipertensión arterial, hipertensión intracraneal, hiperglucemia...). En circunstancias habituales, se produce a continuación un aumento simultáneo de neurotransmisores inhibitorios (GABA), que equilibran la descarga y llevan al cese de la crisis. Cuando este sistema GABA es superado por el exceso excitatorio, se llega a un desequilibrio neuronal y a una segunda fase de descompensación, que prolonga la crisis8–10.
Estos eventos explican que, aun con gran variabilidad interindividual, existe un punto de «no retorno» en el que las crisis que superan aproximadamente los 10 min es poco probable que puedan ceder espontáneamente en los siguientes minutos, con un claro aumento del riesgo de evolución a EE y de ahí que se recomiende tratarlas entonces2.
Las BZD son moduladores de los receptores GABA-érgicos y son efectivos para el tratamiento de las crisis. Sin embargo, se sabe que en crisis prolongadas las BZD pueden llegar a ser ineficaces debido a la plasticidad de los receptores GABA de las neuronas hipocampales. Esto se demostró a través de modelos animales, en los que, a medida que se prolonga la crisis, se observa una aceleración de la internalización de los receptores GABA de la superficie sináptica y, en consecuencia, menor eficacia de las BZD11.
MorbimortalidadDepende de la causa de la crisis, que es el principal factor determinante, de los efectos del tratamiento y, también, de la crisis misma, aunque este es probablemente el factor menos importante. La prolongación de una crisis convulsiva aumenta la morbilidad neurológica, debido al compromiso metabólico cerebral, por agotamiento de la reserva de glucosa y el aumento del consumo de oxígeno. Junto a la acidosis láctica y a la hipertensión intracraneal, favorecen la hipoxia tisular cerebral y el edema cerebral12. Además del evidente impacto a nivel cerebral, el EE provoca otros cambios a nivel sistémico, originando hipertermia, insuficiencia renal por rabdomiólisis, edema y congestión pulmonar, neumonías por aspiración, arritmias cardiacas y disfunción ventricular e hipotensión. Tales complicaciones pueden conducir a la muerte.
El estudio poblacional prospectivo realizado por Chin et al. (estudio NLSTEPSS) en el norte de Londres describió una incidencia de EE convulsivo de 18-20/100.000 por año, que es mayor que la publicada para adultos (4-6/1.000.000 por año), y una mortalidad asociada del 3%, similar a la reportada previamente, pero menor que el 13% reportado para adultos jóvenes y el 38% de los ancianos6. En el estudio poblacional de De Lorenzo, realizado en EE. UU. y que incluyó a niños, pero sobre todo a adultos, se describió una incidencia de EE entre 126-195.000/año y una mortalidad asociada de 22-42.000 fallecidos13. Dicha mortalidad fue más frecuente durante los primeros años de la enfermedad, en varones y en pacientes con déficit neurológico y epilepsias de causa estructural/metabólica. No hay que olvidar que las muertes no siempre se asocian directamente a la crisis, sino a accidentes relacionados con la misma14.
Tratamiento: selección del fármacoAnte la aparición del MDZb en el arsenal terapéutico para el manejo de las crisis prolongadas y EE, revisamos las ventajas y desventajas de cada BZD, su vía de administración, seguridad y coste-efectividad.
EficaciaLas BZD tienen un efecto anticonvulsivo, ansiolítico, hipnótico y relajante muscular. Teniendo efectos similares, sus diferencias se deben a la potencia y la farmacocinética, que varía por la afinidad del fármaco con los diferentes subtipos de los receptores GABA. Son los fármacos de elección en el tratamiento de urgencia de las crisis epilépticas prolongadas desde los años 60, por su eficacia y rapidez de inicio de acción, avalados por múltiples estudios frente a placebo y a otros fármacos como fenitoína (PHT) y fenobarbital (PB)15–18. Las BZD más empleadas para el control de crisis epilépticas son DZP, MDZ y lorazepam (LZP). Respecto a su eficacia:
- –
El DZPr o por vía intravenosa ha sido el más empleado en nuestro ámbito hasta ahora. Su uso tiene base en múltiples ensayos aleatorizados que muestran su eficacia frente a placebo en crisis recurrentes. La dosis recomendada del DZPr es 0,3-0,5mg/kg (presentaciones de 5 y 10mg)10,11.
- –
El MDZ puede administrarse por vía bucal, intranasal, intramuscular o intravenosa La guía NICE en el 2012 recomienda el empleo de MDZb como primera línea para el tratamiento de las crisis prolongadas en niños, jóvenes y adultos, pero limita su indicación a aquellos que hayan presentado previamente crisis prolongadas. La dosis recomendada es 0,25-0,5mg/kg (presentaciones de 2,5mg, 5mg, 7,5mg y 10mg)10.
- –
El LZP por vía intravenosa tiene un uso extendido en otros países, pero no se dispone de presentación parenteral en España19. Se ha indicado que su vida media más larga podría reducir las recaídas14.
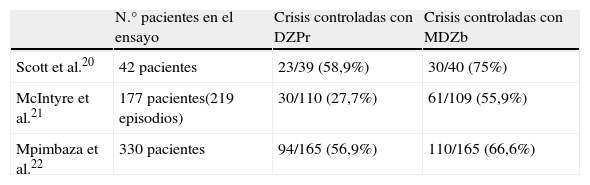
Diversos ensayos clínicos han comparado la eficacia y la seguridad de MDZb y DZPr, demostrando que MDZb es al menos igual o más eficaz para el cese de las crisis epilépticas (tabla 1)20–22.
Ensayos clínicos aleatorizados de MDZb vs. DZPr
| N.° pacientes en el ensayo | Crisis controladas con DZPr | Crisis controladas con MDZb | |
| Scott et al.20 | 42 pacientes | 23/39 (58,9%) | 30/40 (75%) |
| McIntyre et al.21 | 177 pacientes(219 episodios) | 30/110 (27,7%) | 61/109 (55,9%) |
| Mpimbaza et al.22 | 330 pacientes | 94/165 (56,9%) | 110/165 (66,6%) |
En un metaanálisis reciente, el MDZb se mostró más eficaz que DZPr (RR=1,54; IC del 95%,1,29 a 1,85)23. En una revisión sistemática, analizando 8 estudios24, el MDZb demuestra ser efectivo y seguro como alternativa al DZPr. Una revisión de la Cochrane compara la eficacia de MDZ, DZP, LZP, PHT y PB para las crisis tónico-clónicas y el EE en niños tratados a nivel hospitalario, y concluye que el LZP y el DZP por vía intravenosa son al menos igual de eficaces, pero en situaciones en las que no se logre inicialmente el acceso venoso, el MDZb es la mejor opción25.
Vía de administraciónLa vía de administración seleccionada debe ser cómoda, sencilla y asequible para personal no sanitario. Son varias las posibles vías de administración en el ámbito ambulatorio: rectal, oral, intranasal, bucal y, con personal sanitario, las vías intramuscular y la intravenosa. Cada vía de administración tiene unas particularidades:
- –
Hasta ahora, la vía rectal es la más extendida en España. Es relativamente sencilla de emplear, aunque tiene menor aceptación social en adolescentes y adultos, pudiendo existir reparo para su uso en el ámbito extrafamiliar. El fármaco empleado por vía rectal es el DZP, con buena biodisponibilidad y acción rápida. Las presentaciones en cánulas de 5 y 10mg limitan un ajuste adecuado de dosis por peso. Si bien es cierto que no supone un problema patente en la práctica clínica, el estreñimiento o la diarrea puede alterar su absorción y tiene menor facilidad de uso en personas en silla de ruedas23,24.
- –
La vía intranasal tiene una absorción rápida puesto que la mucosa nasal está muy vascularizada y evita el primer paso hepático. Su empleo es más sencillo que la vía rectal para el personal no sanitario. Tiene el inconveniente de que un catarro de vías altas podría alterar su absorción y que precisa de cantidades no pequeñas para su adecuada absorción, ya que es probable que en parte se degluta. Puede provocar en el paciente un sabor amargo, irritación, molestias o incluso dolor en la nasofaringe19,26.
- –
La vía oral tiene el problema fundamental de la deglución en el contexto de un EE convulsivo. La mayoría de BZD se absorben rápidamente por esta vía, con una biodisponibilidad que varía entre el 80 y el 100%, salvo el MDZ, debido a su metabolismo por la enzima 3ª5 del citocromo P-450, presente en el tejido intestinal, que puede reducir su biodisponibilidad hasta en un 50%, pero no existe actualmente ninguna BZD óptima para el cese de la crisis mediante esta vía10.
- –
La vía bucal, mediante la administración del líquido entre los dientes y la mucosa yugal. Su empleo también es sencillo, lo que facilita su uso por personal no sanitario19. Tiene una absorción rápida, puesto que también evita el primer paso hepático. Respecto al MDZb, es más rápido que por vía intranasal, presentando una Cmáx plasmática <30 min, con una biodisponibilidad del 87%23,24. En el trabajo de Garnock-Jones, se observó que el MDZb tenía un tiempo de respuesta más corto que el DZPr pero más lento que el DZP por vía intravenosa; sin embargo, el tiempo de inicio de tratamiento del MDZb fue significativamente menor que el de DZP por vía intravenosa debido a la demora para lograr el acceso venoso27. Wilson et al. realizaron una encuesta en la comunidad y obtuvieron que el 83% de las personas preferían el MDZ bucal o intranasal frente a la vía rectal28,29.
- –
La vía intramuscular y la vía intravenosa son las mejores opciones por su rapidez y eficacia pero son exclusivas del ámbito del transporte medicalizado y hospitalario. La vía intravenosa es considerada como la más eficaz y de primera elección en el medio hospitalario, aunque el acceso de una vía intravenosa en la práctica clínica, especialmente en niños, a menudo es dificultoso19,30. El estudio RAMPART demostró que el MDZ intramuscular no es menos eficaz que LZP por vía intravenosa en controlar las crisis epilépticas prolongadas y su uso se asocia a una menor necesidad de ingreso hospitalario. Por ello, debe considerarse su utilización en pacientes en quienes sea difícil conseguir un acceso venoso31.
Los efectos adversos de las BZD en niños son, en general, dependientes de la dosis: sedación, somnolencia postictal, náuseas y vómitos, depresión respiratoria y amnesia anterógrada. La incidencia de depresión respiratoria es similar para el DZPr y el MDZb, y se produce en alrededor del 5% de los casos. La mayoría de protocolos recomiendan un máximo de 2 BZD, ya que la administración de dosis adicionales triplica el riesgo de depresión respiratoria sin que ello se asocie a una mejora significativa en su eficacia7. En un ensayo clínico en adultos en que se compararon LZP, DZP y placebo por vía intravenosa, se observó que la mayor tasa de depresión respiratoria se daba en los pacientes que recibieron placebo, indicando que la aparición de depresión respiratoria se relacionaba más con la duración de la crisis que con los fármacos empleados32. Los efectos amenazantes para la vida son mayores en pacientes con insuficiencia respiratoria previa o disfunción cardiaca o hepática severas27.
Puesto que el MDZ se elimina a través del citocromo P-450 (CYP), los fármacos inhibidores o inductores del CYP pueden alterar su semivida. La aumentan: azoles, antagonistas del calcio, macrólidos, inhibidores de proteasas, antihistamínicos H1, anticonceptivos orales, entre otros. La disminuyen: rifampicina, xantinas, PB, entre otros10,27. Además, hay que considerar que la capacidad de metabolización del CYP en las edades extremas de la vida —durante los primeros meses de vida y en edades avanzadas— es menor y la eliminación del fármaco es más lenta, lo que prolonga su semivida y, por tanto, sus efectos9,10,33,34.
Coste-efectividadVarios estudios recientes evalúan el coste-efectividad de las BZD empleadas en el manejo de las crisis epilépticas. En su trabajo, Lee et al. consideran el precio del fármaco y la necesidad de ambulancia, de ingreso hospitalario y cuidados intensivos, encontrando que, aunque el MDZb es más caro que el DZPr, globalmente el MDZb resulta más económico al determinar un ahorro en otros conceptos, como menor número de ingresos y necesidad de cuidados intensivos35. Un modelo fármaco-económico realizado en España comparando el tratamiento de las crisis epilépticas prolongadas con MDZb frente a DZPr mostró un ahorro de 5.484 euros/paciente/año con MDZb, basado en un menor número de llamadas a ambulancias, visitas a urgencias y estancias hospitalarias, y una mejora de la calidad de vida relacionada con la salud36.
ConclusionesLas crisis epilépticas prolongadas y el EE son eventos frecuentes que, en la mayoría de las ocasiones, se inician fuera del ámbito hospitalario, por lo que es fundamental tener un fármaco eficaz y de uso sencillo para familiares y cuidadores. En las situaciones extrahospitalarias, el fármaco más empleado hasta la actualidad en España ha sido el DZPr. Sin embargo, la introducción del MDZb en nuestro ámbito supone una alternativa válida, ya que se recomienda como primera línea de tratamiento en pacientes pediátricos con crisis epilépticas prologadas repetidas. Las ventajas ofrecidas por el MDZb han llevado a actualizar las recomendaciones para el manejo de las crisis epilépticas de manera que, en la guía NICE elaborada en 201237, tanto el DZPr como el MDZb aparecen como fármacos válidos para el manejo inicial de las crisis epilépticas en las que no se tenga un acceso venoso
FinanciaciónViropharma ha realizado el soporte financiero del medical writer.
Conflicto de interesesLos autores han participado como expertos en un Panel Delphi esponsorizado por Viropharma.
Agradecemos al Dr. Joaquín Alejandro Fernandez Ramos su labor como medical writer en la elaboración de este artículo.