Sr. Editor:
El adenoma tóxico es una causa relativamente frecuente de hipertiroidismo en los adultos, pero es excepcional en la edad pediátrica. Se trata de un nódulo tiroideo funcionante y autónomo que produce cantidades suprafisiológicas de hormonas tiroideas, triyodotironina (T3) y/o tiroxina (T4), suprimiendo la secreción de hormona tiroestimulante (TSH), y la captación de radioyodo en la gammagrafía por el tejido tiroideo circundante. Clínicamente se caracteriza por la aparición de una tumoración en la cara anterior del cuello, con/sin síntomas de hipertiroidismo. Histológicamente, es un tumor benigno, encapsulado, de tejido folicular rodeado de tejido tiroideo normal 1,2.
La prevalencia de tirotoxicosis producida por adenoma tóxico varía de unas poblaciones a otras 1,2. En su patogenia parecen estar implicados factores de distinta índole (déficit de yodo, edad, tamaño del nódulo > 3 cm, sexo femenino), siendo de especial interés los genéticos (mutaciones en el gen TSH-R y, con menor frecuencia, en el gen Gs alpha) 3-5.
En relación a esta patología, presentamos el caso de un adenoma tóxico en una adolescente. Su interés radica tanto en lo inusual de esta entidad en los niños y adolescentes, como en la falta de guías terapéuticas para su tratamiento. En cuanto a este último punto, hay que tener en cuenta que los nódulos tiroideos en la edad pediátrica, además de ser menos frecuentes que en los adultos, tienen un riesgo de malignidad mucho mayor. Este riesgo parece aplicable también a los adenomas tóxicos, que pueden experimentar una degeneración maligna 1,6.
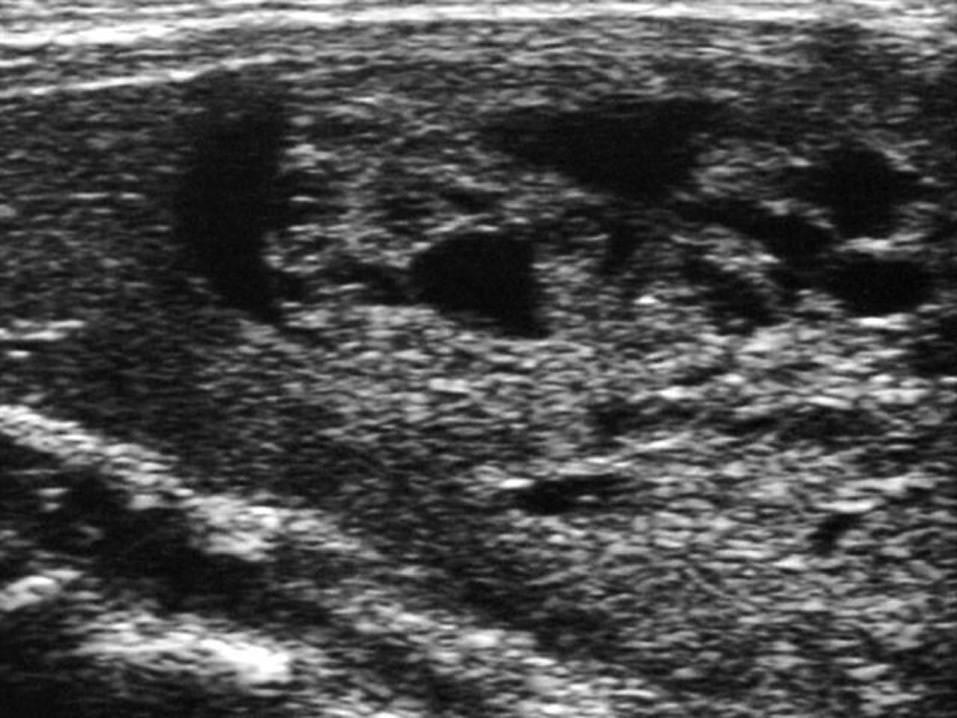
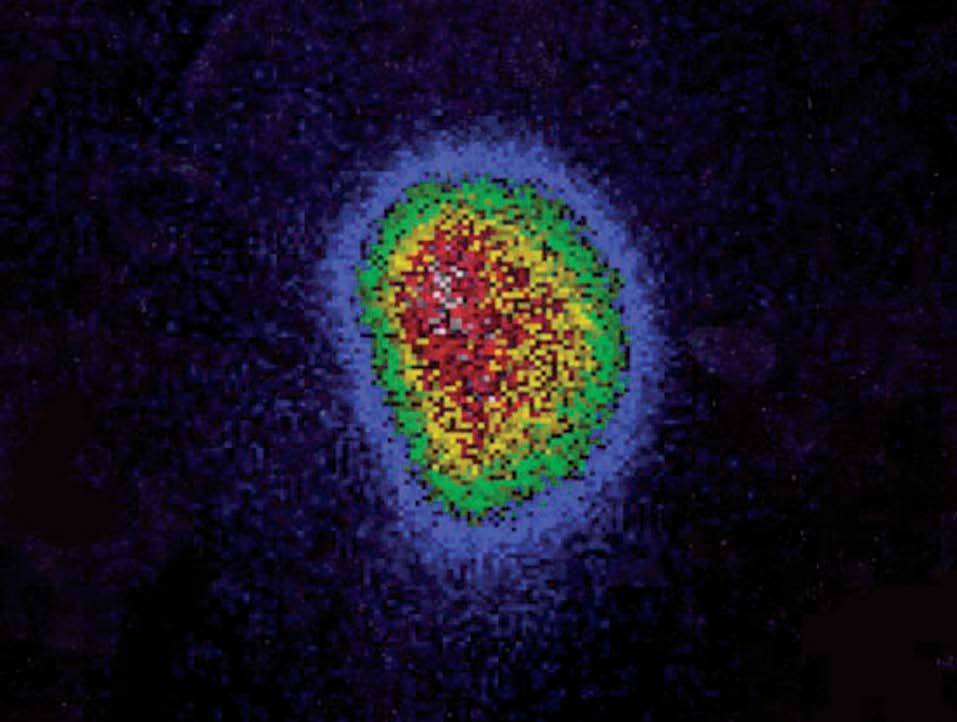
Se trata de una niña de 12 años y 5 meses de edad, que consulta por la aparición 6 meses antes, de una tumoración anterocervical, no dolorosa, acompañada de pérdida de peso, sensación ocasional de palpitaciones, sudoración y disminución de las necesidades de sueño. No se detectó ningún antecedente familiar ni personal de interés, y la paciente no procedía de ninguna zona deficitaria de yodo. Había iniciado el desarrollo puberal a los 10 años, presentando la menarquia a los 12 años y 1 mes de edad, con dos menstruaciones hasta el momento de la primera consulta. En la exploración física, la talla estaba en +2,48 DE y el IMC en 0,56 DE (tablas de Hernández). Presentaba un bocio grado III, a expensas de un nódulo en el lóbulo tiroideo derecho, móvil, no adherido a planos profundos, de consistencia elástica, no doloroso, y sin adenopatías locorregionales significativas. La frecuencia cardíaca era de 125 lat./min, no presentaba exoftalmos y el resto de la exploración era normal, excepto un ligero temblor distal de extremidades superiores. El desarrollo puberal se encontraba en un estadio IV de Tanner (T4, P4, Ac). Se confirmó la sospecha clínica de hipertiroidismo: TSH: < 0,02 mU/ml (VN 0,43-3,7), T4L: 2,66 ng/dl (VN 0,87-1,5) y T3L: 8,79 pg/ml (VN 2,6-3,7). Los anticuerpos antitiroglobulina y antiperoxidasa fueron positivos: 398 mU/ml (VN < 115) y 36,7 mU/ml (VN < 32), respectivamente, con niveles séricos indetectables de TSI. En la ecografía de cuello (fig. 1) se visualizó un nódulo sólido de 5 cm de diámetro mayor en lóbulo derecho, con áreas de necrosis en su interior, que en la gammagrafía con 99Tc (fig. 2), se mostraba como un nódulo caliente, anulando la captación del tejido tiroideo circundante (nódulo tóxico). La punción-aspiración con aguja fina (PAAF) mostró signos de proliferación folicular leve sin signos de malignidad, lo que sugirió el diagnóstico de adenoma folicular.
Figura 1. Nódulo sólido de 5 cm de diámetro mayor, con áreas de necrosis en su interior, en el lóbulo tiroideo derecho.
Figura 2. Nódulo captante en el lóbulo tiroideo derecho que anula el resto de tejido tiroideo.
Se instauró tratamiento con carbimazol (0,4 mg/kg/día) durante 4 semanas, con disminución progresiva de los signos y síntomas de hipertiroidismo. Posteriormente se redujo la dosis, asociando levotiroxina sódica, para lograr un estado eutiroideo. Conseguido éste, la paciente fue sometida a lobectomía tiroidea derecha. La biopsia intraoperatoria y el informe anatomopatológico definitivo de la pieza completa confirmaron el diagnóstico de adenoma folicular. Posteriormente, sin ningún tratamiento, la paciente se mantiene asintomática, sin bocio, con niveles normales de TSH, T4L, anticuerpos antitiroideos negativos, y controles ecográficos normales.
Ante cualquier nódulo tóxico (supresión de TSH con hiperfunción tiroidea) en Pediatría, debemos establecer la gravedad del hipertiroidismo (niveles de T4L y T3L), y realizar pruebas de imagen (ecografía y gammagrafía) 7. La PAAF tiene un valor limitado en estos casos, dada la dificultad para diferenciar entre adenoma y carcinoma folicular 8,9.
El otro punto de interés son las distintas posibilidades terapéuticas, sin que ninguna sea de primera elección 2,10: cirugía (nodulectomía o hemitiroidectomía), la más utilizada en niños, y el yodo radiactivo, con la ventajas de su bajo coste y la infrecuencia de efectos secundarios, pero con el inconveniente de la escasa experiencia en la edad pediátrica.
Correspondencia: Dr. J. Argente Oliver.
Servicio de Pediatría.
Hospital Infantil Universitario Niño Jesús.
Avda. Menéndez Pelayo, 65.
28009 Madrid. España.
Correo electrónico: argentefen@terra.es