Una de las causas más frecuentes de infección bacteriana grave en lactantes es la pielonefritis aguda (PNFA), cuya secuela más prevalente a largo plazo es la instauración de cicatrices renales.
ObjetivosRevisar la incidencia de cicatrices renales a los 6 meses de un episodio de PNFA en niños menores de 36 meses y su relación con la clínica, las pruebas de imagen y la bacteriología.
MétodoEstudio retrospectivo de pacientes de uno a 36 meses previamente sanos ingresados por un primer episodio de PNFA, con un seguimiento mínimo de 6 meses. Se recogieron las variables demográficas junto con bacteriología, ecografía, cistourografía miccional seriada, recidivas y gammagrafía-DMSA.
ResultadosSe incluyeron 125 pacientes, 60% varones, la mayoría febriles al ingreso (92%), debido a E. coli (74,6%). Existía antecedente de alteración ecográfica prenatal solo en el 15,4%. La ecografía detectó dilatación de la vía urinaria en el 22,1%. En 70 pacientes se indicó cistourografía miccional seriada: 54,3% sin anomalías, 12,8% con reflujo vesicoureteral (RVU) grado i-iii y 32,9% con RVU iv-v. Seis pacientes presentaban RVU iv-v con ecografías normales. La adherencia a la gammagrafía DMSA a los 6 meses fue solo del 61% de los indicados. De los efectuados (60 casos), en un 44,3% se hallaron cicatrices renales, relacionadas significativamente con la recurrencia y el RVU iv-v, pero no con la bacteriología ni con la elevación de reactantes.
ConclusionesEl 44% de las gammagrafías-DMSA de pacientes de uno a 36 meses hospitalizados por PNFA desarrolla cicatrices renales a los 6 meses. Estas se relacionaron con las recurrencias y el RVU grave, pero no con la bacteriología y los reactantes inflamatorios.
Acute pyelonephritis (APN) is one of the most common causes of serious bacterial infection in infants. Renal scarring is the most prevalent long-term complication.
ObjectivesTo review the incidence of renal scarring within 6 months after an episode of APN in children under 36 months and its relationship with imaging studies, clinical settings, and bacteriology.
MethodA retrospective study of previously healthy patients aged one to 36 months, admitted for a first episode of APN, with a minimum follow-up of 6 months. Demographic and clinical variables were collected along with bacteriology, renal and bladder ultrasound scan, voiding cystourethrography, DMSA-scintigraphy, and re-infection events.
ResultsA total of 125 patients were included in the study, of which 60% were male, the large majority (92%) febrile, and due to E. coli (74.6%). There was a history of prenatal ultrasound scan changes in 15.4%. Ultrasound scan found dilation of the urinary tract in 22.1%. Voiding cystourethrography was performed on 70 patients: 54.3% no abnormalities, 12.8% vesicoureteral reflux (VUR) grade i-iii, and 32.9% iv-v grade VUR. Six patients had iv-v grade VUR with a normal ultrasound scan. Adherence to DMSA-scintigraphy at 6 months was only 61% of that indicated. Renal scarring was found in 44.3% of those in which it was performed (60 cases).
ConclusionsAlmost half (44%) DMSA-scintigraphy in children aged one to 36 months hospitalised for APN show renal scarring at 6 months, which was found to be associated with the re-infection events and the iv-v grade VUR. There was no relationship between scarring and the bacteriology or the elevations of inflammatory biochemical markers.
El abordaje diagnóstico y terapéutico de la infección del tracto urinario (ITU) en niños es complejo, sobre todo en lactantes pequeños que pueden mostrar especial gravedad, con un elevado porcentaje de pacientes con secuelas en forma de cicatrices renales con repercusión variable a largo plazo. Las indicaciones de las pruebas de imagen han ido cambiando a lo largo de los últimos años según las diferentes guías clínicas publicadas1–4. Los cambios fundamentales se han basado en revisiones sistemáticas de la literatura con base en la microbiología, la ecografía y la cistografía en relación con las secuelas y las recidivas a largo plazo. Existen diversas aproximaciones prácticas relativamente actuales que dan idea de las dificultades a la hora de alcanzar acuerdos en la toma de decisiones sobre la ITU durante la infección aguda y tras el tratamiento, para evaluar la repercusión que ha tenido sobre la función renal, para reconocer la presencia de enfermedad de base y para la prevención de posibles recurrencias2–5. No son muchos los estudios sobre el tema6,7 y, menos aun, en nuestro medio8. Nuestro trabajo estudia la evolución en menores de 36 meses ingresados por ITU grave, revisando la presencia de cicatrices renales en relación con la clínica, los antecedentes y las pruebas de imagen.
Pacientes y métodoEstudio retrospectivo donde se revisaron las historias clínicas de pacientes menores de 36 meses ingresados en un hospital de tercer nivel que cumplieran criterios de primer episodio de infección de vías urinarias altas: probable pielonefritis aguda (PNFA), definida como la presencia de leucocituria y crecimiento de uropatógenos en orina recogida mediante sondaje según criterios previamente establecidos4,9, junto con fiebre y/o afectación del estado general y/o elevación de reactantes de fase aguda4 (proteína C reactiva>20mg/L y/o procalcitonina (PCT)>0,5ng/ml), con un seguimiento mínimo posterior de al menos 6 meses. El estudio abarcó el periodo comprendido entre enero de 2010 y diciembre de 2014. La política antibiótica uniforme fue tratar con ampicilina y gentamicina a los menores de 3 meses y solo con gentamicina a los mayores de 3 meses hasta el antibiograma. Se consideraron criterios de exclusión: la ITU en el contexto de cirugía, infección nosocomial o sondaje vesical previo o concomitante y la ITU como expresión de uropatía obstructiva demostrada o únicamente de cistitis. Fueron excluidos también los menores de 4 semanas de vida por considerarse la ITU en estos casos, como expresión de una infección potencialmente generalizada neonatal.
De cada uno de los pacientes, las variables recogidas fueron: edad, sexo, días de evolución, fiebre al ingreso, alteraciones nefrourológicas en la ecografía prenatal (cualquier dilatación de vías o malformación estructural), valores de reactantes de fase aguda: proteína C reactiva por inmunoanálisis turbidimétrico y PCT por enzimoinmunoanálisis con lectura fluorescente, creatinina al ingreso (método de Jaffé modificado; espectrofotometría bicromática 510, 600nm), alteraciones en el análisis básico de orina, germen aislado en urocultivo por sondaje vesical, resultado del hemocultivo, ecografía urológica y cistouretrografía miccional seriada (CUMS) precoz durante el ingreso hospitalario, recurrencias de ITU en los 6 meses siguientes al ingreso y gammagrafía con ácido dimercaptosuccínico (DMSA) al menos a los 6 meses de la resolución del primer episodio de PNFA.
Algunas variables numéricas fueron categorizadas para el estudio. La edad se dividió en 3 categorías: menores de 3 meses, 3-6 meses y mayores de 6 meses. La PCT se categorizó en<0,5ng/ml, 0,5-1ng/ml y>1ng/ml. La proteína C reactiva se categorizó por cuartiles, la ecografía urológica comprendió 3 categorías: dilatación de vía, nefronía/abscesos y malformaciones complejas. La CUMS se dividió en 3 categorías: normal, reflujo 1 a 3 y reflujo 4 o 5. La bacteriología se dividió en 2 categorías: Escherichia coli (E. coli) y germen distinto de E. coli. Los días de evolución se dividieron en<1 día y>1 día.
Siguiendo las directrices generales vigentes durante el periodo de estudio1,3–5, la CUMS se indicó en aquellos pacientes con sepsis clínica, germen distinto de E. coli, alteraciones ecográficas o hermanos con alteraciones de las vías urinarias. La gammagrafía-DMSA se indicó en los menores de 6 meses y en todos los casos con alteración ecográfica, germen distinto a E. coli, aspecto séptico, persistencia de la fiebre más de 48h tras la antibioterapia, alteraciones de la micción, deshidratación y elevación de la creatinina a partir de los 6 meses de la infección. Se consideró alterado cualquier estudio con disminución cortical de la captación del trazador. Se dividió en 2 categorías: normal y alterado.
Los datos numéricos presentados se expresan en media y desviación estándar. Los datos cualitativos se expresan en porcentaje de frecuencia. Se estudió la relación entre variables cualitativas mediante la prueba de χ2 con la presencia de lesiones en la gammagrafía-DMSA. Las asociaciones con una p<0,20 fueron incluidas en un estudio de regresión logística binomial para encontrar factores de riesgo independiente con la presencia de alteraciones en la gammagrafía-DMSA. El análisis de los resultados se efectuó con el paquete estadístico PSPP (GNU© General Public License by the Free Software Foundation).
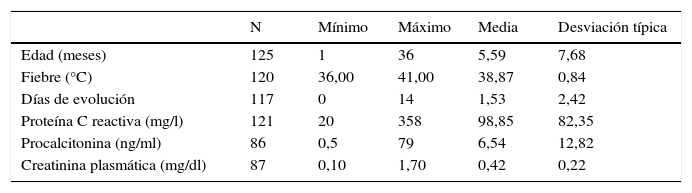
ResultadosSe incluyeron en el estudio un total de 125 pacientes sanos. En la tabla 1 se recogen los datos de las variables cuantitativas de los pacientes. El 60% eran varones. El 52,8% eran menores de 3 meses, el 72,0%, menores de 6 meses, el 87%, menores de 12 meses. El 8% de los casos comenzaron sin fiebre. El 46,7% tenían menos de un día de evolución. En cuanto a las pruebas complementarias, el estudio de la tira reactiva mostró positividad (entendiendo por esta la obtención de 2 o más cruces) en el 84% de los casos para la esterasa leucocitaria, y en el 45% para los nitritos.
Resultados estadísticos descriptivos principales de los datos recogidos en el momento del ingreso hospitalario del primer episodio de infección del tracto urinario de vías altas
| N | Mínimo | Máximo | Media | Desviación típica | |
|---|---|---|---|---|---|
| Edad (meses) | 125 | 1 | 36 | 5,59 | 7,68 |
| Fiebre (°C) | 120 | 36,00 | 41,00 | 38,87 | 0,84 |
| Días de evolución | 117 | 0 | 14 | 1,53 | 2,42 |
| Proteína C reactiva (mg/l) | 121 | 20 | 358 | 98,85 | 82,35 |
| Procalcitonina (ng/ml) | 86 | 0,5 | 79 | 6,54 | 12,82 |
| Creatinina plasmática (mg/dl) | 87 | 0,10 | 1,70 | 0,42 | 0,22 |
El aislamiento bacteriológico en 125 urocultivos fue E. coli (74,6%), seguido de Klebsiella pneumoniae (8,9%), Enterococcus faecalis (7,3%), Pseudomonas aeruginosa (3,2%), Proteus mirabilis (1,6%), Enterobacter cloacae (1,6%) y otros. La positividad de los hemocultivos practicados (108) fue del 7,4%.
La ecografía detectó nefronía/absceso/malformaciones complejas en un 16,7% y algún tipo de dilatación de la vía urinaria en el 21,9%. En 70 pacientes se indicó estudio de CUMS, de los cuales el 54,3% no presentaban anormalidad, el 12,8% mostraban reflujo i-iii, y el 32,9%, reflujo iv-v. Seis casos presentaban reflujo vesicoureteral (RVU) grado iv-v con ecografías normales, de los que 4 desarrollaron cicatrices renales. Tenían indicación de estudio con gammagrafía-DMSA el 80% de las PNFA, aunque solo fueron realizadas en el 61% de las indicaciones por falta de adhesión de los padres. De las efectuadas (60 casos), en el 44% se halló algún grado de cicatriz renal. Presentaron antecedentes de alguna alteración ecográfica prenatal de la vía urinaria el 13,4% de nuestra serie. La tasa de recurrencia recogida hasta los 6 meses de evolución fue del 15,2%.
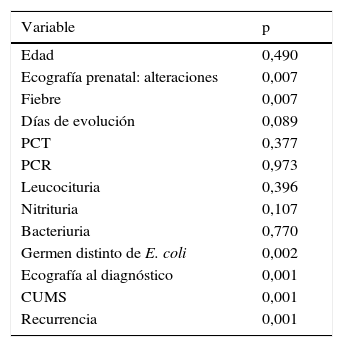
El análisis de asociación de las alteraciones a los 6 meses en el estudio de gammagrafía-DMSA se muestra en la tabla 2. Se halló una relación estadísticamente significativa con la presencia de alteraciones ecográficas prenatales, germen distinto a E. coli, la ecografía al diagnóstico y la ITU recurrente. No se ha encontrado asociación significativa entre la presencia de lesiones renales y la edad o la elevación de reactantes.
Significación estadística χ2 de las alteraciones en la gammagrafía con ácido dimercaptosuccínico frente a otras de variables del estudio
| Variable | p |
|---|---|
| Edad | 0,490 |
| Ecografía prenatal: alteraciones | 0,007 |
| Fiebre | 0,007 |
| Días de evolución | 0,089 |
| PCT | 0,377 |
| PCR | 0,973 |
| Leucocituria | 0,396 |
| Nitrituria | 0,107 |
| Bacteriuria | 0,770 |
| Germen distinto de E. coli | 0,002 |
| Ecografía al diagnóstico | 0,001 |
| CUMS | 0,001 |
| Recurrencia | 0,001 |
CUMS: cistourografía miccional seriada; PCR: proteína C reactiva; PCT: procalcitonina.
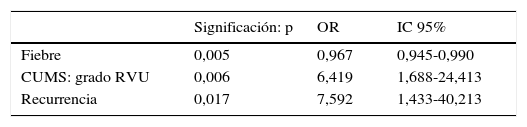
En el análisis de regresión logística la variable CUMS con grado de reflujo iv-v y la recurrencia se mostraron como factores de riesgo, mientras que el grado de fiebre alcanzado se mostró como un débil factor protector (tabla 3).
Variables con significación estadística en el análisis de regresión logística, odds ratio e intervalo de confianza al 95%
| Significación: p | OR | IC 95% | |
|---|---|---|---|
| Fiebre | 0,005 | 0,967 | 0,945-0,990 |
| CUMS: grado RVU | 0,006 | 6,419 | 1,688-24,413 |
| Recurrencia | 0,017 | 7,592 | 1,433-40,213 |
CUMS: cistourografía miccional seriada; IC: intervalo de confianza al 95%; OR: odds ratio; RVU: reflujo vesicoureteral.
La posibilidad de presentar secuelas a largo plazo en forma de cicatrices renales rige las directrices actuales en la toma de decisiones para la realización de pruebas complementarias en las infecciones urinarias graves, más frecuentes durante la infancia. Son pocos los estudios que hacen referencia a las posibles secuelas a largo plazo o la probabilidad de recurrencia de estos procesos en nuestro medio. Por tanto, resulta interesante intentar conocer la posible relación entre la aparición de cicatrices renales en cuanto a la bacteriología actualizada local y los hallazgos ecográficos y cistográficos, con el fin de establecer una correcta pauta de actuación tanto a nivel de tratamiento como de necesidad de estudios complementarios y seguimiento, para conseguir así los mejores resultados de cara a la edad adulta, a la vez que se evitan estudios innecesarios.
Encontramos hallazgos patológicos en la ecografía en el 38,6% de los casos. Destacan, entre estos, la nefronía o la dilatación de las vías urinarias más frecuentemente, muy en consonancia con las publicaciones previas10–15. La gammagrafía-DMSA patológica alcanzó el 44%. Por tanto, el número de casos con algún tipo de daño renal a largo plazo fue estimado globalmente en el 22%, algo superior a lo publicado en una revisión sistemática previa15, si bien esta incluye pacientes hasta 19 años de edad con todo tipo de ITU, febriles y afebriles, con una tasa de afectación precoz en el DMSA del 57%. Hasta el 73% de las ITU febriles a cualquier edad, sin otros criterios de selección, tienen daño renal en fase aguda12. En series centradas en menores de 36 meses14, como la de este estudio, los autores encuentran menor afectación, de en torno al 12% en el DMSA, pero se trata también de pacientes ambulatorios y de enfoques donde solo seleccionan para su indicación la presencia de anormalidades en la ecografía. Esto provoca, a nuestro entender, un sesgo de selección evidente, y pensamos que la indicación de DMSA debe mantenerse en otros supuestos como los elegidos4. También atribuimos nuestra incidencia de cicatrices a la muestra seleccionada, donde predominan lactantes pequeños con muy probable PNFA febriles y elevación franca de reactantes. Aunque la PCT ha sido referida como un marcador de daño renal con cicatrices a largo plazo16, no hemos encontrado esta asociación en nuestra serie. En este sentido, aún no existe consenso suficiente para determinar afectación aguda mediante la determinación sistemática de reactantes de fase aguda10. En trabajos centrados en lactantes con ITU febriles, la presencia de daño en el DMSA a los 3 meses alcanzó el 51% de los casos, con un porcentaje de reflujo de un 25%11. Es muy posible que un número indeterminado de lesiones detectadas en el estudio DMSA no tengan consecuencias a largo plazo como apuntan algunos autores11, pero está por dilucidar en qué casos puede obviarse esta exploración.
La asociación entre alteraciones en la CUMS con reflujo iv-v y en el DMSA en nuestra serie se mantiene en el análisis multivariante e indica que el reflujo es un factor predisponente para la PNFA pero esta, en sí misma, es la responsable de las cicatrices con independencia de su causa. En la revisión sistemática citada se apunta que la pretendida asociación de CUMS-DMSA puede ser debida a factores de confusión15, ya que en casi todos los estudios los altos grados de reflujo se sitúan solo en torno al 2,5% de las PNFA y, sin embargo, la media de secuelas al DMSA es del 25%. En nuestra serie, la asociación se presenta como factor independiente en al análisis de regresión logística (OR 6,419). La presencia de RVU ha sido por décadas el foco de la preocupación de la evolución de las ITU, aunque es evidente que la presencia de RVU no es necesaria ni suficiente para desarrollar cicatrices renales14.
La ausencia de relación entre la formación de cicatrices y la bacteriología distinta de E. coli en el análisis multivariante está en la línea de lo preconizado en las últimas guías clínicas del manejo de la ITU en niños, según la cual la bacteriología no es ya criterio de estudio de imagen de CUMS1,2,4,5. Puede ser que haya que cuestionarse también el criterio de germen para la indicación del DMSA.
La asociación entre las alteraciones ecográficas prenatales y el DMSA ha sido referida como una causa de afectación cortical displásica previa a la infección y es en sí misma un daño renal detectable al DMSA que puede evolucionar a insuficiencia renal con independencia del tratamiento posterior del reflujo asociado, que suele ser de alto grado en general17,18. Es posible que una muestra más amplia de casos pueda demostrar la relación a la que apunta el análisis χ2.
Como está referido en otras series, la recurrencia de PNFA se asoció estadísticamente a daño renal y se mostró como factor de riesgo (OR 7,52). No sabemos qué papel puede jugar en nuestra serie la susceptibilidad genética para la ITU como ha sido descrito19. En este sentido, la mejor medida preventiva es la detección precoz de la reinfección para su rápido tratamiento como está referido1,4,5, cuando además está cuestionada, cada vez más, la necesidad de profilaxis antibiótica en casos de reflujo5,20.
Por último, hay que comentar el rasgo protector, aunque débil, que supone la fiebre respecto al desarrollo de cicatrices renales como un mecanismo que es de respuesta inespecífica contra la infección. No hemos visto estudiado ni referido este aspecto.
Entre las limitaciones del estudio se encuentran la ausencia de seguimiento a largo plazo de las consecuencias de las cicatrices renales halladas, así como la falta de datos sobre las recurrencias más allá de los 6 meses del primer episodio de PNFA. La muestra procede de casos graves con predominio de menores de 6 meses con elevación franca de reactantes y, por tanto, las conclusiones son aplicables a este grupo específico de pacientes con PNFA, para los que, como referíamos, existen escasos datos.
ConclusionesLa presencia de cicatrices renales a los 6 meses alcanzó un 44% para los criterios de selección de gammagrafía-DMSA propuestos en nuestro estudio en pacientes graves hospitalizados. Se comportaron como factores de riesgo de alteraciones al estudio DMSA la recurrencia y los grados altos de RVU. La elevación de la temperatura dentro de la variable fiebre es un débil factor protector. No encontramos asociación con el germen distinto a E. coli. Nos parece planteable suprimir la premisa de germen distinto de E. coli en la indicación del DMSA.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.