La hipotermia es el tratamiento estándar en la encefalopatía hipóxico isquémica (EHI) a pesar de que todavía no se conocen todos sus efectos y complicaciones. La bradicardia sinusal está ampliamente descrita en la literatura como consecuencia de dicho enfriamiento pero se ha estudiado poco la actividad eléctrica cardiaca en este grupo de pacientes.
ObjetivoDeterminar si existe un alargamiento del intervalo QT corregido (QTc) durante la hipotermia en neonatos con EHI moderada-grave y su evolución durante el tratamiento.
Material y métodosSe reclutó a pacientes con EHI tratados con hipotermia entre noviembre del 2012 y octubre del 2013. Se realizaron electrocardiogramas (ECG) durante la hipotermia (uno cada 24 h durante el tratamiento) y durante el recalentamiento (a 34,5, 35,5 y 36,5°C). Se realizó un séptimo ECG a la semana de vida.
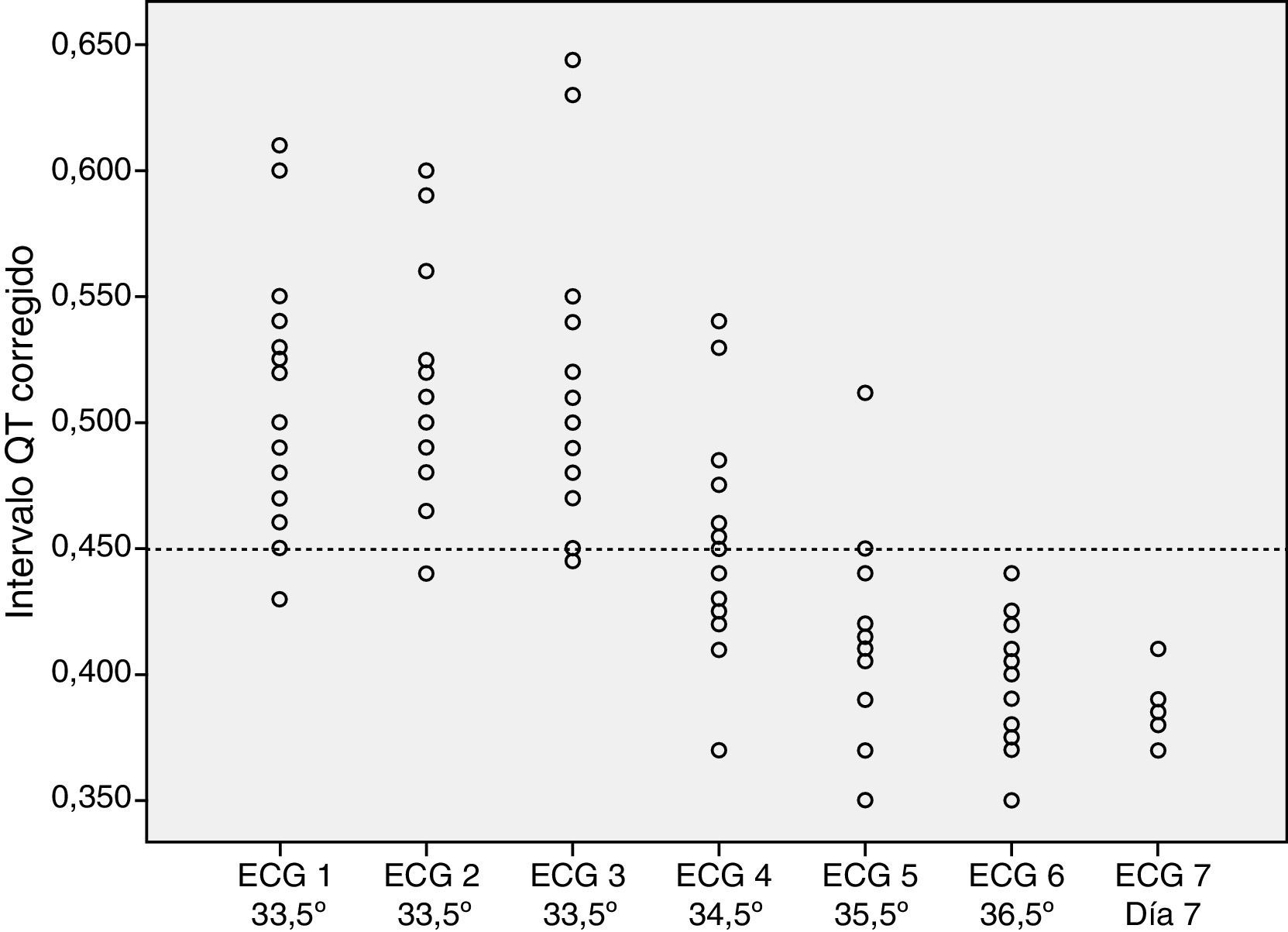
ResultadosSe incluyó a un total de 19 pacientes. Se observó un alargamiento del QTc en todos los pacientes durante la hipotermia. En 84% de los pacientes (n=16), el alargamiento se apreció en todos los ECG durante la hipotermia. Tras el recalentamiento, todos los pacientes presentaron una normalización del mismo. No se encontraron diferencias estadísticamente significativas al evaluar la prolongación del QTc según el grado de EHI (p=0,192) y según el uso de soporte inotrópico o no (p=0,669). Ningún paciente presentó arritmias potencialmente graves.
ConclusionesLa hipotermia moderada aplicada a los recién nacidos con EHI moderada-grave parece inducir una prolongación en el intervalo QTc temporal que se resuelve con el recalentamiento del paciente hasta temperatura fisiológica.
Therapeutic hypothermia is the standard treatment for hypoxic ischaemic encephalopathy (HIE), despite not knowing all its effects and complications. Sinus bradycardia is one of the consequences of cooling that has been previously documented in the literature, but little is known about the cardiac electrical activity in these patients.
ObjectiveTo determine the corrected QT (QTc) interval in newborns treated with therapeutic hypothermia for HIE.
Material and methodsA prospective observational study was conducted in all patients treated with hypothermia for HIE that were admitted to our Unit between November 2012 and October 2013. ECGs were performed during hypothermia (every 24h), during the re-warming period (at 34.5°C, 35.5°C, 36.5°C), and on the 7th day of life.
ResultsA total of 19 patients were included. A prolonged QTc was observed in all patients during hypothermia, and 84% (n=16) had prolonged QTc in all the ECGs during treatment. In 3 patients, one of the ECGs did not have a prolonged QTc. After re-warming, the QTc interval returned to normal in all patients. No statistically significant differences were seen when the degree of HIE (P=.192) or the use of inotropic support (P=.669) were considered.
ConclusionsTherapeutic hypothermia applied to asphyxiated newborns with HIE seems to induce a QTc prolongation that resolves when the patient regains physiological temperature.
La EHI moderada y grave (EHI significativa) representa una importante causa de mortalidad neonatal y de discapacidad neurológica posterior. En los últimos años, diversos ensayos clínicos y metaanálisis han mostrado que la reducción de la temperatura corporal en 3-4°C (hipotermia moderada) mediante un enfriamiento corporal total o selectivo de la cabeza, iniciado precozmente (antes de las 6 h de vida) y mantenido durante 72 h, es una intervención eficaz para reducir la mortalidad y la discapacidad mayor en los niños que sobreviven a una agresión hipóxico-isquémica perinatal1-4.
En ningún estudio publicado hasta la fecha se han descrito complicaciones cardiovasculares o hemodinámicas relevantes atribuibles a la hipotermia moderada, incluyendo como efecto cardiovascular la aparición de arritmias que, a excepción de la bradicardia sinusal, no han visto aumentada su incidencia durante el procedimiento3-6. Ni siquiera en aquellas situaciones de sobreenfriamiento accidental.
Los efectos de la hipotermia sobre el sistema cardiovascular en adultos han sido bien documentados. Desde las primeras evaluaciones del efecto del frío realizadas en supervivientes a hipotermias accidentales profundas hasta modelos animales se ha objetivado de forma repetida y constante la relación del frío con la bradicardia sinusal, pero también con otros trastornos de la actividad eléctrica cardiaca7-9. Tanto las guías conjuntas de la International Liaison European resuscitation Council y la European Resuscitation Council10 como la guía de la American Heart Association11 describen la capacidad potencialmente arritmogénica de la hipotermia12-15 en adultos tratados con hipotermia terapéutica tras una parada cardiaca por arritmia ventricular.
La hipotermia puede aumentar potencialmente el riesgo de arritmia debido a que disminuye la velocidad de despolarización de las células marcapasos y, a su vez, aumenta la duración de los potenciales de acción. Esto conduce a una disminución de la frecuencia cardiaca y a otras alteraciones, entre las que se incluyen la prolongación del intervalo PR y del intervalo QTc16,17. La prolongación del intervalo QTc por sí sola predispone a la aparición de taquicardias ventriculares polimorfas18. La evidencia hasta ahora se restringe prácticamente en exclusiva a los estudios realizados en adultos, en los que no se ha registrado un aumento de la incidencia de arritmias potencialmente graves siempre que la hipotermia haya sido moderada (32-34,5°C) y los electrolitos hayan estado controlados. Se han descrito arritmias ventriculares en pacientes enfriados a menos de 32°C19 y con hipopotasemia20.
El objetivo de nuestro estudio es determinar si existen arritmias y, en particular, un alargamiento del intervalo QTc durante el tratamiento con hipotermia terapéutica en recién nacidos con EHI significativa.
Material y métodosSe trata de un estudio prospectivo observacional realizado en recién nacidos con asfixia neonatal a los que se aplica tratamiento con hipotermia moderada, ingresados en la Unidad de Cuidados Intensivos Neonatales (UCIN) del Hospital Universitario Vall d’Hebron (HUVH) entre noviembre del 2012 y octubre del 2013. Fueron incluidos en el estudio todos aquellos recién nacidos con asfixia neonatal y EHI significativa que cumplieron criterios de tratamiento con hipotermia terapéutica y a los que se les aplicó la terapia en la UCIN del HUVH en el periodo descrito. La hipotermia moderada en los pacientes incluidos se realizó mediante aplicación de hipotermia corporal total con sistema de servocontrol de temperatura según el protocolo de nuestro centro.
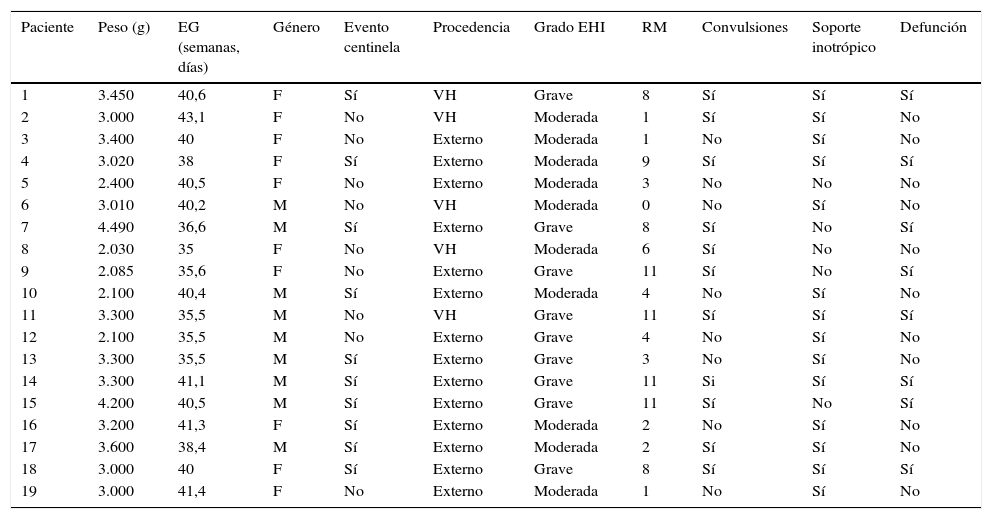
De los pacientes incluidos, se recogieron variables demográficas y clínicas de interés (tabla 1). Se llevaron a cabo ECG de 12 derivaciones durante la hipotermia terapéutica (uno cada 24 h, durante los 3 días de terapia) y durante la fase de recalentamiento (un ECG por cada grado de ascenso de temperatura: 34,5, 35,5 y 36,5°C) hasta alcanzar la temperatura corporal fisiológica. Se realizó un séptimo ECG a la semana de vida. Los ECG se evaluaron de forma sistemática por 2 investigadores. Se determinó la duración del intervalo QTc mediante la aplicación de la fórmula de Bazett en 5 latidos en la derivación DII de cada uno de los ECG, junto con evaluación del resto de parámetros incluyendo: intervalo PR, QRS, repolarización, eje y frecuencia cardiaca. Se analizó la presencia de trastornos del ritmo y trastornos eléctricos en todos los ECG.
Datos demográficos, clínicos y evolutivos de los pacientes
| Paciente | Peso (g) | EG (semanas, días) | Género | Evento centinela | Procedencia | Grado EHI | RM | Convulsiones | Soporte inotrópico | Defunción |
|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 3.450 | 40,6 | F | Sí | VH | Grave | 8 | Sí | Sí | Sí |
| 2 | 3.000 | 43,1 | F | No | VH | Moderada | 1 | Sí | Sí | No |
| 3 | 3.400 | 40 | F | No | Externo | Moderada | 1 | No | Sí | No |
| 4 | 3.020 | 38 | F | Sí | Externo | Moderada | 9 | Sí | Sí | Sí |
| 5 | 2.400 | 40,5 | F | No | Externo | Moderada | 3 | No | No | No |
| 6 | 3.010 | 40,2 | M | No | VH | Moderada | 0 | No | Sí | No |
| 7 | 4.490 | 36,6 | M | Sí | Externo | Grave | 8 | Sí | No | Sí |
| 8 | 2.030 | 35 | F | No | VH | Moderada | 6 | Sí | No | No |
| 9 | 2.085 | 35,6 | F | No | Externo | Grave | 11 | Sí | No | Sí |
| 10 | 2.100 | 40,4 | M | Sí | Externo | Moderada | 4 | No | Sí | No |
| 11 | 3.300 | 35,5 | M | No | VH | Grave | 11 | Sí | Sí | Sí |
| 12 | 2.100 | 35,5 | M | No | Externo | Grave | 4 | No | Sí | No |
| 13 | 3.300 | 35,5 | M | Sí | Externo | Grave | 3 | No | Sí | No |
| 14 | 3.300 | 41,1 | M | Sí | Externo | Grave | 11 | Si | Sí | Sí |
| 15 | 4.200 | 40,5 | M | Sí | Externo | Grave | 11 | Sí | No | Sí |
| 16 | 3.200 | 41,3 | F | Sí | Externo | Moderada | 2 | No | Sí | No |
| 17 | 3.600 | 38,4 | M | Sí | Externo | Moderada | 2 | Sí | Sí | No |
| 18 | 3.000 | 40 | F | Sí | Externo | Grave | 8 | Sí | Sí | Sí |
| 19 | 3.000 | 41,4 | F | No | Externo | Moderada | 1 | No | Sí | No |
Grado de EHI según la escala semicuantitativa de Garcia-Alix.
EG: edad gestacional; F: femenino; M: masculino; RM: resonancia magnética (puntuación en el score de van Rooij); VH: Hospital Vall D’ Hebron.
Se utilizaron las siguientes definiciones a nivel electrocardiográfico, basadas en la guía de interpretación del ECG neonatal de la European Society of Cardiology21:
- –
bradicardia sinusal: aquella frecuencia cardiaca inferior o igual a 93 latidos por minuto (lpm) el primer día de vida, inferior o igual a 91 lpm hasta el tercer día incluido, e inferior o igual a 90 lpm hasta el séptimo día de vida, éste incluido (con ritmo cardiaco normal);
- –
QTc normal: valores inferiores a 450 milisegundos (ms);
- –
prolongación del intervalo QTc: si el valor calculado era superior a 450 ms;
- –
PR prolongado: intervalos superiores a 140 ms.
La presencia y la gravedad clínica de la EHI significativa fueron clasificadas como moderada o grave según la escala semicuantitativa de Garcia-Alix22. A todos los pacientes se les realizó una resonancia magnética (RM) cerebral entre los 5 y los 7 días de vida, evaluando su gravedad según el score de van Rooij et al.23.
Se recogieron variables consideradas como factores de confusión, por su asociación con prolongación del intervalo QT en la literatura, incluyendo: valores plasmáticos de potasio, magnesio y calcio, utilización de fármacos que alargan el intervalo QTc y fármacos vasoactivos (adrenalina, dopamina y dobutamina).
El protocolo de estudio fue revisado y aprobado por el Comité Ético de Investigación Clínica del HUVH y toda la información obtenida de los participantes en el estudio fue tratada de manera confidencial.
Análisis estadísticoSe realizó un análisis descriptivo de las variables demográficas y clínicas y el resultado de las exploraciones complementarias. Las variables categóricas se presentan como porcentajes y frecuencias. Las variables continuas (edad gestacional y peso) se describen como mediana y rango intercuartílico.
Las comparaciones de la variable principal, el intervalo QT corregido medido en ms, en relación con los subgrupos se realizaron mediante modelos lineales generalizados para analizar adecuadamente las medidas repetidas para cada sujeto. El nivel de significación estadística se fijó en p<0,05. Los datos se analizaron mediante el paquete estadístico SPSS versión 20.0 (IBM Corp., Armonk, EE. UU.).
ResultadosSe incluyó a un total de 19 pacientes. Un 73,5% de los pacientes (n=14) ingresaron procedentes de otros centros (habiéndose iniciado hipotermia pasiva durante el traslado). El 47% de ellos fueron recién nacidos varones, la mediana de edad gestacional fue de 40+2 semanas (36+6-41+1 semanas) y el peso de 3.020 g (2.400-3.400 g). Diez (53%) pacientes presentaron EHI moderada según la exploración clínica (tabla 1).
Se identificó un evento centinela en un 53% de los pacientes (n=10), siendo el desprendimiento de placenta (n=3) y la distocia (n=3) los más frecuentes. Otras causas documentadas fueron prolapso de cordón, rotura uterina, corioamnionitis o transfusión feto materna.
En la RM cerebral realizada entre el quinto y el séptimo día de vida, 11 pacientes (58%) presentaron un score de van Roij superior o igual a 4.
En todos los pacientes se monitorizó el electroencefalograma de amplitud integrada (EEGa) durante la hipotermia, el recalentamiento y los días posteriores. El 58% de los pacientes (n=11) presentaron convulsiones clínicas/eléctricas y todos ellos recibieron tratamiento anticomicial. En el 32% de los pacientes el EEGa inicial era patrón de brote supresión (n=6), el 21% patrón bajo voltaje (n=4) y el 21% patrón isoeléctrico (n=4).
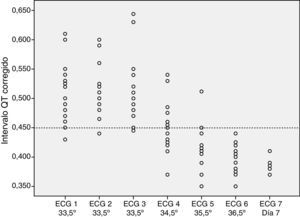
El análisis de los ECG mostró una prolongación del intervalo QTc en todos los pacientes durante la hipotermia (fig. 1). En el 84% de los pacientes (n=16), el alargamiento se apreció en todos los ECG durante la hipotermia. En 3 pacientes, uno de sus ECG no mostraba QTc alargado. Tras el recalentamiento, todos los pacientes presentaron una normalización del intervalo QTc.
Se analizaron los ECG durante el recalentamiento, a 34,5°C el 47% de los pacientes (n=9) aun presentaba prolongación del intervalo QTc y a 35,5°C el 10% de los pacientes (n=2) seguía con el intervalo QTc prolongado. Por encima de 36°C, ningún paciente presentaba alargamiento del intervalo QTc.
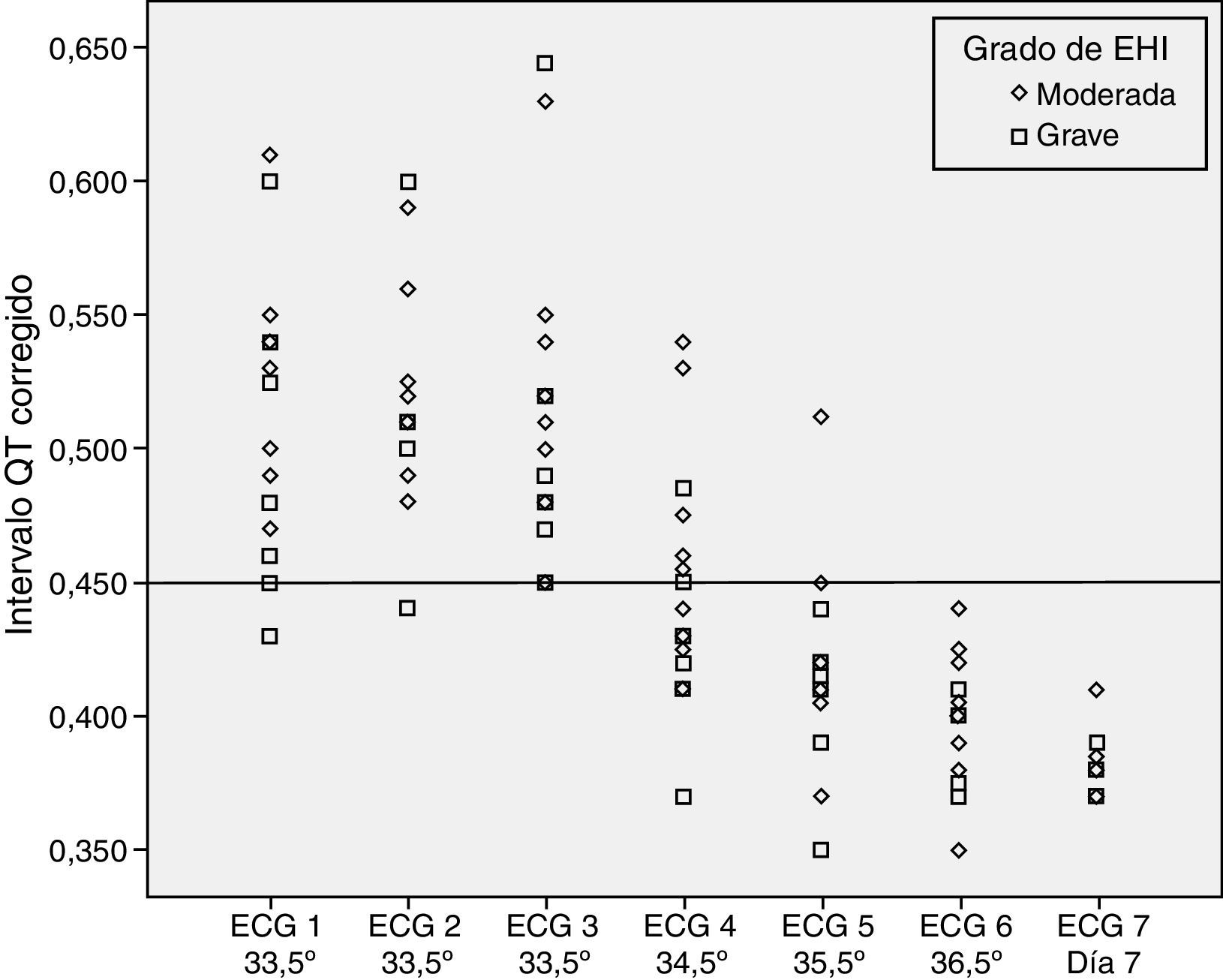
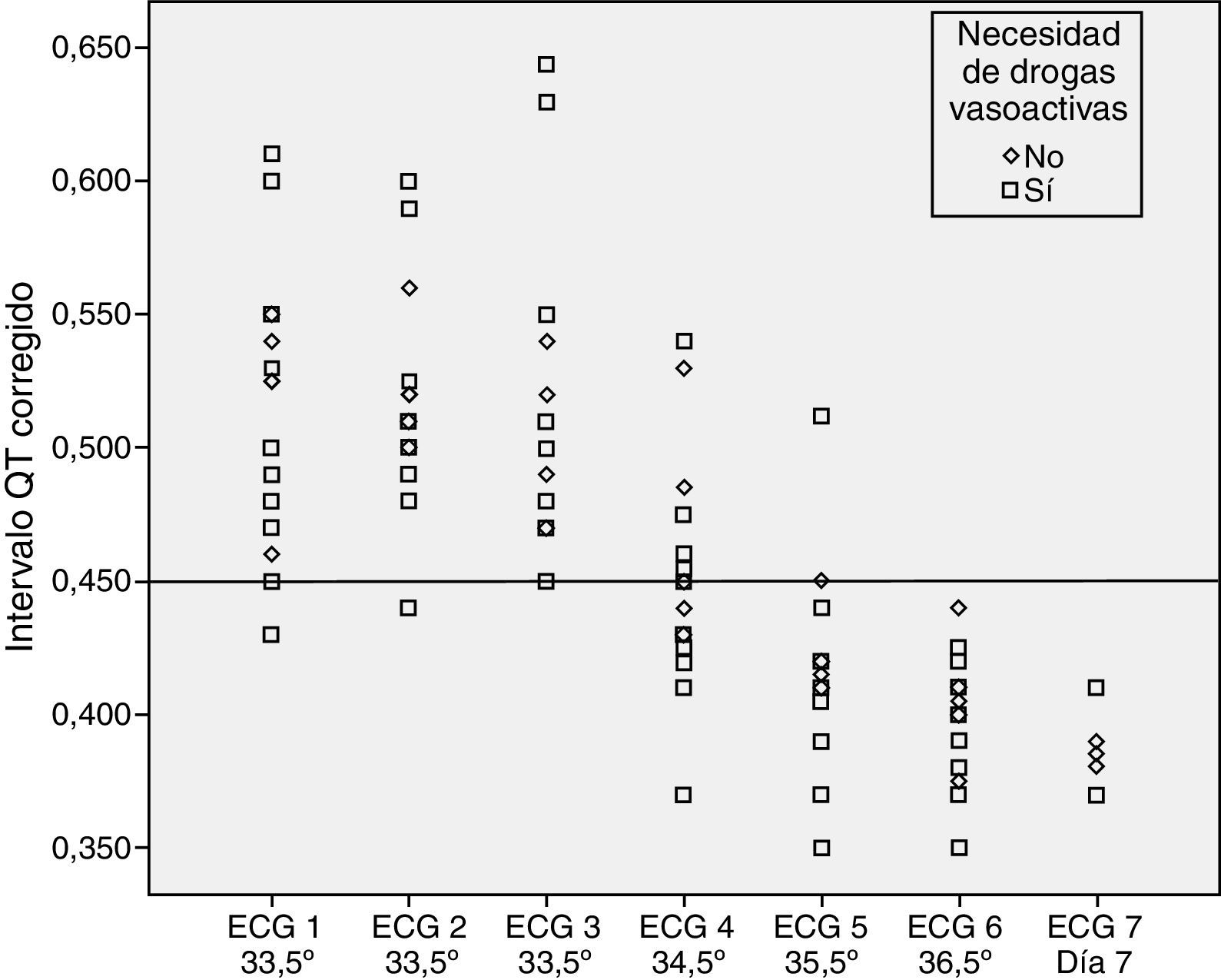
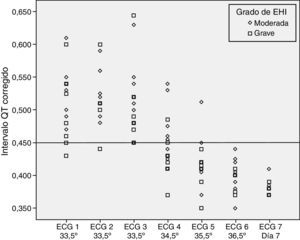
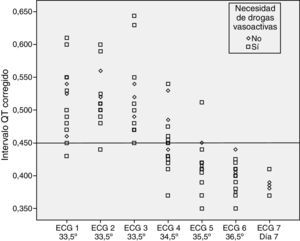
No se encontraron diferencias estadísticamente significativas al evaluar la prolongación del intervalo QTc según el grado de EHI (p=0,192) y según el uso de soporte inotrópico o no (p=0,669) (figs. 2 y 3).
Ningún paciente presentó arritmias potencialmente graves. Los niveles de potasio, magnesio y calcio plasmáticos analizados estuvieron dentro de los límites de normalidad en todos los pacientes. No se registró el uso de otros fármacos que pudieran alargar el intervalo QT (a excepción del uso de fármacos vasoactivos ya descrito).
En un 73,5% de los pacientes (n=14) se registró bradicardia sinusal en algún momento durante el tratamiento con hipotermia mediante monitorización cardiorrespiratoria continua. No se registró alargamiento del intervalo PR.
Uno de los pacientes con EHI moderada presentó un episodio aislado de taquicardia paroxística supraventricular durante su ingreso (a los 10 días de vida) que precisó tratamiento antiarrítmico, retirado previo al alta de la unidad. No se halló relación entre este suceso arrítmico y la hipotermia recibida ni se registró alargamiento del QTc en ningún momento de su ingreso tras la normalización acaecida con el recalentamiento.
DiscusiónEn Neonatología, la evidencia publicada en la literatura sobre la relación de la actividad eléctrica cardiaca y la hipotermia terapéutica en EHI significativa es muy escasa. Se han demostrado la eficacia y la seguridad de la terapia y se ha documentado de forma repetida la aparición de bradicardia sinusal como efecto frecuente y reversible de la hipotermia. Secundariamente a la disminución del ritmo cardiaco, se ha descrito la relación con hipotensión arterial que requiere soporte inotrópico como efecto de la hipotermia. Del resto de los posibles efectos de la hipotermia en recién nacidos, existen muy pocas referencias, en forma de casos aislados que apuntan a una prolongación patológica del intervalo QTc con la hipotermia que recupera tras el recalentamiento24,25.
Este es el primer estudio prospectivo realizado en recién nacidos con EHI significativa tratados con hipotermia moderada con el objetivo de analizar la relación del intervalo QTc con la temperatura corporal en este grupo de pacientes.
La hipotermia moderada en nuestros pacientes induce una prolongación del intervalo QTc en todos ellos durante la terapia. Asimismo, al alcanzar la temperatura corporal rangos fisiológicos (superior o igual a 36°C), los pacientes presentan una normalización en la duración del intervalo QTc.
A pesar de ello, la prolongación del intervalo QTc en recién nacidos con EHI significativa sometidos a hipotermia no parece que predisponga a la aparición de arritmias potencialmente graves.
No parece que factores que pudiesen ser confusionales, como el uso de soporte inotrópico o el grado del insulto hipóxico-isquémico (grado de encefalopatía), modifiquen el comportamiento del intervalo QTc en relación con la temperatura.
La bradicardia sinusal es un efecto frecuente de la hipotermia en recién nacidos, como ya se ha registrado en múltiples estudios y observaciones. Aunque en estudios previos en adultos, el intervalo PR se veía prácticamente de forma constante prolongado con la hipotermia, en los pacientes estudiados no se detectan intervalos PR superiores a 140 ms (ninguno superior a 120 ms).
Parece útil realizar un ECG tras el recalentamiento para confirmar un QTc normal, con el objetivo de no pasar por alto posibles alteraciones congénitas en el intervalo QT, pudiendo ser inmediatamente al finalizar el recalentamiento o de forma más tardía. Esta exploración puede ser de especial interés en aquellos recién nacidos supervivientes al colapso posnatal y que reciban hipotermia terapéutica fuera de protocolo, y en los que el estudio de una arritmia maligna como causante del colapso posnatal podría ser considerado. Una vez confirmado el ECG normal tras el recalentamiento, parece innecesario establecer protocolo de seguimiento en Cardiología para estos pacientes.
Este estudio presenta algunas limitaciones. Debido a que no se han publicado estudios que evalúen la prolongación del intervalo QTc en neonatos con EHI significativa sometidos a hipotermia terapéutica, debimos plantear el estudio como exploratorio, para aumentar el conocimiento sobre esta relación en recién nacidos y obtener los datos necesarios para plantear en un futuro estudios confirmatorios que tengan como objetivo poner a prueba una hipótesis concreta y realizar el cálculo formal del tamaño muestral. Por la necesidad de establecer la hipotermia terapéutica lo más precozmente posible en estos pacientes, no fue posible utilizar cada caso como su propio control y no se pudieron realizar ECG previo al enfriamiento.
ConclusionesLa hipotermia moderada aplicada a los recién nacidos con asfixia y EHI significativa parece inducir una prolongación en el intervalo QTc temporal y que se resuelve con el recalentamiento del paciente hasta temperatura fisiológica (mayor a 36°C). A la temperatura alcanzada con la hipotermia terapéutica (hipotermia moderada) no parece que exista riesgo de presentación de arritmias ventriculares graves, siempre y cuando factores como el ionograma plasmático o el uso de fármacos que prolonguen el intervalo QTc estén dentro de los rangos de normalidad.
Creemos que no es necesario establecer programas de seguimiento de estos pacientes siempre que, al alcanzar la temperatura fisiológica, el intervalo QTc se haya normalizado.
Serían necesarios estudios de mayor potencia para determinar de forma más específica la relación entre la temperatura y el intervalo QTc, y el resto de parámetros electrocardiográficos.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.