Determinar la utilidad de la insulina glargina (IG) en la disminución de hipoglucemias e hiperglucemias en niños y adolescentes con diabetes tipo 1.
Pacientes y métodosSe trata de un estudio retrospectivo/prospectivo, en el que 29 pacientes con hipoglucemias leves/moderadas frecuentes, con edades comprendidas entre 3 y 18 años, y HbA1c de 8 ± 0,7, recibieron tratamiento con IG una vez al día e insulina regular o un análogo de la insulina rápida antes de cada comida. Los criterios de inclusión fueron los siguientes: a) tratamiento previo con insulina de acción intermedia (NPH); b) más de 1 año de evolución de la diabetes, y c) más de tres controles de glucemia/día. Se recogió la incidencia de episodios de hipoglucemias (leves, moderadas y graves), hiperglucemias, los valores de HbA1c, el índice de masa corporal y la dosis diaria de insulina antes y después de iniciar el tratamiento con IG. Además, se realiza una encuesta de opinión directa a la familia sobre la calidad de vida.
ResultadosLos resultados se obtuvieron a partir de 1.294 ± 411 glucemias/ paciente. La incidencia global de hipoglucemias no se reduce (el 5,9 frente al 6,2 % de valores glucémicos/mes) y las hiperglucemias globales permanecen sin cambios. Sin embargo, se reduce de forma significativa la hiperglucemia en ayunas (el 4,3 frente al 2,6 %) con tendencia a la disminución de las hipoglucemias nocturnas. La HbA1c continúa también sin cambios al igual que los requerimientos totales de insulina diaria (0,8 ± 0,2 U/kg/día).
ConclusionesLa IG consigue un control glucémico similar al que se logra con la NPH, con tendencia a la disminución de las hipoglucemias nocturnas y a la mejoría de los valores de glucemia en ayunas.
To determine the usefulness of insulin glargine (IG) to reduce hipoglycaemias and hyperglycaemic events in children and adolescents with type 1 diabetes.
Patients and methodsIn a retrospective/prospective study, 29 patients with a high number of non-severe hypoglycaemias, aged 3-18, and an average HbA1c of 8 ± 0.7, received IG once daily plus regular insulin or rapid analogue before meals. Inclusion criteria were: a) previous treatment with NPH insulin; b) diagnosis of type 1 diabetes for at least 1 year before starting IG, and c) > 3 blood glucose controls within a day. Incidence of severe and non-severe hypoglycaemic events, hyperglycaemic events, HbA1c values, body mass index, daily insulin dose before and after the institution of glargine therapy, were collected. Additionally, family were asked to complete a diabetes quality of life survey.
Results1,294 ± 411 glycaemias/subject were obtained. Hypoglycaemic episodes were not reduced (5.9% vs 6.2 %) and hyperglycaemic events remained unchanged. Fasting blood glucose levels decreased from 195.3 ± 36.6 to 162.8 ± 25.8 in all patients (p < 0.05) and a tendency a decrease in nocturnal hypoglycaemias was observed. The average HbA1c and total daily insulin dosis also remained unchanged (0.8 ± 0.2 UI/Kg/day).
ConclusionsUsing IG achieves a glycaemic control similar to NPH, with a tendency to decrease the frecuency of nocturnal hypoglycaemias and an improvement in fasting glycaemia values.
Para un correcto tratamiento de la diabetes tipo 1 se precisa una insulina que sea capaz de imitar lo máximo posible a la secreción fisiológica. El régimen terapéutico de elección sería actualmente el denominando basal/ bolo1,2, con el que es más fácil conseguir los objetivos glucémicos, incluso en la edad pediátrica, en la que existe una gran variabilidad de requerimientos diarios. El crecimiento, la pubertad, los cambios de ingestiones, el ejercicio y las enfermedades intercurrentes son factores importantes que influyen en esta inestabilidad y que favorecen, por tanto, los episodios de hipoglucemia3,4. Los nuevos análogos de la insulina de acción retardada, denominados glargina y detemir, obtenidos por técnicas de ADN recombinante, han demostrado en diversos estudios que mejoran el control metabólico y reducen la frecuencia de hipoglucemias en niños y adolescentes con diabetes tipo 15–16.
El niño y el adolescente con diabetes deben realizar diariamente múltiples glucemias capilares pre y posprandiales y nocturnas. Su número dependerá de distintos factores pero, como media, se recomienda que sean entre cuatro y seis controles al día. Esta monitorización, pilar fundamental del tratamiento intensivo17, permitirá el auténtico autocontrol, que comprende, además de las pautas de insulina, las modificaciones de la alimentación18–20 y la introducción del ejercicio19,21,22 como tratamiento.
El control metabólico valorado en las HbA1c refleja la glucemia media conseguida en los meses anteriores, pero no es capaz de distinguir entre glucemias normales o hiperglucemias posprandiales e hipoglucemias. Se trata de valorar precisamente estos hechos, es decir, si admitido un control metabólico más o menos semejante con los distintos métodos terapéuticos, existen o no diferencias en los valores de las glucemias realizadas por los pacientes.
Por todo ello, es de gran interés verificar si en nuestro medio la insulina glargina (IG) ha contribuido a mejorar el control metabólico y a disminuir las hipoglucemias, sin aumentar las hiperglucemias y sin cambios en las glucemias medias de los niños-adolescentes.
PACIENTES Y MÉTODOSPacientesSe trata de un estudio retrospectivo-prospectivo en el que cada paciente es su propio control. Ante la presencia de hipoglucemias leves o moderadas frecuentes y/o la existencia de un mal control metabólico (hemoglobina glucosilada superior al 8 %) se ofrece el cambio de tratamiento a IG a 35 niños-adolescentes con diabetes tipo 1 que cumplían los siguientes criterios de inclusión: a) edad comprendida entre 3 y 18 años; b) diabetes de más de 1 año de evolución; c) realización de, al menos, cuatro controles de glucemia digital diarios, y d) firma del consentimiento informado por parte de los padres o tutores.
El estudio se inicia en diciembre de 2004 y finaliza en junio de 2007, y ha sido aprobado por el comité de ética de investigación (CEIC).
Todos los pacientes llevaban previamente tratamiento basal con NPH y estaban recibiendo la misma educación sobre la diabetes. Al inicio del cambio a la nueva insulina tanto los pacientes como sus padres son informados sobre el mecanismo de acción y el modo de administración de la IG, pero no reciben un refuerzo diabetológico diferente del habitual de las visitas programadas. En éstas, cada 3–4 meses, se revisan aspectos detallados del autocontrol: conocimientos, actitudes y capacidades de la familia y/o el niño para realizar cambios de insulina en relación con la alimentación y el ejercicio. Se recogen datos sobre el peso (kg), la talla (cm), el índice de masa corporal (kg/m2), las necesidades totales de insulina diaria (U/kg/día), dosis y tipos de insulina utilizadas, y resultado de la HbA1c. Asimismo, y según protocolo habitual, se insiste en medidas de protección de hipoglucemias y en la revisión de las circunstancias favorecedoras. Las glucemias capilares realizadas por los pacientes durante dicho período son incorporadas a un registro informático.
Régimen terapéuticoSe programa el tratamiento con una dosis única al día de IG. El cálculo de las unidades totales a administrar al inicio se realiza basándose en una disminución de un 20 % en los requerimientos previos de insulina de acción intermedia (NPH). Se instruye a las familias sobre las recomendaciones para ajustar la dosis de IG. El momento de la inyección en los adolescentes se fija después de la cena y en los más pequeños en el desayuno o en el almuerzo, para evitar hipoglucemias nocturnas.
Siguiendo el protocolo de tratamiento habitual de régimen basal-bolo se programan dosis de análogo de insulina rápida antes de todas las ingestiones de comida. Algunos adolescentes por la mañana se inyectan insulina regular humana antes del desayuno.
Protocolo de seguimientoPara poder establecer la existencia o no de posibles variaciones en los parámetros de control clínico y metabólico (HbA1c y glucemia capilar), se recogen dichos datos en las visitas −2, −1 (retrospectivo), 0, +1, +2 y +3. Se considera la visita cero como la de introducción del cambio de tratamiento y el tiempo entre visitas es de 3–4 meses. Se recogen también los valores de glucemias capilares aportados por los pacientes en esos tiempos. Se elabora una recogida de datos en forma de valores medios de los meses anteriores y posteriores al tratamiento.
Registro de glucemiasSe considera válido para el estudio el registro del paciente que incluya un mínimo de 270 glucemias antes y después de la visita cero y lo aportado pueda establecerse como “fiable” (que sea coherente y que guarde una adecuada correlación el cuaderno de autocontrol con los valores aportados en equipos registradores).
DefinicionesSe conoce como hipoglucemia la existencia de un nivel de glucemia igual o inferior a 60mg/dl. Cuando la glucemia es igual o inferior a 40mg/dl se utilizará el término de “hipoglucemia intensa”. La hipoglucemia grave se define como la hipoglucemia en la que al paciente le cuesta responder a estímulos, de la que tarda en recuperarse y en la que en algunas ocasiones es necesario administrar glucagón o acudir a un centro hospitalario. Hipoglucemia nocturna es aquella que se detecta 2h tras la cena y hasta el amanecer, y las hipoglucemias en ayunas son las obtenidas antes del desayuno. Se utiliza el término de hipoglucemia diurna para referirse a aquellas glucemias detectadas en el resto de franja horaria, es decir, exceptuando las hipoglucemias nocturnas y en ayunas.
Se considera hiperglucemia valores de glucemia superiores a 200mg/dl a cualquier hora del día.
Cálculos realizadosA partir de las glucemias obtenidas de cada paciente se calculan las siguientes variables: glucemia media del desayuno, almuerzo, comida, merienda, cena, “recena” y madrugada. Número y porcentaje de hipoglucemias totales, intensas, nocturnas, en ayunas y diurnas al mes. Número y porcentaje de hiperglucemias totales y en ayunas al mes.
Análisis estadísticoSe realiza un análisis descriptivo de las diferentes variables cuantitativas y estudio de frecuencias absolutas y relativas para las variables cualitativas.
Se utiliza el test de la t de Student para las muestras relacionadas o el test de Wilcoxon, según el tamaño de la muestra, para analizar si existen diferencias estadísticamente significativas entre los parámetros analizados antes y después de iniciar el tratamiento con IG. Como nivel de significación estadística se escogió el 5% (p < 0,05).
El estudio de variables cualitativas se realizó mediante pruebas de la chi al cuadrado, aplicando el test exacto de Fisher cuando el número de efectivos lo requiso.
El análisis se realiza con el programa SPSS versión 12.0 para Windows.
RESULTADOSDescripción de la muestraLa muestra ha quedado constituida finalmente por 29 pacientes (14 niños y 15 niñas), con una edad media de 11,5 ± 3,3 años (rango, 2–18), 12 de ellos eran prepuberales y cuatro, menores de 6 años. Cinco de los pacientes a quienes se les propuso el cambio de tratamiento no lo han aceptado y otro ha sido excluido por no seguir las pautas indicadas. La HbA1c media al inicio es de 7,9 ± 0,9 %.
Estudio comparativo de los pacientes antes y después del tratamientoÍndice de masa corporalNo se aprecian diferencias estadísticamente significativas en el IMC, ajustado para edad y sexo, evaluado antes y después del tratamiento con la IG (18,7 ± 1,9 frente a 19 ± 2,2kg/m2).
Dosis de insulinaLa dosis de insulina total/kg de peso corporal disminuye de forma estadísticamente significativa, de 1 ± 0,3 a 0,9 ± 0,2 U/kg/día (p = 0,049) a expensas de la IG, y aumenta de forma no significativa la proporción de insulina rápida.
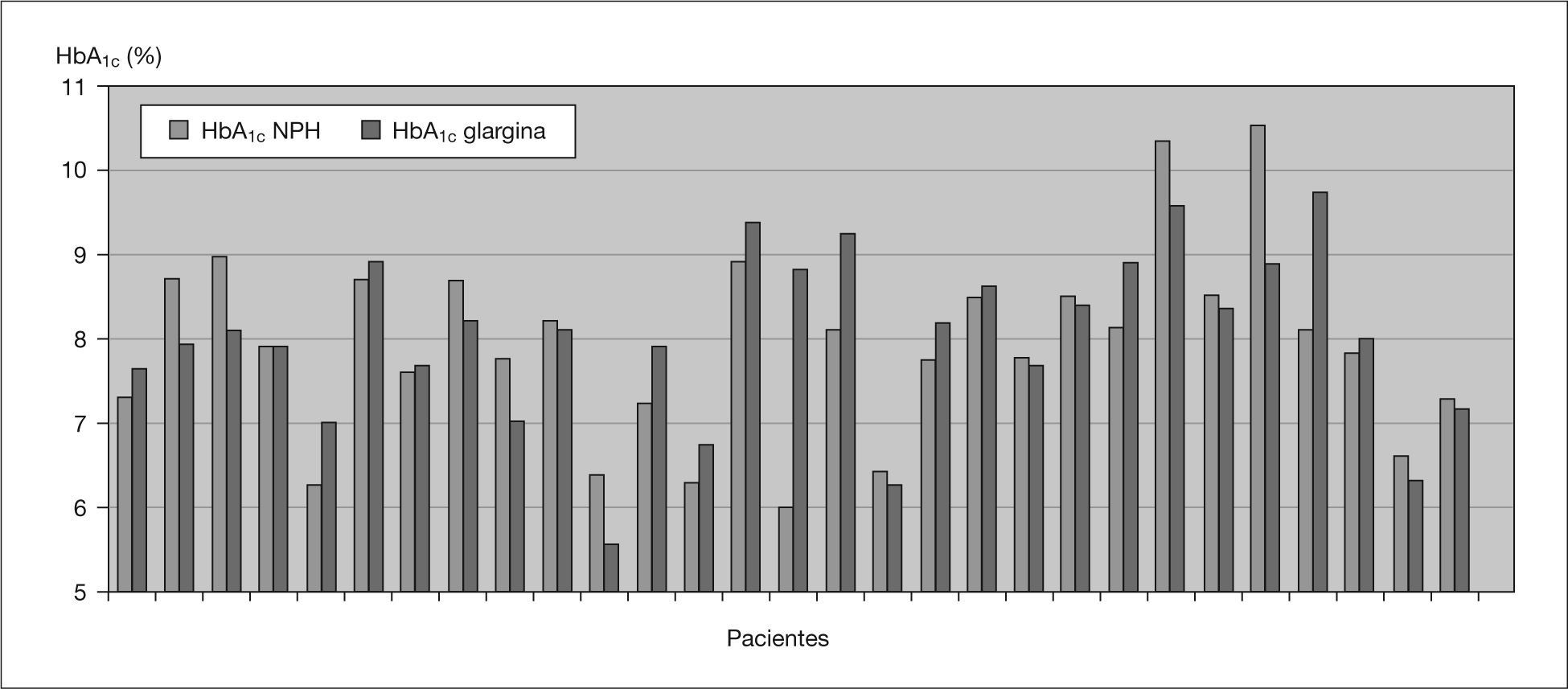
Hemoglobina glucosiladaNo se aprecian diferencias estadísticamente significativas en la HbA1c media total antes y después de iniciar el tratamiento con IG (7,9 ± 0,9 frente al 8 ± 1 %) (fig. 1). Se analizan por separado los pacientes con HbA1c superiores a 8 y no se objetiva tampoco una disminución significativa de ésta.
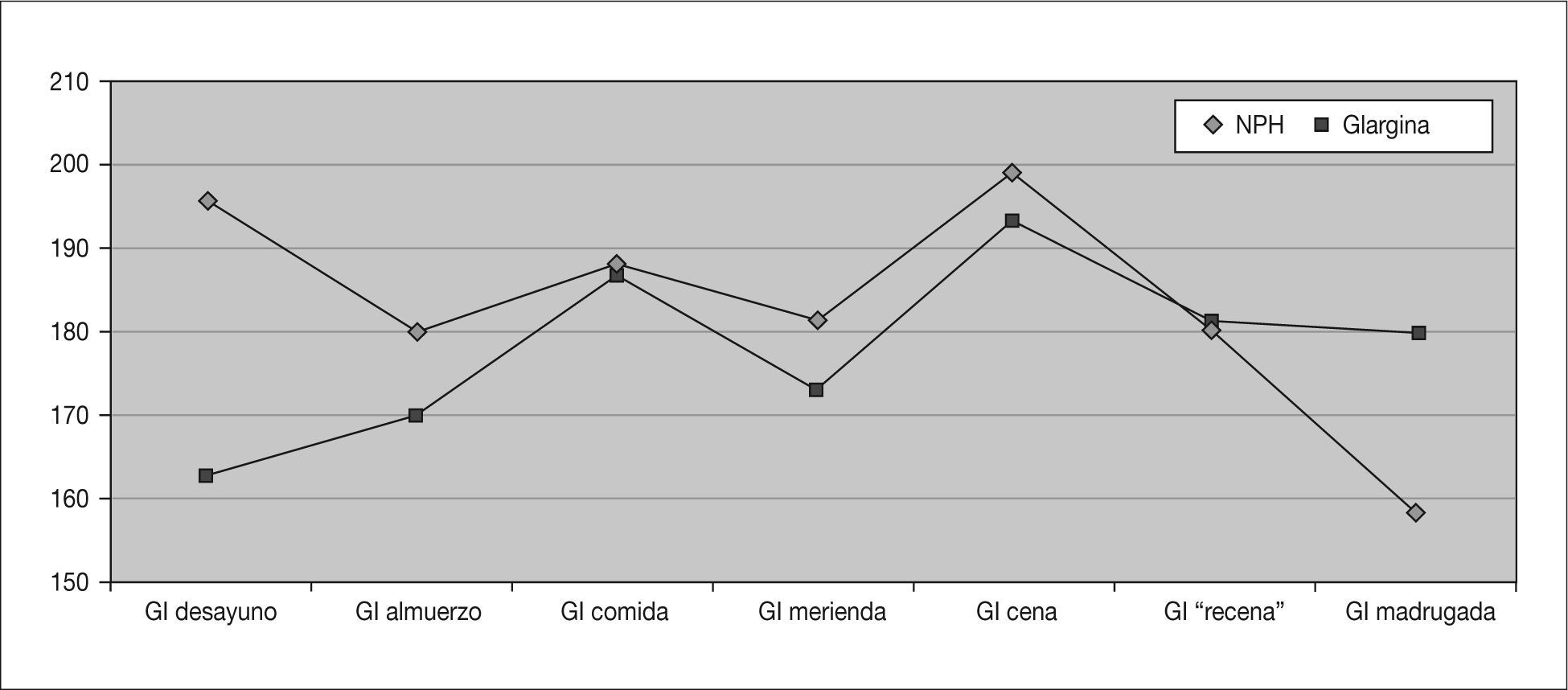
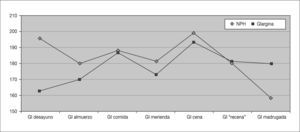
Registro de glucemiasSe analizan unas 1.294 ± 411 glucemias por paciente, de las que se extraen los siguientes resultados: disminución significativa de la glucemia media (p = 0,016) a expensas principalmente de la glucemia media al desayuno (tabla 1 y fig. 2). Se objetiva también una disminución de las hiperglucemias totales de forma significativa (p = 0,011) a expensas principalmente de las hiperglucemias en ayunas (al levantarse), aunque con un aumento significativo de las hipoglucemias a estas horas (p = 0,01). Aparece un ligero aumento del número de hipoglucemias leves totales no significativo con una cierta tendencia a la disminución del número de hipoglucemias nocturnas. Los resultados sobre hipoglucemias intensas no varían (tabla 2) y un solo paciente (2,8 años) presenta hipoglucemias graves que disminuyen tras iniciar el tratamiento con IG.
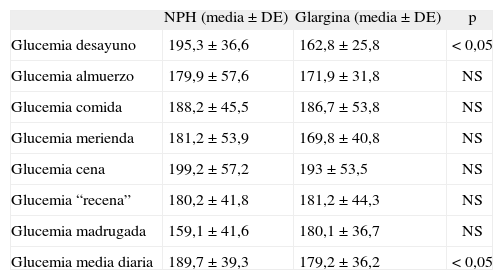
Glucemias de los pacientes antes y después de iniciar el tratamiento con insulina glargina
| NPH (media ± DE) | Glargina (media ± DE) | p | |
| Glucemia desayuno | 195,3 ± 36,6 | 162,8 ± 25,8 | < 0,05 |
| Glucemia almuerzo | 179,9 ± 57,6 | 171,9 ± 31,8 | NS |
| Glucemia comida | 188,2 ± 45,5 | 186,7 ± 53,8 | NS |
| Glucemia merienda | 181,2 ± 53,9 | 169,8 ± 40,8 | NS |
| Glucemia cena | 199,2 ± 57,2 | 193 ± 53,5 | NS |
| Glucemia “recena” | 180,2 ± 41,8 | 181,2 ± 44,3 | NS |
| Glucemia madrugada | 159,1 ± 41,6 | 180,1 ± 36,7 | NS |
| Glucemia media diaria | 189,7 ± 39,3 | 179,2 ± 36,2 | < 0,05 |
DE: desviación estándar; NPH: insulina de acción intermedia; NS: no significativo.
Estudio de hipoglucemias y de hiperglucemias
| NPH | Glardina | p | |
| Hipoglucemias/mes* | 8,1 ± 8,8 | 10 ± 9,1 | NS |
| Hipoglucemias intensas/mes* | 0,6 ± 0,9 | 1,0 ± 2,0 | NS |
| Hipoglucemias nocturnas/mes* | 1,8 ± 1,7 | 2,3 ± 2,3 | NS |
| Hipoglucemias ayunas/mes* | 5,3 ± 6,2 | 2,1 ± 1,5 | <0,05 |
| Hipoglucemias diurnas/mes* | 5,1 ± 5,3 | 5,5 ± 6,2 | NS |
| Hiperglucemias/mes* | 62,8 ± 24,1 | 59,2 ± 25 | <0,05 |
| Hiperglucemias ayunas/mes* | 14,3 ± 5,7 | 9,1 ± 3,6 | < 0,001 |
| Hipoglucemias/mes** | 5,1 | 6,3 | NS |
| Hipoglucemias intensas/mes** | 0,4 | 0,6 | NS |
| Hipoglucemias nocturnas/mes** | 6,5 | 6,3 | NS |
| Hipoglucemias ayunas/mes** | 3,4 | 7,4 | <0,01 |
| Hipoglucemias diurnas/mes** | 6,1 | 6,4 | NS |
| Hipoglucemias nocturnas/totales** | 38,1 | 21,4 | <0,05 |
| Hipoglucemias ayunas/totales** | 10,0 | 30,5 | <0,05 |
| Hipoglucemias diurnas/totales** | 51,9 | 43,1 | NS |
| Hiperglucemias** | 43,4 | 38,9 | <0,05 |
| Hiperglucemias ayunas** | 47,5 | 30,6 | < 0,001 |
NPH: insulina de acción intermedia.
Los análogos de la insulina de acción prolongada constituyen en la actualidad, y cada vez más, dada su curva de acción prácticamente plana, el tratamiento insulínico basal idóneo para la diabetes2,22. Su asociación con los análogos de insulina rápida permite imitar los perfiles de secreción fisiológica de insulina y parecen mejorar la calidad de vida sin influir demasiado en el control metabólico. Este estudio utiliza a cada paciente como su propio control, lo que hace disminuir de esta forma la existencia de variables externas que afecten a los resultados. En contra de lo esperado, y a diferencia de lo que ocurre en otros trabajos6,7, en éste no se ha apreciado una disminución de la HbA1c, dato que podría deberse la ausencia de refuerzo en la educación diabetológica coincidente con el cambio: los niños-adolescentes que participaron en el estudio recibieron el mismo grado de atención que habitualmente se realiza en la visita médica, en la que se hace especial referencia tanto al tratamiento insulínico como a las medidas de protección frente a las hipoglucemias, revisión de alimentación y ejercicio como tratamiento. Los resultados positivos de otros trabajos podrían verse sesgados en la evaluación de una HbA1c a corto plazo, inmediata a la introducción del análogo y no a lo largo de 9–12 meses6.
Bajo tratamiento con IG aparece un descenso significativo de las hiperglucemias, especialmente en ayunas, debido a su perfil de acción prolongado que hace que cubra mejor las últimas horas de la noche2,20 o las primeras del amanecer, y el fenómeno del alba, típico de la pubertad, tiende a desaparecer. También mejora la glucemia media diaria, principalmente a expensas de este descenso de la glucemia en ayunas. Sin embargo, esto no conlleva una mejoría del control metabólico general que se traduzca en una HbA1c mantenida. A pesar de la insistencia en que la administración de dosis de análogo de insulina rápida antes de cada comida, existen dudas muy razonables de que estas medidas sean cumplidas siempre por muchos adolescentes. Un mal cumplimiento de las pautas de tratamiento establecidas puede contribuir a la existencia de picos de glucemias que no quedan documentados, pero que contribuyen de forma muy importante al mantenimiento de hemoglobinas semejantes a las de antes del cambio.
La dosis de insulina total disminuye con la IG; una posible explicación es que ésta es más estable2 y que al producirse menos hiperglucemias se necesitan menos dosis adicionales de insulina.
Se aprecia una ligera tendencia a la disminución del número de hipoglucemias nocturnas, que son las más peligrosas y las que más preocupan. Quizá por ello, y porque se constata una mayor flexibilidad para comer, realizar ejercicio o cambiar de horarios, se detecta un aumento del grado de satisfacción del tratamiento insulínico en todos los casos; ningún paciente ha vuelto al tratamiento anterior. Este aspecto es muy importante, sobre todo en los adolescentes y en los niños pequeños, a quienes les resulta complicado adaptarse a unos horarios rígidos. Los regímenes de tratamiento basal/bolo exigen un mínimo de 4 inyecciones al día (que incluso llegan a ser seis); para nuestros pacientes ello no supone una sobrecarga mayor, dado que en su mayoría, usaban insulina en dispositivos precargados (sin mezclas), con lo que ya necesitaban 5–6 inyecciones al día. Aunque estos resultados no sean tan positivos como los de otros autores6,7,15 podemos afirmar que es evidente una mejoría en la calidad de vida según la opinión directamente expresada por los padres y adolescentes. La mayor facilidad para los horarios, una cierta liberalización de las comidas y la disminución de las hipoglucemias nocturnas son valoradas como muy importantes, a pesar de que en el estudio general de las glucemias no haya cambios claramente ostensibles.