La deficiencia selectiva de IgA (DSIgA) es la inmunodeficiencia primaria más frecuente. Un pequeño porcentaje presenta patología, pero a mayor edad puede asociar deficiencia de alguna subclase de IgG y mayor susceptibilidad a infecciones, enfermedades alérgicas, enfermedades autoinmunes y neoplasias.
ObjetivosDescribir la asociación de DSIgA con: infecciones, enfermedades alérgicas, autoinmunes y neoplasias en una población pediátrica, otras alteraciones de la inmunidad y proponer un protocolo de seguimiento.
Material y métodosEstudio retrospectivo de pacientes pediátricos (<18 años) atendidos en consultas de Inmunología y de los registros de laboratorio del Hospital Sant Joan de Déu de Barcelona con cifras de IgA<50mg/L. Se revisaron la frecuencia e intensidad de las enfermedades asociadas y los estudios inmunológicos realizados desde 1992 a 2007.
ResultadosSe identifican 330 pacientes con DSIgA: 39 (11,8%) presentaron otitis de repetición, 2 con sordera como secuela; 58 (17,5%) infecciones respiratorias de vías altas repetidas y 20 (6%) tenían neumonías recurrentes, 6 de los cuales presentaron bronquiectasias y 2 requirieron lobectomía.
Las enfermedades atópicas se presentaban en 62 pacientes (18,78%). Respecto a enfermedades digestivas, 21 (6,5%) presentaban diarreas crónicas, 22 (6,6%) eran celiacos, y otros 3 tenían hepatitis crónica no filiada.
El 11,5% (38) de los individuos presentaron enfermedades autoinmunes (artritis crónica juvenil, diabetes mellitus, vitíligo, citopenias y enfermedad de Crohn). Se encontraron tumores en 5 pacientes (1,5%).
Respecto a otras alteraciones de la inmunidad, 5 asociaron una deficiencia de subclases de IgG, y en 6 pacientes se objetivó un defecto de síntesis de anticuerpos.
ConclusionesEn nuestra serie, el 56,6% de pacientes con DSIgA presenta otras comorbilidades, por orden de frecuencia, infecciones de repetición (respiratorias y óticas), enfermedades alérgicas, autoinmunes y tumores. Algunos pacientes sometidos a estudio inmunológico más amplio podrían desarrollar una forma de defecto humoral más grave como una deficiencia de subclases de IgG.
Selective IgA deficiency is the most common Primary Immune Deficiency. Only a small proportion of these patients present during childhood, but this proportion increases over the years, and may be associated with an IgG subclass deficiency with increased susceptibility to respiratory and digestive tract infections. During childhood, IgA deficient patients may also refer to symptoms related to allergic and autoimmune diseases or tumours.
AimsTo describe the relationship of selective IgA deficiency with infections, allergic diseases, autoimmune disorders and tumours. To investigate the presence of other immune disorders associated with selective IgA deficiency. To suggest a follow-up protocol for these patients.
MethodsRetrospective study of paediatric patients (<18 years) being followed-up in the Clinical Immunology Department between 1992 and 2007, as well as laboratory records with IgA values below 50mg/L. Clinical records were reviewed (frequency and intensity of diseases associated with selective IgA deficiency) along with immunology tests performed.
ResultsA total of 330 paediatric patients were identified with a selective IgA deficiency: 39 (11.8%) suffered from recurrent ear infections (2 developed secondary deafness), 58 (17.5%) from recurrent upper respiratory tract infections, and 20 patients (6%) from recurrent pneumonia, 6 of whom developed secondary bronchiectasis and 2 underwent a lobectomy.
A relationship with atopic disease was found in 62 (18.78%) of patients. Regarding digestive disorders, chronic diarrhoea was found in 21 (6.5%), coeliac disease in 22 (6.6%), and persistently high plasma transaminases in 3.
Autoimmune manifestations were found in 38 (11.5%), juvenile chronic arthritis, type 1 diabetes, vitiligo, cytopenia, and Crohn's disease, amongst others). Tumours were identified in 5 (1.5%).
An IgG sub-class deficiency was found in 5 patients (4%), and 6 patients had a confirmed deficiency in antibody production.
ConclusionsIn our cohort, 56.6% of patients with IgA deficiency showed other comorbidities which were, in decreasing frequency: recurrent infections (respiratory and ear infections), allergic diseases, autoimmunity and tumours. Some patients will develop a more severe humoral defect (IgG subclass deficiency with or without antibody deficiency).
El déficit de IgA en los primeros años de vida puede ser transitorio, y no se diagnostica de forma definitiva hasta los 4 años de edad1. El déficit selectivo de IgA se describe por primera vez en 1961 en pacientes afectos de ataxia-telangiectasia2.
Según el consenso del Grupo Pan-Americano de Inmunodeficiencias (PAGID) y la Sociedad Europea de Inmunodeficiencias (ESID)3 se define el déficit selectivo de IgA como aquella situación en que los niveles de IgA en sangre son inferiores a 7mg/dl (0,07g/L) con niveles normales de IgG e IgM y una función intacta de las células T en un paciente mayor de 4 años. Otros autores consideran valores inferiores a 5mg/dl4,5.
Se definen como pacientes afectos de déficit parcial de IgA los mayores de 4 años con concentraciones en sangre al menos 2 desviaciones estándar por debajo de la concentración normal para su edad4.
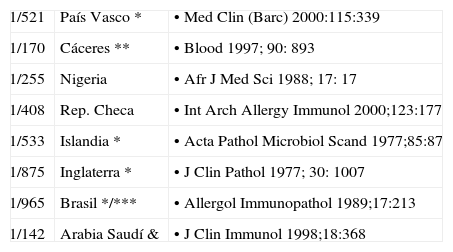
Se calculaba hasta hace poco que hasta el 90% de los déficits selectivos de IgA permanecen asintomáticos; sin embargo6, un seguimiento a largo plazo en donantes de sangre con déficit de IgA mostró que el 80% desarrollan síntomas a lo largo de su vida (tabla 1).
Donantes de sangre con deficiencia de IgA
| 1/521 | País Vasco * | • Med Clin (Barc) 2000:115:339 |
| 1/170 | Cáceres ** | • Blood 1997; 90: 893 |
| 1/255 | Nigeria | • Afr J Med Sci 1988; 17: 17 |
| 1/408 | Rep. Checa | • Int Arch Allergy Immunol 2000;123:177 |
| 1/533 | Islandia * | • Acta Pathol Microbiol Scand 1977;85:87 |
| 1/875 | Inglaterra * | • J Clin Pathol 1977; 30: 1007 |
| 1/965 | Brasil */*** | • Allergol Immunopathol 1989;17:213 |
| 1/142 | Arabia Saudí & | • J Clin Immunol 1998;18:368 |
Donantes de sangre *, Escolares **, Embarazadas sanas ***
Remitidos para descartar ID, alergia, o disgammaglobulinemias & (5)
La prevalencia en caucásicos es aproximadamente de 1/500 y decrece dramáticamente en poblaciones asiáticas7. Estas variaciones apoyan una predisposición genética.
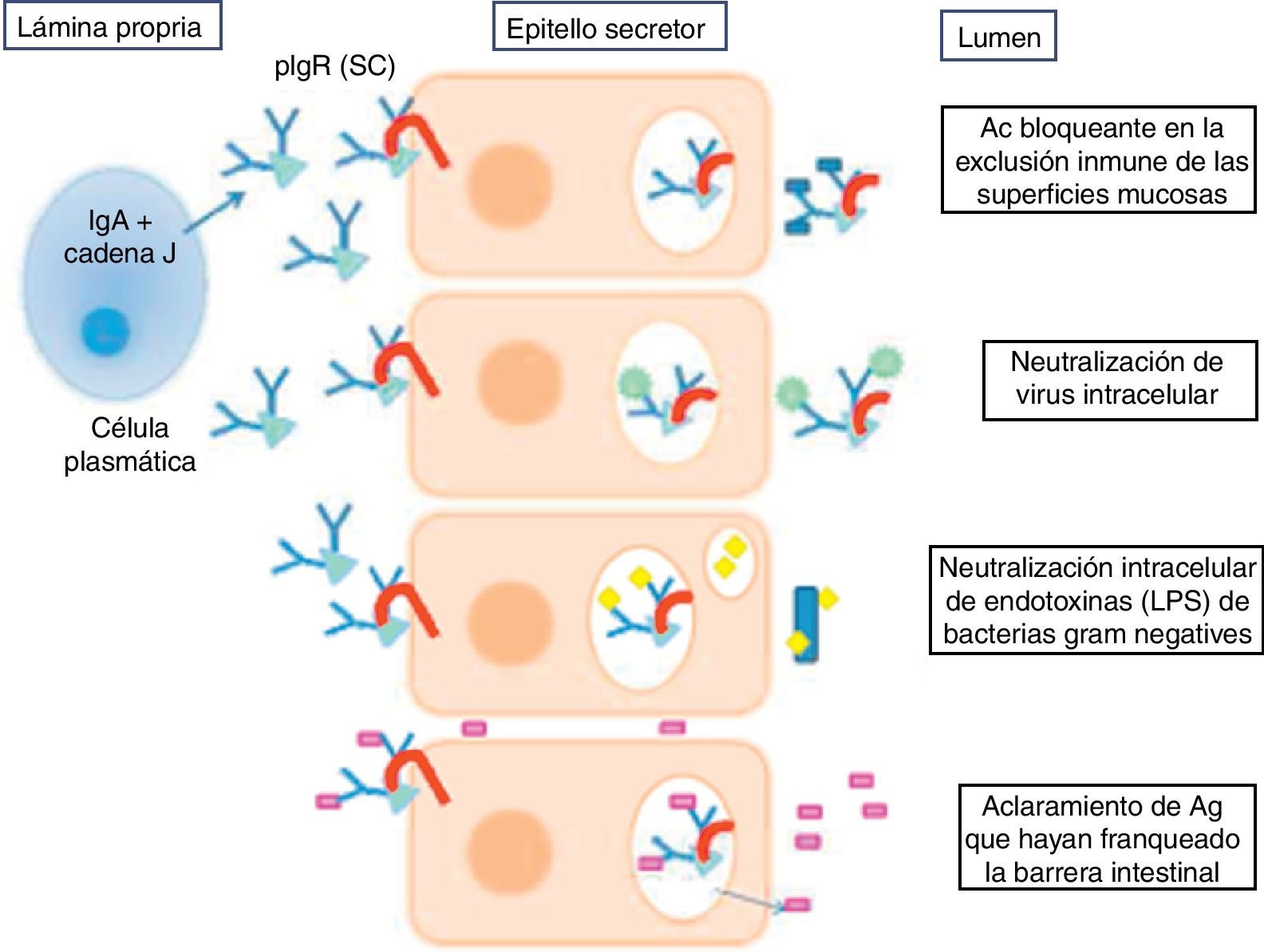
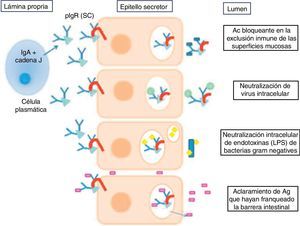
La IgA se encuentra en dos formas: una forma monomérica en suero y una forma dimérica secretora. Existen 2 subclases de IgA: la IgA1 y la IgA2 (la cual predomina en la forma secretora), diferenciándose en 22 aminoácidos. Esta isoforma es más resistente a la degradación proteolítica por las bacterias8. La IgA se une al receptor polimérico para inmunoglobulinas de las células del epitelio secretor y se sugiere que actúa mediante distintos mecanismos inmunes que esquematizamos en la figura 19.
El déficit inmune humoral resulta de un defecto en la producción de anticuerpos por un fallo molecular intrínseco en la célula B o por una disfunción en la interacción entre células B y T que dificultan el cambio de isotipo.
Existe una forma de DSIgA, secundaria a algunos fármacos, que es reversible al retirarlos5 (tabla 2). Además se ha descrito de forma permanente con el uso de la ciclosporina A para tratamiento de las uveítis recurrente10. Infecciones como la rubeola congénita, hepatitis C y virus de Epstein-Barr (EBV) pueden causar déficit persistente de IgA11.
En muchos pacientes con DSIgA, las células B expresan IgA en su superficie, pero existe un fracaso en su diferenciación final en células plasmáticas. En algunos estudios se han relacionado con disfunciones de citocinas5 y otros autores han hallado una sobreexpresión del gen de la caspasa 1 en un grupo de pacientes12.
También se ha demostrado una asociación de ciertos tipos de HLA con el déficit de IgA en diferentes poblaciones étnicas. Estos haplotipos susceptibles incluyen HLA-A1, HLA-B8 y HLA-DR-3, y HLA-A1, HLA-A29, HLA-B8 y HLA-B1411.
El DSIgA se asocia a infecciones respiratorias recurrentes, a enfermedades alérgicas, enfermedades autoinmunes, infecciones u otras enfermedades gastrointestinales, y anafilaxia frente a algunos hemoderivados.
Las infecciones son frecuentemente virales y no suelen ser graves, las infecciones bacterianas son relativamente infrecuentes13. Los pacientes tienen un aumento de infecciones gastrointestinales. La asociación mejor conocida es la infección con Giardia lamblia11 (tabla 3)14.
Asociación de la deficiencia de IgA con otras enfermedades
| • Infecciones | • 43% |
| • Enfermedades alérgicas | • 20% |
| • Enfermedades autoinmunes | • 14% |
| • Enfermedades digestivas | • 12% |
| • Tumores | • 1% |
(12) Schaffer FM, Chapt 4 -IgA deficiency
Inmunodeficiencies, Rosen FS, Seligmann M, Harwood Academic Publishers 1993
Las infecciones son más frecuentes en DSIgA asociadas con déficit de subclase de IgG2. La hiperplasia nodular linfoide probablemente es la alteración maligna más común en estos pacientes11.
ObjetivosDescribir la asociación de la deficiencia selectiva de IgA con: infecciones, enfermedades alérgicas, enfermedades autoinmunes y neoplasias en la edad pediátrica.
Investigar la presencia asociada a la deficiencia de IgA de otras alteraciones de la inmunidad.
Proponer un protocolo de seguimiento para estos pacientes.
Material y métodosEstudio retrospectivo de 331 historias, obtenidas de la consulta externa pediátrica de Alergia e Inmunología Clínica del Hospital Sant Joan de Déu de Barcelona desde el año 1992 hasta marzo de 2007, así como los registros del laboratorio del hospital con resultados de IgA<50mg/L de los últimos 10 años. Se revisaron los datos analíticos y clínicos, como:
- •
Infecciones respiratorias (IRVA, otitis, neumonías)
- •
Enfermedades digestivas
- •
Enfermedades alérgicas
- •
Enfermedades autoinmunes
- •
Neoplasias
En cuanto a las infecciones respiratorias y a las gastroenteritis, se valoró la incidencia y repercusión de la patología separando cuatro grupos,
- •
0: pacientes en cuya historia no constaba ningún proceso de este tipo
- •
1: Pacientes que habían presentado episodios con una frecuencia que podía considerarse propia de la edad del paciente.
- •
2: Pacientes que presentaban procesos infecciosos de repetición.
- •
3: Pacientes con secuelas de los procesos padecidos.
De los 330 pacientes con IgA<50mg/l, 178 pacientes (54%) son varones y 152 (46%) son mujeres. En cuanto a los antecedentes familiares; 35 pacientes (10,8%) tenían antecedentes de atopia y 7 (2,16%) de enfermedad autoinmune.
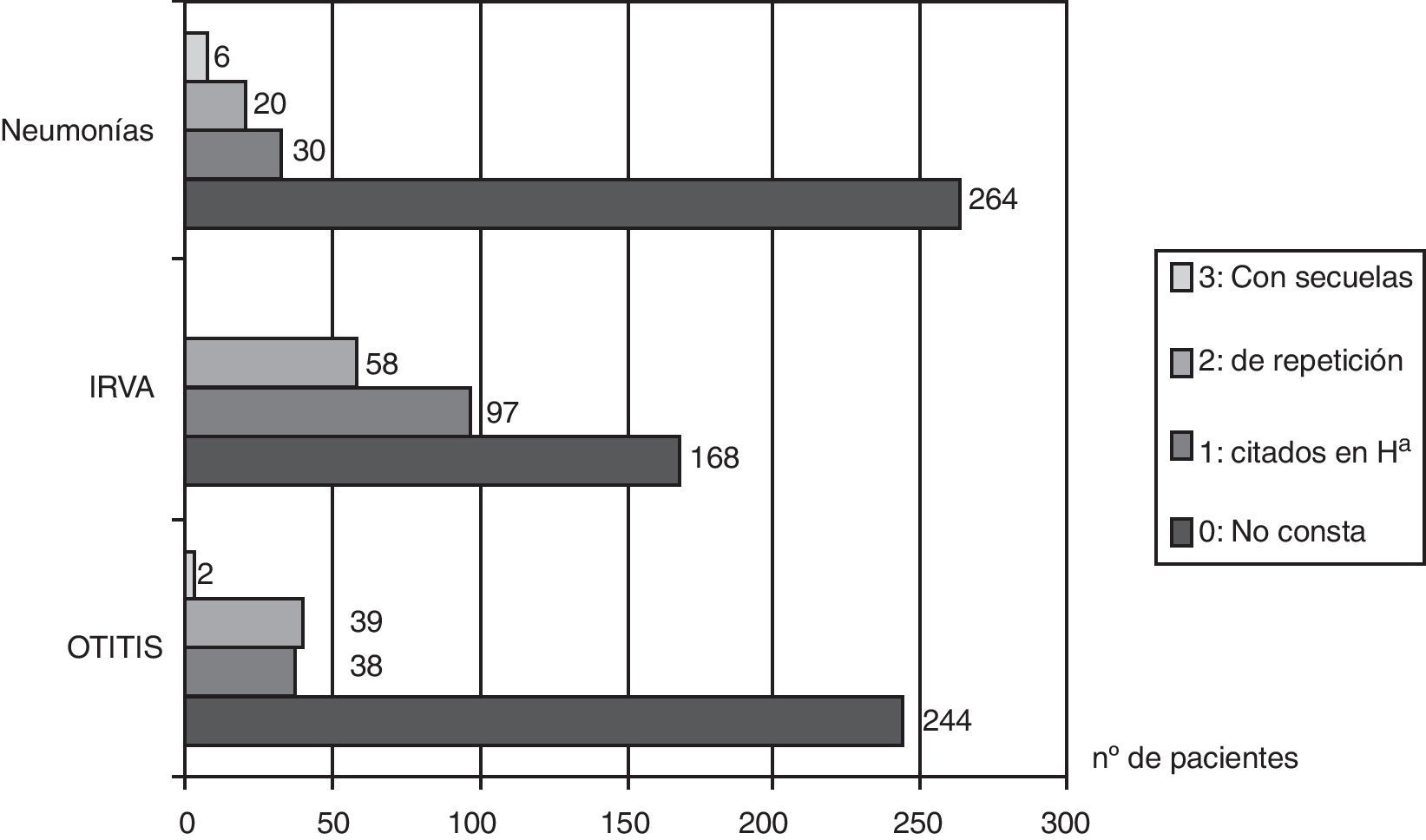
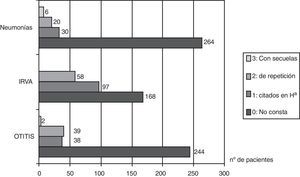
En cuanto a las infecciones respiratorias de vías altas, las relatan 155 pacientes de 330 (47%), y en 58 pacientes (17,5%) constan en la historia clínica como de repetición. Sesenta y tres pacientes (19%) fueron sometidos a adenoidectomía. Respecto a la frecuencia infecciones óticas, de 330 pacientes en 244 (73,5%) su historia clínica no mostraba datos de ningún proceso infeccioso ótico; 79 (24%) relataban otitis y de ellos 39 (11,8%) tuvieron otitis de repetición. Solo 2 pacientes (0,6%) tuvieron sordera como secuela (gráfico 1).
Cincuenta y nueve pacientes presentaron neumonías (17,8%), en 20 (6%) son neumonías de repetición y en 6 pacientes (1,8%) había secuelas: 5 bronquiectasias y 2 lobectomías.
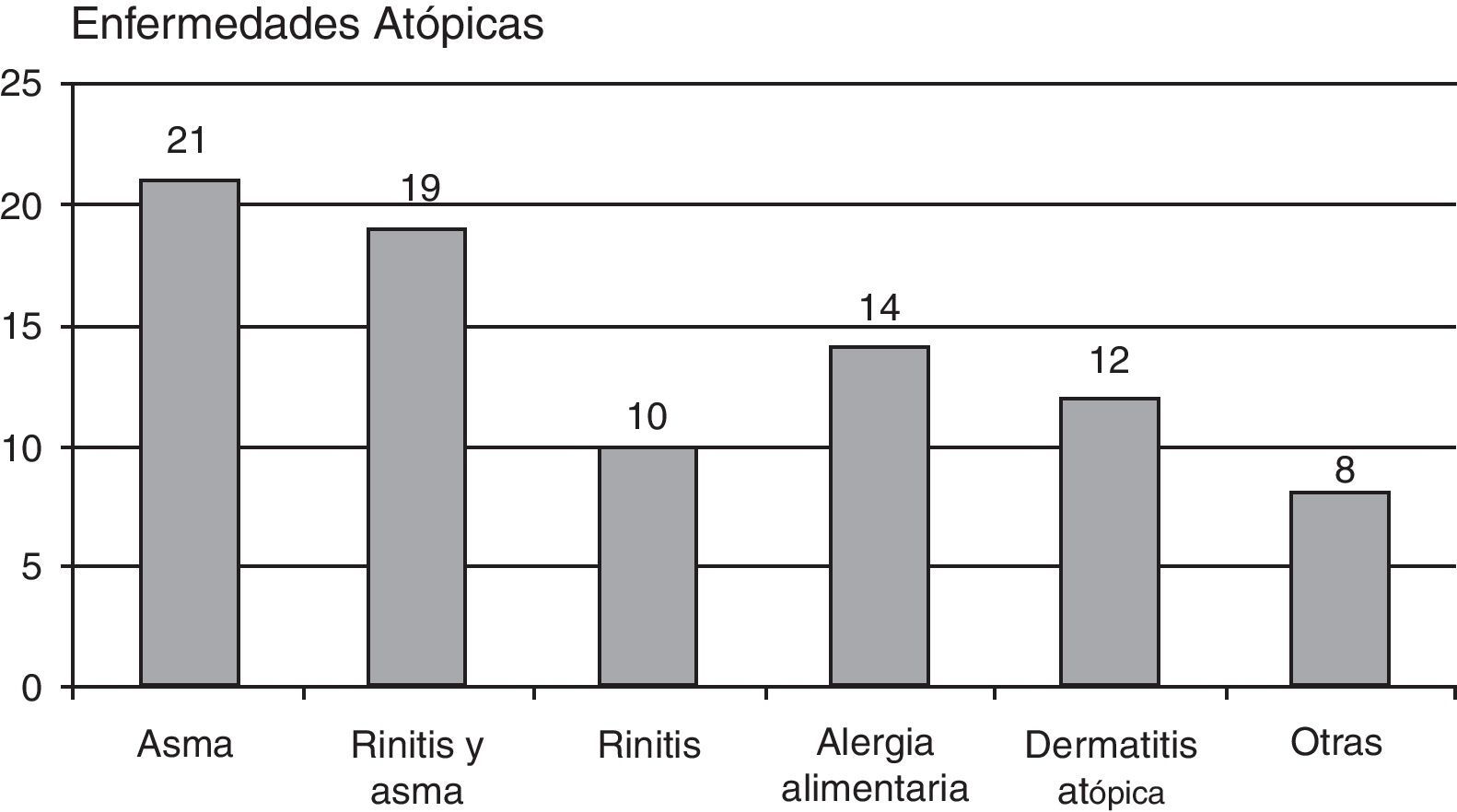
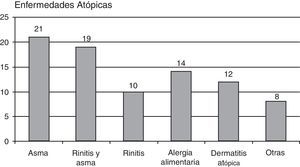
Tenían enfermedades alérgicas 62 pacientes (18,78%): 21 pacientes asma extrínseca, 20 asma y rinitis, 10 referían rinitis aislada, 14 pacientes alergia alimentaria, 12 pacientes dermatitis atópica, y 8 otras enfermedades alérgicas (gráfico 2).
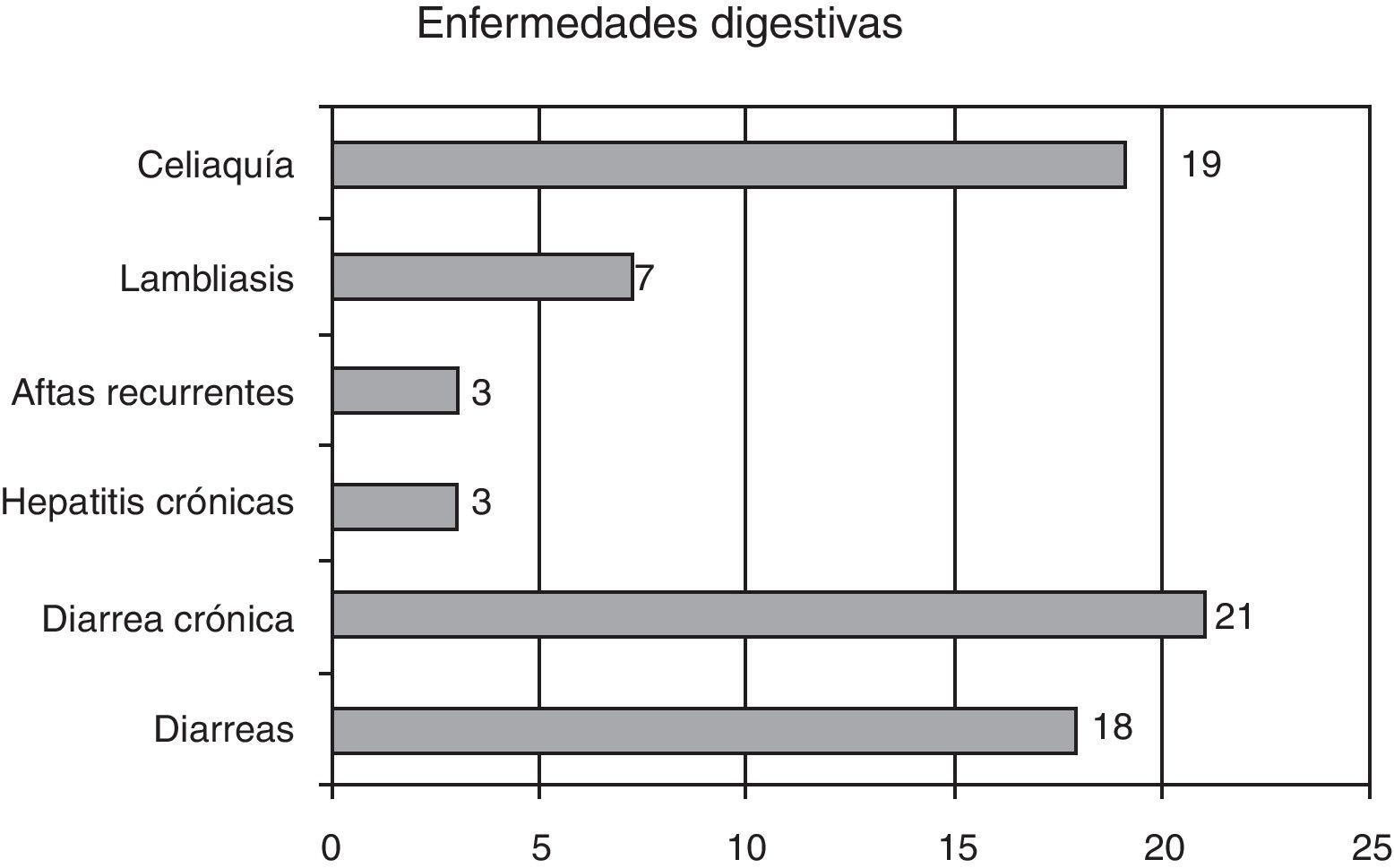
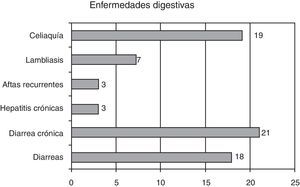
En cuanto a las enfermedades digestivas, las presentaron 70 pacientes (21,2%); las más frecuentes fueron las diarreas, en 21 pacientes (6,5%) figuran en la historia como de repetición o crónicas, en 1 paciente (0,3%) hay secuelas (gráfico 3).
Otras enfermedades digestivas observadas fueron la celiaquía 22 pacientes (un 6,6%), 7 lambliasis, 3 aftas recurrentes y 3 pacientes presentaban hepatitis crónica.
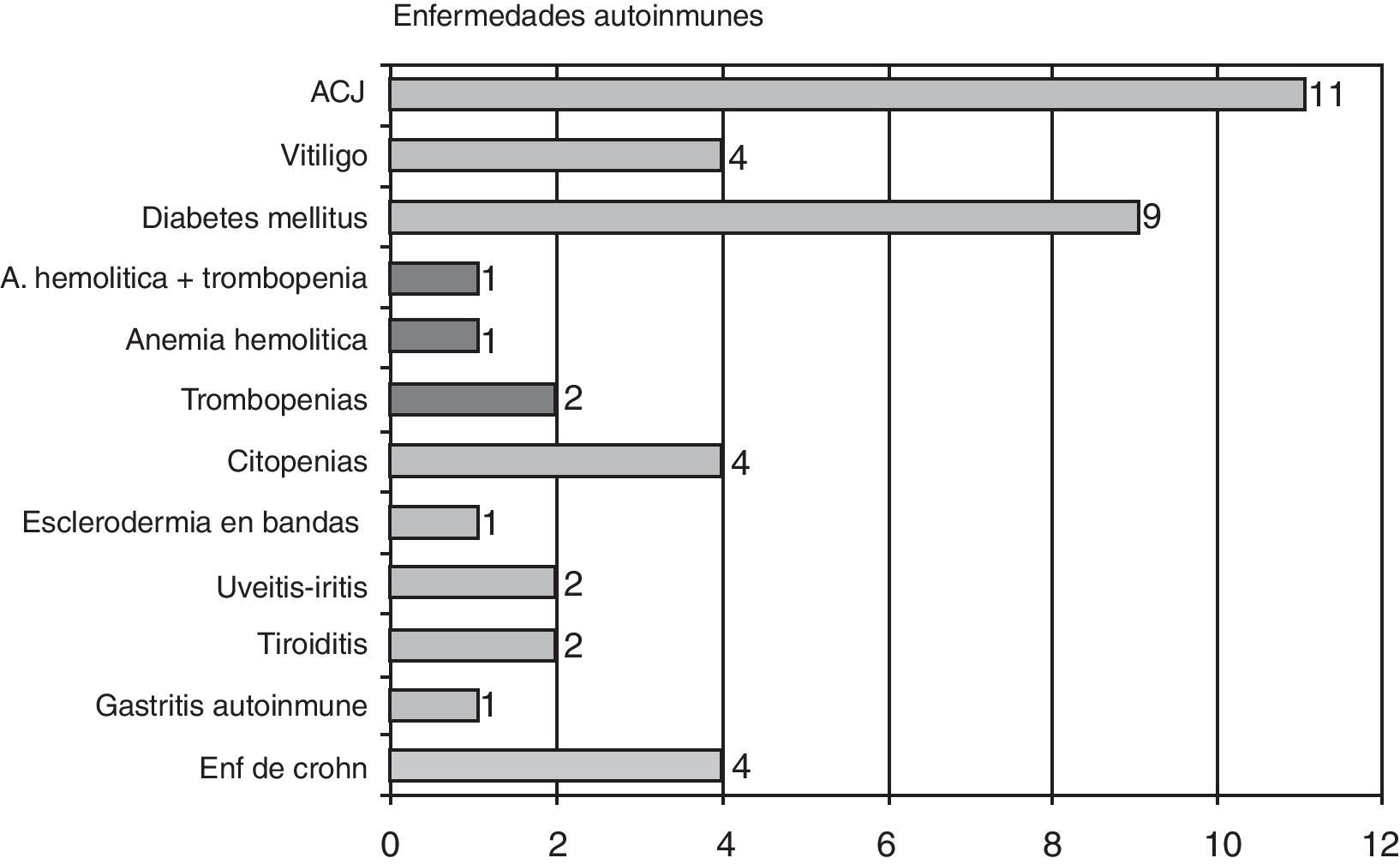
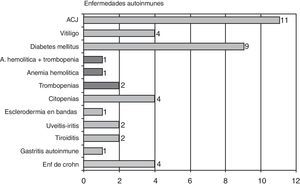
Las enfermedades autoinmunes se presentaron en 38 pacientes (11,5%), siendo las más frecuentes la artritis crónica juvenil, con 11 casos, la diabetes mellitus insulino dependiente con 10, citopenias4, vitíligo4, enfermedad de Crohn4, uveítis2, tiroiditis2, una esclerodermia en bandas, una gastritis autoinmune, y una enfermedad mixta del tejido conectivo. Seis pacientes tenían más de 2 enfermedades autoinmunes, y dos pacientes diabéticas eran además celiacas (gráfico 4).
Cinco pacientes presentaron neoplasias (1,5%): linfoma de Hodgkin, leucemia linfoide aguda, tumor de Wilms, linfoma de Burkitt y ganglioneuroma.
Entre los hallazgos de laboratorio destacaban niveles de IgE total elevados para su edad en 154 pacientes de 330.
De los 70 pacientes a los que se determinaron los valores de subclases de IgG, solo 5 presentaron alteraciones de estas pasados los 7 años de edad, junto con clínica predominantemente infecciosa: 1 asoció una deficiencia de IgG2 y presentaba bronquitis de repetición, otro deficiencia de IgG3 que había tenido una sepsis neonatal, neumonías de repetición y artritis crónica juvenil (ACJ); otro paciente deficiencia de IgG2 e IgG4 con neumonías que requirió lobectomía, y 2 pacientes presentaron IgG4 indetectable exclusivamente, a pesar de su poca significación clínica, uno tenía bronquiectasias. El otro paciente estaba asintomático.
En relación a la respuesta de anticuerpos específica, 2 pacientes no respondieron a antígenos polisacáridos (vacunación con Pneumovax), y 4 tenían anticuerpos antitetánicos no protectores (en estos pacientes los niveles de las subclases de IgG eran normales). Un paciente, diagnosticado a los 6 años de DSIgA, evolucionó a los 7 a una inmunodeficiencia variable común (IDVC).
DiscusiónLos datos de nuestra revisión van en concordancia con lo publicado y ponen de manifiesto la elevada incidencia de comorbilidades y serias complicaciones en este grupo de pacientes que con frecuencia se minusvaloran en la práctica.
Revisando familias de pacientes con déficit selectivo de IgA (DSIgA), se halló la misma anomalía en el 7,2% de los familiares en primer grado (frente al 0,25% de la población) tal como cita Hostoffer5. Sin embargo, el patrón de herencia no es bien conocido. Además, los datos no explican la enfermedad en los pacientes asintomáticos que son la mayoría.
El primer defecto genético que se identificó en esta enfermedad fue una mutación en un miembro de la familia de receptores del TNF, denominado transmembrane activator and calcium modulator an cyclophilin ligand interactor (TACI)5.
Esta mutación se ha descrito en un pequeño grupo de pacientes de DSIgA y de inmunodeficiencia variable común (IDVC) y algunos con DSIgA pueden progresar a un DSIgA con déficit de subclases de IgG o a una IDVC15. En el paciente de nuestra serie que evolucionó a una inmunodeficiencia variable común, el estudio del gen TACI fue negativo.
Los pacientes con DSIgA están asintomáticos en su mayor parte (85-90%) y este defecto es frecuentemente un hallazgo casual en un estudio por otra causa.
A pesar de que el diagnóstico definitivo se establezca a los 4 años, la mayoría de los pacientes (77%) que tienen una IgA por debajo de 7mg/dl a los 3 años siguen presentando iguales cifras a los 7 años16.
Debe tenerse en cuenta que nuestros pacientes pertenecen a un subgrupo seleccionado por su necesidad de asistencia en uno u otro departamento del hospital, con lo que es posible un sesgo de la prevalencia en este grupo de las enfermedades descritas.
Aun así, llama la atención la asociación con la enfermedad celiaca en 22 pacientes de los 330 (6,6%) frente a un 0,5-1%17 en la población general y en lo descrito en otras publicaciones en pacientes con déficit selectivo de IgA18. Los pacientes se diagnosticaron a los 8 años como media (entre 1 y 17 años). Las enfermedades asociadas al DSIgA en nuestros pacientes no diferían en cuanto a la edad de inicio, de la del resto de la población afecta de esa enfermedad.
Llama también la atención en nuestro grupo el número de enfermedades autoinmunes:
- •
11/330 habían desarrollado una artritis crónica juvenil (3,3 frente al 0.113% de la población general)
- •
10 presentaban una diabetes mellitus (3 frente al 0,08% de la población)
- •
tenían una enfermedad de Crohn (1,2 frente a un 0,13%)19
Y curiosamente, a pesar de que una parte importante de los pacientes procedía de la consulta externa de Alergia e Inmunología Clínica, el porcentaje de pacientes afectos de asma y/o rinitis alérgica era mayor que en la población española de su edad, pero no tanto como cabría esperar.
En nuestro grupo padecían asma o rinitis el 15,4%, teniendo en cuenta que en el estudio Isaac publicado en 2006 la frecuencia de síntomas de asma en población pediátrica era del 9,6%, y la de síntomas de rinitis del 7,9% en España20,21.
En cuanto a las infecciones respiratorias, siendo un estudio retrospectivo que incluía pacientes procedentes de otros servicios del hospital no controlados en nuestro servicio, la evaluación de la frecuencia de las infecciones respiratorias tan comunes a estas edades posiblemente era dispar de manera que se tuvo en cuenta si constaban en la historia como procesos de repetición, o había secuelas de los mismos.
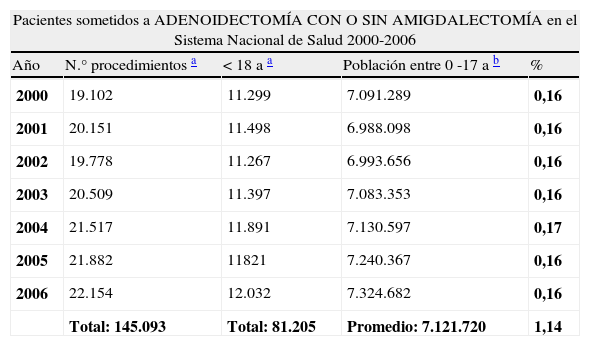
Para contar con datos más objetivos se tomó nota en la revisión de la historia si constaba en ella que los pacientes hubieran sido sometidos a adenoidectomía con o sin amigdalectomía. En la historia de 63 pacientes (19% del grupo) consta que fueron sometidos a una adenoidectomía, proporción que parece alta.
Para confirmarlo, en el portal estadístico del Ministerio de Sanidad se accedió al registro de altas de los hospitales del Sistema Nacional de Salud, y se obtuvo el número anual de altas hospitalarias por este procedimiento quirúrgico en menores de 18 años, dato disponible desde el año 2000. Se consiguieron dichos datos desde el año 2000 al 2006 inclusive y en el Instituto Nacional de Estadística se averiguó el número de personas de ese rango de edad, por año, en el país calculándose la media de población de esa edad en el periodo.
Se obtuvo el porcentaje de pacientes adenoidectomizados en la media de población menor de 18 años entre el año 2000 y 2006, y se comparó con los pacientes de nuestro grupo que pertenecían a ese grupo etario en el mismo periodo temporal, y estaban adenoidectomizados, que eran 22 de 192 (tabla 4).
Diferencia de proporción de pacientes adenoidectomizados en población general entre 0 y 17 años, y pacientes afectos de DSIgA sometidos a dicho procedimiento quirúrgico, en el periodo comprendido entre los años 2000 y 2006 ambos inclusive
| Pacientes sometidos a ADENOIDECTOMÍA CON O SIN AMIGDALECTOMÍA en el Sistema Nacional de Salud 2000-2006 | ||||
| Año | N.° procedimientos a | <18 a a | Población entre 0 -17 a b | % |
| 2000 | 19.102 | 11.299 | 7.091.289 | 0,16 |
| 2001 | 20.151 | 11.498 | 6.988.098 | 0,16 |
| 2002 | 19.778 | 11.267 | 6.993.656 | 0,16 |
| 2003 | 20.509 | 11.397 | 7.083.353 | 0,16 |
| 2004 | 21.517 | 11.891 | 7.130.597 | 0,17 |
| 2005 | 21.882 | 11821 | 7.240.367 | 0,16 |
| 2006 | 22.154 | 12.032 | 7.324.682 | 0,16 |
| Total: 145.093 | Total: 81.205 | Promedio: 7.121.720 | 1,14 | |
| Pacientes con DSIgA sometidos a ADENOIDECTOMÍA en el mismo intervalo temporal. | ||||
| DSIgA | 22 | 192 | 11,46 | |
| Diferencia entre de proporción entre ambos grupos: 10,3% (IC 95%: 5,8- 14,8) | ||||
La diferencia entre grupos fue de un 10,3% (IC 95%: 5,8–14,8), lo cual es estadísticamente significativo. Estos datos apoyan que son pacientes con un número de infecciones de la esfera otorrinolaringológica muy superior a los demás niños de su edad.
Dada la disparidad de origen de los pacientes y el largo periodo de tiempo transcurrido, el tipo de estudios realizados y los métodos analíticos para la valoración de la situación inmunológica de los pacientes fueron muy distintos, por lo que no podemos compararlos.
En conjunto, nuestros datos sugieren que sería adecuado que los pacientes diagnosticados de deficiencia selectiva de IgA siguieran un control evolutivo y analítico.
En nuestra opinión, debería realizarse al diagnóstico un hemograma, VSG, inmunoglobulinas, subclases IgG, Ac antidifteria, Ac antitétanos, Ac antineumocócicos, que nos permitan valorar la respuesta de anticuerpos y su persistencia con niveles protectores en el tiempo si es necesario, IgE total y específica (si precisa), y AAN, a los que se pueden añadir otros autoanticuerpos si la clínica es sugestiva de alguna enfermedad autoinmune específica.
El seguimiento posterior, que puede realizar por el pediatra habitual, podría ser anual o bianual hasta los 10 años de edad (fase de maduración del sistema inmune) y cada 2 a 5 años posteriormente, y debería incluir hemograma, VSG, inmunoglobulinas, subclases IgG y AAN, evaluando la respuesta de anticuerpos si la evolución del paciente lo indica (tabla 5).
Control evolutivo de la deficiencia selectiva de IgA en pacientes asintomáticos
| Exámenes complementarios | Periodicidad |
| Evaluación clínica en cada control | |
| • Hemograma• VSG• Inmunoglobulinas (G; A, M, E)• Subclases IgG• Ac antidifteria• Ac antitétanos• Ac antineumocócicos• CH50• AAN | Al diagnóstico |
| • Hemograma• VSG• Inmunoglobulinas (G; A, M)• Subclases IgG• AAN• Respuesta de Ac (según clínica) | Cada 1-2 años:<de 10 a.Cada 2-5 años:>de 10 a. |
En caso de defecto de la respuesta a antígenos vacunales, estimulación con vacuna y reevaluar
La evaluación analítica debe estar siempre condicionada por la clínica.
En todos los pacientes sintomáticos con déficit de IgA, especialmente si tienen asociación con deficiencia de subclases de IgG o enfermedades autoinmunes, debería controlarse su posible evolución hacia una IDCV.
En nuestro centro se realizan automáticamente ante la detección de unas cifras de IgA <50mg/L, unos marcadores de celiaquía mediante anticuerpos IgG. La homocigosis para los haplotipos de HLA B8, DR3, DQ2 o parte de este haplotipo es un factor de riesgo para el desarrollo de enfermedades autoinmunes, así como de desarrollo de IDCV14,22.
Los pacientes deben informar a sus médicos de su deficiencia de IgA ante la posibilidad desarrollar patologías asociadas, También los asintomáticos, ya que de precisar transfusiones sanguíneas, un porcentaje de estos pacientes pueden reaccionar frente a la IgA presente en la sangre perfundida, que deberá someterse a tratamiento previo11. La incidencia actual de estas reacciones ha sido estimada en 1,3 por millón de unidades de sangre o productos sanguíneos infundidos11. Los anticuerpos anti-IgA son normalmente de la subclase IgG1 y más común en sujetos con déficit de IgA que también tienen un déficit de IgG223.
En resumen en nuestra serie, la deficiencia selectiva de IgA se asocia con infecciones de repetición (respiratorias -23,5%- y óticas -17,5%-), enfermedades alérgicas (18,7%), autoinmunes (13,5%) y tumores (1,5%). Algunos de los pacientes sometidos a estudio inmunológico más amplio desarrollan una forma más grave de defecto humoral (déficit de subclases con o sin defecto de producción de anticuerpos).
Esta revisión de pacientes con déficit de IgA pretende alertar sobre la elevada incidencia de enfermedades en la edad pediátrica que pueden mermar la calidad de vida de los pacientes, y el seguimiento de los pacientes diagnosticados de deficiencia selectiva de IgA debe enfocarse en el despistaje de dichas comorbilidades para un diagnóstico precoz, que minimice en lo posible las complicaciones.
Recomendaríamos una evaluación inicial por parte del inmunólogo pediátrico, pero es un grupo de población que se beneficia de un seguimiento regular que puede realizar su pediatra habitual, basándose en el protocolo que sugerimos.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.