Los linfomas son la tercera neoplasia maligna en los niños y, dentro de ellos, los linfomas no Hodgkin (LNH) representan tan solo el 7% del cáncer en menores de 15 años. La quimioterapia constituye actualmente el tratamiento de elección. El objetivo de este estudio es analizar la toxicidad secundaria al tratamiento en pacientes pediátricos diagnosticados de LNH.
Material y métodosEstudio retrospectivo de pacientes diagnosticados de LNH de células B maduras tratados según el protocolo LMB 2001, desde enero del 2007 hasta febrero del 2014. Se recogieron los datos referentes al diagnóstico, el tratamiento y las toxicidades que desarrollaron durante el mismo.
ResultadosSe diagnosticaron 20 LNH de células B maduras: 16 linfomas Burkitt, 2 linfomas difusos de células grandes y 2 leucemias maduras. Un 65% de los pacientes se clasificó al diagnóstico en un estadio de alto grado (iii-iv). Los procesos infecciosos graves, la mielosupresión severa, las alteraciones hepáticas y la mucositis fueron las toxicidades más frecuentes. La supervivencia global fue del 95% (19/20). Un paciente falleció por causas no relacionadas con su enfermedad.
ConclusiónLa mayoría de los pacientes diagnosticados de LNH de células B maduras experimentan toxicidades grado iii y iv durante el tratamiento, a pesar de lo cual la supervivencia es excelente.
Lymphomas are the third malignancy in children, and within them non-Hodgkin lymphoma (NHL) accounts for just 7% of cancers in children under 15 years old. Chemotherapy is currently the treatment of choice. The objective of this study is to analyze the toxicity caused by the treatment in pediatric patients diagnosed with NHL.
Material and methodsA retrospective study was conducted on patients diagnosed with mature B-cell NHL, treated according to the LMB protocol 2001, from January 2007 to February 2014. Data concerning the diagnosis, treatment and toxicities that developed in the patients during the same period were collected.
ResultsA total of 20 mature B-cell NHL cases were diagnosed: 16 Burkitt lymphomas, 2 diffuse large cell lymphomas and 2 mature leukemias. Almost two-thirds (65%) of patients were classified in a high grade stage (iii-iv) at diagnosis. Serious infectious processes, severe myelosuppression, liver abnormalities, and mucositis were the most frequent toxicities. Overall survival was 95% (19/20). One patient died of causes unrelated to the illness.
ConclusionDespite the excellent survival rate, most patients diagnosed with NHL mature B cells experience grade iii and iv toxicities during treatment.
Los linfomas constituyen la tercera neoplasia maligna más frecuente en niños, detrás de la leucemia aguda y los tumores del sistema nervioso central1. Los linfomas no Hodgkin (LNH) constituyen un grupo heterogéneo de enfermedades que representan el 7% del cáncer en menores de 15 años en los países desarrollados2. Actualmente, la clasificación de LNH más aceptada es la de la Organización Mundial de la Salud3. En la infancia, los subtipos más frecuentes derivan de las células B maduras4. Entre ellos se encuentran el linfoma Burkitt, el linfoma difuso de células grandes y la leucemia madura5. El linfoma Burkitt es el tercer tumor de origen linfoide más común después de la leucemia aguda linfoblástica y el linfoma de Hodgkin en niños menores de 15 años de edad6. En general, son tumores de alto grado de malignidad y comportamiento agresivo7. La quimioterapia, que constituye la piedra angular del tratamiento, asocia una importante toxicidad aguda, fundamentalmente la mielosupresión, que hace necesario el soporte transfusional y la profilaxis antiinfecciosa. Las náuseas y los vómitos, así como la mucositis, son también frecuentes8,9. A pesar de ello, el pronóstico es muy favorable con los tratamientos actuales. La supervivencia ha mejorado de forma espectacular en los últimos años gracias a los nuevos esquemas de quimioterapia, superando el 85% a los 5 años2. El protocolo francés Lymphoma Malignancy B (LMB 96) ha demostrado un aumento de la supervivencia global y libre de eventos en pacientes diagnosticados de linfoma Burkitt y leucemia madura en comparación con otros protocolos10.
El objetivo de este trabajo es analizar la toxicidad secundaria al tratamiento quimioterápico de pacientes con linfoma de Burkitt, linfoma difuso de células grandes y leucemia B madura, tratados según el protocolo LMB-2001 (LNH 04).
Material y métodosSe revisaron las historias clínicas de los pacientes diagnosticados de LNH que recibieron tratamiento según el protocolo LNH 04 desde enero del 2007 hasta febrero del 2014. Se recogieron los datos referentes al diagnóstico y las toxicidades que desarrollaron a lo largo de los diferentes ciclos del tratamiento. Las toxicidades se recopilaron según la hoja de datos incluida en el protocolo y se clasificaron según los criterios comunes de toxicidad del Instituto Nacional del Cáncer, versión 2.0. Los datos cuantitativos se expresan como mediana (rango), y los cualitativos como número sobre el total (n/N). El análisis estadístico se realizó a través del programa SPSS statistics® versión 19.
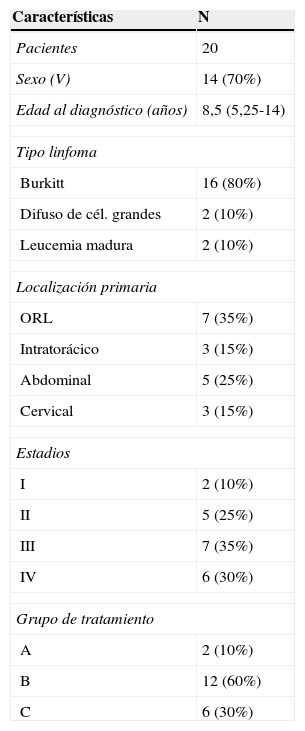
ResultadosUn total de 20 pacientes se diagnosticaron en nuestra Unidad desde enero de 2007 hasta febrero del 2014. Las características de la población se resumen en la tabla 1. La edad variaba desde los 3 a los 16 años. Existía un predominio de varones (70%). No se identificaron antecedentes personales de interés en relación con el riesgo de desarrollar un LNH (inmunodeficiencia, trasplante de órgano sólido, neoplasia previa, VIH). Al diagnóstico, 6 pacientes presentaron afectación ganglionar, 9 afectación extranodal secundaria, fundamentalmente renal y hepática, 6 tenían derrame pleural y 8 precisaron ingreso en la UCIP con una estancia media de 3,25 días. El 65% de los pacientes se clasificaron en un estadio de alto grado (iii-iv).
Características de los pacientes y clasificación según estadios y grupos de tratamiento
| Características | N |
|---|---|
| Pacientes | 20 |
| Sexo (V) | 14 (70%) |
| Edad al diagnóstico (años) | 8,5 (5,25-14) |
| Tipo linfoma | |
| Burkitt | 16 (80%) |
| Difuso de cél. grandes | 2 (10%) |
| Leucemia madura | 2 (10%) |
| Localización primaria | |
| ORL | 7 (35%) |
| Intratorácico | 3 (15%) |
| Abdominal | 5 (25%) |
| Cervical | 3 (15%) |
| Estadios | |
| I | 2 (10%) |
| II | 5 (25%) |
| III | 7 (35%) |
| IV | 6 (30%) |
| Grupo de tratamiento | |
| A | 2 (10%) |
| B | 12 (60%) |
| C | 6 (30%) |
Los datos cualitativos se expresan como n (%) y los datos cuantitativos como mediana (rango).
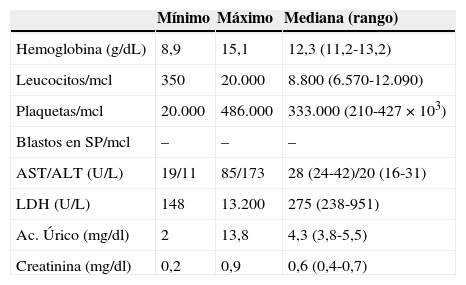
En la analítica inicial al diagnóstico (tabla 2) 4/20 presentaron anemia con cifras de hemoglobina < 11g/dL asociando solo en un caso una trombocitopenia severa que precisó soporte transfusional. En cuanto a los glóbulos blancos, un paciente presentó neutropenia severa, y 6 pacientes tenían leucocitosis. En la bioquímica, cabe destacar que un paciente presentó una hipertransaminasemia leve; sin embargo, hasta 7 debutaron con cifras elevadas de LDH y de ellos 4 también con hiperuricemia. No hubo alteraciones en los niveles de creatinina en ningún caso.
Datos de laboratorio al diagnóstico
| Mínimo | Máximo | Mediana (rango) | |
|---|---|---|---|
| Hemoglobina (g/dL) | 8,9 | 15,1 | 12,3 (11,2-13,2) |
| Leucocitos/mcl | 350 | 20.000 | 8.800 (6.570-12.090) |
| Plaquetas/mcl | 20.000 | 486.000 | 333.000 (210-427×103) |
| Blastos en SP/mcl | – | – | – |
| AST/ALT (U/L) | 19/11 | 85/173 | 28 (24-42)/20 (16-31) |
| LDH (U/L) | 148 | 13.200 | 275 (238-951) |
| Ac. Úrico (mg/dl) | 2 | 13,8 | 4,3 (3,8-5,5) |
| Creatinina (mg/dl) | 0,2 | 0,9 | 0,6 (0,4-0,7) |
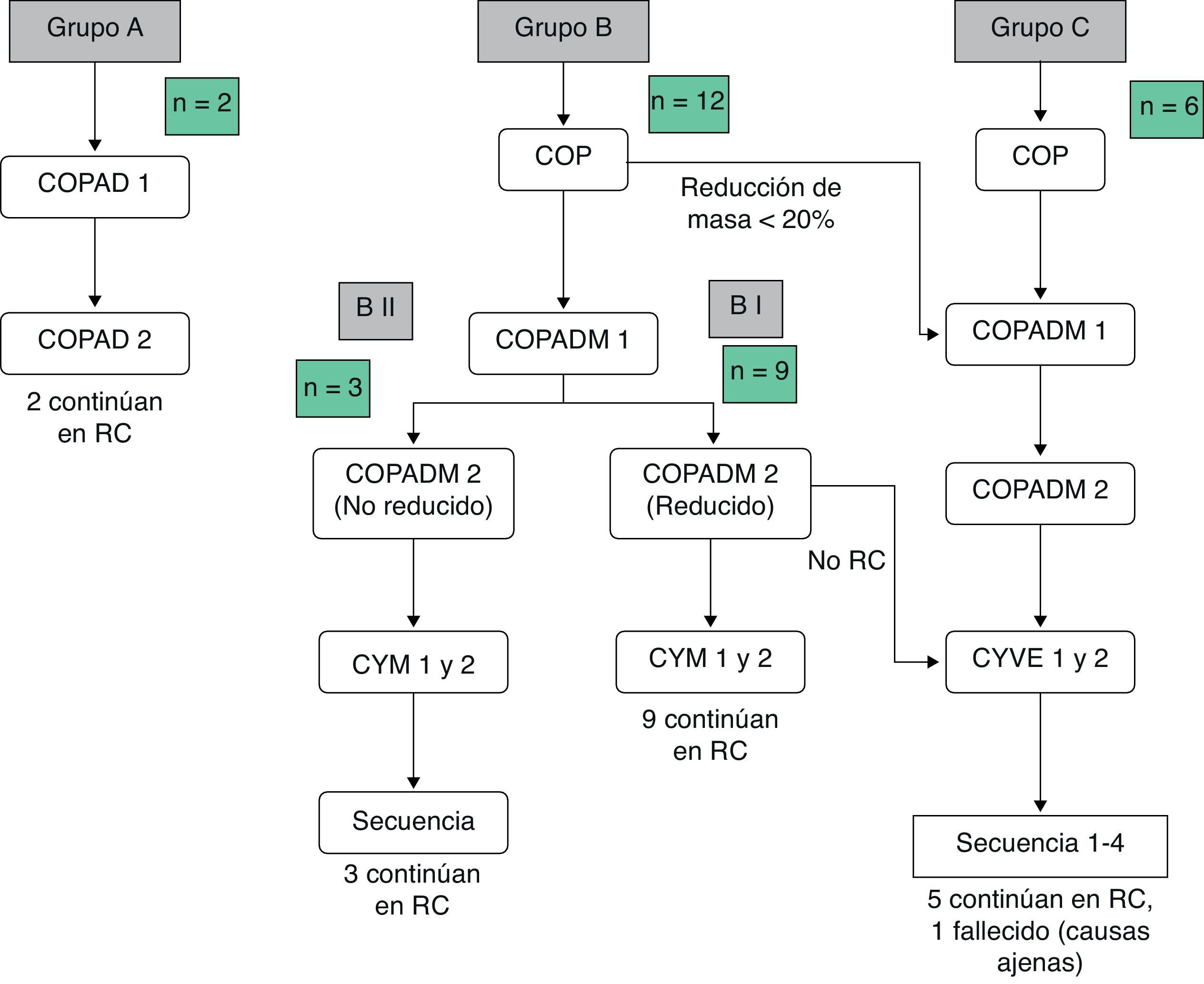
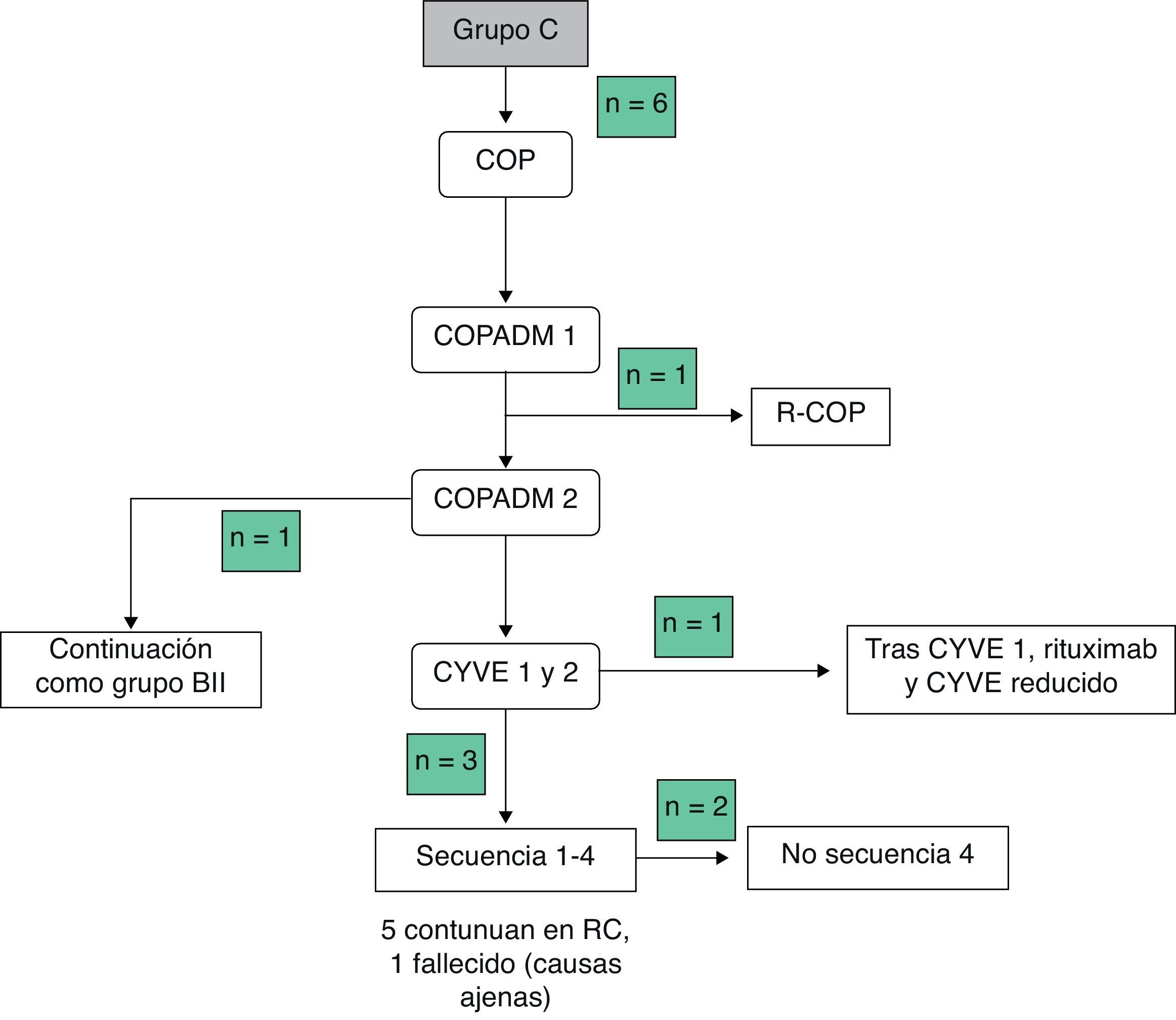
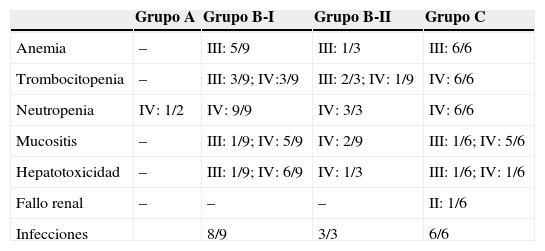
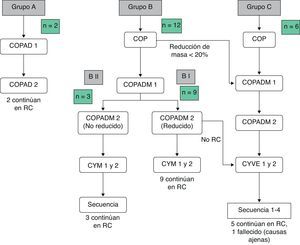
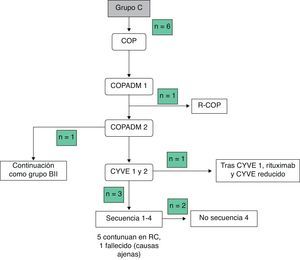
Las toxicidades grado iii/iv y los efectos adversos durante el tratamiento se recogen en la tabla 3Mencionar que 2 pacientes en el grupo BI presentaron complicaciones graves, edema agudo de pulmón y alteraciones de la coagulación, respectivamente. En el grupo BII, un paciente presentó un fallo hepático agudo. Debido a ello, se decidió administrar el segundo COPADM reducido y, posteriormente, seguir el protocolo según el grupo BII de tratamiento. En el grupo C, 5/6 pacientes presentaron toxicidades importantes, entre las que cabe señalar: una enterocolitis intestinal masiva que precisó hemodiafiltración, por lo que en el siguiente ciclo se redujo la intensidad de la quimioterapia asociando rituximab al mismo; una candidiasis invasiva que, junto a otras complicaciones, entre ellas toxicidad neurológica grado iii, justificaron la administración de rituximab tras el primer ciclo de citarabina en perfusión continua de 12 horas, citarabina en altas dosis y etopósido (CYVE) y la suspensión del tratamiento tras el segundo; una infección diseminada por cigomicetos coincidiendo con el COPADM 1, que obligó a continuar el tratamiento según el esquema propuesto para el grupo BII; crisis convulsivas que precisaron tratamiento con levetiracetam; una insuficiencia respiratoria aguda secundaria a una atelectasia masiva del pulmón izquierdo en el contexto de una neumonía; íleo paralítico, síndrome de secreción inadecuada de hormona antidiurética (SIADH) y cardiotoxicidad durante la secuencia 3, motivo por el que no se administró la secuencia 4. En resumen, todos los pacientes del grupo A y BI pudieron completar el tratamiento según el protocolo; en el grupo BII un paciente recibió un COPADM reducido pero posteriormente continuó con el tratamiento según lo planeado (fig. 1). No obstante, en el grupo C, de los 6 pacientes incluidos solo un paciente realizó el protocolo de forma completa (fig. 2).
Frecuencia de efectos adversos durante el tratamiento
| Grupo A | Grupo B-I | Grupo B-II | Grupo C | |
|---|---|---|---|---|
| Anemia | – | III: 5/9 | III: 1/3 | III: 6/6 |
| Trombocitopenia | – | III: 3/9; IV:3/9 | III: 2/3; IV: 1/9 | IV: 6/6 |
| Neutropenia | IV: 1/2 | IV: 9/9 | IV: 3/3 | IV: 6/6 |
| Mucositis | – | III: 1/9; IV: 5/9 | IV: 2/9 | III: 1/6; IV: 5/6 |
| Hepatotoxicidad | – | III: 1/9; IV: 6/9 | IV: 1/3 | III: 1/6; IV: 1/6 |
| Fallo renal | – | – | – | II: 1/6 |
| Infecciones | 8/9 | 3/3 | 6/6 |
Se muestran las toxicidades grado iii/iv y los efectos adversos durante el tratamiento. Las toxicidades y los efectos adversos relacionados con la quimioterapia fueron evaluados y clasificados según los Criterios Comunes de Toxicidad del Instituto Nacional del Cáncer, versión 2.0. Los datos se expresan como n/N.
En los grupos B y C, el 89% (16/18) de los pacientes precisaron soporte transfusional de hematíes y el 60% (11/18) de plaquetas. Se pautó soporte con factores de estimulación de colonias de granulocitos en el 80% del total de pacientes (16/20). Durante el tratamiento 4 pacientes precisaron ingreso en UCIP (3 del grupo C y 1 del grupo BII). El 100% de los pacientes de los grupos B y C presentaron toxicidad infecciosa relevante.
La supervivencia en nuestro grupo fue del 95%. De los 20 pacientes diagnosticados, solo uno falleció por causas no relacionadas con su enfermedad. El tiempo de seguimiento desde el diagnóstico fue de 2,9 años.
DiscusiónEl linfoma es el tercer tumor maligno más frecuente en niños y representa aproximadamente el 15% del cáncer en la infancia4. El 7-10% de los linfomas son LNH, más frecuentes en menores de 10 años de edad. En las 2 últimas décadas se ha incrementado la incidencia del LNH en adolescentes y adultos jóvenes, mientras que ha permanecido constante en menores de 15 años11. Más del 50% de los LNH en niños y adolescentes son LNH de células B maduras12.
Su incidencia es mayor en varones. Las inmunodeficiencias, tanto congénitas como adquiridas (VIH, inmunosupresión secundaria a un trasplante), son el principal factor de riesgo conocido. Igualmente, el virus de Epstein-Barr se ha relacionado con la mayoría de los casos de LNH en inmunodeficientes13-15.
Desde el punto de vista clínico, son tumores agresivos que pueden presentarse como urgencias oncológicas (síndrome de lisis tumoral, síndrome de compresión de vena cava superior o inferior, obstrucción de la vía aérea, obstrucción intestinal, taponamiento cardíaco secundario a derrame pleural) o de una forma más leve, dependiendo de su localización1.
El principal factor pronóstico en los LNH es el estadio tumoral. La estadificación de Murphy del St. Jude Children¿s Research Hospital es la más utilizada (tabla 4)16.
Estadificación de Murphy
| Estadio I | Tumor único ganglionar o extraganglionar, excepto masas torácicas, abdominales o invasión del canal raquídeo |
| Estadio II | Tumores múltiples ganglionares o extraganglionares en un mismo lado del diafragmaTumor abdominal completamente resecado (incluso con ganglios afectados) |
| Estadio III | Tumores a ambos lados del diafragmaTodas las localizaciones intratorácicas (mediastino, pleura, timo), abdominales extensas y epidurales o paraespinales, con/sin afectación ganglionar regional |
| Estadio IV | Afectación del SNC y/o la MO (> 25% de blastos) |
La quimioterapia constituye la piedra angular del tratamiento. Estudios en niños han demostrado que la radioterapia no mejora los resultados en estadios precoces ni como profilaxis de la afectación del sistema nervioso central17,18. Además, una respuesta similar a la radioterapia se obtuvo en pacientes con afectación del SNC tratados con quimioterapia sistémica e intratecal19.
Diferentes regímenes de quimioterapia han demostrado resultados similares, con una supervivencia global superior al 80%. No obstante, la toxicidad asociada al tratamiento entraña una importante morbilidad, de ahí la necesidad de desarrollar nuevas modalidades terapéuticas menos tóxicas. Con rituximab, un anticuerpo monoclonal anti-CD20 utilizado en adultos, se están obteniendo resultados prometedores en pacientes pediátricos12. España está participando en un estudio intergrupo a nivel europeo que tiene como objetivo evaluar la eficacia y la seguridad de rituximab en niños y adolescentes con LNH o leucemia linfoblástica de células B en pacientes de alto riesgo (Inter-B-NHL ritux 2010).
Actualmente, en nuestro país, los LNH de células B maduras (Burkitt, difuso de células grandes y la leucemia madura) se tratan según el protocolo LNH B 04 (LMB 2001). Este protocolo estratifica a los pacientes en 3 grupos de tratamiento (A, B o C) según el estadio y el grado de resección tumoral.
El protocolo actual constituye una modificación del protocolo francés LMB 89 (FAB/LMB 96), consistente en estratificar a los pacientes incluidos en el grupo B en función de la respuesta a la quimioterapia, disminuyendo la intensidad de la misma en los buenos respondedores, manteniendo la misma estrategia o incrementado la intensidad del tratamiento en los malos respondedores o en aquellos que no puedan mantener un tiempo apropiado entre ciclos.
El estudio French American-British Lymphome Malins de Burkitt (FAB/LMB 96) fue el primer estudio, aleatorizado y prospectivo, de carácter internacional19 que analizó la reducción de la intensidad y la duración del tratamiento en niños y adolescentes con linfoma de células B maduras, con el fin de minimizar la toxicidad, tanto aguda como tardía y optimizar la supervivencia20.
En los 3 grupos de tratamiento se observaron toxicidades grado iii-iv, fundamentalmente estomatitis y episodios infecciosos. A pesar de ello, la supervivencia global a los 4 años fue excelente en el grupo A (98,3%)20, algo inferior en el grupo B (95,6%)21 y en el grupo C del 82%19.
En otro estudio se analizó de forma retrospectiva la supervivencia de pacientes pediátricos diagnosticados de linfoma de Burkitt y leucemia madura B y la toxicidad asociada al tratamiento del protocolo LMB 96 en comparación con otros protocolos. La supervivencia global en el grupo LMB fue superior, 86% vs. 68,2%. En cuanto a la toxicidad asociada al tratamiento del grupo LMB, presentaron neutropenia febril el 87% de los pacientes, infección severa el 27% y estomatitis superior a grado ii el 39%10.
La incidencia, comportamiento biológico y la respuesta al tratamiento difieren en la edad pediátrica respecto al adulto. Por su parte, los adolescentes constituyen un grupo independiente, con unas características aún desconocidas, cuyo tratamiento obedece a protocolos pediátricos o adultos según el país de origen y los distintos grupos de estudio. Burkhardt et al. observaron que la supervivencia libre de eventos a los 5 años fue inferior en adolescentes en comparación con los pacientes menores de 15 años tratados ambos grupos según los protocolos Non-Hodgkin Lymphoma-Berlin-Frankfurt-Münster (NHL-BFM) para el LNH en la infancia (79±2% vs. 85±1%) (p=0,014)22.
El grupo de edad comprendido entre los 15 y 21 años se consideraba un factor de peor pronóstico en el LNH de células B maduras. Sin embargo, en el estudio FAB LMB 96 se observó que la edad no se asociaba a un aumento de fracaso del tratamiento, mientras que los niveles de LDH al diagnóstico, la afectación mediastínica y la infiltración de la médula ósea o el sistema nervioso central se identificaron como factores de riesgo independientes23.
En nuestra serie observamos, como en otras publicaciones, un claro aumento de la toxicidad en los estadios avanzados, destacando los procesos infecciosos graves, la mielosupresión severa, las alteraciones hepáticas y la mucositis. Una limitación de nuestro estudio es el reducido tamaño muestral, a pesar del cual ya observamos dificultades para que los pacientes sigan el esquema quimioterápico propuesto en el protocolo, teniendo hasta en un 30% que disminuir su intensidad bien pasando al esquema de tratamiento de un estadio inferior o incluso interrumpiéndolo. A pesar de ello, el pronóstico es excelente observando en nuestra serie una supervivencia muy alta (95%).
Al igual que con el protocolo previo, futuros estudios deberían evaluar la importancia de la toxicidad en pacientes incluidos en este nuevo protocolo y la necesidad de intensificar o reducir el tratamiento quimioterápico según el estadio tumoral. Asimismo, se precisan estudios con un seguimiento a largo plazo donde se observarán las futuras complicaciones. Idealmente dichos estudios deberían ser multicéntricos e internacionales, con el fin de incluir un mayor número de pacientes pediátricos.
En conclusión, el pronóstico de los pacientes pediátricos con LNH de células B maduras es excelente a pesar de una alta toxicidad que se observa, sobre todo en aquellos con estadios avanzados al diagnóstico fruto de la intensidad del tratamiento quimioterápico. Se hace necesario el estudio en un futuro próximo de cómo disminuir la intensidad del tratamiento y, por lo tanto, la toxicidad del mismo sin mermar la supervivencia de estos pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Presentación previa en congresos: VII Congreso de la SEHOP 2014, 22-24 de mayo. Las Palmas de Gran Canaria. España.