Introducción
En los últimos años se ha producido un incremento importante de algunas enfermedades metabólicas en la población infantil de gran repercusión social y económica como la obesidad, que constituye un auténtico brote desde el punto de vista epidemiológico, asociándose a cuadros de intolerancia hidrocarbonada, diabetes mellitus tipo 2 y síndrome metabólico o síndrome de resistencia insulínica, todo ello debido fundamentalmente a cambios en los hábitos de vida1-3. La insulina y el péptido C en ayunas son 2 hormonas básicas que valoran la función de la célula beta pancreática, la situación clínica del paciente y la necesidad de realizar otras pruebas complementarias añadidas que puedan establecer un diagnóstico y terapia adecuada. Las nuevas patologías emergentes como las ya citadas y otros posibles tratamientos en un futuro temprano nos obliga a estandarizar estas variables en nuestra población actual infantil4,5. Lo mismo sucede con los índices Homeostasis Model Assessment (HOMA) y Quantitative Insulin Sensitivity Check Index (QUICKI) que se utilizan en la valoración de las situaciones de insulinorresistencia6,7. Todo ello, dificulta la interpretación de los resultados y la posibilidad de establecer un diagnóstico precoz correcto en los niños con riesgo real.
El objetivo del presente trabajo es por tanto, la estandarización de los valores de insulina y péptido C en ayunas, así como los índices HOMA y QUICKI según la edad, sexo y estadio puberal, para establecer percentiles a partir de los cuales definir a los sujetos con riesgo, lo que permitirá su valoración y seguimiento posterior.
Material y métodos
Población a estudio
Se trata de un estudio descriptivo transversal en el que participan 372 niños sanos de raza caucásica (162 niños y 210 niñas) procedentes de diferentes Centros de Salud del Área Sur de la CAM, elegidos de forma aleatoria, de edades comprendidas entre 1 mes y 18 años y diferente estadio puberal, tras consentimiento informado y aprobación del comité ético. Los criterios de exclusión son índice de masa corporal (IMC) > P75 y < P258, prematuridad o bajo peso para la edad gestacional, presencia de enfermedad o tratamiento agudo o crónico y antecedentes de alteraciones del metabolismo de la glucosa. Se registra el peso (kg) y la talla (cm) mediante aparato Secca, el índice de masa corporal (IMC: peso/talla2). Además se define el estadio puberal según Tanner, considerándose Tanner II la presencia de botón mamario en las niñas y un volumen testicular igual o mayor a 4 ml en los niños9.
De cada sujeto se obtienen 5 ml de sangre de la vena antecubital en ayunas, entre las 8:00-9:00 h de la mañana a lo largo del período de estudio. A continuación las muestras se centrifugan y congelan a 30 °C, para su posterior análisis.
Determinación de insulina, péptido C y glucosa e índices HOMA Y QUICKI
Las determinaciones de insulina y péptido C se realizan mediante inmunoensayo de electroquimioluminiscencia en un autoanalizador Elecsys 2010 (Roche). Ambos métodos se adaptan a los criterios establecidos por la National Committee for Clinical Laboratory Standard (NCCLS) en cuanto a precisión intraanálisis e interanálisis y especificidad, y tienen una sensibilidad de 0,20 μU/ml para insulina y de 0,01 ng/ml para el péptido C. Los rangos de referencia establecidos para el adulto oscilan entre 2,6 y 24,9 μU/ml para la insulina, y 1,1-4,4 ng/ml para el péptido C.
La determinación de glucosa se realiza mediante un método de glucosa oxidasa en un Hitachi 917 (Roche).
El índice HOMA se define como insulinemia (μU/ml) x glucemia (mmol/l)/22,56.
El índice QUICKI se define como 1/(log insulina ayunas [μU/ml] + log glucosa en ayunas [mg/dl])7.
Análisis estadístico
La población estudiada se clasifica en relación a la edad, sexo y estadio puberal en 8 grupos: Tanner I (1-6 meses, 7-18 meses, 19-48 meses, 49-84 meses y 85-160 meses), Tanner II, III, IV-V. En cada grupo se buscan los valores alejados y extremos siguiendo el método de Turkey, y se mantienen o eliminan del análisis siguiendo las recomendaciones de la International Federation of Clinical Chemistry (IFCC)10,11. Para estudiar si los datos siguen la distribución normal se utiliza la prueba de Kolmorogov-Smirnov, así como la prueba de Shapiro-Wilk cuando el número de casos es inferior a 30.
La búsqueda de diferencias estadísticamente significativas entre sexos, en cada grupo de edad, se realiza mediante las pruebas de la t de Student y U de Mann-Whitney, mientras que para analizar los cambios de las variables entre los grupos de edad, se utiliza el análisis de la varianza, la corrección de Bonferroni y la prueba no paramétrica de Kruskall-Wallis. La homogeneidad de varianzas entre grupos se valora mediante la prueba de Levene12. Se calcula el coeficiente de correlación de Pearson entre la insulina en ayunas y el resto de las variables cuantitativas: péptido C, glucosa, IMC, índice HOMA e índice QUICKI. El nivel de significación estadística establecido es p < 0,05. El análisis estadístico de los datos se efectúa mediante el programa SPSS 10.0.
Resultados
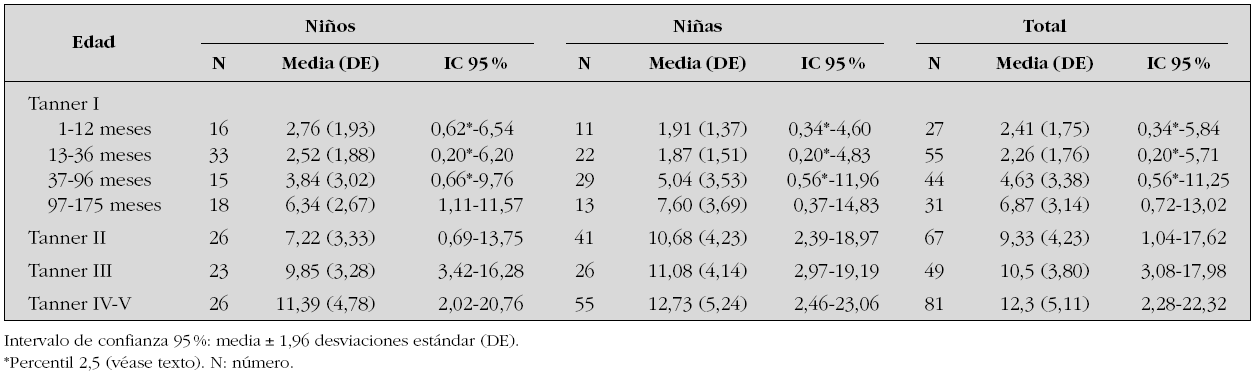
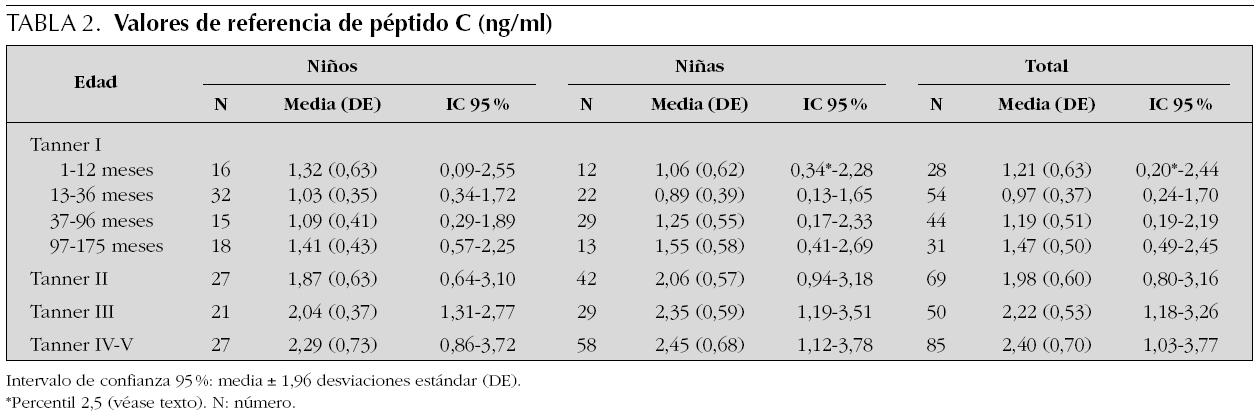
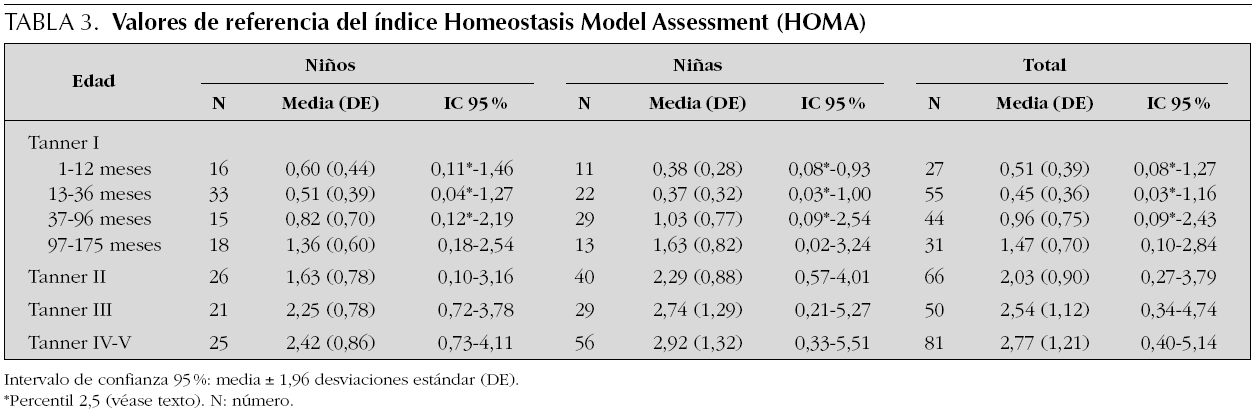
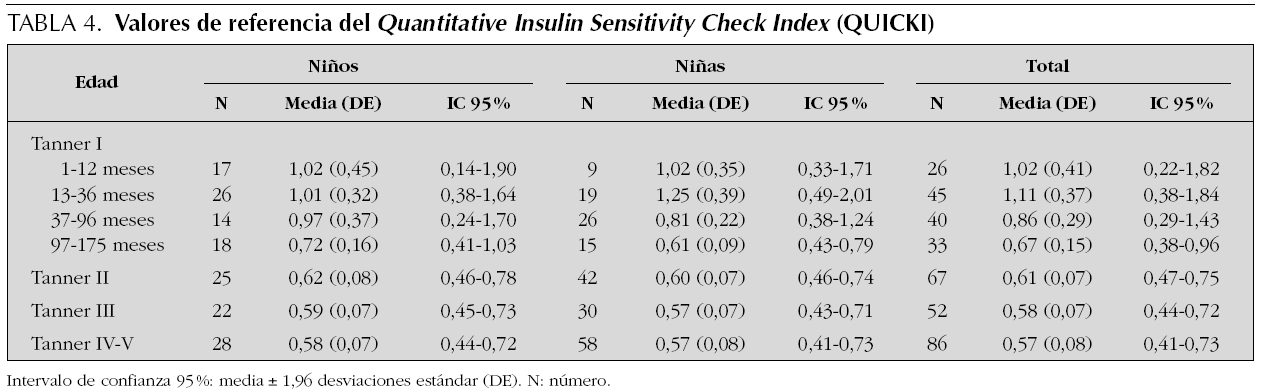
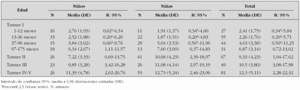
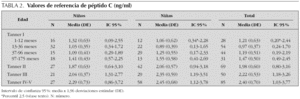
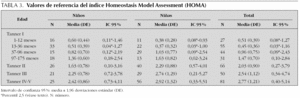
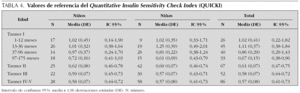
Se estudian 372 pacientes, distribuidos por sexo y estadio puberal según queda reflejado en las tablas 1 a 4 y en las figuras 1 a 3. Los niños en el estadio Tanner I son clasificados según edad cronológica en 4 grupos. Tras eliminar todos los resultados aberrantes se obtienen 372 valores de IMC, 368 de glucosa, 354 valores de insulina, 361 de péptido C, 354 de índice HOMA y 354 de índice QUICKI.
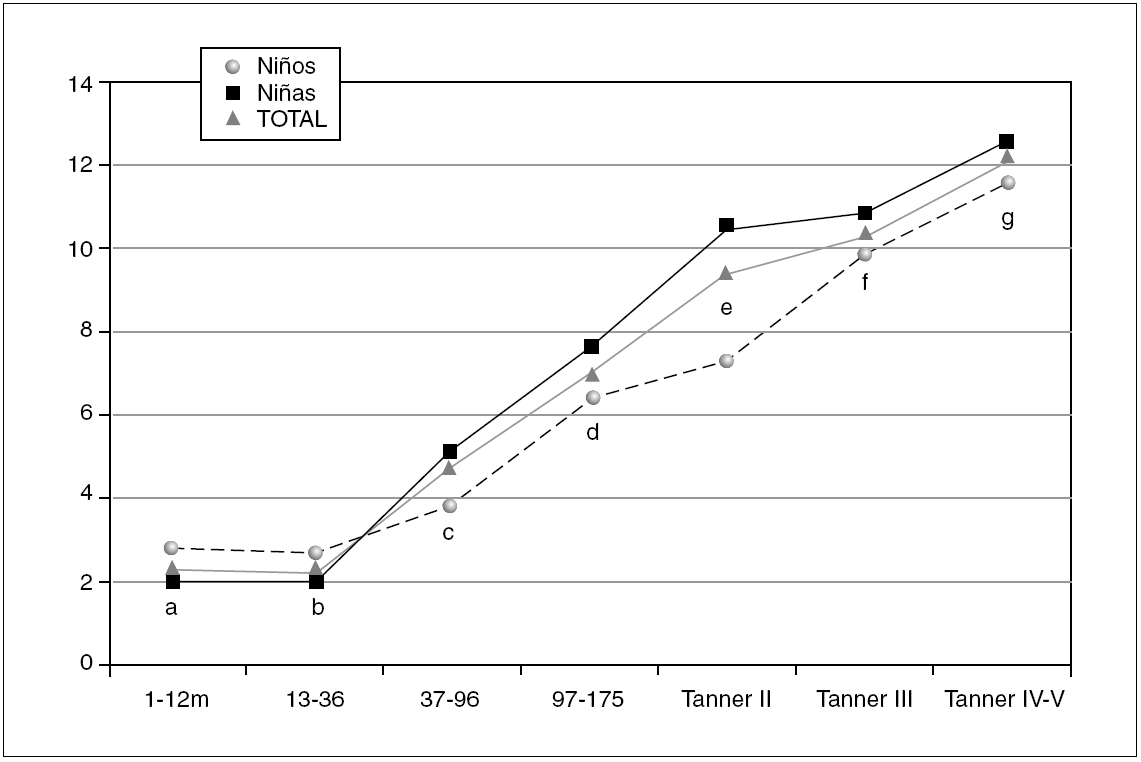
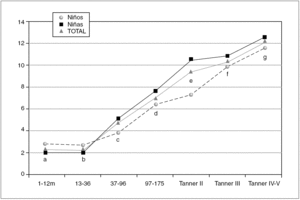
Figura 1. Valores de referencia pediátricos de Insulina (mUI/mL) en suero. X (DE): a: 2,41 (1,75); b: 2,26 (1,76); c: 4,63 (3,38); d: 6,87 (3,14); e: 9,33 (4,23); f: 10,5 (3,80); g: 12,3 (5,11).
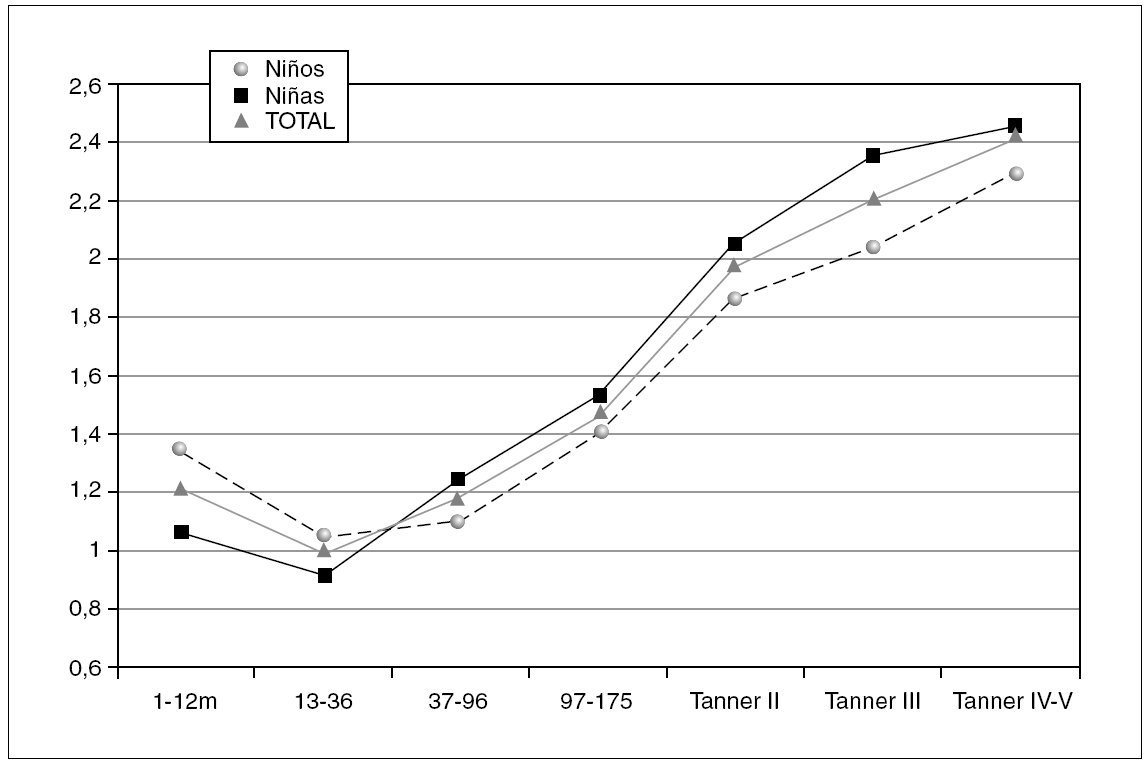
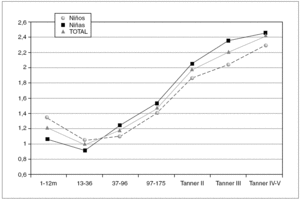
Figura 2. Valores de referencia pediátricos de Péptido C (ng/mL) en suero. X (DE): a: 1,21 (0,63); b: 0,97 (0,37); c: 1,19 (0,51); d: 1,47 (0,50); e: 1,98 (0,60); f: 2,22 (0,53); g: 1,03 (0,70).
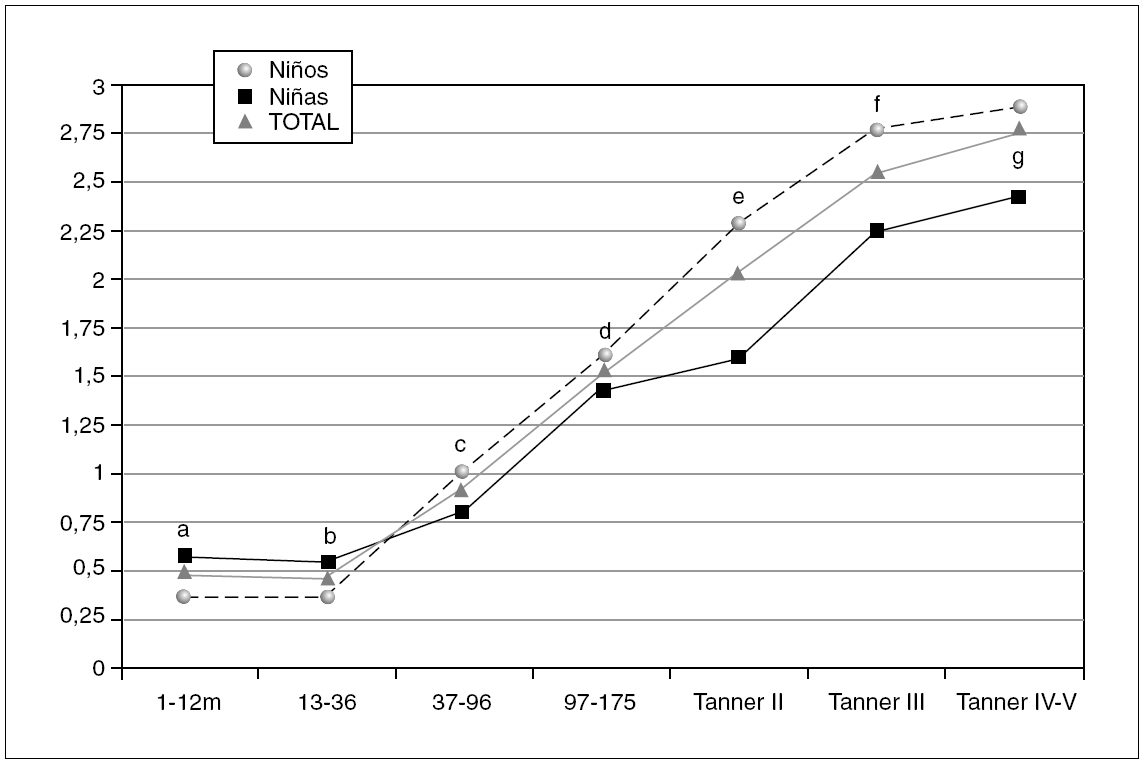
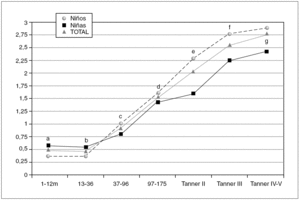
Figura 3. Valores de referencia pediátricos del índice HOMA en suero. X (DE): a: 1,51 (0,39); b: 0,45 (0,36); c: 0,96 (0,75); d: 1,47 (0,70); e: 2,03 (0,90); f: 2,54 (1,12); g: 2,77 (1,21).
Insulina
La tabla 1 refleja los resultados obtenidos para esta variable. Debido a la variabilidad de esta hormona en algunos grupos, el límite inferior del intervalo de referencia se expresa como percentil 2,5.
En los 372 pacientes iniciales los valores oscilan entre 0,20 y 55,80 μU/ml, mientras que una vez eliminados del análisis 18 valores aberrantes (4,8 %) lo hacen entre un mínimo de 0,20 μU/ml y un máximo de 26,55 μU/ml.
Estudiado el grupo en su conjunto se aprecian diferencias estadísticamente significativas entre sexos (p = 0,001), presentando las niñas valores más altos que los niños. Al analizar cada grupo de edad por separado, únicamente se aprecian diferencias estadísticamente significativas entre sexos en el grupo Tanner II (p = 0,001), mostrando las niñas una concentración de insulina superior a los varones.
Tal como se aprecia en la figura 1 la concentración de insulina disminuye entre los grupos de 1-12 meses y el grupo 13-36 meses, aunque no de forma significativa. A partir de ese momento la concentración de insulina muestra una tendencia lineal creciente, estadísticamente significativa (p < 0,001) en ambos sexos. Así mismo existen diferencias estadísticamente significativas entre los estadios prepuberales (Tanner I) y puberales (Tanner II, III y IV) (p < 0,001).
Los valores de insulina se correlacionan positivamente con los valores de péptido C (r = 0,898) e índice HOMA (r = 0,993), y negativamente con los valores del índice QUICKI (r = 0,721).
Péptido C
En la tabla 2 se reflejan los resultados obtenidos para el péptido C en los diferentes grupos, expresándose el percentil 2,5 como límite inferior de referencia en algunos grupos.
En los 372 pacientes de la población inicial los valores de péptido C oscilan entre 0,20 y 9,19 ng/ml, y tras eliminar del análisis 11 valores aberrantes (2,96 %), los valores se encuentran entre 0,20 y 4,28 ng/ml.
Se aprecian diferencias estadísticamente significativas entre sexos (p = 0,001), presentando las niñas valores más altos que los niños cuando se estudia el grupo en su conjunto. Sin embargo, estas diferencias no son significativas cuando se analiza cada grupo de edad por separado.
El perfil del péptido C sigue una evolución similar al de la insulina, observándose una disminución no significativa entre los grupos de 1-12 y de 13-36 meses, existiendo posteriormente una tendencia lineal creciente estadísticamente significativa tanto en niños como en niñas (p < 0,001). Igualmente, se observan diferencias estadísticamente significativas tanto en niñas (p = 0,001) como en niños (p = 0,005) entre los estadios prepuberales y puberales.
Índice HOMA
La tabla 3 refleja los resultados obtenidos para este índice que en algunos grupos se expresa como percentil 2,5, debido a la variabilidad del mismo.
En los 372 pacientes iniciales los valores oscilaban entre 0,03 y 14,30 mientras que tras eliminar los 18 valores aberrantes (4,8 %) los valores oscilan entre 0,03 y 6,08.
En relación con el sexo valorando el grupo en su totalidad, las niñas presentan valores más altos que los niños (p = 0,001). Sin embargo, analizando cada grupo de edad por separado, se aprecian diferencias estadísticamente significativas entre sexos en el grupo Tanner II (p = 0,003), mostrando las niñas un valor de índice HOMA superior a los varones. La diferencias observadas en los grupos Tanner III y IV no son estadísticamente significativas (p = 0,387 y p = 0,09, respectivamente).
El índice HOMA presenta un patrón evolutivo similar al de la insulina y el péptido C, como se observa en la figura 3, con diferencias estadísticamente significativas entre los diferentes grupos a partir de los 13-36 meses (p < 0,001), así como entre los estadios prepuberales y puberales tanto en niñas (p < 0,001) como en niños (p < 0,001). Finalmente el índice HOMA se correlaciona positivamente con la insulina (r = 0,993), el péptido C (r = 0,883) y la glucosa (r = 0,607), y negativamente con el índice QUICKI (r = 0,706).
Índice QUICKI
En la tabla 4 se refleja los resultados obtenidos para esta variable. En los 372 pacientes iniciales los valores oscilan entre 16 y 6,03, mientras que una vez eliminados del análisis 18 valores aberrantes (4,8 %), los valores se encuentran entre 0,40 y 1,96.
Estudiando el grupo en su conjunto se aprecian diferencias estadísticamente significativas entre sexos (p = 002), presentando los niños valores más altos que las niñas. Al analizar cada grupo de edad por separado, se aprecian diferencias estadísticamente significativas entre sexos en los grupos de 13-36 meses (p = 0,03) y 97-175 meses (p = 0,021). Dentro del grupo de 13-36 meses las niñas muestran un valor de índice QUICKI superior a los varones. Por el contrario en el grupo de 97-175 meses se invierte esta situación y los niños presentan valores más altos que las niñas.
El índice QUICKI aumenta entre el grupo de 1-12 meses y el grupo de 13-36 meses. Dicho incremento es estadísticamente significativo en el grupo de las niñas (p = 0,03). A partir de ese momento se produce una tendencia lineal decreciente también estadísticamente significativa para ambos sexos (p < 0,001). Así mismo existen diferencias estadísticamente significativas entre los estadios prepuberales y puberales tanto en niñas (p < 0,001) como en niños (p < 0,001).
Percentiles
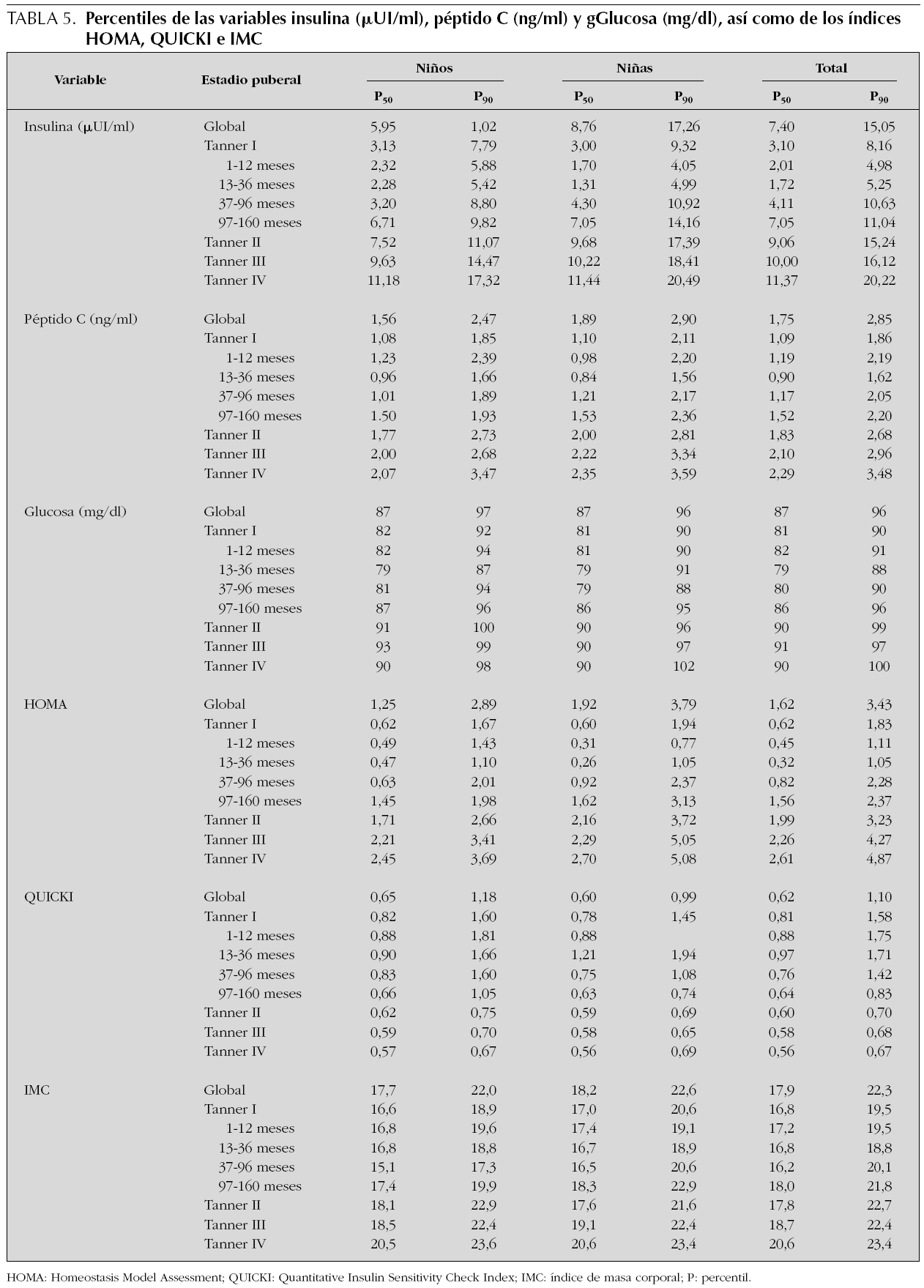
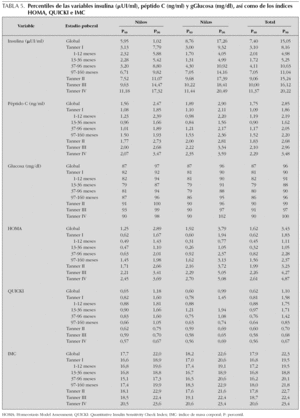
En la tabla 5 quedan reflejados los percentiles P50 y P90 para todas las variables estudiadas. Se han omitido el resto de percentiles para facilitar su manejo clínico.
Discusión
La obesidad infantil constituye un problema creciente de salud pública en todos los países desarrollados, estimándose una prevalencia en la población infantil española del 14 % y en concreto en nuestra área sanitaria del 13,2 %13,14. Se ha demostrado en los últimos años que la obesidad en la infancia se asocia con una alta probabilidad de obesidad en la edad adulta. Esta enfermedad se acompaña de un aumento considerable de otras patologías como la intolerancia a los hidratos de carbono (25 %) y, sobre todo a diabetes mellitus tipo 2 (4 %)2. Si bien en Estados Unidos la experiencia con estas últimas patologías es importante, en nuestro país aún es escasa. En los últimos años se ha demostrado que la obesidad en el adulto se asocia además de diabetes mellitus tipo 2, a dislipemia y a hipertensión arterial (HTA), componentes todos ellos del llamado síndrome de resistencia insulínica o síndrome metabólico descrito por Reaven, que se asocia a un mayor riesgo cardiovascular15. Diferentes estudios han demostrado que enfermedades como la aterosclerosis empiezan a desarrollarse desde la infancia16. Por ello es necesario buscar parámetros que nos ayuden a prevenir estas alteraciones desde edades precoces.
Se conoce como resistencia insulínica una reducción de la respuesta de los tejidos a los efectos de la insulina sobre el metabolismo de la glucosa, que incluye: disminución de la captación de glucosa por el músculo y el tejido graso, disminución de la formación de glucógeno en el hígado y aumento de la producción de glucosa hepática17.
En los últimos años, se han desarrollado diferentes técnicas para valorar la sensibilidad periférica a la insulina, considerándose en el momento actual el clamp euglucémico hiperinsulinémico como el estándar de oro para dicha valoración18. Sin embargo, esta técnica es compleja, cara y no exenta de riesgo, sobre todo en niños, realizándose en el momento actual sólo en estudios de investigación. Otras técnicas más sencillas y prácticas en la clínica diaria como la insulinemia en ayunas, el índice HOMA o QUICKI entre otros, son las más utilizadas6,7.
En el momento actual los estudios de algunos de estos parámetros en la población infantil se han desarrollado en pacientes obesos con o sin resistencia insulínica sin saber cuáles son los valores dentro de la población sana.
El objetivo de nuestro estudio ha sido por tanto, establecer los valores de normalidad de insulina, péptido C, e índices HOMA y QUICKI en nuestra población infantil según el estadio puberal, ya que aunque la mayoría de los autores coinciden en la necesidad de estandarizar los valores de referencia de estos parámetros en función de los estadios de Tanner, hasta el momento actual no existen trabajos completos en este sentido, ni en la literatura médica española ni en la internacional. Por lo tanto, resulta difícil comparar nuestros resultados con los de otros autores, debido fundamentalmente, a las diferencias entre las poblaciones estudiadas así como a los métodos empleados.
La insulinemia en ayunas ha sido hasta ahora el método más empleado en estudios epidemiológicos para valorar la situación de resistencia insulínica, debido a su sencillez y a su buena correlación con el índice HOMA y QUICKI, demostrada en adultos y también en niños y adolescentes con obesidad19,20. Recientemente se ha descrito tanto en el adulto como en el niño que la situación de hiperinsulinismo está presente años antes de que se produzca la alteración en la secreción de insulina. Por ello, la Asociación Americana del Corazón recomienda la determinación de insulina y glucosa en ayunas para valorar el riesgo de resistencia insulínica en niños, y sobre todo en niñas con la menarquia temprana, debido a la tendencia al sobrepeso y al mayor riesgo cardiovascular21,22. Además, diferentes estudios prospectivos establecen una clara correlación entre hiperinsulinemia e índice HOMA elevados, y el riesgo aumentado de hipertensión y de diabetes en el adulto23,24.
En el trabajo de François et al25 se observa en conjunto unos valores de insulinemia en ayunas mayores en las niñas que en los niños, y todos ellos superiores a los de la población adulta, correlacionándose de forma positiva sobre todo con el IMC y la glucemia acorde a nuestros resultados. Sin embargo, no establecen diferencias entre los estadios puberales, donde nuestros datos demuestran diferencias significativas, debido a la situación fisiológica de resistencia insulínica durante la pubertad25,26.
Por otro lado, Allard et al27 en su trabajo se refieren a grupos de niños de edades puntuales y no hacen referencia de nuevo, a los estadios de Tanner. Si bien nuestros valores de glucemias son inferiores a los de dichos autores, los de insulinemia en ayunas son superiores, coincidiendo con los descritos en otras poblaciones caucásicas. Además, nosotros hemos encontrado diferencias en los valores de esta variable en los niños con la misma edad pero diferente estadio puberal, lo que una vez más avala la necesidad de la estandarización teniendo en cuenta el mismo.
Así mismo nuestros valores de insulinemia son más elevados que los presentados por Wennlof et al28, siendo los valores de glucemia semejantes. Ellos encuentran las cifras más altas de insulina en los estadios II-III para los niños y los estadios IV-V en el caso de las niñas. En este sentido, nosotros encontramos un ascenso progresivo de dicha variable con el estadio puberal. Finalmente llama la atención cuando comparamos nuestros valores de insulinemia con los publicamos por Arslanian et al29, que nuestra población de niños prepuberales presenta valores muy inferiores a los de dichos autores, siendo, sin embargo, similares los resultados en el grupo de los niños puberales.
Distintos autores han establecido en el adulto como punto de corte de riesgo cardiovascular el percentil P90, que corresponde a unos niveles de insulinemia en ayunas de 16 μU/ml. En nuestra población el percentil P90 corresponde de forma global a 15,05 μU/ml existiendo diferencia entre sexos y también entre sujetos prepuberales y puberales, y alcanzándose los valores más elevados en las niñas Tanner IV-V (18,76 μU/ml) (tabla 4)24,30.
Por otro lado, existen escasas publicaciones respecto a los valores de normalidad del péptido C en niños. Ratzmann et al31 ya demostraron que los niveles de esta hormona aumentan con la edad y van paralelos a los niveles de glucemia e insulina, por lo que el péptido C proporciona en esta población una información importante sobre la función de la célula beta. Comparando nuestros resultados con los de Heinze et al32 y Carel et al33 las concentraciones de péptido C son superiores a los de dichos autores, si bien ellos no establecen, una vez más, diferencias entre niños prepuberales y puberales32,33.
El índice HOMA propuesto por Matthews et al6 en 1988 es un índice indirecto de resistencia insulínica. Se trata de un método muy sencillo, de bajo coste y poco invasivo, basado en un modelo matemático que relaciona la insulina y la glucemia. Fue validado por Bonora et al34 con el estándar de oro que es el clamp euglucémico hiperinsulinémico, demostrando ser un buen método para medir la sensibilidad periférica en estudios epidemiológicos. Algunos estudios prospectivos en la población adulta demuestran cómo los sujetos con índice HOMA e insulinemia por encima del percentil P90 para su población, evolucionan a alteraciones cardiovasculares24. En este sentido Bonora et al34 demuestra que en sujetos con peso normal los valores del índice HOMA están por debajo de 4, y Haffner et al35 en un estudio prospectivo que los sujetos adultos con índice HOMA por debajo de 4 no desarrollan diabetes. Por otro lado en la población infantil todos los estudios están realizados en niños obesos con o sin insulinorresistencia por lo que resulta difícil la comparación, existiendo escasos estudios en población infantil no obesa y ninguno que considere todos los estadios puberales36,37.
En nuestra población, al igual que los valores de insulina en ayunas, los del índice HOMA aumentan con la edad y el estadio puberal. Allard et al27 obtienen valores del índice HOMA inferiores a los nuestros, siendo Raikkonen et al38 el único autor que presenta resultados similares aunque no incluye algunos estadios puberales. Distintos autores establecen como punto de corte de riesgo cardiovascular para el índice HOMA el P90, que en población adulta es de 3,8. Recientemente Tresaco et al39 refiere como punto de corte valores de 3. Nosotros obtenemos de forma global un índice HOMA de 3,43, existiendo diferencia entre sexos y entre sujetos prepuberales y puberales, encontrándose los valores más altos en las niñas Tanner IV-V4,63 (tabla 4)22-24. Este punto de corte es más elevado que el de 3,16 establecido por Keskin et al36 en niños obesos.
El índice QUICKI descrito en el año 2000 por Katz et al7 parece mostrar una correlación lineal excelente con el estándar de oro con una variabilidad y capacidad discriminativa similar a éste. En nuestro estudio, al contrario que las variables anteriores, este índice disminuye de forma progresiva con la edad y estadio puberal. Hrebicek et al40 presentan unos valores muy inferiores, asumiendo que los niños de ambos sexos que incluyen en su estudio son prepuberales. Cuando estudiamos el P90 de esta variable de forma global obtenemos un resultado de 1,1, mucho más alto que el punto de corte de 0,3 propuesto por Katz et al7 para población adulta.
En conclusión, este trabajo establece los valores de normalidad para insulina, péptido C e índices HOMA y QUICKI en nuestra población de niños sanos que aumentan con la edad y el estadio puberal de forma significativa, a excepción del índice QUICKI que por el contrario disminuye. Además establecemos el percentil P90 de estas variables que nos servirá como punto de referencia para valorar el riesgo cardiovascular en nuestra población. Sin embargo, es necesario considerar algunas limitaciones de nuestro estudio, como el número de sujetos que han participado en alguno de los grupos, y el no haber podido realizar también el clamp euglucémico hiperinsulinémico o una sobrecarga intravenosa de glucosa, si bien tanto la insulinemia como el índice HOMA y QUICKI han sido validados ampliamente con el estándar de oro, demostrando su sensibilidad en la valoración de la insulinorresistencia en estudios epidemiológicos en adultos, y por tanto su asociación a riesgo cardiovascular29,37.
A la luz de los datos obtenidos, se demuestra la necesidad una vez más, de estandarizar los valores de referencia en relación a los estadios de Tanner más que en relación con la edad, en particular durante la adolescencia debido a la situación fisiológica de resistencia insulínica, donde vemos los valores más elevados respecto a los publicados por otros grupos33,34,37,39. Además, llama la atención, cómo los puntos de corte establecidos en niños con obesidad en los trabajos publicados, son inferiores a los valores de normalidad en la población sana que nosotros presentamos, dato importante ya que quizás estemos sobrediagnosticando a los pacientes36,37.
De esta forma establecemos los puntos de corte para determinar aquellos niños que precisen un seguimiento estrecho, con el objeto de poder realizar medidas preventivas para evitar el riesgo cardiovascular en nuestra población infantil.
Queda por ver cuáles son los valores de estos índices en nuestra población obesa y si estos estándares establecidos en nuestra población infantil definirán también a los sujetos con síndrome metabólico en un futuro16.
Agradecimientos
A Laboratorios Roche, por su colaboración en el estudio.
Correspondencia: Dra. B. García Cuartero.
Unidad de Endocrinología Pediátrica.
Servicio de Pediatría. Hospital Severo Ochoa.
Avda. de Orellana, s/n. 28911 Leganés. Madrid. España.
Correo electrónico: bgarciac.hsvo@salud.madrid.org
Recibido en junio de 2006.
Aceptado para su publicación en febrero de 2007.