Describir la epidemiología y evolución clínica, así como los factores anatómicos y neurológicos implicados, en una serie de casos de 34 pacientes con esta afectación.
Pacientes y métodosSe han recopilado 34 pacientes diagnosticados y/o en seguimiento en la sección de neuropediatría del Hospital Infantil Universitario Niño Jesús entre 1995 y 2010. Todos los pacientes tienen una resonancia magnética indicativa de polimicrogiria y la mayoría sigue controles periódicos, por lo que conocemos su evolución.
ResultadosEl 76,5% de los pacientes son varones. La media de edad de inicio de la clínica neurológica es de 10 meses; el motivo del estudio fue por retraso psicomotor (44%) seguido por crisis (38,2%). En su evolución los pacientes presentaron epilepsia (61,7%), parálisis cerebral infantil (47%), retraso psicomotor/mental (94,1%), trastorno generalizado del desarrollo (26,4%), alteraciones conductuales (38,2%), déficits neurosensoriales (35,2%) y microcefalia el 67,6%. En el 82,3% la afectación es bilateral (42,8% perisilviana). El 58,8% asoció otras alteraciones en la resonancia magnética. El electroencefalograma al diagnóstico estaba alterado en el 41,1% y a lo largo de la evolución aumentó hasta el 67,6%. Reciben tratamiento antiepiléptico el 61,7%, precisando ≥ 2 fármacos el 52,3%. Dos pacientes se sometieron a cirugía de la epilepsia. Presentó algún tipo de secuela el 91,1%. La etiología es desconocida en el 61,7%; se sospecha infección congénita en 10 y cuadro sindrómico o polimalformativo en 3.
ConclusionesCon este estudio se pone en evidencia la amplitud de expresión clínica y radiológica posible en la polimicrogiria, además de las posibilidades futuras en cuanto a una aproximación etiológica en esta patología.
The aim of our study is to describe the epidemiology, clinical evolution, and the anatomical and neurological factors involved in polymicrogyria in 34 patients with this disorder.
Subjects and methodsWe have compiled 34 patients diagnosed and/or in follow-up at the Department of Paediatric Neurology of the Hospital Infantil Niño Jesús between 1995 and 2010. All the patients had a magnetic resonance imaging suggestive of polymicrogyria, and most of the patients still have periodic checks, thus their outcome is known.
ResultsThe large majority were male (76.5%). The median age at presentation was 10 months; the reason for the study was psychomotor or mental delay (44%) followed by seizures (38.2%). During the condition patients presented with epilepsy (61.7%), infantile cerebral palsy (47%), psychomotor/mental retardation (94.1%), pervasive developmental disorder (26.4%), behavioural disturbances (38.2%), neurosensory deficit (35.2%) and microcephaly 67.6%. In 82.3% of patients there was bilateral involvement (42.8% perisylvian). Other abnormalities were observed in the MRI of 58.8% of patients. The electroencephalogram at diagnosis showed changes in 41.1%, and this rose to 67.6% during follow-up. 61.7% received antiepileptic treatment was received by 61.7% of patients, with 52.3% requiring ≥2 drugs. Epilepsy surgery was performed on two patients. Some type of sequelae was observed in 91.1% of patients. The aetiology was unknown in 61.7%; a congenital infection was suspected in 10 patients and syndromic or polymalformative disorder in three patients.
ConclusionsThis study shows the range of clinical and radiological expression in polymicrogyria, in addition to the possibilities for the future in terms of determining the aetiology of this pathology.
La polimicrogiria es la más frecuente de las malformaciones del desarrollo cortical debido a la organización cortical anormal. Macroscópicamente aparece como una superficie cortical irregular1, formada por una corteza con múltiples circunvoluciones pequeñas, separadas por muchos surcos poco profundos; microscópicamente, las neuronas alcanzan la corteza pero no forman capas corticales de forma normal2,3.
La etiología de la polimicrogiria está todavía poco aclarada La infección intrauterina por citomegalovirus (CMV) podría ser la base de un porcentaje importante de los mismos; además, en los últimos años, se están descubriendo un gran número de genes que podrían estar implicados en la fisiopatología de este tipo de malformaciones cerebrales4,5.
Con el desarrollo de la resonancia magnética (RM) usando técnicas de visión tridimensional y Flair o inversión-recuperación, se ha podido describir la amplia variedad de las malformaciones del desarrollo cortical, entre ellas la polimicrogiria6.
La afectación cerebral en esta patología puede ser generalizada o focal/multifocal y, a su vez, el cuadro clínico es variable según la localización, aunque de forma característica, y en la gran mayoría de los casos, consta de retraso psicomotor y epilepsia. En los casos de polimicrogiria generalizada, las manifestaciones son graves y se acompañan de microcefalia. La polimicrogiria tiene predilección por la corteza de la región perisilviana, y así hay un gran número de casos descritos en la literatura del denominado síndrome opercular o perisilviano, caracterizado por parálisis seudobulbar. La polimicrogiria puede presentarse con una gran variedad de síntomas a cualquier edad, desde el período neonatal hasta la adolescencia tardía.
En muchas ocasiones, el tipo de epilepsia asociada a la polimicrogiria es resistente a la terapia con fármacos antiepilépticos; este problema junto a otras complicaciones o secuelas que presentan (problemas motores, retraso mental, alteraciones de la conducta) hacen que el manejo de este tipo de pacientes sea difícil.
El objetivo de este estudio es determinar la epidemiología y la evolución clínica, así como los factores anatómicos y neurológicos, de una serie de casos de 34 pacientes con este tipo de alteración de la migración neuronal.
Pacientes y métodosSe han recopilado 34 pacientes diagnosticados y/o en seguimiento de polimicrogiria en el Hospital Infantil Universitario Niño Jesús en los últimos 15 años.
Todos los pacientes tienen al menos una RM 3D con Flair o inversión-recuperación para obtener mejor visualización de la malformación en la que se objetiva polimicrogiria, la cual fue solicitada con el objetivo de investigar la causa de la patología por la que consultaban. El 17% de los pacientes (n=6) aportaba un estudio de imagen desde su provincia de origen o desde otro hospital de la comunidad de Madrid, por ser allí donde se inició el estudio; la mayoría de estos pacientes acudían a nuestro hospital para una segunda opinión o para seguimiento en este centro remitidos desde su hospital de origen; sólo en 3 de estos pacientes se realizó una nueva prueba de imagen en nuestro hospital, y en todos los casos siempre después de pasado al menos un año desde la previa.
En todos los pacientes se solicitó, en algún momento del estudio, mayoritariamente al inicio, una analítica sanguínea completa y un electroencefalograma (EEG) basal.Se describen la epidemiología de los pacientes incluidos, el motivo del inicio del estudio o clínica al inicio, la existencia de diversa clínica neurológica a lo largo de su evolución, los factores anatómicos —como la localización y/o extensión de la malformación cortical—, la existencia de síndrome opercular y la aparición de otros hallazgos asociados en la imagen de RM, el patrón encefalográfico inicial y evolutivo, el tratamiento administrado a los pacientes, el desarrollo de secuelas a medio y largo plazo y, en último lugar, se plantean los pocos casos en los que se tiene una aproximación etiológica del cuadro de polimicrogiria.
ResultadosLa incidencia de diagnóstico de casos de polimicrogiria varía en función de los años analizados. En los años 2003 (5 pacientes), 2006 (5 pacientes) y 2008 (11 pacientes) se concentra hasta un 61,7% de los diagnósticos. En los últimos 5 años aparece el 67,6% del total de diagnósticos.
El 76,5% (n=26) de los pacientes incluidos son varones. La media de edad de inicio de la clínica neurológica por la cual se inicia el estudio es de 10 meses, con un rango de edad entre los pocos días de vida (1 paciente) y los 6 años (2 pacientes). En los primeros 6 meses tuvieron su inicio un 67,5% de los pacientes (n=23) y hasta un 85,3% (n=29) lo tuvieron en el primer año de vida; sólo 3 pacientes comenzaron con clínica neurológica más allá de los 2 años de vida.
La media de edad al diagnóstico es 3 años y 6 meses, y la media de tiempo entre el inicio de la clínica y el diagnóstico de polimicrogiria (retraso diagnóstico) fue de casi 3 años, en ambos casos con un rango de edad bastante amplio.
Los motivos de consulta y por los cuales se inició el estudio de los pacientes constan en la tabla 1.
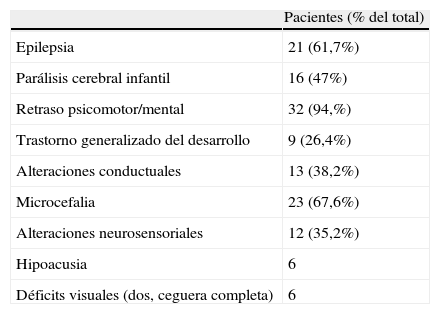
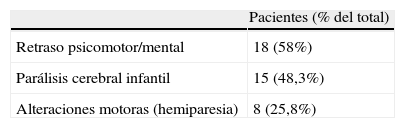
En la tabla 2a se recogen las principales manifestaciones clínicas que presentaron evolutivamente estos pacientes. En la mayoría de estos pacientes aparecen dos o más de estas manifestaciones, como se expone en la tabla 2b.
Manifestaciones clínicas evolutivas
| Pacientes (% del total) | |
| Epilepsia | 21 (61,7%) |
| Parálisis cerebral infantil | 16 (47%) |
| Retraso psicomotor/mental | 32 (94,%) |
| Trastorno generalizado del desarrollo | 9 (26,4%) |
| Alteraciones conductuales | 13 (38,2%) |
| Microcefalia | 23 (67,6%) |
| Alteraciones neurosensoriales | 12 (35,2%) |
| Hipoacusia | 6 |
| Déficits visuales (dos, ceguera completa) | 6 |
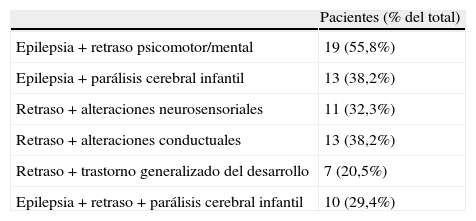
Asociación de manifestaciones clínicas en pacientes con PMG
| Pacientes (% del total) | |
| Epilepsia+retraso psicomotor/mental | 19 (55,8%) |
| Epilepsia+parálisis cerebral infantil | 13 (38,2%) |
| Retraso+alteraciones neurosensoriales | 11 (32,3%) |
| Retraso+alteraciones conductuales | 13 (38,2%) |
| Retraso+trastorno generalizado del desarrollo | 7 (20,5%) |
| Epilepsia+retraso+parálisis cerebral infantil | 10 (29,4%) |
PMG: polimicrogiria.
En los pacientes que presentaron epilepsia en algún momento de su evolución, esta fue mayoritariamente de tipo parcial.
En varios pacientes de nuestra serie no han aparecido crisis epilépticas en ningún momento de su evolución.
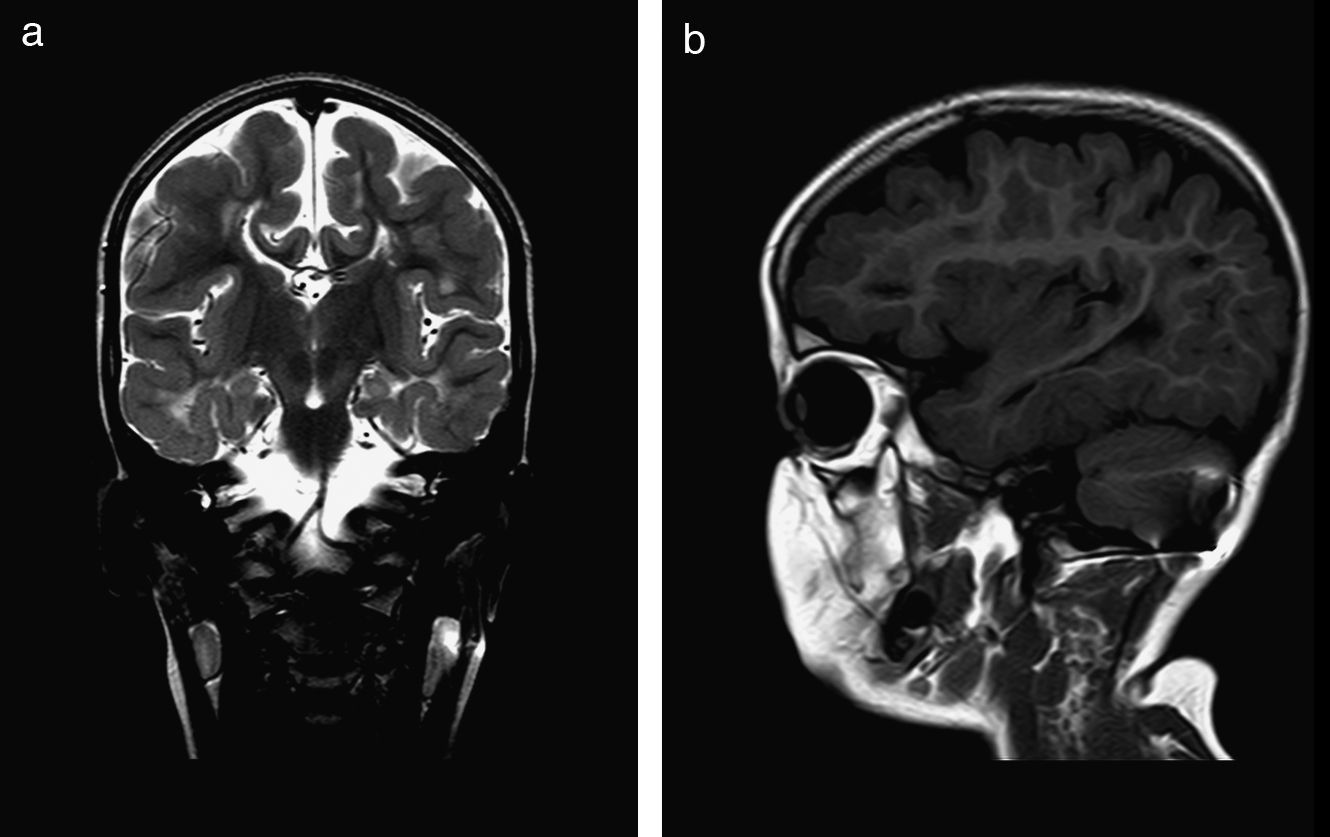
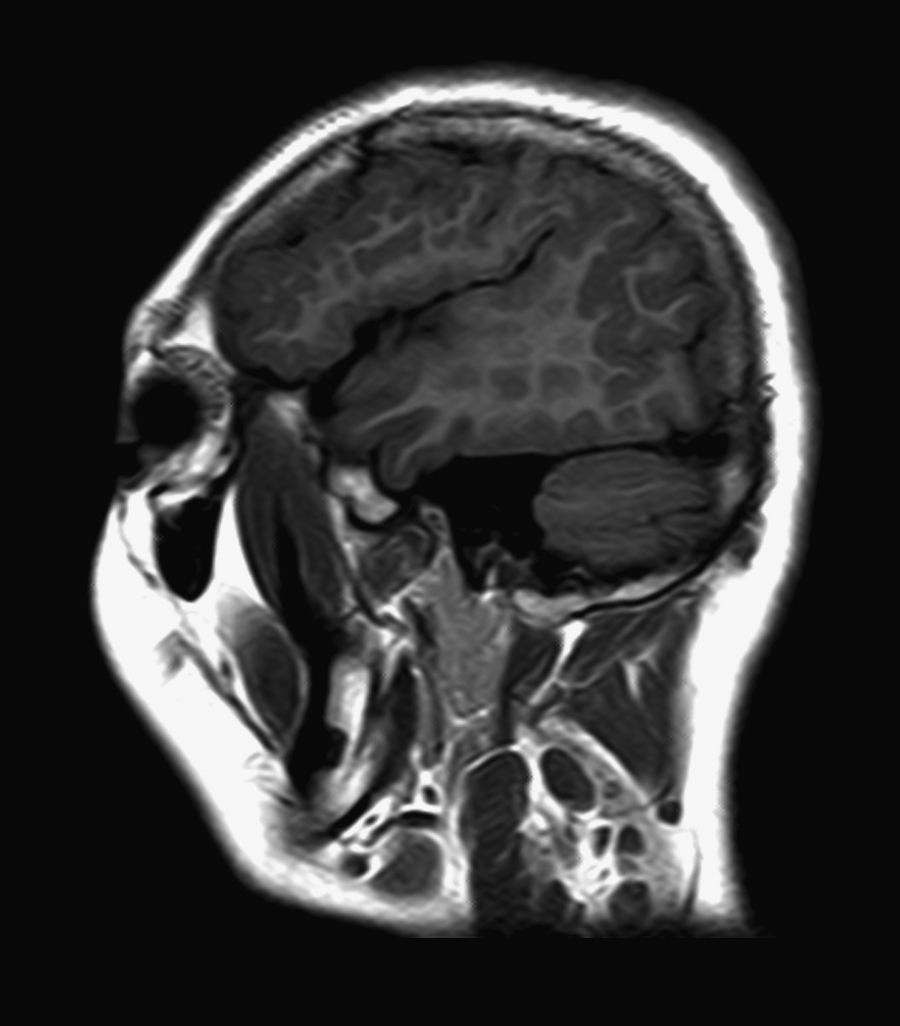
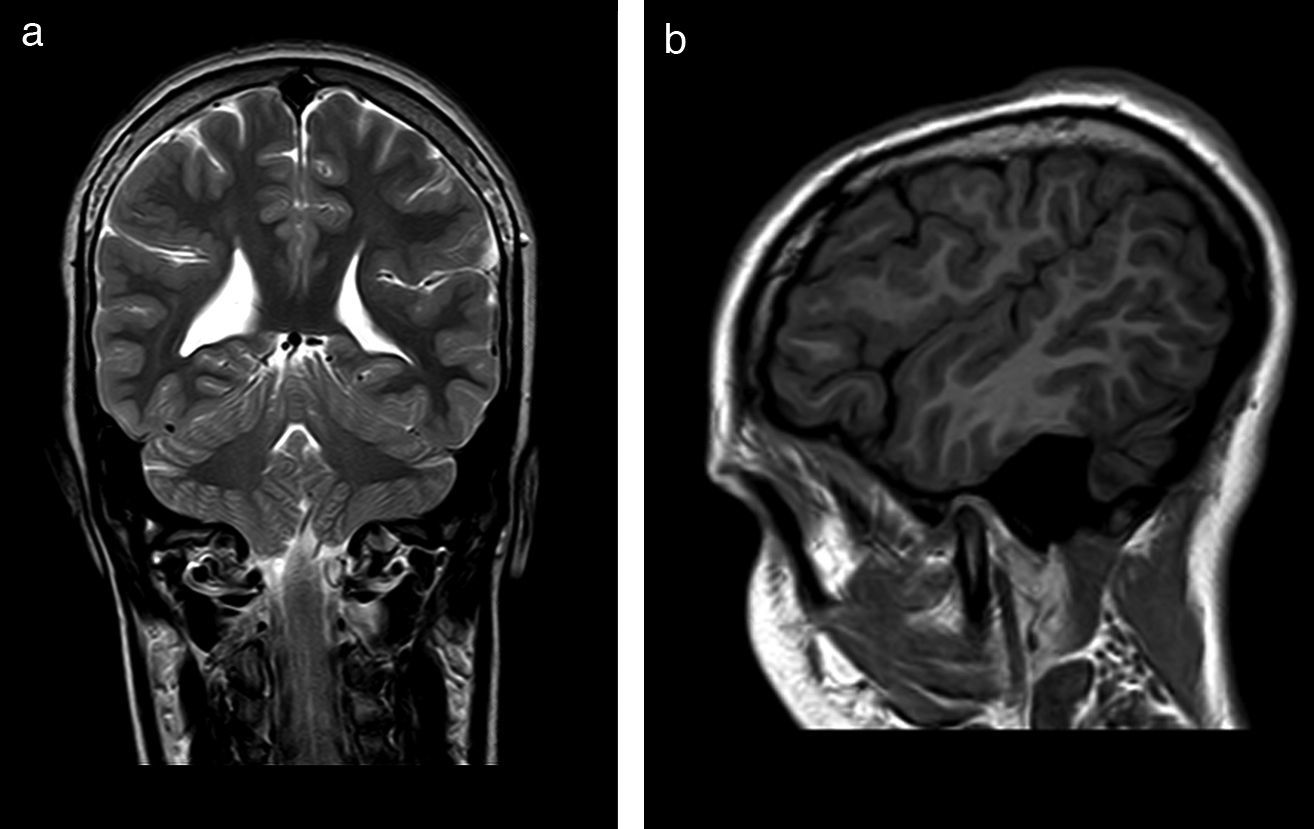
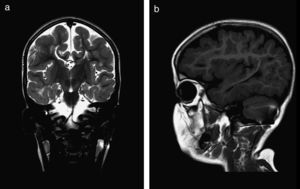
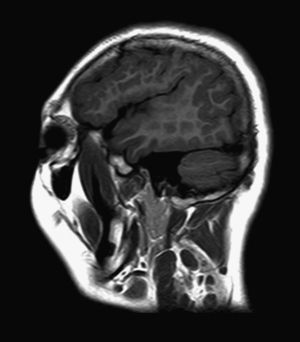
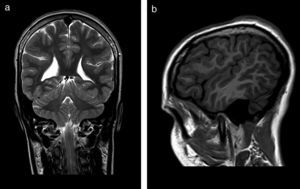
El 82,3% (n=28) de las polimicrogirias en nuestros pacientes asientan de forma bilateral en la corteza cerebral; en 5 de los pacientes anteriores la afectación es difusa o casi universal de todos los lóbulos cerebrales (fig. 1). En el resto, la afectación es unilateral sobre uno (polimicrogirias focales) o varios lóbulos cerebrales (1 caso de polimicrogiria hemigeneralizada fronto-parieto-temporal derecha) (fig. 2). La localización perisilviana bilateral es la más frecuentemente encontrada en un 39,2% de los casos (n=11). Fueron diagnosticados de síndrome opercular el 44% de los pacientes (n=15), la mayoría de ellos con imagen en RM descrita como afectación perisilviana bilateral (fig. 3), excepto 2 casos en los cuales la afectación por RM era focal en región frontotemporal.
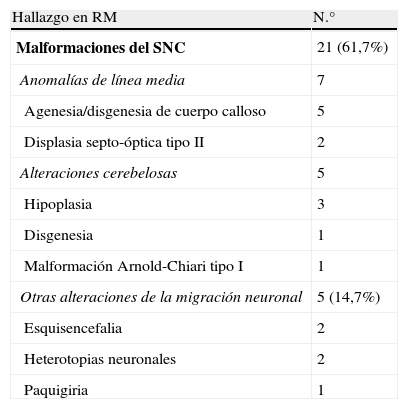
En cuando a otros hallazgos en la imagen de RM, se encontraron asociaciones con otras patologías en un alto porcentaje de casos, como se detalla en la tabla 3.
Hallazgos neurorradiológicos asociados a polimicrogiria
| Hallazgo en RM | N.° |
| Malformaciones del SNC | 21 (61,7%) |
| Anomalías de línea media | 7 |
| Agenesia/disgenesia de cuerpo calloso | 5 |
| Displasia septo-óptica tipo II | 2 |
| Alteraciones cerebelosas | 5 |
| Hipoplasia | 3 |
| Disgenesia | 1 |
| Malformación Arnold-Chiari tipo I | 1 |
| Otras alteraciones de la migración neuronal | 5 (14,7%) |
| Esquisencefalia | 2 |
| Heterotopias neuronales | 2 |
| Paquigiria | 1 |
RM: resonancia magnética; SNC: sistema nervioso central.
El estudio con EEG inicial estaba alterado en el 41% de los casos (n=14) y de forma evolutiva han presentado algún tipo de alteración el 67,6% (n=23). Las descargas en el EEG son más frecuentemente focales en nuestros pacientes.
En todos pacientes que desarrollaron epilepsia se indicó tratamiento con fármacos antiepilépticos. Hasta un 42,8% de los pacientes (n=10) se controlan con monoterapia, siendo el ácido valproico el fármaco más utilizado en el 60% de los casos (n=6). Sin embargo, precisan politerapia para intentar controlar las crisis el 52,3% (n=11) de los pacientes.
Dos pacientes se sometieron a cirugía de la epilepsia, con escaso control de la misma; un paciente se sometió a estimulación magnética transcraneal.
Un 44% de los pacientes (n=15) siguen algún tipo de terapia complementaria (rehabilitación, logopedia, estimulación temprana, etc.).
Un 91,1% de nuestros pacientes (n=31) presentan algún tipo de secuela (obviando la epilepsia) tabla 4.
Además, en algunos pacientes se suman más de una de estas secuelas, como por ejemplo retraso psicomotor/mental y parálisis cerebral infantil en 4 de los pacientes de la serie.
Al hablar de la etiología, no se ha encontrado causa aparente en el 61,7% de los casos (n=21); sin embargo, se sospecha un cuadro sindrómico o polimalformativo en 3 pacientes con hallazgos compatibles (síndrome de Killian, síndrome de macrocefalia-cutis marmorata-telangiectasia congénita y otro paciente con artrogriposis y facies peculiar sin diagnóstico); en otros 10 pacientes la etiología sugerida es una infección congénita (en 9 de los casos por CMV y en el último caso por toxoplasma) por los hallazgos clínicos y de imagen (fig. 1).
DiscusiónEste es un estudio realizado en 34 pacientes diagnosticados de polimicrogiria. Existen otras series de polimicrogiria en la literatura, con un número mayor de pacientes, como la de Leventer et al2, con 328 casos descritos, y otras series con pacientes con algún tipo de malformación del desarrollo cortical, en las cuales la polimicrogiria es una de las principales entidades descritas2,3,7.
La agrupación de un gran número de diagnósticos de polimicrogiria en los últimos 5 años en nuestra serie (67,6% de los casos) podría estar en relación con la mejoría de las técnicas de imagen, ya que algunos de los pacientes diagnosticados en los últimos años tenían pruebas de imagen previas informadas como normales.
En nuestra serie, el diagnóstico en varones ha supuesto el 76,5% del total de los pacientes. La mayor frecuencia de esta malformación en el sexo masculino ya se ha encontrado en otras series de la literatura; este hallazgo epidemiológico puede orientar a que detrás de cierto número de casos de polimicrogiria pudiera existir una herencia ligada al cromosoma X2,3.
Como en la serie de Leventer, la clínica neurológica tiene su inicio de forma habitual durante el primer año de vida2, siendo raro el inicio de los síntomas pasados los 2 años.
Sin embargo, la edad al diagnóstico es bastante mayor que la edad de inicio de la clínica, situándose la media en 3 años y medio, y así obtenemos un retraso diagnóstico con una media aproximada de 36 meses. Esta contrariedad puede explicarse porque existen valores de edad muy extremos: en algunos pacientes se ha llegado al diagnóstico a edades muy precoces (días o primeros meses de vida) o, por el contrario, muy tardías. Están descritos en la literatura varios casos diagnosticados en la adolescencia tardía debido al inicio de crisis a una edad avanzada8,9 y el caso de una mujer diagnosticada a los 72 años a la cual seguían en consultas desde hacía muchos años por disquinesia perioral, pero con debut de crisis tónico-clónicas generalizadas durante el sueño a dicha edad, momento en el cual se le solicitó una RM donde se objetivó polimicrogiria occipital bilateral10.
Los trastornos de la migración neuronal asocian una tríada clínica característica y habitualmente grave: retraso mental, epilepsia y trastornos motores11; en el caso concreto de la polimicrogiria, las manifestaciones clínicas no son específicas y dependen de las áreas de corteza afectadas; por tanto, la expresión y la gravedad son variables, sin poder obviar los casos sin clínica aparente12.
En nuestra serie, la clínica más frecuente al inicio del cuadro fue el retraso psicomotor y/o las crisis, lo que concuerda con los datos publicados hasta el momento2,13. Otras manifestaciones clínicas habituales son alteraciones motoras (tetra o hemiparesia) y alteraciones conductuales. Las alteraciones del perímetro craneal son otro hallazgo habitual en la polimicrogiria, concretamente la microcefalia, que se ha objetivado en el 67,6% de nuestros pacientes. Este hallazgo es más frecuente en casos de afectación cortical generalizada13.El desarrollo de epilepsia a lo largo de la evolución del paciente es bastante probable, un 61,7% de los pacientes de nuestra serie, cifra que está por debajo de las publicadas2. Se cree que las crisis en las alteraciones del desarrollo cortical (ADC) son el resultado, por una parte, de la malposición de las neuronas corticales normales y, por otra, de la presencia de neuronas corticales anormales, siendo un área epileptógena con mayor probabilidad que el tejido cerebral sano1,14.
La localización y la extensión de la polimicrogiria sobre la corteza cerebral, así como el intento de correlacionar el tipo de afectación con las manifestaciones clínicas de los pacientes, son los datos que mayor interés ha suscitado en los últimos años y sobre los cuales mayor número de artículos se han publicado a lo largo del tiempo2,3. La afectación bilateral es más frecuente que la unilateral (82,3% de los casos de nuestra serie), siendo la polimicrogiria perisilviana bilateral la más frecuente en todas las series, incluida la nuestra, suponiendo un 39% de las formas bilaterales2,3. La existencia de polimicrogiria en localización perisilviana con clínica de disfunción oral motora y crisis se conoce como síndrome perisilviano congénito bilateral o síndrome opercular el cual tuvo lugar en la mayoría de los pacientes de nuestra serie con esta afectación1,3,15-20. La polimicrogiria frontoparietal bilateral es poco frecuente y hay pocos casos descritos en literatura; esta cursa con encefalopatía con retraso psicomotor grave y crisis convulsivas3,21,22; en nuestra serie, hay un paciente con esta afectación, difiriendo de los descritos en que no presenta epilepsia. En el caso de la polimicrogiria posterior, lo más destacado son las crisis con mala respuesta al tratamiento y con retraso psicomotor leve-moderado2,3,23, presentándose en 4 pacientes de nuestra serie con las características descritas en la mitad de ellos.
Aunque desde hace casi dos siglos se conoce la existencia de malformaciones constitucionales de la corteza por hallazgos de autopsia, ha sido con el desarrollo de nuevos métodos de imagen, sobre todo la RM con visión tridimensional y Flair o inversión-recuperación, cuando ha podido descubrirse la amplia variedad de entidades y su importancia en el conocimiento de la etiología de muchos casos de epilepsia antes no diagnosticados. El límite entre la corteza polimicrogírica con la sana puede ser brusco6. Además, con las nuevas técnicas de RM también se han visto asociación frecuente de esta entidad con otro tipo de malformaciones; así en nuestra serie hay varios pacientes con malformaciones de la línea media y del cuerpo calloso, 2 pacientes con heterotopias neuronales de la sustancia blanca y otros 2 con esquisencefalia, como se han descrito en la literatura de forma frecuente1,2,24,25.
El registro encefalográfico del paciente va a diferir en función del tipo de polimicrogiria, pudiendo ser normal el registro en algunos pacientes que no presentan crisis, como ocurre en alguno de nuestros pacientes. De forma general, las descargas iniciales suelen ser focales en el EEG, correspondiendo con el área anatómica de la malformación y manifestándose en forma de crisis parciales, con tendencia a la generalización secundaria. De forma ocasional la polimicrogiria se asocia a estatus epiléptico durante el sueño o estatus epiléptico focal26.
Según datos publicados en la literatura, los pacientes con polimicrogiria tienen de forma global menor incidencia de epilepsia que en otras alteraciones del desarrollo cortical7. En todos nuestros casos, cuando aparecieron crisis, se inició tratamiento con fármacos antiepilépticos; hasta un 52,3% de los pacientes precisan politerapia para el control de crisis por ser farmacorresistentes, como aparece descrito en la literatura1,16,19.
Hay pocos datos en la literatura acerca del área epileptógena y su relación con el tejido polimicrogírico27. De hecho, los pacientes con polimicrogiria raramente son candidatos para la cirugía de la epilepsia. El índice de éxito quirúrgico en términos de desaparición de crisis es bajo, ya que además de la epileptogenicidad del tejido malformado, el área epileptógena se extiende más allá de la lesión identificada por imagen; sin embargo, en algunos casos de farmacorresistencia, la callostomía puede llevar a una disminución de las crisis12,28, como ocurrió en uno de nuestros dos pacientes sometidos a cirugía de la epilepsia.
Las terapias complementarias también son importantes para el mejor desarrollo y adaptación de estos pacientes, como por ejemplo la rehabilitación en el caso de los pacientes con algún tipo de déficit motor (hipotonía, hemiparesia), logopedia en los pacientes con retraso mental y/o del lenguaje, estimulación temprana en pacientes con déficits sensoriales y apoyo psicoterapéutico en pacientes en los que las alteraciones conductuales son una de las principales manifestaciones clínicas29. En el caso de los pacientes en nuestra serie, casi la mitad de ellos seguía algún tipo de terapia de este tipo.
En cuanto a las otras manifestaciones clínicas de la polimicrogiria, las alteraciones motoras se observan en un número muy importante de los pacientes con polimicrogiria como una manifestación evolutiva de la alteración congénita; en nuestra serie, la parálisis cerebral infantil (15 pacientes) fue la más frecuente, seguida de la hemiparesia (8 pacientes). La hemiparesia es contralateral al hemisferio afectado en el caso de polimicrogiria hemigeneralizada30. En pacientes con debut en el período de lactante puede haber otras alteraciones sensoriales, como hipoacusia (6 pacientes en esta serie) o alteración visual (6 pacientes, 2 de ellos con ceguera completa)1.
Hay mucha discusión acerca de la etiología y la patogénesis de la polimicrogiria. Hoy día hay múltiples hallazgos que orientan la etiología de las polimicrogirias hacia causas genéticas, por un lado, y causas no genéticas, por otro, entre las cuales destaca la infección congénita por CMV31,32. La duración del daño fetal influye en la severidad de la malformación resultante4,31. En nuestra serie se sospecha esta etiología en 9 pacientes, ya sea por los hallazgos en la RM (calcificaciones periventriculares o intraparenquimatosas córtico-subcorticales) como por el diagnóstico prenatal o de la infección en el paciente32.
La polimicrogiria también se ha descrito, aunque de forma ocasional, formando parte de múltiples síndromes, incluidos alteraciones metabólicas, síndromes de deleción cromosómica, como el 22q11 o DiGeorge33, o síndromes congénitos (Zellweger, Ehlers-Danlos, Sturge-Weber, Joubert)7. En nuestra revisión parece que pudiera haber 3 pacientes pertenecientes a este último grupo.
Con todos los datos expuestos podemos concluir que el espectro clínico de la polimicrogiria es muy extenso, así como el neurorradiológico. Cada vez el diagnóstico de estas malformaciones corticales es más accesible debido al desarrollo de las técnicas de imagen. También parece claro que aún queda mucho por conocer acerca de la etiología de las malformaciones del desarrollo cortical, concretamente de la polimicrogiria, y que probablemente en los próximos años, con el desarrollo de las técnicas genéticas, este va a ser uno de los aspectos más interesantes de esta patología.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.