Debido a los avances en obstetricia y neonatología nos encontramos actualmente con un aumento importante de recién nacidos prematuros y una mayor supervivencia de éstos. Son niños con mayor riesgo de alteraciones en su desarrollo, por lo que es necesario un seguimiento y una actuación precoces, además de una prevención desde el período neonatal.
Material y métodosSe evalúan 116 prematuros de peso menor o igual a 1.000 g que ingresaron en nuestra unidad durante 5 años. Sobrevivieron al período neonatal 75 (64,7 %) y se hizo un seguimiento de su desarrollo durante los primeros 3 años de vida.
ResultadosEn esos 5 años aumentó el 100 % el número de ingresos de recién nacidos de bajo peso extremado y la supervivencia subió el 15 %. La secuela más frecuente fue el retraso ponderal; más de la mitad no seguían una curva normal en sus primeros 2 años de vida (el 58 % el primer año, el 57 % el segundo año y el 40 % el tercer año) aunque tendían progresivamente a la normalidad, salvo aquéllos nacidos con retraso del crecimiento intrauterino, que tuvieron peor pronóstico. En cuanto al desarrollo neurológico, las secuelas motoras fueron las más graves; lo más frecuente fueron mínimas alteraciones en la motricidad que no comprometían la vida normal del niño, pero el 14% presentaba signos de parálisis cerebral el primer año de vida, el 17,4 % el segundo año y el 19 % el tercer año. Aunque el porcentaje de retinopatía de la prematuridad en nuestro grupo fue alto (74 %), las secuelas oftalmológicas fueron escasas (el 3,2 % el primer año, el 3,9 el Segundo año y el 2,4 % el tercer año), así como las auditivas (sordera, 2,0 %). El desarrollo del lenguaje y el psicomotor fue normal en la mayoría de los niños y los que presentaron algún retraso fue leve o moderado.
ConclusionesNos encontramos ante un aumento importante de la incidencia y supervivencia de recién nacidos de bajo peso extremo, con mayor riesgo de presentar secuelas en su desarrollo. La más frecuente es el retraso en la curva ponderal y la más grave, la parálisis cerebral; las alteraciones oftalmológicas y auditivas graves son poco frecuentes y el desarrollo psicomotor y del lenguaje es normal en la mayoría de estos niños.
Obstetrics and Perinatal Care has improved in the last few years. As a result there has been a significant increase in preterm babies and longer survival. The risk of abnormalities in their development is high; they need follow up, prompt action and prevention from the neonatal period.
Material and methodsWe evaluated 116 preterm babies, birth weight less than or equal to 1,000 grams, admitted to our Unit over 5 years. Seventy five neonates survived after the neonatal period (64.7 %). We studied the development during the first three years of life.
ResultsThe number of admissions of extremely low birth weigh infants has increased by 100 % in the last five years and the survival has increased by 15 %. Failure to thrive was the most frequent problem; in the first 2 years of life neonatal growth retardation was present in more than 50 % of cases (58 % 1st year, 57 % 2nd year, 40 % 3rd year). Catch-up growth occurred except in infants who had intrauterine growth retardation. Motor function disorders were the most serious; minor alterations in this system were the most frequent but usually did not compromise the life of the patient. Cerebral palsy was present in 14% in the 1st year of life, 17,4 % 2nd year and 19 % 3rd year. Retinopathy of prematurity was very high in our group (74 %), but ophthalmic sequela were infrequent (3.2 % 1st year, 3.9 % 2nd year, and 3.4 % 3rd year); similarly with hearing function (deafness 2.0 %). Only some mild or moderate language development delay was present and psychomotor development was normal in the majority of cases and those who were retarded improved with time.
ConclusionsNowadays there is a significant increase in the incidence and survival of extremely low birth weigh infants. They have a higher risk of abnormal development. The most frequent problem is failure to thrive and the most serious is cerebral palsy. Major ophthalmic and hearing sequela are rare. Psychomotor and language development is normal in the majority of these patients.
En los últimos años ha existido un aumento importante de recién nacidos prematuros que ingresan en las unidades neonatales con peso y edad gestacional menores de lo normal.
Debido al desarrollo actual de las técnicas de reproducción asistida nos encontramos un mayor número de gestaciones múltiples, partos prematuros y recién nacidos de bajo peso1. En nuestro hospital el 17 % de los recién nacidos menores de 1.000g son fruto de fecundación in vitro (FIV).
Los últimos avances en obstetricia y neonatología en cuanto al cuidado del prematuro hacen que la supervivencia de estos niños sea cada vez mayor2,3. En nuestra unidad, en 1998 sobrevivieron el 58 %, y en 2002, el 73 %.
Esta mayor incidencia y supervivencia de neonatos cada vez más inmaduros preocupa tanto al personal sanitario como a los familiares de los niños, por las posibles secuelas en su desarrollo evolutivo.
Las secuelas más importantes detectadas en estos niños son las alteraciones neurológicas, aunque la mayoría no son graves. En el metaanálisis realizado por Escobar et al4 en 1991, la incidencia media de parálisis cerebral fue del 7,7 % y en los últimos trabajos publicados en niños menores de 1.500g, varía de 6,7 a 13%5–8, diferencia probablemente debida a la falta de unanimidad en cuanto a la definición de esta patología. Esta incidencia aumenta de forma considerable cuando los recién nacidos estudiados son menores de 1.000g o de edad gestacional menor de 25 semanas, con el 6,6-18 %9–14. No obstante, hay quien afirma que el aumento de supervivencia de estos grandes prematuros no incrementa significativamente la incidencia de parálisis cerebral10.
Durante el primer año de vida se detectan alteraciones graves (parálisis cerebral, retraso mental), pero para poder detectar trastornos neurosensoriales leves-moderados es necesario un seguimiento más prolongado. Según estudios recientes, los niños prematuros presentan en la primera infancia un cociente intelectual (CI) significativamente más bajo que los niños a término, problemas de aprendizaje (20–50 %) y desarrollan con más frecuencia dificultades para la lectura, la aritmética, la memoria visual, la motricidad fina y, por tanto, para la escritura y el dibujo, y alteraciones del comportamiento15–17. El “inconveniente” de haber sido prematuro permanece incluso hasta la adolescencia y la juventud. Un estudio de la Universidad de Kansas18 con adolescentes que habían sido prematuros de menos de 801g al nacer refleja un peor estado de salud, mayor necesidad de educación especial y calificaciones académicas más bajas; y otro estudio con jóvenes19 que nacieron con menos de 1.500g demuestra que tienen un CI y resultados académicos más bajos, cursan con menos frecuencia estudios secundarios y presentan más problemas neurosensoriales y de crecimiento.
En cuanto a secuelas oftalmológicas y auditivas, el 4–12 % de prematuros menores de 1.000g presentan alteraciones visuales graves y el 6–7 %, sordera (Lefebvre20, Grupo Victoriano Colaborador de Estudio de la Infancia [VISCG]21, Teplin22, Saigal23 y Grupo de Estudio de Multidosis de Survanta [SMSG]24). Es muy importante detectar algún grado de hipoacusia de forma precoz, antes de la adquisición del lenguaje. El estrabismo y la miopía son frecuentes en prematuros que han padecido retinopatía de la prematuridad (ROP)25; el peso al nacer, la gravedad de la ROP y el grado de miopía a los 3 meses son factores predictores de miopía grave a los 5,5 años26.
Los recién nacidos pretérmino son significativamente más bajos, de menor peso y de perímetro cefálico inferior que los a término y, además, asociado este último factor a deficiencias motoras y cognitivas27. El 89 % presenta retraso del crecimiento a las 36 semanas de edad corregida y el 40 % a los 18–22 meses28. La nutrición adecuada es imprescindible para un crecimiento adecuado28, sobre todo en niños con patología respiratoria por displasia broncopulmonar (DBP)29.
Por todo esto, es necesario un seguimiento temprano e individualizado según los requerimientos de cada niño, hasta al menos la edad escolar. El objetivo del seguimiento es reconocer las secuelas e intervenir de forma precoz y multidisciplinaria, ayudar a la familia y al niño en el proceso de adaptación a la escuela y la sociedad y obtener datos que nos ayuden a la prevención de secuelas ya desde el período neonatal.
Los objetivos de este trabajo son:
- 1.
Hacer un seguimiento de una cohorte de niños definidos por un peso al nacer de no más de 1.000g y que ingresaron en nuestra unidad en 5 años, durante sus primeros 3 años de vida y observar la aparición y grado de secuelas.
- 2.
Buscar la asociación de dichas secuelas con variables recogidas del período perinatal, para poder obtener factores predictores y promover actuaciones que disminuyan el riesgo de dichas secuelas.
Los neonatos evaluados son los prematuros de un peso menor e igual a 1.000g que ingresaron en la Unidad de Cuidados Intensivos Neonatales del Hospital Son Dureta de Palma de Mallorca durante 5 años. Se incluyen los nacidos en hospitales secundarios de las islas Baleares y que se trasladaron a nuestro hospital en las primeras horas de vida. Se excluyen aquéllos fallecidos en el paritorio y que no llegaron a ingresar en la unidad y los afectados de cromosomopatías o patología malformativa mayor.
La forma de seguimiento durante los primeros 3 años de vida de estos niños fue mediante visitas programadas a las consultas de neonatología (curva ponderoestatural, controles analíticos, coordinación multidisciplinaria, etc.) y neuropediatría (test de Denver, pruebas imagen, etc.), generalmente cada 3 meses intercalando ambas consultas; consulta de oftalmología; realización de potenciales auditivos evocados (PEAT); valoración, seguimiento y tratamiento si es preciso por el servicio de fisioterapia-rehabilitación-estimulación precoz (ofertado por el Institut Balear D'afers Socials [IBAS]) y evaluación en otras consultas pediátricas en caso necesario.
La obtención de datos para el estudio se ha realizado de forma retrospectiva mediante la revisión de historias clínicas para obtener variables del período neonatal y del seguimiento posterior en las consultas al primero, segundo y tercer año de vida.
Se realizó un análisis descriptivo de las variables, en el que se exponía las medidas de tendencia central y dispersión (media aritmética y desviación estándar [DE], o mediana, y rango intercuartil [RIC]). Para la comparación de medias entre subgrupos, se utilizó la t de Student oel análisis de Kruskal-Wallis. El test exacto de Fisher se utilizó para comparar proporciones. Usamos el análisis de regresión logística para obtener estimaciones máximo verosímiles de la odds ratio (OR) y sus respectivos intervalos de confianza (IC), para evaluar la asociación de las variables de exposición prenatales y perinatales, mutuamente ajustadas, con las variables dependientes de afectación en el desarrollo: existencia o no de secuelas motoras, oftalmológicas, auditivas y de alteraciones del lenguaje. Se consideró significación estadística un error alfa inferior o igual a 0,05.
El análisis estadístico de los datos ha sido realizado mediante el paquete informático SPSS para Windows.
ResultadosDesde el 1 de enero de 1998 hasta el 31 de diciembre de 2002 (5 años) ingresaron en nuestra unidad neonatal 116 recién nacidos de peso menor o igual a 1.000g (17 en 1998, 17 en 1999, 34 en 2000, 22 en 2001 y 26 en 2002). Ha existido un aumento del 100 % de recién nacidos de peso de hasta 1.000g en los últimos 5 años (de 17 neonatos en 1998 a 34 en 2003).
El 6,8 % de estos ingresos provenían de hospitales secundarios de la provincia y fueron trasladados a nuestra unidad en la primeras horas de vida.
El 52,2 % fueron varones y el 47,8 %, mujeres. La edad gestacional media fue de 27,1 semanas (DE ± 2,29) con un rango entre 23 y 34 semanas y el peso medio fue 807,9g (DE ± 137,91) con un rango entre 420 y 1.000g.
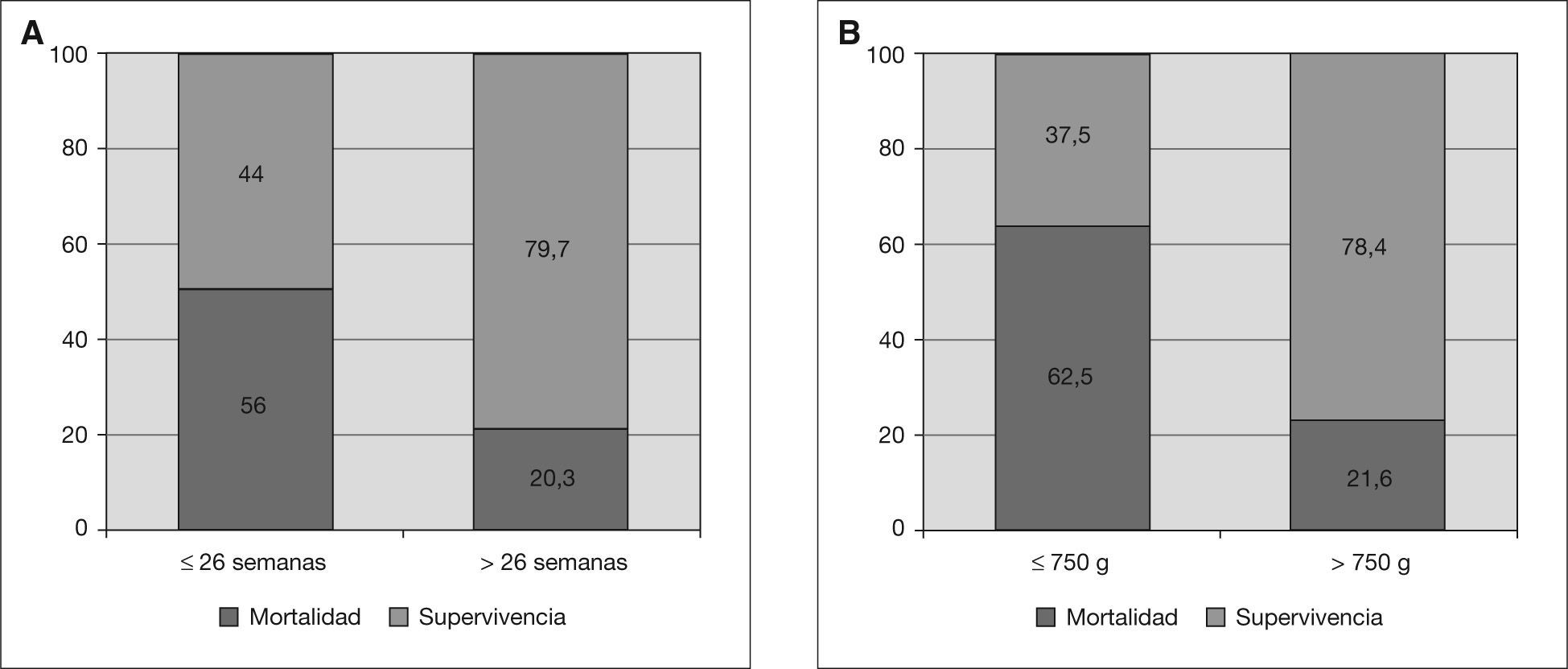
De los 116 niños fallecieron en el período neonatal 41 (35,3 %) distribuidos según edad gestacional y peso al nacimiento según se muestra en la figura 1.
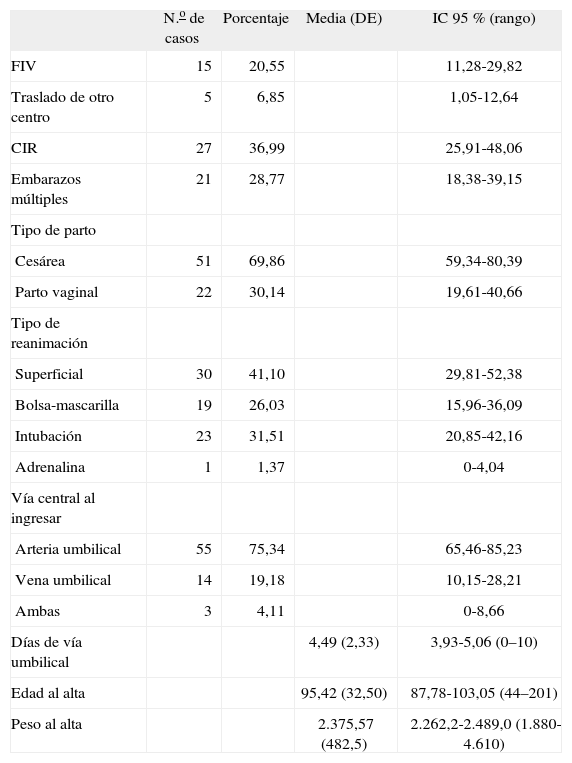
De los 75 supervivientes hemos encontrado datos del período neonatal de 73 recién nacidos. Los resultados obtenidos del período neonatal según patologías se detallan en las tablas 1 a 4.
Datos generales del período neonatal (n = 73)
| N.o de casos | Porcentaje | Media (DE) | IC 95 % (rango) | |
| FIV | 15 | 20,55 | 11,28-29,82 | |
| Traslado de otro centro | 5 | 6,85 | 1,05-12,64 | |
| CIR | 27 | 36,99 | 25,91-48,06 | |
| Embarazos múltiples | 21 | 28,77 | 18,38-39,15 | |
| Tipo de parto | ||||
| Cesárea | 51 | 69,86 | 59,34-80,39 | |
| Parto vaginal | 22 | 30,14 | 19,61-40,66 | |
| Tipo de reanimación | ||||
| Superficial | 30 | 41,10 | 29,81-52,38 | |
| Bolsa-mascarilla | 19 | 26,03 | 15,96-36,09 | |
| Intubación | 23 | 31,51 | 20,85-42,16 | |
| Adrenalina | 1 | 1,37 | 0-4,04 | |
| Vía central al ingresar | ||||
| Arteria umbilical | 55 | 75,34 | 65,46-85,23 | |
| Vena umbilical | 14 | 19,18 | 10,15-28,21 | |
| Ambas | 3 | 4,11 | 0-8,66 | |
| Días de vía umbilical | 4,49 (2,33) | 3,93-5,06 (0–10) | ||
| Edad al alta | 95,42 (32,50) | 87,78-103,05 (44–201) | ||
| Peso al alta | 2.375,57 (482,5) | 2.262,2-2.489,0 (1.880-4.610) |
CIR: crecimiento intrauterino retardado;DE: desviación estándar; FIV: fecundación in vitro; IC intervalo de confianza.
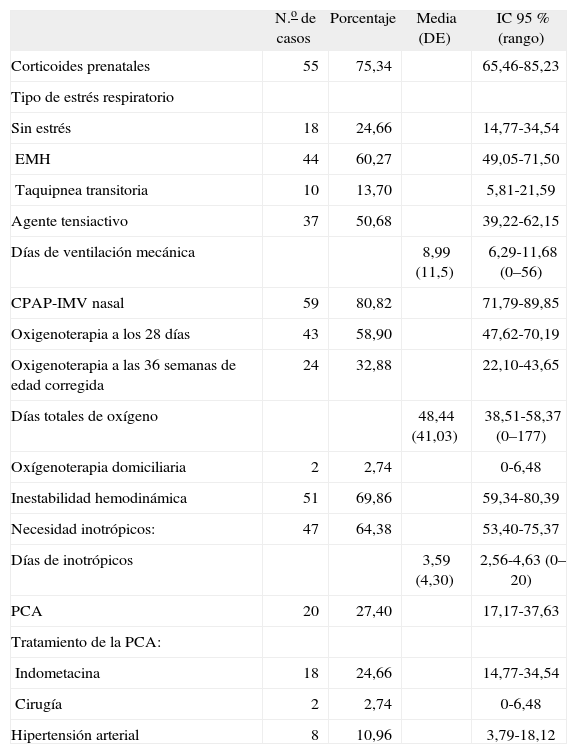
Patología respiratoria y hemodinámica durante el período neonatal (n = 73)
| N.o de casos | Porcentaje | Media (DE) | IC 95 % (rango) | |
| Corticoides prenatales | 55 | 75,34 | 65,46-85,23 | |
| Tipo de estrés respiratorio | ||||
| Sin estrés | 18 | 24,66 | 14,77-34,54 | |
| EMH | 44 | 60,27 | 49,05-71,50 | |
| Taquipnea transitoria | 10 | 13,70 | 5,81-21,59 | |
| Agente tensiactivo | 37 | 50,68 | 39,22-62,15 | |
| Días de ventilación mecánica | 8,99 (11,5) | 6,29-11,68 (0–56) | ||
| CPAP-IMV nasal | 59 | 80,82 | 71,79-89,85 | |
| Oxigenoterapia a los 28 días | 43 | 58,90 | 47,62-70,19 | |
| Oxigenoterapia a las 36 semanas de edad corregida | 24 | 32,88 | 22,10-43,65 | |
| Días totales de oxígeno | 48,44 (41,03) | 38,51-58,37 (0–177) | ||
| Oxígenoterapia domiciliaria | 2 | 2,74 | 0-6,48 | |
| Inestabilidad hemodinámica | 51 | 69,86 | 59,34-80,39 | |
| Necesidad inotrópicos: | 47 | 64,38 | 53,40-75,37 | |
| Días de inotrópicos | 3,59 (4,30) | 2,56-4,63 (0–20) | ||
| PCA | 20 | 27,40 | 17,17-37,63 | |
| Tratamiento de la PCA: | ||||
| Indometacina | 18 | 24,66 | 14,77-34,54 | |
| Cirugía | 2 | 2,74 | 0-6,48 | |
| Hipertensión arterial | 8 | 10,96 | 3,79-18,12 |
CPAP: presión positiva continua en la vía respiratoria; DE: desviación estándar; EMH: enfermedad de la membrana hiaina; IC: intervalo de confianza; IMV: ventilación mandatoria intermitente; PCA: persistencia del conducto arterioso.
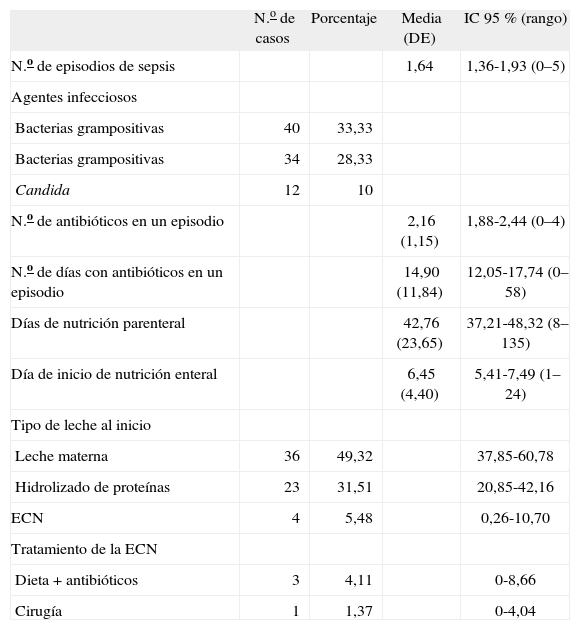
Patología infecciosa y digestiva durante el período neonatal (n = 73)
| N.o de casos | Porcentaje | Media (DE) | IC 95 % (rango) | |
| N.o de episodios de sepsis | 1,64 | 1,36-1,93 (0–5) | ||
| Agentes infecciosos | ||||
| Bacterias grampositivas | 40 | 33,33 | ||
| Bacterias grampositivas | 34 | 28,33 | ||
| Candida | 12 | 10 | ||
| N.o de antibióticos en un episodio | 2,16 (1,15) | 1,88-2,44 (0–4) | ||
| N.o de días con antibióticos en un episodio | 14,90 (11,84) | 12,05-17,74 (0–58) | ||
| Días de nutrición parenteral | 42,76 (23,65) | 37,21-48,32 (8–135) | ||
| Día de inicio de nutrición enteral | 6,45 (4,40) | 5,41-7,49 (1–24) | ||
| Tipo de leche al inicio | ||||
| Leche materna | 36 | 49,32 | 37,85-60,78 | |
| Hidrolizado de proteínas | 23 | 31,51 | 20,85-42,16 | |
| ECN | 4 | 5,48 | 0,26-10,70 | |
| Tratamiento de la ECN | ||||
| Dieta + antibióticos | 3 | 4,11 | 0-8,66 | |
| Cirugía | 1 | 1,37 | 0-4,04 |
DE: desviación estándar; ECN: enterocolitis necrosante; IC: intervalo de confianza.
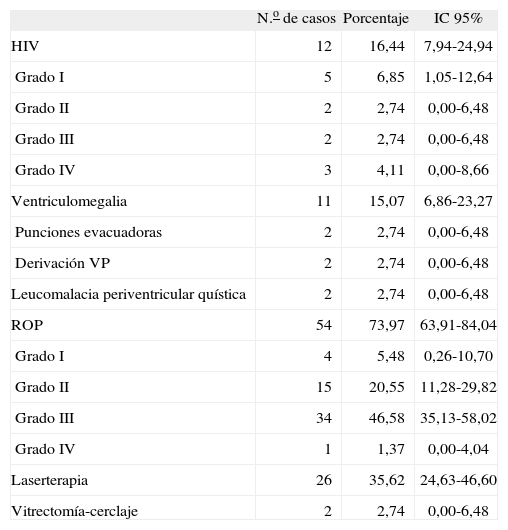
Patología neurológica y oftalmológica durante el período neonatal (n = 73)
| N.o de casos | Porcentaje | IC 95% | |
| HIV | 12 | 16,44 | 7,94-24,94 |
| Grado I | 5 | 6,85 | 1,05-12,64 |
| Grado II | 2 | 2,74 | 0,00-6,48 |
| Grado III | 2 | 2,74 | 0,00-6,48 |
| Grado IV | 3 | 4,11 | 0,00-8,66 |
| Ventriculomegalia | 11 | 15,07 | 6,86-23,27 |
| Punciones evacuadoras | 2 | 2,74 | 0,00-6,48 |
| Derivación VP | 2 | 2,74 | 0,00-6,48 |
| Leucomalacia periventricular quística | 2 | 2,74 | 0,00-6,48 |
| ROP | 54 | 73,97 | 63,91-84,04 |
| Grado I | 4 | 5,48 | 0,26-10,70 |
| Grado II | 15 | 20,55 | 11,28-29,82 |
| Grado III | 34 | 46,58 | 35,13-58,02 |
| Grado IV | 1 | 1,37 | 0,00-4,04 |
| Laserterapia | 26 | 35,62 | 24,63-46,60 |
| Vitrectomía-cerclaje | 2 | 2,74 | 0,00-6,48 |
HIV: hemorragia intraventricular; IC: intervalo de confianza; ROP: retinopatía de la prematuridad; VP: ventrículo peritoneal.
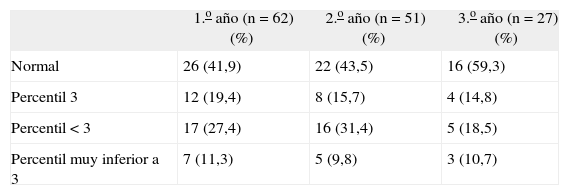
En cuanto al seguimiento, hemos obtenido dartos evolutivos de 62 niños el primer año de vida (85 %); de 52 niños el segundo año de vida (71 %) y de 47 niños el tercero (64 %). Los casos perdidos lo han sido por cambio de residencia o no acudir a la cita de revisión en las distintas consultas.
En la tabla 1 se describen los datos generales durante el período neonatal. En las tablas 2, 3 y 4 se pueden ver las proporciones de niños con patologías respiratoria, hemodinámica, infecciosa, digestiva, neurológica y oftalmológica, también durante el período neonatal. El seguimiento posterior a este período se recoge en las tablas de la 5 a la 8, en las que se cuantifican las secuelas observadas en su desarrollo motor y psicomotor, así como las oftalmológicas y auditivas, el desarrollo ponderal y las secuelas respiratorias.
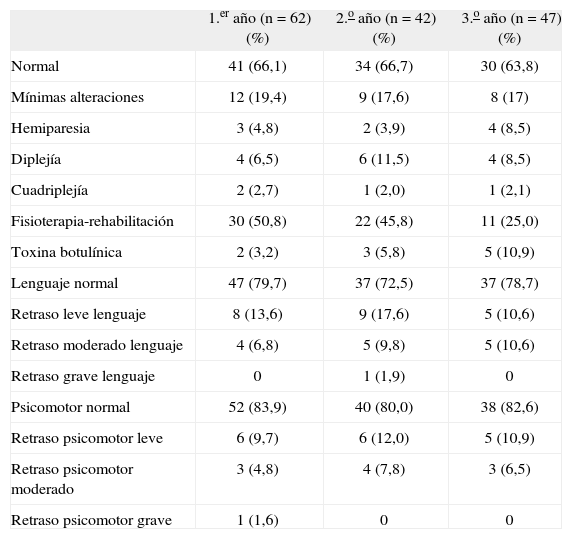
Desarrollo motor, del lenguaje y psicomotor y tratamientos
| 1.er año (n = 62) (%) | 2.o año (n = 42) (%) | 3.o año (n = 47) (%) | |
| Normal | 41 (66,1) | 34 (66,7) | 30 (63,8) |
| Mínimas alteraciones | 12 (19,4) | 9 (17,6) | 8 (17) |
| Hemiparesia | 3 (4,8) | 2 (3,9) | 4 (8,5) |
| Diplejía | 4 (6,5) | 6 (11,5) | 4 (8,5) |
| Cuadriplejía | 2 (2,7) | 1 (2,0) | 1 (2,1) |
| Fisioterapia-rehabilitación | 30 (50,8) | 22 (45,8) | 11 (25,0) |
| Toxina botulínica | 2 (3,2) | 3 (5,8) | 5 (10,9) |
| Lenguaje normal | 47 (79,7) | 37 (72,5) | 37 (78,7) |
| Retraso leve lenguaje | 8 (13,6) | 9 (17,6) | 5 (10,6) |
| Retraso moderado lenguaje | 4 (6,8) | 5 (9,8) | 5 (10,6) |
| Retraso grave lenguaje | 0 | 1 (1,9) | 0 |
| Psicomotor normal | 52 (83,9) | 40 (80,0) | 38 (82,6) |
| Retraso psicomotor leve | 6 (9,7) | 6 (12,0) | 5 (10,9) |
| Retraso psicomotor moderado | 3 (4,8) | 4 (7,8) | 3 (6,5) |
| Retraso psicomotor grave | 1 (1,6) | 0 | 0 |
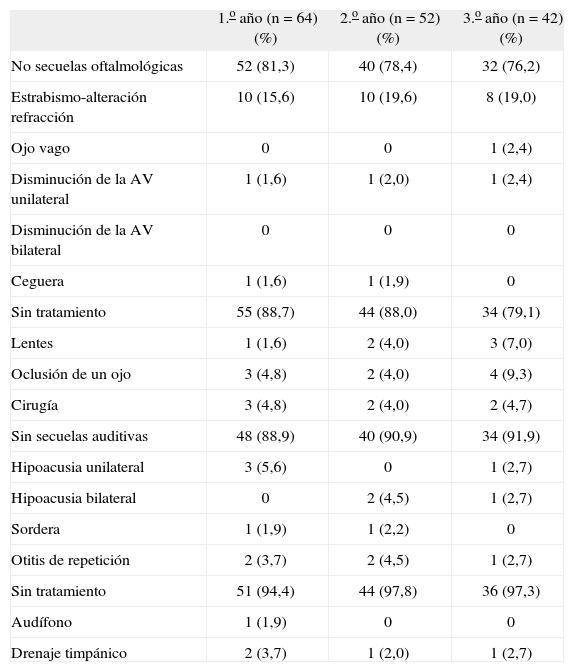
Secuelas oftalmológicas y auditivas y tratamientos
| 1.o año (n = 64) (%) | 2.o año (n = 52) (%) | 3.o año (n = 42) (%) | |
| No secuelas oftalmológicas | 52 (81,3) | 40 (78,4) | 32 (76,2) |
| Estrabismo-alteración refracción | 10 (15,6) | 10 (19,6) | 8 (19,0) |
| Ojo vago | 0 | 0 | 1 (2,4) |
| Disminución de la AV unilateral | 1 (1,6) | 1 (2,0) | 1 (2,4) |
| Disminución de la AV bilateral | 0 | 0 | 0 |
| Ceguera | 1 (1,6) | 1 (1,9) | 0 |
| Sin tratamiento | 55 (88,7) | 44 (88,0) | 34 (79,1) |
| Lentes | 1 (1,6) | 2 (4,0) | 3 (7,0) |
| Oclusión de un ojo | 3 (4,8) | 2 (4,0) | 4 (9,3) |
| Cirugía | 3 (4,8) | 2 (4,0) | 2 (4,7) |
| Sin secuelas auditivas | 48 (88,9) | 40 (90,9) | 34 (91,9) |
| Hipoacusia unilateral | 3 (5,6) | 0 | 1 (2,7) |
| Hipoacusia bilateral | 0 | 2 (4,5) | 1 (2,7) |
| Sordera | 1 (1,9) | 1 (2,2) | 0 |
| Otitis de repetición | 2 (3,7) | 2 (4,5) | 1 (2,7) |
| Sin tratamiento | 51 (94,4) | 44 (97,8) | 36 (97,3) |
| Audífono | 1 (1,9) | 0 | 0 |
| Drenaje timpánico | 2 (3,7) | 1 (2,0) | 1 (2,7) |
AV: agudeza visual.
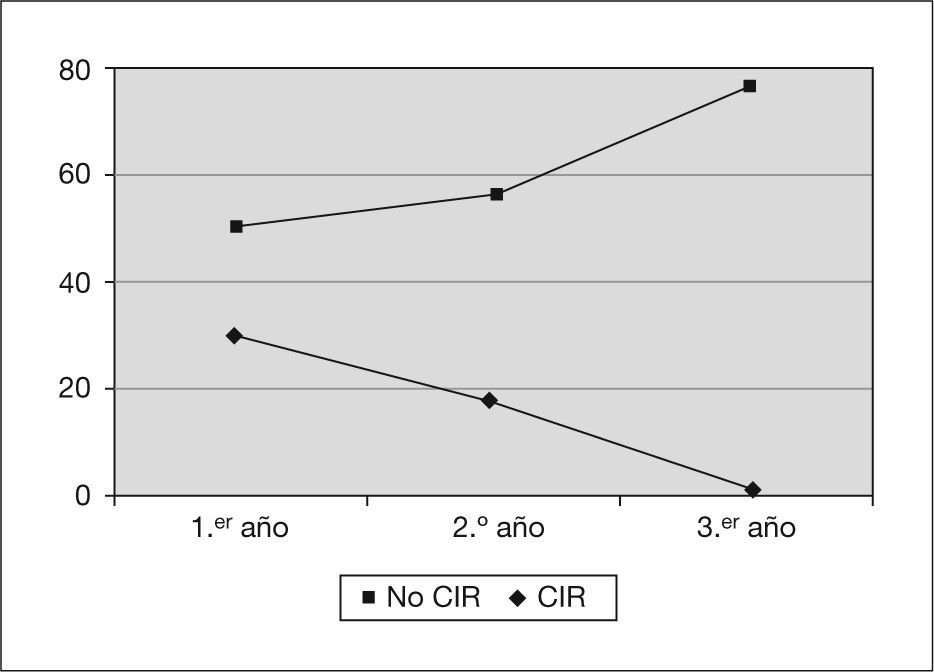
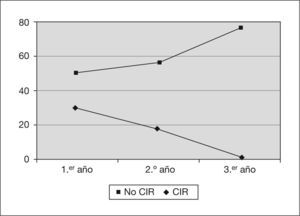
En cuanto al desarrollo ponderal, se observa una evolución diferente entre los niños que nacieron con peso adecuado y los que tuvieron un crecimiento intrauterino retardado (CIR); los primeros tienden a la normalidad con el paso de los años, al contrario que los CIR (fig. 2).
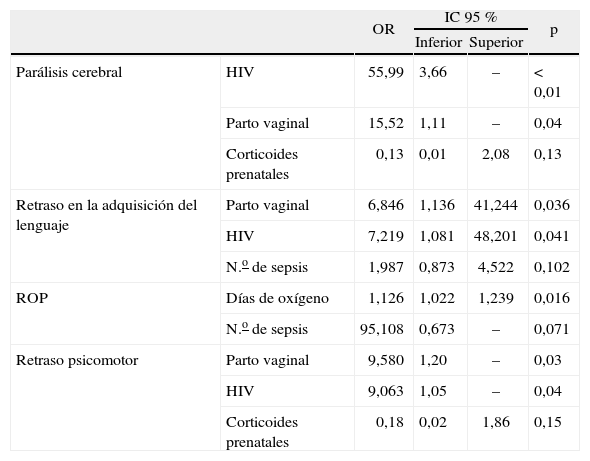
Los resultados del análisis exploratorio multivariante se recogen en la tabla 9, en la que se observa que las variables asociadas a secuelas son principalmente el parto por vía vaginal y la presencia de hemorragia intraven tricular. La variable “parto vaginal” ha de tomarse con cautela, pues podría estar influenciada por factores prenatales (corioamnionitis, preeclampsia materna, etc.) que no han sido recogidos en este estudio.
Análisis multivariante de factores de riesgo
| OR | IC 95 % | p | |||
| Inferior | Superior | ||||
| Parálisis cerebral | HIV | 55,99 | 3,66 | – | < 0,01 |
| Parto vaginal | 15,52 | 1,11 | – | 0,04 | |
| Corticoides prenatales | 0,13 | 0,01 | 2,08 | 0,13 | |
| Retraso en la adquisición del lenguaje | Parto vaginal | 6,846 | 1,136 | 41,244 | 0,036 |
| HIV | 7,219 | 1,081 | 48,201 | 0,041 | |
| N.o de sepsis | 1,987 | 0,873 | 4,522 | 0,102 | |
| ROP | Días de oxígeno | 1,126 | 1,022 | 1,239 | 0,016 |
| N.o de sepsis | 95,108 | 0,673 | – | 0,071 | |
| Retraso psicomotor | Parto vaginal | 9,580 | 1,20 | – | 0,03 |
| HIV | 9,063 | 1,05 | – | 0,04 | |
| Corticoides prenatales | 0,18 | 0,02 | 1,86 | 0,15 | |
HIV: hemorragia intraventricular; IC 95 %: intervalo de confianza del 95 %; OR: odds ratio; ROP: retinopatía de la prematuridad.
En los últimos años ha existido un importante aumento de recién nacidos prematuros y de su supervivencia; en nuestro centro ha aumentado el 100 % el número de ingresos de prematuros de peso menor o igual a 1.000g en los últimos 5 años y la supervivencia ha mejorado en el 15 % en este tiempo (aproximadamente 3 veces más que hace 14 años).
En nuestra unidad, la supervivencia de estos niños de peso menor o igual a 1.000g desde 1998 hasta 2002 (64 %) es equiparable, para este mismo grupo, a algunas estadísticas nacionales (Sociedad Española de Neonatología en 1997–2001: 65 %; Grupo de Estudios Neonatales de la Comunidad Valenciana en 1998–2001: 67,2%30) e internacionales (National Institute of Child Health and Human Development Neonatal Research Network [NICHD] en 1993–2001: 65%91,31; Children's Medical Center of Dallas en 1995–1997: 57 %32; Tomminska en 1999–2000: 44%33; Kaija Mikkola en 1996–1997: 59%13; Victorian Infant Collaborative Study Group [VICSG] en 1997: 73%12).
Durante el período neonatal llama la atención con respecto a otros estudios para recién nacidos que no sobrepasan los 1.000g:
- –
Un mayor número de niños con retraso del crecimiento intrauterino: el 37 % frente al 13,8-18%9,17,28,32, probablemente por ser diferente el percentil o la curva utilizados en cada trabajo para diagnosticar a un recién nacido de CIR.
- –
Existe un alto porcentaje de ROP: el 74 % (todos los grados), aunque si se compara con otros estudios, aquellos que incluyen todos los grados de ROP presentan una incidencia similar, del 70 %9.
- –
- –
Una incidencia menor de hemorragia intraventricular (HIV) grado III-IV: el 6,8 % frente al 7,5-23-3%6,13,14,32–34 y de leucomalacia periventricular quística: el 2,7 % (8,4% incluyendo los detectados durante el primer año) frente al 6,9-8,5%14,32,34. Wadhawan et al34 observaron una frecuencia mayor de HIV III-IV, leucomalacia periventricular y alteraciones en el neurodesarrollo en prematuros nacidos por parto que en los nacidos por cesárea.
- –
Menor frecuencia de enterocolitis necrosante (ECN): el 5,5 % frente al 6–11,9%13,32.
- –
Menos días de ventilación mecánica: 9 días frente a 19–3513,14,35.
Las secuelas más frecuentes observadas durante el seguimiento fueron las del desarrollo ponderal. Más de la mitad no seguían una curva normal al primer y segundo año de vida, con diferente evolución entre los niños que nacieron con peso adecuado y los CIR. Los niños con CIR tienen más frecuentemente problemas de desarrollo ponderal que los nacidos con peso adecuado. Asimismo, algunos autores (Bustos et al36, Figueras et al37, Wocadlo et al38) observaron que los niños con más problemas ponderales son los que tuvieron menor peso al nacer y aquéllos con secuelas respiratorias.
Las secuelas más graves fueron las motoras. El 34 % tenía algún tipo de alteración motora en el primer año de vida; el 33 %, el segundo año, y el 36 %, el tercer año. La mayoría eran mínimas alteraciones en la motricidad que no comprometían la vida normal del niño; y se detectaron signos de parálisis cerebral (hemiparesia, diplejía, cuadriplejía) en el 14 % el primer año y discreto aumento en los años sucesivos (el 15,7 % el segundo año y el 19% el tercero). Resulta difícil la comparación con otros estudios por los distintos criterios seguidos para el diagnóstico y las diferentes edades en el momento de la evaluación. Para recién nacidos de peso inferior o igual a 1.000g existen datos desde el 8–10,7 % (Saigal23, Lefebvre20, VISCG12,21, SMSG24)20; el 14%13 y hasta el 17 % del NICHD en 1993-19949. Resultan, por tanto, comparables nuestros datos con los de otros trabajos, con un aumento del porcentaje al tercer año de vida, debido a un tamaño sesgado probablemente por una disminución del tamaño de la muestra a esta edad, como ya se comentó previamente.
La mayoría de los niños con alteraciones motoras se detectaron desde los primeros meses de vida7 y aquéllos con secuelas más graves habían presentado imágenes de leucomalacia o HIV en las ecografías del período neonatal. En nuestra serie, de los 8 niños con alteraciones más graves (diplejía, cuadriplejía) 3 tenían leucomalacia periventricular quística, 3 HIV y 3 signos de atrofia cerebral en las prueba de imagen realizadas en el período neonatal y primeros meses de vida. Algunos autores afirman que una ecografía y una exploración neurológica normal en el período neonatal aumentan la posibilidad de normalidad al año de vida hasta el 98%39.
Encontramos una relación significativa entre parálisis cerebral y antecedente de HIV y parto vaginal, así como una clara asociación, con efecto protector, con la administración de corticoides prenatales. Otros autores encontraron también asociación de secuelas neurológicas con la administración de agente tensiactivo, ECN, displasia broncopulmonar, ventilación mecánica, ductus arterioso persistente (DAP), hiperbilirrubinemia, sepsis y nacimiento fuera de centros de atención perinatal6,9,40–43.
En cuanto a la adquisición del lenguaje y desarrollo psicomotor, la mayoría de los niños siguieron un desarrollo normal y los retrasos suelen ser leves o moderados, casi nunca graves. El antecedente del HIV en el período neonatal y el parto vaginal se asocian de forma significativa con retraso en el lenguaje y en el desarrollo psicomotor. Cada episodio de sepsis supone dos veces más riesgo de sufrir retraso del lenguaje, y la administración de corticoides prenatales parece ejercer un efecto protector del desarrollo psicomotor. De todos modos, el retraso psicomotor está claramente influido por el padecimiento de secuelas motoras graves.
Algunos autores afirman que el desarrollo neurológico al año de vida es un predictor de secuelas en la edad escolar44.
En los últimos años ha existido un aumento de secuelas oftalmológicas debido al incremento de ROP y del nacimiento de prematuros de menor peso (< 750g) con mayor riesgo de ROP15,45. Los días de oxígeno y el número de sepsis en el período neonatal se asocian con el desarrollo de ROP.
En nuestros niños, a pesar de existir un alto porcentaje de ROP, las secuelas oftalmológicas (disminución de la agudeza visual unilateral o bilateral, ceguera) son escasas (el 3,2 % el primer año, el 3,9 % el segundo año, y el 2,4 % el tercero) comparadas con otras series (Lefebvre20, el 11 %; VISCG12, el 11 %; Teplin22, el 12 %; Saigal23, el 7 %; SMSG24, el 4 %; NICHD9, el 3 %). Esta menor incidencia puede ser debida a un estrecho control y tratamiento. Sin embargo, son frecuentes los casos de estrabismo y alteraciones de refracción que precisan corrección con lentes y/o oclusión de un ojo. De los 14 niños con estrabismo y alteraciones de refracción, todos salvo uno, tenían antecedente de ROP, y el grado más frecuente era el III. Son predictores de miopía grave en prematuros el peso al nacer, la gravedad de la ROP y el grado de miopía a los 3 meses26, por lo que es muy importante un seguimiento oftalmológico secuencial y precoz.
En los controles auditivos realizados (PEAT) en el primer año de vida se detectó un déficit unilateral en el 5,6 % y sordera en el 1,9 %, porcentaje algo menor al de otras series, que dan el 6-11 % (Lefebvre20, VISCG12, Teplin22, Sargal23, NICHD9). Precisan audífono el 1,9 %, porcentaje menor que lo referido en otros estudios9. La detección y abordaje precoz de los problemas auditivos es crucial para una adquisición normal del lenguaje.
Por último, en cuanto a secuelas respiratorias, estos niños son controlados en su mayoría en la consulta de neumología infantil, y precisan tratamientos con broncodilatadores y corticoides inhalados; algunos tuvieron que ingresar en varias ocasiones por su patología respiratoria. Fueron 3 los niños que precisaron al alta de la unidad neonatal monitor domiciliario (4,8 %), que pudo retirarse entre los 12 y 14 meses y un niño precisó oxigeno domiciliario (1,6 %), que también pudo suspenderse al año de vida.
Es importante el seguimiento multidisciplinario de los niños extremadamente prematuros, no sólo durante los primeros 3 años, sino de forma prolongada hasta la edad escolar e incluso la adolescencia, tarea pendiente en nuestra unidad y susceptible de próximos estudios.
Existen limitaciones en este trabajo; el tamaño pequeño de la muestra al 2.o y 3.o año, lo que nos hace interpretar con cautela los análisis estadísticos obtenidos y la subjetividad de algunos datos obtenidos en las historias que resultan difícilmente comparables con otras series.