La persistencia de un conducto arterioso (PCA) hemodinámicamente significativo es una complicación frecuente en el recién nacido prematuro1,2. En los últimos años su tratamiento se ha convertido en un importante foco de controversia3–5; de hecho, la indicación de cierre quirúrgico tras fracaso del tratamiento médico es en la actualidad una de las decisiones clínicas más controvertidas en el manejo del recién nacido prematuro. Los neonatólogos con frecuencia echamos de menos datos objetivos a la hora de tomar decisiones terapéuticas en la práctica clínica. Debido a que la PCA puede comprometer la perfusión cerebral, es un factor de riesgo para el desarrollo de hemorragia intraventricular/periventricular, así como daño de la sustancia blanca6,7. Los recién nacidos con PCA pueden presentar el denominado «robo ductal» que provoca una disminución del flujo sanguíneo cerebral con compromiso de la oxigenación cerebral (rSO2), así como un incremento en la extracción de oxígeno6. Por ello, la monitorización de la oximetría cerebral mediante espectroscopia cercana al infrarrojo (NIRS) podría ser útil en la evaluación de la repercusión cerebral y, por consiguiente, en la toma de decisiones terapéuticas.
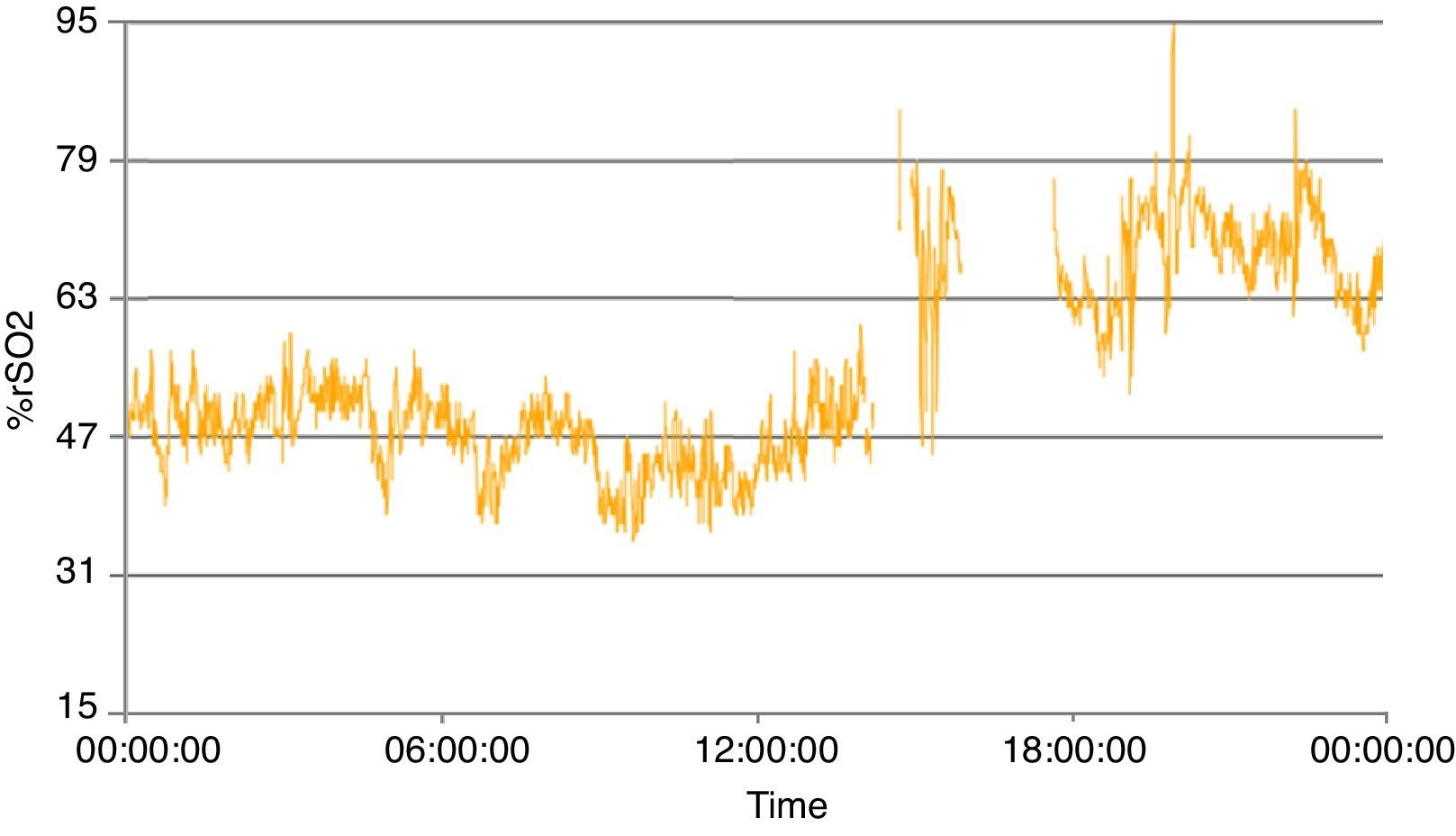
Presentamos el caso de una recién nacida prematura de 25+4 semanas de gestación y peso al nacimiento de 760g, que desarrolló PCA hemodinámicamente significativo y en la que se monitorizó la oximetría cerebral mediante NIRS. Nace tras parto eutócico y corioamnionitis materna. Precisa soporte respiratorio invasivo y administración de una dosis de surfactante. A los 3 días de vida es diagnosticada de PCA hemodinámicamente significativo recibiendo 2 tandas de ibuprofeno tras las cuales se objetivó ausencia de cierre ductal. Se monitoriza oximetría cerebral desde el primer ciclo de ibuprofeno. A pesar de la repercusión constatada en el estudio ecocardiográfico inicial no se apreciaron alteraciones a nivel de la oxigenación cerebral; incluso tras el segundo ciclo de ibuprofeno únicamente se observó un moderado descenso de la rSO2 media (71%; rango: 58-87%), en cualquier caso dentro del rango de normalidad. A las 2 semanas de vida presenta insuficiencia respiratoria hipoxémica observándose en la ecocardiografía shunt derecha-izquierda a través del ductus sugestivo de hipertensión pulmonar. Recibe tratamiento con óxido nítrico inhalado durante 24h con respuesta favorable. A pesar del empeoramiento en la oxigenación sistémica, la rSO2 media no sufre modificaciones significativas (68%; rango: 52-85%). Tras superar cuadro de hipertensión pulmonar se observa en los días siguientes a pesar de mayor estabilidad respiratoria un descenso paulatino de la rSO2 que se asocia a incremento del índice de resistencia en el Doppler cerebral. A las 3 semanas de vida y ante el descenso a niveles críticos de la rSO2 (54%; rango: 32-76%) se decide cierre quirúrgico. El postoperatorio trascurre sin incidencias significativas con normalización de la rSO2, a las 24h postintervención, la rSO2 media es del 70% (rango: 53-86%), hecho que se puede constatar en el registro de rSO2 ya en las primeras horas del postoperatorio (fig. 1).
Existen estudios que han puesto de manifiesto una reducción en la entrega de oxígeno a los tejidos como consecuencia de la PCA con la consiguiente afectación de la perfusión cerebral en comparación con recién nacidos sin PCA6,8. Lemmers et al.6 demostraron un incremento mantenido, así como normalización de la rSO2 hasta valores encontrados en recién nacidos sin PCA tras tratamiento con indometacina. Con relación al cierre quirúrgico, recientemente un estudio9 ha constatado que aquellos recién nacidos que precisaron cirugía tenían un mayor riesgo de presentar cambios significativos en la oxigenación cerebral con relación a aquellos que habían recibido tratamiento conservador o con indometacina, sugiriendo que la monitorización mediante NIRS podría identificar aquellos con un mayor riesgo de desarrollar daño cerebral. En otro estudio10 se observó un descenso significativo de la oximetría cerebral durante el cierre quirúrgico, aunque tras 24h de la cirugía la oximetría cerebral era superior a la observada previamente a la cirugía. El descenso inicial podría representar un incremento significativo del consumo de oxígeno a nivel cerebral. En nuestro caso, el importante compromiso observado ya previo a la cirugía a diferencia de la mayoría de los casos con cierre quirúrgico de los estudios citados, probablemente provocó que ya en el postoperatorio inmediato fuera evidente la mejoría de la oxigenación cerebral.
Como comentario final señalar que la monitorización de la oximetría cerebral mediante NIRS es una técnica no invasiva y de fácil interpretación que podría contribuir a la toma de decisiones desde el punto de vista terapéutico en estos pacientes si bien este hecho requiere de estudios que corroboren los hallazgos encontrados en nuestro caso.