Como cada año, el Comité Asesor de Vacunas de la Asociación Española de Pediatría (CAV-AEP) actualiza sus recomendaciones de inmunización en niños, adolescentes y embarazadas residentes en España.
Se mantiene el esquema 2+1 en lactantes (dos, cuatro y 11 meses), incluyendo prematuros, para vacunas hexavalentes (DTPa-VPI-Hib-HB) y neumocócica conjugada 13-valente.
A los seis años de edad, refuerzo con DTPa-VPI a los que recibieron la pauta 2+1 con hexavalentes siendo lactantes, y, en la adolescencia, Tdpa, una dosis. En gestantes, Tdpa en cada embarazo, preferentemente entre las semanas 27 y 32, aunque si hay riesgo de parto pretérmino se puede desde la semana 20 de gestación.
Todos los lactantes deben recibir vacunas contra rotavirus (dos o tres dosis) y meningococo B (2+1).
Todos los niños de entre seis y 59 meses deben ser vacunados anualmente contra la gripe, además de los grupos de riesgo desde los 6 meses.
MenACWY debe administrarse a los 12 meses de edad y a los adolescentes entre 12 y 18 años que no la hayan recibido.
Se mantienen las recomendaciones sobre SRP (12 meses y tres a cuatro años) y varicela (15 meses y tres a cuatro años), procurando en la segunda dosis el uso de la vacuna tetravírica (SRPV).
Las recomendaciones para el uso de las vacunas contra la COVID-19 en la edad pediátrica se actualizarán periódicamente en la web del CAV-AEP.
Vacuna contra el virus del papiloma humanon (VPH) indicada para todos los adolescentes, independientemente del género, a los 12 años.
Como novedades, se incluyen la recomendación de uso de nirsevimab sistemático en recién nacidos y lactantes menores de seis meses como inmunización pasiva contra el virus respiratorio sincitial (VRS), y se aglutinan las hexavalentes en un solo apartado.
As it does every year, the CAV-AEP publishes the update of its recommendations for the use of vaccines in children, adolescents and pregnant women residing in Spain.
The 2 + 1 schedule is maintained in infants (at 2, 4 and 11 months), including preterm infants, with the hexavalent vaccine (DTaP-IPV-Hib-HB) and the pneumococcal 13-valent conjugate vaccine.
A booster dose with DTaP-IPV is needed at 6 years for those who received the 2 + 1 series with hexavalent vaccine as infants, in addition to 1 dose of dTap in adolescence. Routine vaccination of pregnant women with a dose of dTap is recommended in each pregnancy, preferably between weeks 27 and 32 of gestation, although can be given from 20 weeks if there is risk of preterm delivery.
All infants should receive the rotavirus vaccine (2–3 doses) and the 4 CMenB vaccine (2 + 1 series).
All children aged 6–59 months should be vaccinated against influenza each year, in addition to risk groups from 6 months.
The MenACWY vaccine should be given routinely at 12 months of age and in adolescence between ages 12 and 18 years.
The recommendations for the MMR vaccine (12 months and 3–4 years) and varicella vaccine (15 months and 3–4 years) also remain unchanged, using the MMRV vaccine for the second dose.
Recommendations for the use of SARS-CoV-2 vaccines in the paediatric age group will be updated periodically on the CAV-AEP website.
The HPV vaccine is indicated in all adolescents, regardless of sex, at age 12 years.
Novelties include the recommendation of routine administration of nirsevimab to neonates and infants aged less than 6 months for passive immunization against RSV, and the recommendations regarding the hexavalent vaccine are consolidated in a single section.
Cumpliendo con su compromiso, el Comité Asesor de Vacunas de la Asociación Española de Pediatría (CAV-AEP) publica sus recomendaciones de inmunización anuales aplicables en España para la infancia, adolescencia y embarazo (fig. 1), fruto de la revisión crítica de información científica relevante obtenida a partir de múltiples fuentes (tabla 1), y adaptadas a nuestra epidemiología. En la web del CAV-AEP y en el manual de vacunas en línea pueden consultarse con detalle las bases que sustentan estas recomendaciones.
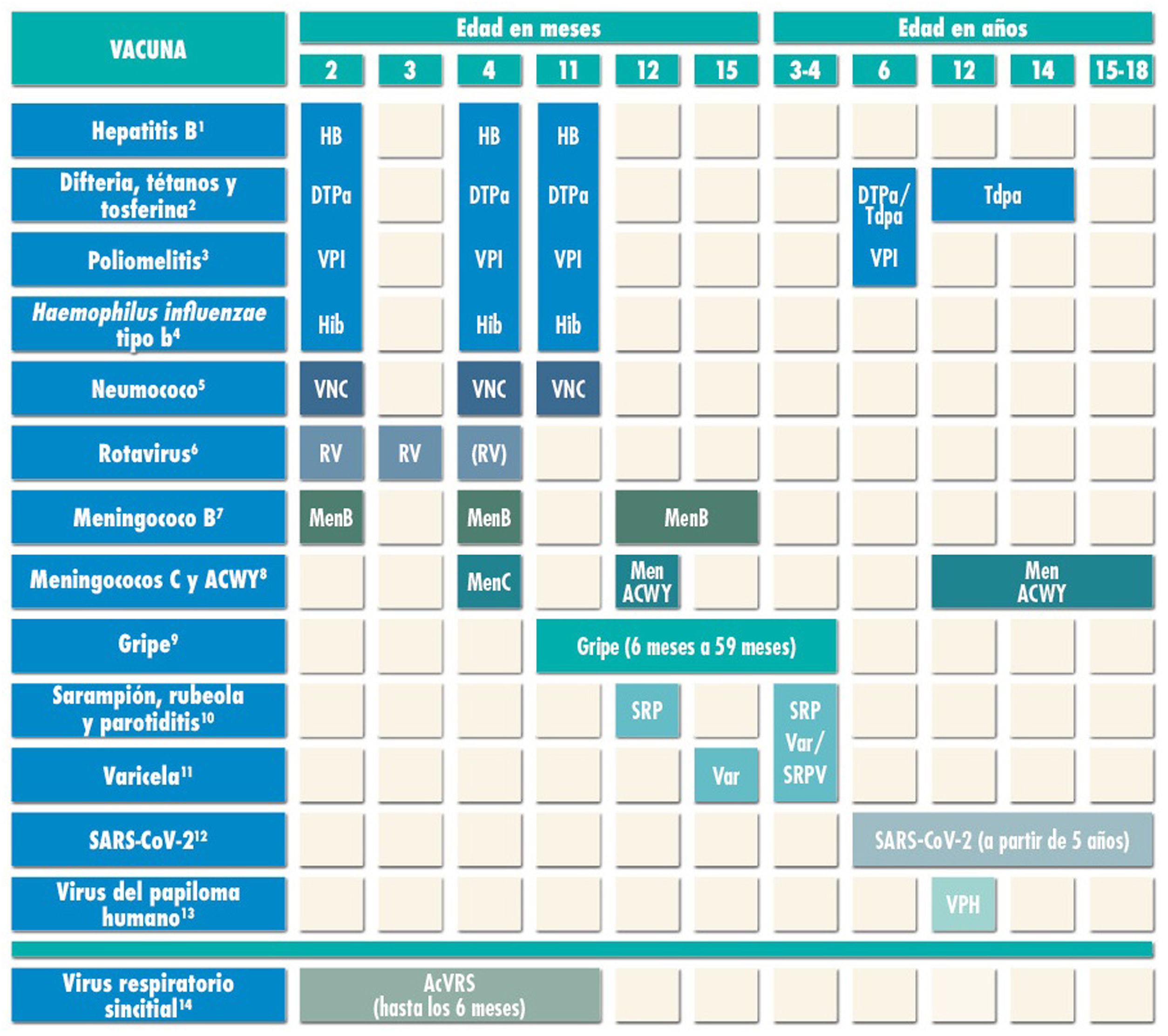
Calendario de inmunizaciones de la Asociación Española de Pediatría: recomendaciones 2023.
(1) Vacuna antihepatitis B (HB). Tres dosis, en forma de vacuna hexavalente, a los 2, 4 y 11 meses de edad. Los hijos de madres HBsAg positivas recibirán en las primeras 12 horas de vida una dosis de vacuna y otra de IGHB (0,5 ml). Si la serología materna fuera desconocida, deberá administrarse la vacuna en las primeras 12 horas y realizar serología y si resultara positiva administrar 0,5 ml de IGHB, preferentemente en las primeras 72 horas de vida. Los lactantes vacunados al nacimiento seguirán el calendario habitual del primer año, por lo que recibirán 4 dosis de HB. A los niños y adolescentes no vacunados se les administrarán 3 dosis de vacuna monocomponente según la pauta 0, 1 y 6 meses.
(2) Vacuna frente a la difteria, el tétanos y la tosferina (DTPa/Tdpa). Cinco dosis: primovacunación con 2 dosis, a los 2 y 4 meses, de vacuna DTPa-VPI-Hib-HB (hexavalente); refuerzo a los 11 meses (3.ª dosis) con DTPa (hexavalente); a los 6 años (4.ª dosis) con el preparado de carga estándar (DTPa-VPI), preferible al de baja carga antigénica de difteria y tosferina (Tdpa-VPI) y a los 12-14 años (5.ª dosis) con Tdpa. En los casos vacunados anteriormente con la pauta 3+1 (2, 4, 6 y 18 meses), en la dosis de los 6 años se podrá utilizar Tdpa, ya que no precisan nuevas dosis de vacuna frente a la poliomielitis.
(3) Vacuna antipoliomielítica inactivada (VPI). Cuatro dosis: primovacunación con 2 dosis, a los 2 y 4 meses, y refuerzos a los 11 meses (con hexavalentes) y a los 6 años (con DTPa-VPI o Tdpa-VPI). En los casos vacunados anteriormente con la pauta 3+1 (2, 4, 6 y 18 meses), no se precisan más dosis de VPI.
(4) Vacuna conjugada frente al Haemophilus influenzae tipo b (Hib). Tres dosis: primovacunación a los 2 y 4 meses y refuerzo a los 11 meses con hexavalentes.
(5) Vacuna conjugada frente al neumococo (VNC). Tres dosis: las 2 primeras a los 2 y 4 meses, con un refuerzo a partir de los 11 meses de edad. La vacuna recomendada en nuestro país por el CAV-AEP sigue siendo la VNC13.
(6) Vacuna frente al rotavirus (RV). Dos o tres dosis de vacuna frente al rotavirus: a los 2 y 3-4 meses con la vacuna monovalente; o a los 2, 3 y 4 meses o 2, 3-4 y 5-6 meses con la pentavalente. Para minimizar el riesgo raro de invaginación intestinal, la pauta ha de iniciarse entre las 6 y las 12 semanas de vida y debe completarse antes de las 24 semanas en la monovalente y de las 33 en la pentavalente. El intervalo mínimo entre dosis es de 4 semanas. Ambas vacunas se pueden coadministrar con cualquier otra (a excepción de la vacuna de la poliomielitis oral, no comercializada en España).
(7) Vacuna frente al meningococo B (MenB). 4CMenB. Tres dosis: se iniciará a los 2 meses de edad, con 2 dosis separadas por 2 meses y un refuerzo a partir de los 12 meses, siempre que hayan pasado, al menos, 6 meses de la última dosis de primoinmunización. Se puede coadministrar con las otras vacunas del calendario, aunque podría producir más fiebre; por lo que también se podría aplicar con una separación de 1 o 2 semanas con las otras vacunas inactivadas inyectables de primovacunación, para minimizar su posible reactogenicidad. No es necesaria la separación de 1 o 2 semanas con las vacunas MenACWY, triple vírica, varicela y rotavirus. Para el resto de las edades, la recomendación es de tipo individual con cualquiera de las dos vacunas (4CMenB o MenB-fHbp), respetando la edad mínima autorizada para cada una de ellas.
También se recomienda a cualquier edad en grupos de riesgo: asplenia anatómica o funcional, déficit de factores de complemento, tratamiento con eculizumab o ravulizumab, receptores de trasplante de progenitores hematopoyéticos, infección por VIH, episodio previo de EMI por cualquier serogrupo y contactos de un caso índice de EMI por serogrupo B en el contexto de un brote epidémico.
(8) Vacuna conjugada frente al meningococo C (MenC) y vacuna frente a los meningococos ACWY (MenACWY). Una dosis de vacuna conjugada MenC-TT a los 4 meses de edad. A los 12 meses y a los 11-13 años se recomienda una dosis de la vacuna MenACWY, aconsejándose un rescate progresivo hasta los 18 años. En CC. AA. donde no está incluida la vacuna MenACWY a los 12 meses en calendario sistemático, si los padres deciden no administrarla, deberá aplicarse la MenC-TT financiada por su comunidad. Para el resto de las edades, la recomendación es de tipo individual.
También se sigue recomendando especialmente MenACWY para niños y adolescentes que vayan a residir en países en los que la vacuna se indique a esas edades (Canadá, EE. UU., Argentina, Chile, Arabia Saudí, Australia, Andorra, Austria, Bélgica, Chipre, Grecia, Irlanda, Italia, Malta, Países Bajos, Reino Unido, República Checa, San Marino y Suiza) y para los que tengan factores de riesgo de EMI: asplenia anatómica o funcional, déficit de factores del complemento, tratamiento con eculizumab o ravulizumab, receptores de trasplante de progenitores hematopoyéticos, infección por VIH, episodio previo de EMI por cualquier serogrupo y contactos de un caso índice de EMI por serogrupo A, C, W o Y en el contexto de un brote epidémico. Los viajeros a La Meca por razones religiosas y al llamado cinturón de la meningitis africano durante la estación seca deben recibir también MenACWY.
(9) Vacuna frente a la gripe. Se recomienda esta vacunación para todos los niños de 6 a 59 meses de edad con vacunas inactivadas por vía intramuscular (algún preparado admite también la vía subcutánea profunda), o con vacuna atenuada intranasal, esta última a partir de los 2 años de edad. En niños menores de 9 años no vacunados en otras campañas se aplicarán dos dosis separadas por 4 semanas; posteriormente precisarán una sola dosis para el resto de las campañas. La dosis es de 0,5 ml intramuscular en las inactivadas y de 0,1 ml en cada fosa nasal para la atenuada. También se recomienda para todos los grupos de riesgo y convivientes a partir de 6 meses de edad. Para consultar los grupos de riesgo de esta vacuna se puede acceder al Manual de vacunas en línea.
(10) Vacuna frente al sarampión, la rubeola y la parotiditis (SRP). Dos dosis de vacuna del sarampión, rubeola, y parotiditis (triple vírica). La 1.ª a los 12 meses y la 2.ª a los 3-4 años de edad. La 2.ª dosis se podría aplicar en forma de vacuna tetravírica (SRPV). En pacientes susceptibles fuera de las edades anteriores, se recomienda la vacunación con 2 dosis de SRP con un intervalo de, al menos, un mes.
(11) Vacuna frente a la varicela (Var). Dos dosis: la 1.ª a los 15 meses (también es aceptable a partir de los 12 meses de edad) y la 2.ª a los 3-4 años de edad. La 2.ª dosis se podría aplicar en forma de vacuna tetravírica (SRPV). En pacientes susceptibles fuera de las edades anteriores, se recomienda vacunación con 2 dosis de vacuna monocomponente con un intervalo de, al menos, un mes, siendo recomendable 12 semanas en los menores de 13 años.
(12) Vacuna frente al SARS-CoV-2. Actualmente están autorizadas dos vacunas en nuestro país a partir de los 12 años, Comirnaty-30 mcg (Pfizer) y Spikevax-100 mcg (Moderna) y otras dos más para menores de esa edad: una entre los 5 y los 11 años, Comirnaty, con menor cantidad de antígeno (Comirnaty-10 mcg), y otra, Spikevax-100 mcg (Moderna) con la mitad de la dosis (0,25 ml) entre los 6 y los 11 años. Se aplicarán dos dosis. La Comisión de Salud Pública de España ha decidido que la separación entre las 2 dosis de Comirnaty 10 mcg y de Spikevax-100 mcg (0,25 ml) en niños menores de 12 años sea de 8 semanas. Si se administran por error antes de ese intervalo, se considerarán válidas a partir de los 21 y 28 días de la primera dosis, respectivamente. Se pueden administrar con otras vacunas el mismo día o con la separación que se desee. En menores de 18 años no está indicada en la actualidad una tercera dosis (dosis de recuerdo), aunque sí en los niños y adolescentes a partir de los 5 años con condiciones de muy alto riesgo o que reciban tratamiento inmunosupresor, que recibirán una tercera (dosis adicional, a partir de 8 semanas tras la última dosis de primovacunación) y una cuarta dosis (dosis de recuerdo, a partir de 5 meses tras la dosis adicional). Se han autorizado por la EMA otras 2 vacunas: para niños de 6 meses a 4 años, Comirnaty-3 mcg (Pfizer) en 3 dosis y para niños entre 6 meses y 5 años, Spikevax-25 mcg (Moderna) en 2 dosis. La Comisión de Salud Pública ha aprobado la vacunación de los grupos de riesgo desde los 6 meses de edad con estas vacunas.
(13) Vacunación sistemática universal frente al VPH, tanto de chicas como de chicos, a los 10-12 años, con dos dosis. Las vacunas disponibles en la actualidad son VPH2 y VPH9. Las dos están autorizadas en varones, aunque con VPH2 es aún escasa la experiencia en ellos. Pautas de vacunación: dos dosis (0 y 6 meses) entre 9 y 14 años y pauta de tres dosis [0,1-2 (según preparado vacunal) y 6 meses] para ≥15 años. Es posible su coadministración con las vacunas MenC, MenACWY, hepatitis A y B y Tdpa. No hay datos de coadministración con la vacuna de la varicela, aunque no debería plantear problemas.
(14) Virus respiratorio sincitial. Se recomienda nirsevimab (anticuerpo anti-VRS) en todos los recién nacidos y lactantes menores de seis meses y su administración anual a niños menores de dos años con enfermedades subyacentes que aumenten el riesgo de infección grave por VRS.
Fuentes de información y estrategias de búsqueda bibliográfica del documento
| - TripDatabase: Búsqueda avanzada: (disease) (vaccine) (vaccination) |
| - Cochrane Library: Disease AND vaccine |
| - MEDLINE/Pubmed: (“disease/microorganism” [MeSH Terms]) AND (“vaccine” [MeSH Terms] OR “vaccination” [MeSH Terms]). Filters activated: Child birth-18 years, Human (Sort by: Best Match) |
| - EMBASE: “disease”/exp AND “vaccine”/exp |
| - Webs oficiales del Ministerio de Sanidad y el Instituto de Salud Carlos III |
| - Páginas web de agencias reguladoras de medicamentos: Agencia Española de Medicamentos y Productos Sanitarios y European Medicines Agency. |
| - CAV-AEP. Fichas técnicas |
| - Organismos gubernamentales o consultivos internacionales relacionados con la política vacunal: ACIP (EE. UU.), JCVI (RU), STIKO (Alemania), Public Health Agency of Canada, Australian Department of Health. |
| - Comunicaciones y ponencias en congresos nacionales e internacionales |
| - Fuentes primarias (libros de texto, bibliografía de artículos seleccionados en la búsqueda) |
| - Datos cedidos directamente por los autores (no publicados) |
| - Publicaciones no indexadas en bases de datos |
| - Información procedente de la industria farmacéutica |
Insistimos en la necesidad de un calendario vacunal único estatal; en explorar cauces alternativos de financiación para vacunas aún no incluidas en calendarios oficiales; en cambiar el paradigma clásico de valoración farmacoeconómica aplicado a vacunas y que la industria farmacéutica colabore para que los niños y adolescentes de España cuenten con la mejor protección posible contra enfermedades inmunoprevenibles.
Habiéndose demostrado el importantísimo papel que han jugado las vacunas frente a covid en el control de la pandemia, y lo exitosas que son las estrategias colaborativas entre sociedades científicas y autoridad sanitaria, el CAV-AEP se reafirma en la necesidad de que en los órganos decisorios sobre política vacunal de España participen activamente representantes de pediatría, entre otros.
Las coberturas han disminuido de forma marcada en el mundo durante la pandemia, resurgiendo enfermedades inmunoprevenibles previamente controladas, poniendo de manifiesto la importancia de la Atención Primaria (AP) en el mantenimiento de buenas coberturas vacunales. Sólo reforzando la Pediatría de AP y los servicios de Salud Pública regionales se podrá asegurar que las vacunas lleguen a todos, salvando activamente barreras de acceso a la inmunización, combatiendo bulos y desinformación.
Vacunación con hexavalentes (DTPa-VPI-Hib-HB)Recomendación 2023: esquema 2+1 con hexavalentes DTPa-VPI-Hib-HB (dos, cuatro y 11 meses), DTPa-VPI, preferiblemente, o Tdpa-VPI a los seis años y Tdpa a los 12-14 años. Se recomienda Tdpa, en cada embarazo, preferentemente entre la 27 y 32 semana de gestación, lo más precozmente posible. Si alta probabilidad de parto pretérmino, a partir de las 20 semanas. En niños y adolescentes no vacunados de HB se administrarán, a cualquier edad, tres dosis de vacuna monocomponente (o combinada con hepatitis A si existe indicación), con pauta 0, uno y seis meses.
En países con buenas coberturas, la vacunación frente a difteria, tétanos, poliomielitis, hepatitis B y Haemophilus influenzae tipo b es altamente eficaz para el control de estas enfermedades1. El esquema 2+1 aplicando vacunas hexavalentes, con separación de, al menos, dos meses entre la serie primaria y de seis meses entre primovacunación y refuerzo es seguro y eficaz, se implementó en España en 2017 y obliga a administrar una cuarta dosis de vacuna de polio inactivada (VPI) a los seis años. Durante 2022 los primeros niños con esa pauta deben recibir DTPa-VPI, pero si esta presentación no está disponible o el niño es mayor de siete años, se utilizará Tdpa-VPI.
En la adolescencia, con la administración de Tdpa, se aplica la quinta dosis de vacuna frente a tétanos y difteria, completando el esquema recomendado hasta los 60-65 años y reforzando la protección frente a tosferina en el adulto joven.
En la tosferina, debido a que, ni la vacunación ni la enfermedad natural confieren inmunidad duradera, hay susceptibles de todas las edades, pero con mayor morbimortalidad en los lactantes menores de tres meses2. La vacunación en el embarazo es una estrategia eficaz para prevenir la enfermedad grave del lactante; con una efectividad de hasta el 90,5% para evitar hospitalización en menores de tres meses3. Cuanto antes se administra, mayor es el paso de anticuerpos al recién nacido4. Existe cierta interferencia en la respuesta a la primovacunación (blunting) que no justifica retrasar la dosis ya que hay trabajos que muestran que la disminución de la concentración de anticuerpos posvacunales no afecta a la seroprotección5.
La hepatitis B es una infección de distribución universal. Por ello, la Organización Mundial de la Salud (OMS) ha adoptado la «Estrategia mundial del sector de salud contra las hepatitis víricas, 2016-2021», con el objetivo de eliminarla hacia 2030. España es un país de baja endemicidad, con 394 casos notificados en 2021, muy rara transmisión vertical e infección infantil infrecuente6.
La pauta completa induce, en más de 95% de lactantes, niños y adultos jóvenes, respuesta seroprotectora (antiHBs >10 mUI/ml) que dura 20 años y, probablemente, toda la vida. No obstante, los pacientes hemodializados e inmunodeprimidos pueden presentar menores tasas de seroconversión, por lo que puede ser necesario aumentar dosis antigénica o aplicar más dosis.
Vacunación frente al neumococoRecomendación 2023: vacunación antineumocócica en los menores de cinco años y a cualquier edad en grupos de riesgo. Para la vacunación sistemática del lactante sano, se recomienda el esquema 2+1 (dos, cuatro y 11 meses), siendo la vacuna tridecavalente (VNC13) la recomendada.
Las vacunas neumocócicas conjugadas (VNC) protegen frente a enfermedad neumocócica invasora (ENI) y no invasora (neumonía y otitis media aguda)7,8. La vacunación antineumocócica sistemática infantil a escala global ha reducido significativamente la carga de ENI, disminuyendo el consumo de antibióticos y las resistencias bacterianas9.
Tras el empleo de VNC, se ha documentado un aumento de serotipos no vacunales. Esto conlleva el desarrollo de vacunas nuevas que incorporan un mayor número de serotipos (VNC15, VNC20, VNC24) para uso en adultos y niños10. VNC13 proporciona la mejor cobertura frente a serotipos circulantes en población pediátrica en España10.
Vacunación frente al rotavirusRecomendación 2023:la vacuna antirrotavirus (RV) debería incluirse en calendario sistemático para todos los lactantes.
La gastroenteritis por RV afecta a prácticamente todos los lactantes durante los primeros dos años de vida, siendo más grave cuanto menor edad, pudiendo producirse reinfecciones por otros genotipos del virus. Su gravedad es menor en países desfavorecidos, pero, aun así, comporta elevados costes sanitarios y sociales11. La manera más efectiva de prevenir esta infección es la vacunación. La OMS, la Academia Europea de Pediatría y la Sociedad Europea de Enfermedades Infecciosas Pediátricas apoyan esta recomendación.
En sus calendarios sistemáticos, 114 países incluyen RV. Los beneficios sanitarios de esta medida son incuestionables. En España disponemos de dos vacunas antirrotavirus.
Los prematuros, cuya vacunación está financiada como grupo de riesgo, deben vacunarse sin retrasos, incluso hospitalizados, entre seis y 12 semanas de vida12.
Un reciente metaanálisis valorando efectos de la vacuna en más de 100.000 menores de cinco años reafirma su efectividad y seguridad y su positiva relación coste/beneficio13.
Vacunación frente a meningococosRecomendación 2023:vacunación sistemática frente MenB en lactantes a los dos meses de edad con pauta 2+1, frente MenC (cuatro meses), y con vacuna MenACWY (12 meses, 12 años y rescate en adolescentes entre 13 y 18 años). Para el resto de las edades, la recomendación es de carácter individual.
Para la prevención de enfermedad meningocócica invasora (EMI) por serogrupo B (MenB) disponemos de dos vacunas: 4 CMenB (a partir de dos meses de edad) y MenB-fHbp (a partir de 10 años).
Existen datos consistentes de la efectividad de 4 CMenB. Reino Unido redujo 75% la incidencia de EMI por MenB, con efectividad vacunal (EV) con pauta 2+1 del 71,2%14. Italia comunicó elevada efectividad en lactantes en Toscana (93,6%) y Veneto (91,0%), con mayor impacto del inicio precoz de la pauta15. Portugal mostró EV del 79% para, al menos, dos dosis, no produciéndose fallecimientos ni secuelas16. Un estudio similar en España, pendiente de publicación, muestra EV del 72% para pauta completa (97% en menores de un año), evitando 37 casos de EMI por MenB, 25 ingresos en UCI, 3 casos con secuelas y dos fallecimientos.
El CAV-AEP sigue apostando por la vacunación sistemática en lactantes frente a MenB, serogrupo más frecuente en España, con pauta 2+1 e inicio a los dos meses. Andalucía, Canarias, Castilla y León, Cataluña y Galicia ya la incluyen en sus calendarios. La indicación en otras edades es de carácter individual17.
El incremento global de incidencia de EMI por W e Y18 llevó a que algunos países sustituyeran MenC por MenACWY en la adolescencia, mientras que otros la introdujeron para lactantes y niños entre dos y 24 meses buscando la protección directa por su mayor riesgo. La pandemia también redujo significativamente la incidencia de estos serogrupos. No obstante, dada la epidemiología impredecible de la enfermedad, el CAV-AEP recuerda la necesidad de seguir extremando la vigilancia epidemiológica y conseguir elevadas coberturas vacunales. Dado que la pandemia interrumpió el rescate entre 13 y 18 años, siendo difícil alcanzar coberturas que protejan al lactante de forma indirecta, seguimos recomendando introducir esta vacuna a los 12 meses y continuar con la vacunación a los 12 años y el rescate en adolescentes. Para el resto de las edades la recomendación es individual. Andalucía, Castilla y León, Baleares, Galicia, Murcia y Melilla ya la tienen en su calendario a los 12 meses. En el resto de CC.AA., se debe asegurar la dosis de MenC a los 12 meses si no se administra MenACWY.
Vacunación frente a gripeRecomendación 2023:la vacuna anual frente a gripe debería incluirse en el calendario sistemático para todos los niños de seis a 59 meses y para los grupos de riesgo y sus convivientes a partir de los 6 meses.
La vacuna antigripal es la forma más efectiva de prevención. Desde el año 2012 la OMS19 y otros organismos consideran a los niños de seis a 59 meses prioritarios para la vacunación antigripal. Se justifica porque con frecuencia se cree que afecta a niños con enfermedades de base, numerosos estudios demuestran su enorme incidencia en niños sanos20; por el papel en la transmisión de enfermedad al resto de la comunidad, especialmente colectivos vulnerables, y por la reducción de morbimortalidad en personas mayores mediante vacunación infantil.
Disponemos de vacunas eficaces y seguras para uso pediátrico. La vacunación infantil es una de las medidas más efectivas para reducir la carga global de enfermedad, en niños y en adultos, especialmente en aquellos de edad avanzada con peores respuestas a la vacunación.
Vacunación frente a sarampión, rubeola y parotiditis (vacuna triple vírica: SRP)Recomendación 2023:la primera dosis de SRP se administrará a los 12 meses como triple vírica y la segunda a los tres a cuatro años en forma de SRPV.
La OMS recomienda una cobertura superior al 95% para, al menos, una dosis de vacuna, objetivo que se ha logrado en muchos países de EE. UU./EEA; entre ellos, España, que continúa siendo un país libre de sarampión autóctono.
En 2021 en España se notificaron dos casos de sarampión, cuatro casos de rubeola (ninguna congénita) y 1.095 casos de parotiditis.
Se recomienda administrar la primera dosis a los 12 meses con SRP y la segunda dosis a los tres a cuatro años con tetravírica, aunque si la incidencia de sarampión aumentara, podría adelantarse esta dosis a los dos años21.
Cuando por motivos epidemiológicos se precisa vacunar a menores de 12 meses, se puede administrar SRP entre los seis y 11 meses de vida, pero será necesario aplicar posteriormente dos dosis de vacuna a partir de 12 meses de edad, con un intervalo mínimo de cuatro semanas.
Por otro lado, el CAV-AEP considera válida una primera dosis de SRP administrada erróneamente o por otros motivos entre los 11-12 meses. Estudios propios22 y de países de nuestro entorno, han certificado menor concentración y más rápida evanescencia de los anticuerpos maternos en hijos de vacunadas, disminuyendo su interferencia con la respuesta vacunal en estos, y validando la eficacia protectora de la vacuna a los 11 meses.
Se mantiene la recomendación de administrar por separado la primera dosis de SRP y varicela en menores de dos años por mayor riesgo de convulsiones febriles.
Vacunación frente a varicelaRecomendación 2023:vacunación sistemática con dos dosis [15 meses y a los tres a cuatro años (en la segunda se puede utilizar SRPV)]. En niños y adolescentes no vacunados y que no han padecido enfermedad, se recomienda vacunación de rescate con dos dosis.
Todas las vacunas antivaricela son de virus vivos atenuados. Existen dos vacunas monocomponentes y una SRPV, todas con elevada efectividad (92-97%)23.
El control de la enfermedad precisa vacunar con dos dosis24. Desde 2016, todas las CC.AA. la incluyen (15 meses y tres a cuatro años). La segunda dosis se administra con SRPV en 10 CC.AA.
Según diversos estudios, la incidencia de HZ en niños vacunados de varicela es inferior que tras la infección natural25.
Vacunación frente al SARS-CoV-2Recomendación 2023:se recomienda la vacunación frente a COVID-19 en niños de cinco a 11 años y entre 12-17 años con cualquiera de las vacunas de ARNm aprobadas en España.
Para niños de 12-17 años se utilizan las vacunas de adultos Comirnaty y Spikevax, que contienen 30 y 100 mcg de ARNm, respectivamente. Para niños de cinco a 11 años, Comirnaty 10 mcg y Spikevax 50 mcg. Ambos fabricantes disponen de vacunas con menor cantidad de ARNm para la vacunación a partir los seis meses de edad, habiendo sido aprobadas por la FDA en junio de 202226 y recomendadas por los CDC27. La OMS también recomienda la vacunación en niños, siempre y cuando las personas consideradas de alto riesgo hayan recibido la serie primaria de la vacuna y el refuerzo cuando esté indicado28.
El Ministerio de Sanidad29 recomienda que, en mayores de 12 años, el intervalo entre dosis de la serie primaria sea tres semanas para Comirnaty y cuatro para Spikevax. En niños de cinco a 11 años las dosis se separan ocho semanas. Los niños inmunodeprimidos (grupo 7 del Ministerio) o que reciben tratamientos inmunosupresores deben recibir una serie primaria de tres dosis, administrando la última, al menos, 28 días después de la segunda. Se han autorizado por la EMA otras 2 vacunas: para niños de 6 meses a 4 años, Comirnaty-3 mcg (Pfizer) en 3 dosis y para niños entre 6 meses y 5 años, Spikevax-25 mcg (Moderna) en 2 dosis. La Comisión de Salud Pública ha aprobado la vacunación de los grupos de riesgo desde los 6 meses de edad con estas vacunas.
Aunque en niños la COVID-19 es benigna y de baja letalidad, la vacunación previene hospitalizaciones, ingresos en UCIP y complicaciones graves, entre ellos el síndrome inflamatorio multisistémico pediátrico.
Estas vacunas han perdido EV frente a las infecciones causadas por las variantes y subvariantes Ómicron (BA.1, BA.1.1, BA.2, BA.2.12.1, BA.4 y BA.5), ya que las mutaciones que acumulan en la proteína S facilitan el escape a los anticuerpos neutralizantes30–32, pero siguen manteniendo una protección muy alta -probablemente mediada por inmunidad celular- frente a hospitalización y enfermedad grave.
Por ello, con una inmunidad poblacional alta en niños, ya infectados o vacunados, el CAV-AEP reconoce que los criterios de vacunación infantil pueden modificarse en un futuro, según el comportamiento de la COVID-19 en la comunidad.
Las vacunas ARNm en niños han confirmado su seguridad. Los efectos secundarios más frecuentes son locales y generales leves como fiebre, cefalea, cansancio y mialgias. En EE. UU., tras 38 millones de dosis administradas a niños de cinco a 17 años, la miocarditis fue un evento raro, más frecuente en varones y tras la segunda dosis. Cuando coincidieron ambas condiciones, la incidencia por millón fue 4,3, 45,7 y 70,2 para los grupos de cinco a 11 años, 12-15 y 16-17 años, respectivamente. En la mayoría de casos, la evolución fue benigna con curación espontánea en dos a tres días33
Vacunación frente al VPHRecomendación 2023:vacunación sistemática universal, con independencia del género, a los 10-12 años. Las vacunas disponibles en la actualidad son VPH2 y VPH9.
La edad recomendada para iniciar la vacunación es 10-12 años, antes del inicio de relaciones sexuales, para mayor beneficio y coberturas. También se recomienda vacunación de rescate y en grupos de riesgo34.
La mayoría de infecciones por VPH son transitorias y se resuelven en 12-24 meses en mujeres y en 6-12 en varones. Sin embargo, entre un 3-10% de los casos la infección se hace persistente y comporta riesgo de cáncer de cérvix y de otros tipos como anal y cabeza y cuello, que afectan a ambos sexos.
Se dispone de datos de protección frente a infección persistente, verrugas genitales, lesiones cervicales y anales premalignas, y recientemente frente a cáncer de cérvix35 y cáncer anogenital en varones36.
Múltiples estudios37 han demostrado excelente seguridad y tolerancia de las vacunas VPH en diferentes edades.
El CAV-AEP recomienda la vacunación sistemática frente al VPH, sin distinción de género.
Prevención de infección por VRSRecomendación 2023:administración de una dosis de nirsevimab de forma sistemática a todos los recién nacidos y lactantes menores de 6 meses y una dosis anual en menores de dos años con factores de riesgo.
El VRS es la causa más frecuente de infección respiratoria de vías bajas en lactantes. Representa un problema sanitario enorme por la cantidad de consultas que genera en todos los ámbitos de atención sanitaria, elevado número de hospitalizaciones y mortalidad en edades extremas de la vida.
En un estudio realizado en España donde se analiza la carga de enfermedad durante un periodo de nueve años, las hospitalizaciones anuales por bronquiolitis por VRS en menores de 1 año oscilaron entre 5.997 y 8.637. Más de 98% fueron lactantes sin factores de riesgo (fundamentalmente menores de 3 meses); sin embargo, la presencia de alguno de los siguientes: prematuridad, enfermedad pulmonar crónica, síndrome Down, cardiopatía congénita o enfermedad neuromuscular, se asoció con mortalidad intrahospitalaria estimada de 90 casos por cada 100.00038.
El conocimiento de la configuración espacial de la proteína F del virus in vivo (formas pre y posfusión) y los loci a los que se unen los anticuerpos neutralizantes ha posibilitado el desarrollo de prometedoras tecnologías preventivas: vacunas y anticuerpos monoclonales (ACM).
El enfoque que más repercusión tiene en la disminución de la carga de enfermedad por VRS será mixto, mediante el uso de ACM en menores de seis meses e individuos de riesgo y vacunas en otras poblaciones (embarazadas, lactantes mayores, niños y ancianos).
El nirsevimab, es un anticuerpo monoclonal humano dirigido contra el locus θ de la proteína F, con semivida mucho más prolongada que el palivizumab, permitiendo con una dosis la protección durante toda la estación del VRS. El ensayo fase 3 (MELODY) evaluó su eficacia y seguridad en lactantes sanos y pretérminos tardíos, con eficacia en la prevención de la atención médica de 74,5% (IC 95%: 49,6 a 87,1), de 62,1% (IC 95%: -8,6 a 86,8) para ingreso hospitalario por infección de vías bajas por VRS y de 59,0% (IC 95%: 1,8 a 82,9) para ingreso hospitalario por cualquier tipo de infección VRS39. Otro ensayo, en prematuros de 29 a 34 semanas, mostró eficacia del 78,4%; IC 95%: 51,9 a 90,3 en la prevención del ingreso hospitalario40.
Ante esta evidencia y la reciente recomendación de la EMA de autorizar su comercialización, el CAV-AEP recomienda nirsevimab en todos los recién nacidos y lactantes menores de seis meses y su administración anual a niños menores de dos años con enfermedades subyacentes que aumenten el riesgo de infección grave por VRS.
FinanciaciónLa elaboración de estas recomendaciones (análisis de los datos publicados, debate, consenso y publicación) no ha contado con ninguna financiación externa a la logística facilitada por la AEP.
Conflicto de intereses (últimos 5 años)Francisco José Álvarez García ha colaborado en actividades docentes subvencionadas por Alter, Astra, GlaxoSmithKline, MSD, Pfizer y Sanofi Pasteur y como consultor en Advisory Board de GlaxoSmithKline, MSD, Pfizer y Sanofi Pasteur.
María José Cilleruelo Ortega ha colaborado en actividades docentes subvencionadas por GlaxoSmithKline, Novartis, MSD, Pfizer y Sanofi, como investigadora en ensayos clínicos de GlaxoSmithKline y Pfizer, y como consultora en Advisory Board de GlaxoSmithKline, Novartis, MSD, Pfizer y Sanofi Pasteur.
Javier Álvarez Aldeán ha colaborado en actividades docentes subvencionadas por AstraZeneca, GlaxoSmithKline, MSD, Pfizer, Sanofi Pasteur y Seqirus; como investigador en ensayos clínicos de GlaxoSmithKline y Sanofi Pasteur y como consultor en Advisory Board de AstraZeneca, GlaxoSmithKline, MSD, Pfizer, Sanofi Pasteur, Seqirus.
María Garcés-Sánchez ha colaborado en actividades docentes subvencionadas por Astra, GlaxoSmithKline, MSD, Pfizer y Sanofi Pasteur, como investigadora en ensayos clínicos de GlaxoSmithKline, Janssen, MSD, Pfizer y Sanofi Pasteur y como consultora en Advisory Board de GlaxoSmithKline, Novartis y Pfizer.
Elisa Garrote Llanos ha recibido ayuda económica para asistir a actividades docentes nacionales y ha participado en actividades docentes subvencionadas por GlaxoSmithKline, MSD, Pfizer y Sanofi Pasteur, como investigadora en estudios de GlaxoSmithKline y MSD, y como consultora en Advisory Board de GlaxoSmithKline.
Antonio Iofrío de Arce ha colaborado en actividades docentes subvencionadas por GlaxoSmithKline, MSD y Pfizer y como consultor en Advisory Board de GlaxoSmithKline. Ha recibido ayuda económica de GlaxoSmithKline, MSD y Pfizer para asistir a actividades docentes nacionales.
Abián Montesdeoca Melián ha colaborado como investigador sin recibir remuneración en un estudio promovido por MSD en 2019-20. En los últimos cinco años no ha recibido honorarios ni financiación directa alguna por parte de la industria farmacéutica.
María Luisa Navarro Gómez ha colaborado en actividades docentes subvencionadas por Gilead, GlaxoSmithKline, Janssen, MSD, Pfizer y ViiV, como consultor en Advisory Board para Abbott, AstraZeneca, Novartis y ViiV y en ensayos clínicos promovidos por GlaxoSmithKline, Pfizer, Roche y Sanofi Pasteur.
Valentín Pineda Solas ha recibido ayuda económica de MSD, Pfizer y Sanofi Pasteur para asistir a actividades docentes nacionales e internacionales, ha colaborado en actividades docentes subvencionadas por AstraZeneca, GlaxoSmithKline, MSD, Pfizer y Sanofi Pasteur y como consultor en Advisory Board de GlaxoSmithKline, Pfizer y Sanofi Pasteur.
Irene Rivero Calle ha colaborado en actividades docentes subvencionadas por GlaxoSmithKline, MSD, Pfizer y Sanofi Pasteur, como investigadora en ensayos clínicos de vacunas de Abbot, Astrazeneca, Enanta, Gilead, GlaxoSmithKline, Janssen, Medimmune, Merck, Moderna, MSD, Novavax, Pfizer, Reviral, Roche, Sanofi Pasteur y Seqirus; y como consultora en Advisory Board de GlaxoSmithKline, MSD, Pfizer y Sanofi Pasteur.
Jesús Ruiz-Contreras ha colaborado en actividades docentes subvencionadas por GlaxoSmithKline, MSD, Pfizer y Sanofi Pasteur y como investigador en ensayos clínicos de GlaxoSmithKline y Pfizer.
Pepe Serrano Marchuet ha colaborado en actividades docentes subvencionadas por Astra-Zéneca, GlaxoSmithKline y MSD, como investigador en ensayos clínicos de Sanofi Pasteur y como consultor en Advisory Board para GlaxoSmithKline. Ha recibido ayuda económica de GlaxoSmithKline, MSD y Pfizer para asistir a actividades docentes nacionales e internacionales. Ha recibido becas bajo mecenazgo de GlaxoSmithKline.
A Javier Arístegui, José María Corretger, Nuria García Sánchez, Ángel Hernández Merino, Manuel Merino Moína y Luis Ortigosa, por su asesoría interna en la redacción y elaboración de estas recomendaciones.
- -
Francisco José Álvarez García. Pediatra. Centro de Salud de Llanera. Asturias. Profesor Asociado en Ciencias de la Salud. Departamento de Medicina. Universidad de Oviedo.
- -
María José Cilleruelo Ortega. Pediatra. Servicio de Pediatría. Hospital Universitario Puerta de Hierro-Majadahonda, Madrid. Departamento de Pediatría. Facultad de Medicina. Universidad Autónoma de Madrid.
- -
Javier Álvarez Aldeán. Pediatra. Servicio de Pediatría. Hospital Costa del Sol. Marbella. Málaga.
- -
María Garcés-Sánchez. Pediatra. Centro de Salud Nazaret. Valencia. Investigadora adscrita al Área de Vacunas. FISABIO. Valencia.
- -
Elisa Garrote Llanos. Pediatra. Sección de Infectología del Hospital Universitario Basurto. Bilbao. Profesora Asociada. Facultad de Medicina. Universidad del País Vasco. UPV-EHU.
- -
Antonio Iofrío de Arce. Pediatra. Centro de Salud El Ranero. Murcia
- -
Abián Montesdeoca Melián. Pediatra. Equipo de Intervención. Las Palmas de Gran Canaria.
- -
María Luisa Navarro Gómez. Pediatra. Servicio de Pediatría. Hospital Universitario Gregorio Marañón. Madrid. Profesora asociada. Departamento de Pediatría. Facultad de Medicina. Universidad Complutense de Madrid.
- -
Valentín Pineda Solas. Pediatra. Sección de Infectología Pediátrica del Hospital Universitario Parc Tauli-Sabadell. Barcelona. Profesor asociado. Universidad Autónoma de Barcelona.
- -
Irene Rivero Calle. Pediatra. Sección de Pediatría Clínica, Infectológica y Traslacional. Hospital Clínico Universitario de Santiago de Compostela. La Coruña. Miembro del Grupo Genética, Vacunas, Infecciones y Pediatría (GENVIP).
- -
Jesús Ruiz-Contreras. Pediatra. Servicio de Pediatría. Hospital Universitario 12 de octubre. Madrid. Departamento de Pediatría. Facultad de Medicina. Universidad Complutense de Madrid.
- -
Pepe Serrano Marchuet. Pediatra. Equipo de Pediatría territorial del Garraf. Barcelona.
Este artículo no ha contado con financiación externa a la logística facilitada por la AEP.



![Calendario de inmunizaciones de la Asociación Española de Pediatría: recomendaciones 2023. (1) Vacuna antihepatitis B (HB). Tres dosis, en forma de vacuna hexavalente, a los 2, 4 y 11 meses de edad. Los hijos de madres HBsAg positivas recibirán en las primeras 12 horas de vida una dosis de vacuna y otra de IGHB (0,5 ml). Si la serología materna fuera desconocida, deberá administrarse la vacuna en las primeras 12 horas y realizar serología y si resultara positiva administrar 0,5 ml de IGHB, preferentemente en las primeras 72 horas de vida. Los lactantes vacunados al nacimiento seguirán el calendario habitual del primer año, por lo que recibirán 4 dosis de HB. A los niños y adolescentes no vacunados se les administrarán 3 dosis de vacuna monocomponente según la pauta 0, 1 y 6 meses. (2) Vacuna frente a la difteria, el tétanos y la tosferina (DTPa/Tdpa). Cinco dosis: primovacunación con 2 dosis, a los 2 y 4 meses, de vacuna DTPa-VPI-Hib-HB (hexavalente); refuerzo a los 11 meses (3.ª dosis) con DTPa (hexavalente); a los 6 años (4.ª dosis) con el preparado de carga estándar (DTPa-VPI), preferible al de baja carga antigénica de difteria y tosferina (Tdpa-VPI) y a los 12-14 años (5.ª dosis) con Tdpa. En los casos vacunados anteriormente con la pauta 3+1 (2, 4, 6 y 18 meses), en la dosis de los 6 años se podrá utilizar Tdpa, ya que no precisan nuevas dosis de vacuna frente a la poliomielitis. (3) Vacuna antipoliomielítica inactivada (VPI). Cuatro dosis: primovacunación con 2 dosis, a los 2 y 4 meses, y refuerzos a los 11 meses (con hexavalentes) y a los 6 años (con DTPa-VPI o Tdpa-VPI). En los casos vacunados anteriormente con la pauta 3+1 (2, 4, 6 y 18 meses), no se precisan más dosis de VPI. (4) Vacuna conjugada frente al Haemophilus influenzae tipo b (Hib). Tres dosis: primovacunación a los 2 y 4 meses y refuerzo a los 11 meses con hexavalentes. (5) Vacuna conjugada frente al neumococo (VNC). Tres dosis: las 2 primeras a los 2 y 4 meses, con un refuerzo a partir de los 11 meses de edad. La vacuna recomendada en nuestro país por el CAV-AEP sigue siendo la VNC13. (6) Vacuna frente al rotavirus (RV). Dos o tres dosis de vacuna frente al rotavirus: a los 2 y 3-4 meses con la vacuna monovalente; o a los 2, 3 y 4 meses o 2, 3-4 y 5-6 meses con la pentavalente. Para minimizar el riesgo raro de invaginación intestinal, la pauta ha de iniciarse entre las 6 y las 12 semanas de vida y debe completarse antes de las 24 semanas en la monovalente y de las 33 en la pentavalente. El intervalo mínimo entre dosis es de 4 semanas. Ambas vacunas se pueden coadministrar con cualquier otra (a excepción de la vacuna de la poliomielitis oral, no comercializada en España). (7) Vacuna frente al meningococo B (MenB). 4CMenB. Tres dosis: se iniciará a los 2 meses de edad, con 2 dosis separadas por 2 meses y un refuerzo a partir de los 12 meses, siempre que hayan pasado, al menos, 6 meses de la última dosis de primoinmunización. Se puede coadministrar con las otras vacunas del calendario, aunque podría producir más fiebre; por lo que también se podría aplicar con una separación de 1 o 2 semanas con las otras vacunas inactivadas inyectables de primovacunación, para minimizar su posible reactogenicidad. No es necesaria la separación de 1 o 2 semanas con las vacunas MenACWY, triple vírica, varicela y rotavirus. Para el resto de las edades, la recomendación es de tipo individual con cualquiera de las dos vacunas (4CMenB o MenB-fHbp), respetando la edad mínima autorizada para cada una de ellas. También se recomienda a cualquier edad en grupos de riesgo: asplenia anatómica o funcional, déficit de factores de complemento, tratamiento con eculizumab o ravulizumab, receptores de trasplante de progenitores hematopoyéticos, infección por VIH, episodio previo de EMI por cualquier serogrupo y contactos de un caso índice de EMI por serogrupo B en el contexto de un brote epidémico. (8) Vacuna conjugada frente al meningococo C (MenC) y vacuna frente a los meningococos ACWY (MenACWY). Una dosis de vacuna conjugada MenC-TT a los 4 meses de edad. A los 12 meses y a los 11-13 años se recomienda una dosis de la vacuna MenACWY, aconsejándose un rescate progresivo hasta los 18 años. En CC. AA. donde no está incluida la vacuna MenACWY a los 12 meses en calendario sistemático, si los padres deciden no administrarla, deberá aplicarse la MenC-TT financiada por su comunidad. Para el resto de las edades, la recomendación es de tipo individual. También se sigue recomendando especialmente MenACWY para niños y adolescentes que vayan a residir en países en los que la vacuna se indique a esas edades (Canadá, EE. UU., Argentina, Chile, Arabia Saudí, Australia, Andorra, Austria, Bélgica, Chipre, Grecia, Irlanda, Italia, Malta, Países Bajos, Reino Unido, República Checa, San Marino y Suiza) y para los que tengan factores de riesgo de EMI: asplenia anatómica o funcional, déficit de factores del complemento, tratamiento con eculizumab o ravulizumab, receptores de trasplante de progenitores hematopoyéticos, infección por VIH, episodio previo de EMI por cualquier serogrupo y contactos de un caso índice de EMI por serogrupo A, C, W o Y en el contexto de un brote epidémico. Los viajeros a La Meca por razones religiosas y al llamado cinturón de la meningitis africano durante la estación seca deben recibir también MenACWY. (9) Vacuna frente a la gripe. Se recomienda esta vacunación para todos los niños de 6 a 59 meses de edad con vacunas inactivadas por vía intramuscular (algún preparado admite también la vía subcutánea profunda), o con vacuna atenuada intranasal, esta última a partir de los 2 años de edad. En niños menores de 9 años no vacunados en otras campañas se aplicarán dos dosis separadas por 4 semanas; posteriormente precisarán una sola dosis para el resto de las campañas. La dosis es de 0,5 ml intramuscular en las inactivadas y de 0,1 ml en cada fosa nasal para la atenuada. También se recomienda para todos los grupos de riesgo y convivientes a partir de 6 meses de edad. Para consultar los grupos de riesgo de esta vacuna se puede acceder al Manual de vacunas en línea. (10) Vacuna frente al sarampión, la rubeola y la parotiditis (SRP). Dos dosis de vacuna del sarampión, rubeola, y parotiditis (triple vírica). La 1.ª a los 12 meses y la 2.ª a los 3-4 años de edad. La 2.ª dosis se podría aplicar en forma de vacuna tetravírica (SRPV). En pacientes susceptibles fuera de las edades anteriores, se recomienda la vacunación con 2 dosis de SRP con un intervalo de, al menos, un mes. (11) Vacuna frente a la varicela (Var). Dos dosis: la 1.ª a los 15 meses (también es aceptable a partir de los 12 meses de edad) y la 2.ª a los 3-4 años de edad. La 2.ª dosis se podría aplicar en forma de vacuna tetravírica (SRPV). En pacientes susceptibles fuera de las edades anteriores, se recomienda vacunación con 2 dosis de vacuna monocomponente con un intervalo de, al menos, un mes, siendo recomendable 12 semanas en los menores de 13 años. (12) Vacuna frente al SARS-CoV-2. Actualmente están autorizadas dos vacunas en nuestro país a partir de los 12 años, Comirnaty-30 mcg (Pfizer) y Spikevax-100 mcg (Moderna) y otras dos más para menores de esa edad: una entre los 5 y los 11 años, Comirnaty, con menor cantidad de antígeno (Comirnaty-10 mcg), y otra, Spikevax-100 mcg (Moderna) con la mitad de la dosis (0,25 ml) entre los 6 y los 11 años. Se aplicarán dos dosis. La Comisión de Salud Pública de España ha decidido que la separación entre las 2 dosis de Comirnaty 10 mcg y de Spikevax-100 mcg (0,25 ml) en niños menores de 12 años sea de 8 semanas. Si se administran por error antes de ese intervalo, se considerarán válidas a partir de los 21 y 28 días de la primera dosis, respectivamente. Se pueden administrar con otras vacunas el mismo día o con la separación que se desee. En menores de 18 años no está indicada en la actualidad una tercera dosis (dosis de recuerdo), aunque sí en los niños y adolescentes a partir de los 5 años con condiciones de muy alto riesgo o que reciban tratamiento inmunosupresor, que recibirán una tercera (dosis adicional, a partir de 8 semanas tras la última dosis de primovacunación) y una cuarta dosis (dosis de recuerdo, a partir de 5 meses tras la dosis adicional). Se han autorizado por la EMA otras 2 vacunas: para niños de 6 meses a 4 años, Comirnaty-3 mcg (Pfizer) en 3 dosis y para niños entre 6 meses y 5 años, Spikevax-25 mcg (Moderna) en 2 dosis. La Comisión de Salud Pública ha aprobado la vacunación de los grupos de riesgo desde los 6 meses de edad con estas vacunas. (13) Vacunación sistemática universal frente al VPH, tanto de chicas como de chicos, a los 10-12 años, con dos dosis. Las vacunas disponibles en la actualidad son VPH2 y VPH9. Las dos están autorizadas en varones, aunque con VPH2 es aún escasa la experiencia en ellos. Pautas de vacunación: dos dosis (0 y 6 meses) entre 9 y 14 años y pauta de tres dosis [0,1-2 (según preparado vacunal) y 6 meses] para ≥15 años. Es posible su coadministración con las vacunas MenC, MenACWY, hepatitis A y B y Tdpa. No hay datos de coadministración con la vacuna de la varicela, aunque no debería plantear problemas. (14) Virus respiratorio sincitial. Se recomienda nirsevimab (anticuerpo anti-VRS) en todos los recién nacidos y lactantes menores de seis meses y su administración anual a niños menores de dos años con enfermedades subyacentes que aumenten el riesgo de infección grave por VRS. Calendario de inmunizaciones de la Asociación Española de Pediatría: recomendaciones 2023. (1) Vacuna antihepatitis B (HB). Tres dosis, en forma de vacuna hexavalente, a los 2, 4 y 11 meses de edad. Los hijos de madres HBsAg positivas recibirán en las primeras 12 horas de vida una dosis de vacuna y otra de IGHB (0,5 ml). Si la serología materna fuera desconocida, deberá administrarse la vacuna en las primeras 12 horas y realizar serología y si resultara positiva administrar 0,5 ml de IGHB, preferentemente en las primeras 72 horas de vida. Los lactantes vacunados al nacimiento seguirán el calendario habitual del primer año, por lo que recibirán 4 dosis de HB. A los niños y adolescentes no vacunados se les administrarán 3 dosis de vacuna monocomponente según la pauta 0, 1 y 6 meses. (2) Vacuna frente a la difteria, el tétanos y la tosferina (DTPa/Tdpa). Cinco dosis: primovacunación con 2 dosis, a los 2 y 4 meses, de vacuna DTPa-VPI-Hib-HB (hexavalente); refuerzo a los 11 meses (3.ª dosis) con DTPa (hexavalente); a los 6 años (4.ª dosis) con el preparado de carga estándar (DTPa-VPI), preferible al de baja carga antigénica de difteria y tosferina (Tdpa-VPI) y a los 12-14 años (5.ª dosis) con Tdpa. En los casos vacunados anteriormente con la pauta 3+1 (2, 4, 6 y 18 meses), en la dosis de los 6 años se podrá utilizar Tdpa, ya que no precisan nuevas dosis de vacuna frente a la poliomielitis. (3) Vacuna antipoliomielítica inactivada (VPI). Cuatro dosis: primovacunación con 2 dosis, a los 2 y 4 meses, y refuerzos a los 11 meses (con hexavalentes) y a los 6 años (con DTPa-VPI o Tdpa-VPI). En los casos vacunados anteriormente con la pauta 3+1 (2, 4, 6 y 18 meses), no se precisan más dosis de VPI. (4) Vacuna conjugada frente al Haemophilus influenzae tipo b (Hib). Tres dosis: primovacunación a los 2 y 4 meses y refuerzo a los 11 meses con hexavalentes. (5) Vacuna conjugada frente al neumococo (VNC). Tres dosis: las 2 primeras a los 2 y 4 meses, con un refuerzo a partir de los 11 meses de edad. La vacuna recomendada en nuestro país por el CAV-AEP sigue siendo la VNC13. (6) Vacuna frente al rotavirus (RV). Dos o tres dosis de vacuna frente al rotavirus: a los 2 y 3-4 meses con la vacuna monovalente; o a los 2, 3 y 4 meses o 2, 3-4 y 5-6 meses con la pentavalente. Para minimizar el riesgo raro de invaginación intestinal, la pauta ha de iniciarse entre las 6 y las 12 semanas de vida y debe completarse antes de las 24 semanas en la monovalente y de las 33 en la pentavalente. El intervalo mínimo entre dosis es de 4 semanas. Ambas vacunas se pueden coadministrar con cualquier otra (a excepción de la vacuna de la poliomielitis oral, no comercializada en España). (7) Vacuna frente al meningococo B (MenB). 4CMenB. Tres dosis: se iniciará a los 2 meses de edad, con 2 dosis separadas por 2 meses y un refuerzo a partir de los 12 meses, siempre que hayan pasado, al menos, 6 meses de la última dosis de primoinmunización. Se puede coadministrar con las otras vacunas del calendario, aunque podría producir más fiebre; por lo que también se podría aplicar con una separación de 1 o 2 semanas con las otras vacunas inactivadas inyectables de primovacunación, para minimizar su posible reactogenicidad. No es necesaria la separación de 1 o 2 semanas con las vacunas MenACWY, triple vírica, varicela y rotavirus. Para el resto de las edades, la recomendación es de tipo individual con cualquiera de las dos vacunas (4CMenB o MenB-fHbp), respetando la edad mínima autorizada para cada una de ellas. También se recomienda a cualquier edad en grupos de riesgo: asplenia anatómica o funcional, déficit de factores de complemento, tratamiento con eculizumab o ravulizumab, receptores de trasplante de progenitores hematopoyéticos, infección por VIH, episodio previo de EMI por cualquier serogrupo y contactos de un caso índice de EMI por serogrupo B en el contexto de un brote epidémico. (8) Vacuna conjugada frente al meningococo C (MenC) y vacuna frente a los meningococos ACWY (MenACWY). Una dosis de vacuna conjugada MenC-TT a los 4 meses de edad. A los 12 meses y a los 11-13 años se recomienda una dosis de la vacuna MenACWY, aconsejándose un rescate progresivo hasta los 18 años. En CC. AA. donde no está incluida la vacuna MenACWY a los 12 meses en calendario sistemático, si los padres deciden no administrarla, deberá aplicarse la MenC-TT financiada por su comunidad. Para el resto de las edades, la recomendación es de tipo individual. También se sigue recomendando especialmente MenACWY para niños y adolescentes que vayan a residir en países en los que la vacuna se indique a esas edades (Canadá, EE. UU., Argentina, Chile, Arabia Saudí, Australia, Andorra, Austria, Bélgica, Chipre, Grecia, Irlanda, Italia, Malta, Países Bajos, Reino Unido, República Checa, San Marino y Suiza) y para los que tengan factores de riesgo de EMI: asplenia anatómica o funcional, déficit de factores del complemento, tratamiento con eculizumab o ravulizumab, receptores de trasplante de progenitores hematopoyéticos, infección por VIH, episodio previo de EMI por cualquier serogrupo y contactos de un caso índice de EMI por serogrupo A, C, W o Y en el contexto de un brote epidémico. Los viajeros a La Meca por razones religiosas y al llamado cinturón de la meningitis africano durante la estación seca deben recibir también MenACWY. (9) Vacuna frente a la gripe. Se recomienda esta vacunación para todos los niños de 6 a 59 meses de edad con vacunas inactivadas por vía intramuscular (algún preparado admite también la vía subcutánea profunda), o con vacuna atenuada intranasal, esta última a partir de los 2 años de edad. En niños menores de 9 años no vacunados en otras campañas se aplicarán dos dosis separadas por 4 semanas; posteriormente precisarán una sola dosis para el resto de las campañas. La dosis es de 0,5 ml intramuscular en las inactivadas y de 0,1 ml en cada fosa nasal para la atenuada. También se recomienda para todos los grupos de riesgo y convivientes a partir de 6 meses de edad. Para consultar los grupos de riesgo de esta vacuna se puede acceder al Manual de vacunas en línea. (10) Vacuna frente al sarampión, la rubeola y la parotiditis (SRP). Dos dosis de vacuna del sarampión, rubeola, y parotiditis (triple vírica). La 1.ª a los 12 meses y la 2.ª a los 3-4 años de edad. La 2.ª dosis se podría aplicar en forma de vacuna tetravírica (SRPV). En pacientes susceptibles fuera de las edades anteriores, se recomienda la vacunación con 2 dosis de SRP con un intervalo de, al menos, un mes. (11) Vacuna frente a la varicela (Var). Dos dosis: la 1.ª a los 15 meses (también es aceptable a partir de los 12 meses de edad) y la 2.ª a los 3-4 años de edad. La 2.ª dosis se podría aplicar en forma de vacuna tetravírica (SRPV). En pacientes susceptibles fuera de las edades anteriores, se recomienda vacunación con 2 dosis de vacuna monocomponente con un intervalo de, al menos, un mes, siendo recomendable 12 semanas en los menores de 13 años. (12) Vacuna frente al SARS-CoV-2. Actualmente están autorizadas dos vacunas en nuestro país a partir de los 12 años, Comirnaty-30 mcg (Pfizer) y Spikevax-100 mcg (Moderna) y otras dos más para menores de esa edad: una entre los 5 y los 11 años, Comirnaty, con menor cantidad de antígeno (Comirnaty-10 mcg), y otra, Spikevax-100 mcg (Moderna) con la mitad de la dosis (0,25 ml) entre los 6 y los 11 años. Se aplicarán dos dosis. La Comisión de Salud Pública de España ha decidido que la separación entre las 2 dosis de Comirnaty 10 mcg y de Spikevax-100 mcg (0,25 ml) en niños menores de 12 años sea de 8 semanas. Si se administran por error antes de ese intervalo, se considerarán válidas a partir de los 21 y 28 días de la primera dosis, respectivamente. Se pueden administrar con otras vacunas el mismo día o con la separación que se desee. En menores de 18 años no está indicada en la actualidad una tercera dosis (dosis de recuerdo), aunque sí en los niños y adolescentes a partir de los 5 años con condiciones de muy alto riesgo o que reciban tratamiento inmunosupresor, que recibirán una tercera (dosis adicional, a partir de 8 semanas tras la última dosis de primovacunación) y una cuarta dosis (dosis de recuerdo, a partir de 5 meses tras la dosis adicional). Se han autorizado por la EMA otras 2 vacunas: para niños de 6 meses a 4 años, Comirnaty-3 mcg (Pfizer) en 3 dosis y para niños entre 6 meses y 5 años, Spikevax-25 mcg (Moderna) en 2 dosis. La Comisión de Salud Pública ha aprobado la vacunación de los grupos de riesgo desde los 6 meses de edad con estas vacunas. (13) Vacunación sistemática universal frente al VPH, tanto de chicas como de chicos, a los 10-12 años, con dos dosis. Las vacunas disponibles en la actualidad son VPH2 y VPH9. Las dos están autorizadas en varones, aunque con VPH2 es aún escasa la experiencia en ellos. Pautas de vacunación: dos dosis (0 y 6 meses) entre 9 y 14 años y pauta de tres dosis [0,1-2 (según preparado vacunal) y 6 meses] para ≥15 años. Es posible su coadministración con las vacunas MenC, MenACWY, hepatitis A y B y Tdpa. No hay datos de coadministración con la vacuna de la varicela, aunque no debería plantear problemas. (14) Virus respiratorio sincitial. Se recomienda nirsevimab (anticuerpo anti-VRS) en todos los recién nacidos y lactantes menores de seis meses y su administración anual a niños menores de dos años con enfermedades subyacentes que aumenten el riesgo de infección grave por VRS.](https://static.elsevier.es/multimedia/16954033/0000009800000001/v3_202301100618/S1695403322002259/v3_202301100618/es/main.assets/thumbnail/gr1.jpeg?xkr=ue/ImdikoIMrsJoerZ+w95erwEulN6Tmh1xJpRhO+VE=)


