Los prematuros tardíos (PT) son un subgrupo de prematuros numeroso con riesgo de déficit en el desarrollo psicomotor (DPM). Muchas alteraciones sutiles pasan desapercibidas si no se emplean herramientas adecuadas de evaluación. El cuestionario para padres Ages & Stages Questionnaires3® (ASQ3®) parece sencillo y útil para la detección de riesgo en el DPM y está recomendado por sociedades científicas que estudian a los PT.
ObjetivosEvaluar el riesgo de déficit en el DPM a los 5años de edad en PT y compararlos con recién nacidos a término (RNAT) con ASQ3.
Pacientes y métodosSe recogieron los PT nacidos en un hospital de tercer nivel en el año 2010 y 2RNAT del mismo sexo por cada PT. Se compararon variables de morbilidad prenatal y neonatal. A los 5años se solicitó a sus familias (excluyendo aquellos con otros riesgos neurológicos) completar ASQ3. Se determinó el punto de corte para la puntuación total de ASQ3 que discriminará el riesgo de déficit del DPM mediante un análisis ROC. El punto de corte para determinar alteración en cada dominio se obtuvo según el manual ASQ3.
ResultadosASQ3 fue completado por 88PT (47%) y 131RNAT (35%). Todas las puntuaciones medias globales y por dominios fueron menores en PT, sin encontrar diferencias significativas entre ambos grupos. Siete PT tuvieron riesgo de déficit del DPM (≤253 puntos) frente a 4RNAT, sin diferencia significativa. Un total de 195PT tuvieron mayor patología materna, fetal y neonatal que RNAT (n=390). En el análisis univariante el sexo varón y el crecimiento intrauterino restringido (CIR) fueron factores asociados al riesgo de déficit del DPM y en el multivariante solo CIR.
ConclusiónEl riesgo de déficit en el DPM entre PT y RNAT a los 5años parece no evidenciarse con diferencias significativas entre ambos, siendo los valores obtenidos en el ASQ3 ligeramente inferiores en los PT. Sexo varón y CIR parecen influir negativamente en este riesgo.
Late prematures (LP) belong to a subgroup of many premature babies with a risk of delayed psychomotor development (PMD). Many subtle changes pass unnoticed if adequate assessment tools are not used. The Ages & Stages Questionnaires 3® (ASQ3®) for parents appears simple and useful for the detection of risk of impairment of PMD, and is recommended by scientific societies that study LP.
ObjectivesTo evaluate the risk of impaired PMD in LP at 5years-old, and compare them with term newborns (TNB) using the ASQ3.
Patients and methodsData were collected on the LP born in a third level hospital in 2010, as well as 2TNB of the same gender for each LP. The prenatal and postnatal morbidity variables were compared. At 5years, their families (excluding those with other neurological risks) were asked to complete the ASQ3. The cut-off point was determined for the total score of the ASQ3 that would discriminate the risk of PMD impairment using ROC analysis. The cut-off point to determine a change in each domain was obtained according to the ASQ3 manual.
ResultsThe ASQ3 was completed for 88 (47%) and 131 (35%) TNB. All the overall mean scores and those for domains were lower in LP, with no significant differences found between the two groups. A risk of PMD impairment (≤253 points) was observed in 7LP compared to 4TNB, with no significant difference. More maternal, foetal, and neonatal illnesses were observed in 195LP than in the 390TNB. In the univariate analysis, male gender and restricted uterine growth (RUG) were factors associated with a risk of PMD impairment and only RUG in the multivariate analysis.
ConclusionThe risk of PMD impairment between LP and TNB at 5years appears not to be shown, with no significant differences between both, and with the values obtained in the ASQ3 being slightly lower in the LP. Male gender and RUG negatively influence this risk.
El término «prematuro tardío» (PT) fue definido en una conferencia en Estados Unidos en el año 2005 y tenía como objetivo optimizar la atención y la evolución de los embarazos y de los recién nacidos (RN) casi a término1. Esta definición engloba a los RN entre las 34 y las 37semanas de edad gestacional1,2.
La prevalencia de PT de embarazos únicos suponía entre el 3 y el 6% en países desarrollados en el año 2010 y constituía entre el 65 y el 75% de todos los prematuros3. Hasta hace poco tiempo se consideraba y trataba a los PT como RN a término (RNAT)1, pero en numerosos revisiones de los últimos 10años se ha demostrado inmadurez física neonatal y en el desarrollo posterior4,5. En consecuencia están expuestos a un mayor riesgo de complicaciones no solo en el periodo neonatal2,6 sino a largo plazo, presentando, entre otras, alteraciones en el desarrollo motor, cognitivo y comportamental7-10 que debemos tener presentes para detectarlas e intervenir precozmente y así mejorar la evolución a largo plazo de estos niños.
El proceso de maduración cerebral, incluidas la neurogénesis y la sinaptogénesis, ocurre durante las últimas semanas de gestación; además, el cerebro de un PT pesa el 65% del de un RNAT y está menos mielinizado11. En el nacimiento del PT este desarrollo cerebral intrauterino se interrumpe, siendo más vulnerable a factores que pueden afectar de forma negativa a esta maduración; entre ellos se han descrito el ingreso en neonatología con sus problemas médicos12,13, ausencia de lactancia materna14, bajo peso para la edad gestacional15, sexo varón16 y el ambiente sociocultural en el que se desarrollan17.
El desarrollo psicomotor (DPM) en la primera infancia es un factor determinante en el comportamiento y en el aprendizaje, y la evidencia sugiere que la detección precoz de problemas del DPM permite una intervención a tiempo y eficaz que puede modificar la historia natural de estas alteraciones18.
Las sociedades pediátricas recomiendan la aplicación universal de herramientas de cribado de DPM durante la primera infancia, especialmente cuando existen factores de riesgo como la prematuridad y alteraciones genéticas o metabólicas19. Algunas herramientas son complejas, requieren profesionales entrenados para su realización y suponen un tiempo excesivo. Como resultado, existe un riesgo de infradiagnóstico en niños con problemas de DPM sutiles, como ha sido publicado20.
Existen cuestionarios para padres que pueden detectar problemas de DPM. Uno de ellos es el Ages Stages Questionnaire (ASQ), que es un conjunto de cuestionarios sobre el desarrollo infantil diseñado por J. Squires y D. Bricker21 en la Universidad de Oregon y puede ser completado por los padres en 12-18min. En el año 2009 se revisó con la 3.a edición Ages & Stages Questionnaires3® (ASQ3®), que abarca desde los 2 a los 60meses de edad. Las propiedades varían según la edad de aplicación, el tipo de niños y el método de referencia, entre otros, y algunos estudios apuntan una moderada sensibilidad y una elevada especificidad22, con buena correlación con test más complejos22,23. ASQ ha mostrado ser válido y consistente como cribado tanto en niños RNAT como con factores de riesgo como la prematuridad24,25. Además de la facilidad de su aplicación, la implicación de los padres en la evaluación de sus niños parece positiva26. Actualmente es el test de cribado de desarrollo infantil completado por los padres más empleado en el mundo23. Ha sido traducido a varios idiomas, incluido el español23, y también se ha adaptado y validado en varios países, incluida la región de Galicia en España27. El grupo de seguimiento de niños PT de la Sociedad Española de Neonatología (SEN34-36) ha propuesto recientemente el uso de ASQ3 a los 2años y a los 4-5años en este grupo de niños28.
Pacientes y métodosEstudio de casos y controles que compara DPM a los 5años, y estudio descriptivo comparativo de morbilidad perinatal entre RNAT y PT. En un hospital terciario se revisaron las historias de todos los PT nacidos durante el año 2010, recogiendo datos prenatales y neonatales.
Para comparar la población de PT con la de RNAT se recogieron los mismos datos de dos RNAT del mismo sexo y nacidos inmediatamente (no más de 48h después) por cada PT. Los datos recogidos se encuentran en la tabla 1.
Datos recogidos prenatales, neonatales y exitus de los PT y RNAT en el estudio
| Problemas maternos durante la estación | Problemas de hipertensión maternos | Pre-eclampsia, hipertensión, eclampsia, síndrome HELLP |
| Alteración de glucosa materna | Diabetes gestacional, diabetes pregestacional | |
| Otros problemas maternos | Fiebre intraparto, infección aguda, infección crónica, enfermedad autoinmune, colestasis, drogas maternas | |
| Problemas fetales | Crecimiento intrauterino restringido | Diagnóstico por ecografía fetal |
| Alteración aguda de registro fetal | ||
| Alteraciones de la placenta y anejos | Desprendimiento de placenta, oligoamnios, polihidramnios | |
| Gestación múltiple | Dos o más fetos | |
| Parto | Eutócico, instrumental, cesárea | |
| Reanimación en paritorio | Necesidad de reanimación al nacimiento (presión positiva intermitente, intubación, masaje cardiaco y/o adrenalina) | |
| Test de Apgar | Al minuto y 5minutos de vida | |
| Sexo | ||
| Peso recién nacido | En gramos | |
| Ingreso en periodo neonatala | En unidad de neonatología y/o unidad de cuidados intensivos neonatales (UCIN) | |
| Días de estancia hospitalaria neonatal | ||
| Patología metabólica neonatal | Hipoglucemia | Glucosa <45mg/dl |
| Hipocalcemia | Calcio iónico <0,9mmol/l o calcio total <7mg/dl | |
| Hiperbilirrubinemia | Que precisó fototerapia | |
| Patología respiratoria neonatal | Enfermedad de membrana hialina (EMH) | Clínica y radiografía compatibles y/o necesidad de oxígeno |
| Taquipnea transitoria | Clínica respiratoria en las primeras 6h de vida sin cumplir EMH ni otra patología | |
| Fuga aérea pulmonar | En radiografía pulmonar | |
| Patología infecciosa neonatal relevante | Sepsis vertical confirmada | Se excluyeron infecciones locales leves |
| Sepsis nosocomial confirmada | ||
| Sepsis clínica >72h de vida | ||
| Sepsis clínica <72h de vida | ||
| Infección congénita | ||
| Malformaciones | Cardiaca, renal, digestiva, genital, otras (se excluyeron hernias y criptorquidias) | |
| Patología digestiva neonatal | Dificultad para alimentación oral, reflujo gastroesofágico, vómitos | |
| Otra patología neonatal | Renal | Insuficiencia renal aguda… |
| Neurológica | Convulsiones, hemorragia intraventricular… | |
| Hematológica | Anemia, isoinmunización, trombocitopenia… | |
| Hemodinámica | Hipotensión, hipertensión pulmonar del recién nacido, alteración del ritmo cardiaco, ductus arterioso persistente significativo… | |
| Exitus | Hasta los 5años de vida | Causas y día de exitus |
Los criterios de ingreso en la unidad neonatal fueron: <35 semanas de edad gestacional, <2.200g de peso al nacer y cualquier patología que requiriera tratamiento y/o vigilancia. En la UCIN: necesidad de cualquier tipo de soporte ventilatorio, hemodinámico, vía central, alteraciones metabólica, hematológica o endocrinológica graves, compromiso neurológico grave, malformaciones graves o con riesgo vital, <32 semanas de edad gestacional y <1.500g al nacer.
Para comparar el riesgo de déficit del DPM a los 5años se envió por correo postal el cuestionario ASQ3 de 60meses de edad a los PT y RNAT participantes en el estudio excluyendo exitus, malformaciones mayores, alteraciones del sistema nervioso central y síndromes genéticos. Los cuestionarios ASQ3 se enviaron cuando los sujetos cumplieron 60meses de edad y se completaron nunca más tarde de los 66meses de edad (periodo de validez). Además, se habilitaron un teléfono y una dirección de correo electrónico para resolver dudas.
El ASQ3 evalúa 5 dominios —comunicación, motor grueso y fino, resolución de problemas y socio-individual—, con 6 preguntas cada dominio y 3 respuestas posibles en cada pregunta: «sí» (10 puntos), «a veces» (5 puntos) y «todavía no» (0 puntos). Se tomó la puntación total de ASQ3 y de cada uno de los 5dominios.
Para determinar el punto de corte de la puntuación total del ASQ3 que fuera capaz de discriminar el riesgo de déficit de DPM de nuestra muestra se utilizó un análisis ROC. El punto se fijó en 253. Este método ya ha sido utilizado en otro estudio similar14. Además, se analizaron los niños con <2DE en cualquier dominio según el manual ASQ3.
En el análisis estadístico las variables cualitativas se describieron como porcentaje, y las cuantitativas como media y DE cuando se ajustaban a la normalidad, o como mediana y recorrido intercuartílico (IQR=p25-p75) si se separaban significativamente de ella (prueba Shapiro-Wilks, p<0,05).
El estudio se basa en la comparación de grupos independientes. Para comparar variables cualitativas se utilizó la prueba ji cuadrado (χ2), o la prueba Fisher si el número de efectivos esperados era menor de cinco en alguna casilla de tabla 2×2. Las variables numéricas se compararon mediante la prueba t de Student para grupos independientes. Si la distribución no era normal se utilizó la prueba U de Mann-Whitney.
Para analizar los factores asociados en niños con riesgo de déficit del DPM se empleó análisis de regresión logística univariante. Con las variables encontradas con p≤0,1 se realizó un análisis multivariante.
Se consideraron significativas las diferencias con probabilidad aleatoria (p<0,05). Los análisis estadísticos se realizaron con el programa informático SPSS versión 22.
El estudio fue aprobado por el Comité Ético de Investigación del Hospital, y los padres de los participantes dieron por escrito su consentimiento informado.
ResultadosDe los 2.565 RN durante el año 2010, 195 (7,6%) fueron PT. El total de prematuros en ese periodo fue de 276, lo que se traduce en que el 70,6% de estos son PT. Un total de 107PT fueron varones (54,9%).
La muestra de RNAT fue de 390 (dos por cada PT).
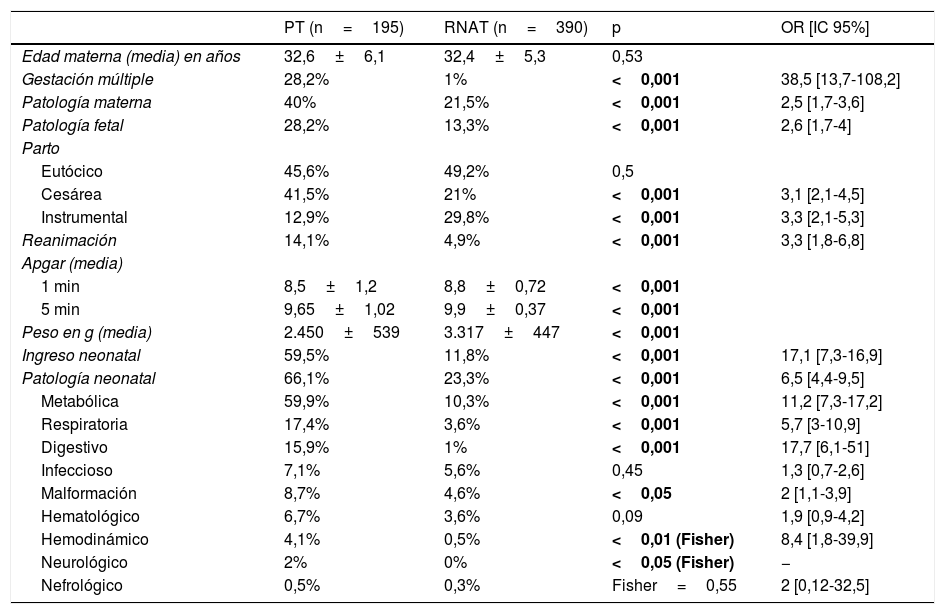
En la tabla 2 se pueden observar las características maternas, prenatales y neonatales de los grupos PT y RNAT. Dentro de la patología materna en el embarazo los problemas de hipertensión maternos, la diabetes gestacional y los tóxicos siguieron siendo estadísticamente mayores en PT. En cuanto a la patología fetal, el crecimiento intrauterino restringido (CIR), el riesgo de pérdida de bienestar fetal periparto y las alteraciones de placenta fueron superiores estadísticamente en PT.
Datos maternos, prenatales y periodo neonatal de ambos grupos PT y RNAT y diferencias estadísticas
| PT (n=195) | RNAT (n=390) | p | OR [IC 95%] | |
|---|---|---|---|---|
| Edad materna (media) en años | 32,6±6,1 | 32,4±5,3 | 0,53 | |
| Gestación múltiple | 28,2% | 1% | <0,001 | 38,5 [13,7-108,2] |
| Patología materna | 40% | 21,5% | <0,001 | 2,5 [1,7-3,6] |
| Patología fetal | 28,2% | 13,3% | <0,001 | 2,6 [1,7-4] |
| Parto | ||||
| Eutócico | 45,6% | 49,2% | 0,5 | |
| Cesárea | 41,5% | 21% | <0,001 | 3,1 [2,1-4,5] |
| Instrumental | 12,9% | 29,8% | <0,001 | 3,3 [2,1-5,3] |
| Reanimación | 14,1% | 4,9% | <0,001 | 3,3 [1,8-6,8] |
| Apgar (media) | ||||
| 1 min | 8,5±1,2 | 8,8±0,72 | <0,001 | |
| 5 min | 9,65±1,02 | 9,9±0,37 | <0,001 | |
| Peso en g (media) | 2.450±539 | 3.317±447 | <0,001 | |
| Ingreso neonatal | 59,5% | 11,8% | <0,001 | 17,1 [7,3-16,9] |
| Patología neonatal | 66,1% | 23,3% | <0,001 | 6,5 [4,4-9,5] |
| Metabólica | 59,9% | 10,3% | <0,001 | 11,2 [7,3-17,2] |
| Respiratoria | 17,4% | 3,6% | <0,001 | 5,7 [3-10,9] |
| Digestivo | 15,9% | 1% | <0,001 | 17,7 [6,1-51] |
| Infeccioso | 7,1% | 5,6% | 0,45 | 1,3 [0,7-2,6] |
| Malformación | 8,7% | 4,6% | <0,05 | 2 [1,1-3,9] |
| Hematológico | 6,7% | 3,6% | 0,09 | 1,9 [0,9-4,2] |
| Hemodinámico | 4,1% | 0,5% | <0,01 (Fisher) | 8,4 [1,8-39,9] |
| Neurológico | 2% | 0% | <0,05 (Fisher) | − |
| Nefrológico | 0,5% | 0,3% | Fisher=0,55 | 2 [0,12-32,5] |
1 min: Apgar al minuto de vida; 5 min: Apgar a los 5 min de vida; g: gramos; OR [IC]: odds ratio [intervalo de confianza del 95%]; PT: prematuro tardío; RNAT: recién nacido a término.
En negrita, p<0,05.
La estancia en la unidad de neonatología de los niños ingresados en el periodo neonatal fue superior estadísticamente (p<0,001) en los PT (mediana 12,5días [8-17,7]) en comparación con RNAT (mediana 5,5días [3-7]).
En cuanto a la mortalidad (se excluyeron síndromes malformativos mayores, cromosomopatías y metabolopatías), solo se encontraron 2 exitus, y ambos en el grupo PT (1%): una sepsis nosocomial en un PTCIR y una muerte súbita en otro PTCIR. No se encontraron diferencias significativas (pFisher=0,1).
Para la evaluación del riesgo de déficit del DPM a los 5años de edad se seleccionaron 187 de los 195PT (se excluyeron ocho PT: tres exitus, una malformación digestiva mayor, dos alteraciones del sistema nervioso central y dos síndromes genéticos). Del grupo de RNAT se seleccionaron 374.
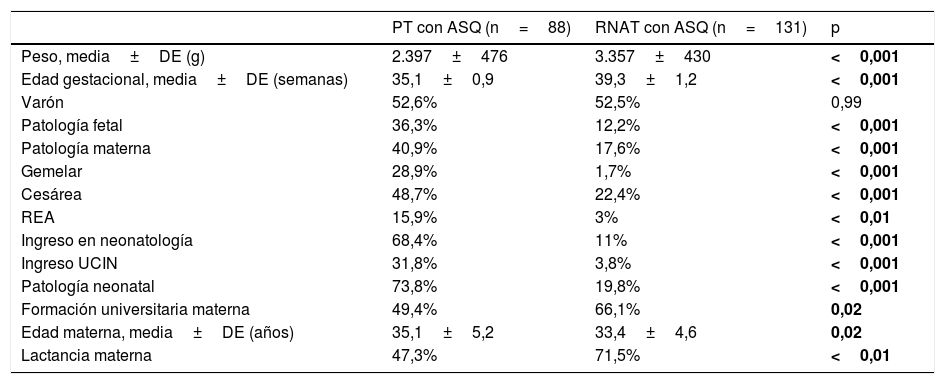
Respondieron al cuestionario ASQ3 88PT (47%) y 131RNAT (35%). Las características de los niños que respondieron se muestran en la tabla 3.
Características de los niños con ASQ3 completado y diferencias estadísticas
| PT con ASQ (n=88) | RNAT con ASQ (n=131) | p | |
|---|---|---|---|
| Peso, media±DE (g) | 2.397±476 | 3.357±430 | <0,001 |
| Edad gestacional, media±DE (semanas) | 35,1±0,9 | 39,3±1,2 | <0,001 |
| Varón | 52,6% | 52,5% | 0,99 |
| Patología fetal | 36,3% | 12,2% | <0,001 |
| Patología materna | 40,9% | 17,6% | <0,001 |
| Gemelar | 28,9% | 1,7% | <0,001 |
| Cesárea | 48,7% | 22,4% | <0,001 |
| REA | 15,9% | 3% | <0,01 |
| Ingreso en neonatología | 68,4% | 11% | <0,001 |
| Ingreso UCIN | 31,8% | 3,8% | <0,001 |
| Patología neonatal | 73,8% | 19,8% | <0,001 |
| Formación universitaria materna | 49,4% | 66,1% | 0,02 |
| Edad materna, media±DE (años) | 35,1±5,2 | 33,4±4,6 | 0,02 |
| Lactancia materna | 47,3% | 71,5% | <0,01 |
DE: desviación estándar; PT: prematuro tardío; REA: reanimación en paritorio; RNAT: recién nacido a término; UCIN: unidad de cuidados intensivos neonatales.
En negrita, p<0,05.
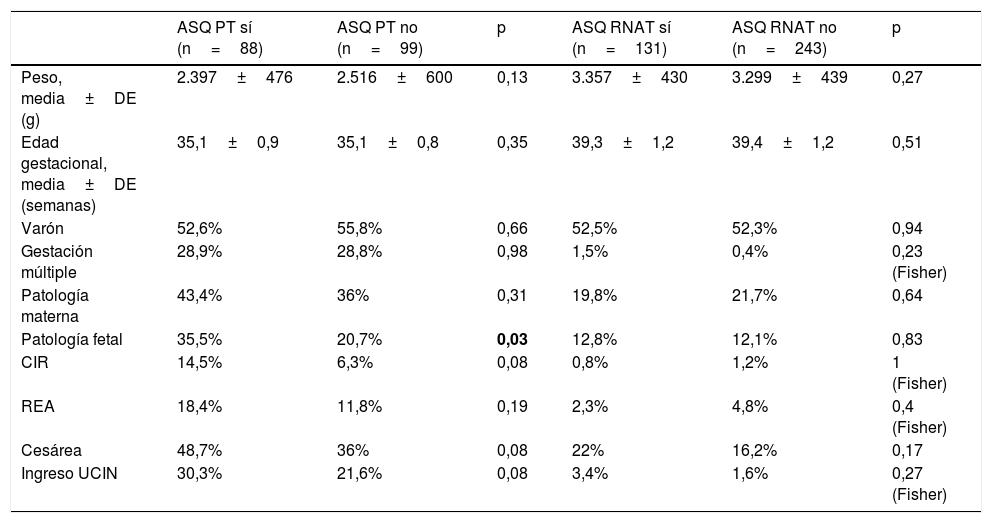
Entre los PT que respondieron al cuestionario y los que no lo hicieron no se encontraron diferencias estadísticas en variables perinatales que pudieran influir en el DPM, salvo en patología fetal de forma global (aunque en CIR, la principal patología fetal, no se encontró diferencia). En los RNAT no se encontraron diferencias en estos ítems (tabla 4).
Características y antecedentes de PT y RNAT que respondieron sí y no en el cuestionario ASQ3 y diferencias estadísticas
| ASQ PT sí (n=88) | ASQ PT no (n=99) | p | ASQ RNAT sí (n=131) | ASQ RNAT no (n=243) | p | |
|---|---|---|---|---|---|---|
| Peso, media±DE (g) | 2.397±476 | 2.516±600 | 0,13 | 3.357±430 | 3.299±439 | 0,27 |
| Edad gestacional, media±DE (semanas) | 35,1±0,9 | 35,1±0,8 | 0,35 | 39,3±1,2 | 39,4±1,2 | 0,51 |
| Varón | 52,6% | 55,8% | 0,66 | 52,5% | 52,3% | 0,94 |
| Gestación múltiple | 28,9% | 28,8% | 0,98 | 1,5% | 0,4% | 0,23 (Fisher) |
| Patología materna | 43,4% | 36% | 0,31 | 19,8% | 21,7% | 0,64 |
| Patología fetal | 35,5% | 20,7% | 0,03 | 12,8% | 12,1% | 0,83 |
| CIR | 14,5% | 6,3% | 0,08 | 0,8% | 1,2% | 1 (Fisher) |
| REA | 18,4% | 11,8% | 0,19 | 2,3% | 4,8% | 0,4 (Fisher) |
| Cesárea | 48,7% | 36% | 0,08 | 22% | 16,2% | 0,17 |
| Ingreso UCIN | 30,3% | 21,6% | 0,08 | 3,4% | 1,6% | 0,27 (Fisher) |
CIR: crecimiento intrauterino restringido; DE: desviación estándar; g: gramos; PT: prematuro tardío; REA: reanimación en paritorio; RNAT: recién nacido a término; UCIN: unidad de cuidados intensivos neonatales.
En negrita, p<0,05.
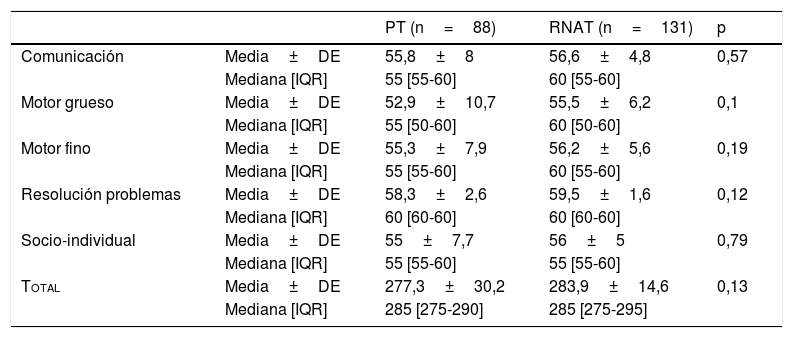
La media de puntuación global del ASQ3 y la de cada dominio fueron menores en los PT, aunque no se encontraron diferencias estadísticas en ninguno de ellos (tabla 5).
ASQ3 en PT y RNAT. Dominios y puntuación total y diferencias estadísticas
| PT (n=88) | RNAT (n=131) | p | ||
|---|---|---|---|---|
| Comunicación | Media±DE | 55,8±8 | 56,6±4,8 | 0,57 |
| Mediana [IQR] | 55 [55-60] | 60 [55-60] | ||
| Motor grueso | Media±DE | 52,9±10,7 | 55,5±6,2 | 0,1 |
| Mediana [IQR] | 55 [50-60] | 60 [50-60] | ||
| Motor fino | Media±DE | 55,3±7,9 | 56,2±5,6 | 0,19 |
| Mediana [IQR] | 55 [55-60] | 60 [55-60] | ||
| Resolución problemas | Media±DE | 58,3±2,6 | 59,5±1,6 | 0,12 |
| Mediana [IQR] | 60 [60-60] | 60 [60-60] | ||
| Socio-individual | Media±DE | 55±7,7 | 56±5 | 0,79 |
| Mediana [IQR] | 55 [55-60] | 55 [55-60] | ||
| Total | Media±DE | 277,3±30,2 | 283,9±14,6 | 0,13 |
| Mediana [IQR] | 285 [275-290] | 285 [275-295] |
DE: desviación estándar; IQR: recorrido intercuartílico, p25-p75; PT: prematuro tardío; RNAT: recién nacido a término.
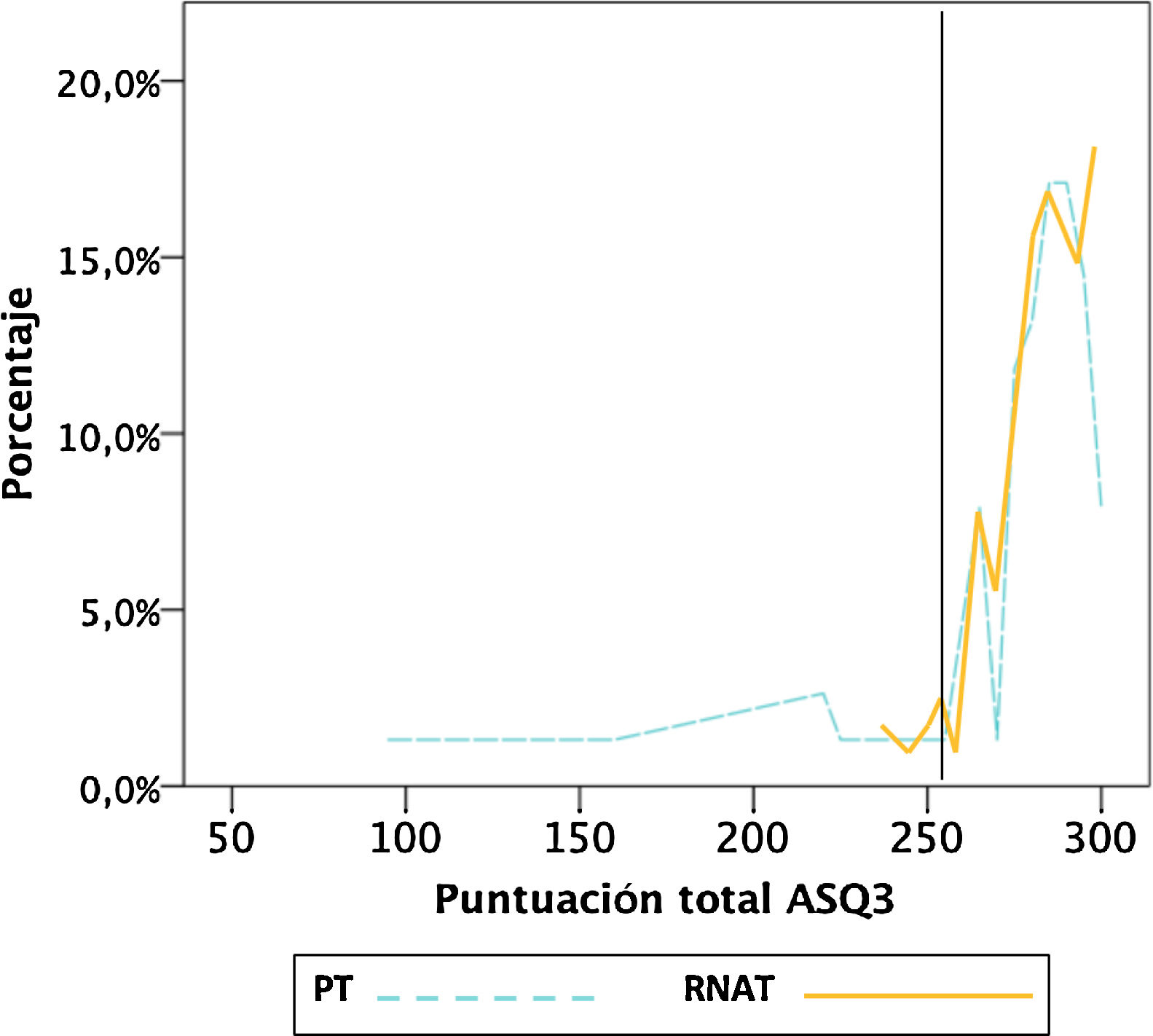
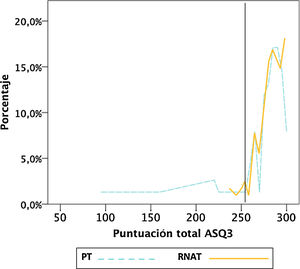
Al hacer un gráfico (fig. 1) con la distribución de porcentajes de la puntuación total del ASQ3, ambos grupos tenían una distribución equivalente a partir de 253 puntos, y bajo ese punto había más PT con puntuaciones más bajas. El análisis ROC mostró una sensibilidad superior al 81% para este punto. Además, ese punto de corte fue similar a la media menos 2DE de la población de referencia RNAT (254,7puntos). La prueba de Kolgomorov-Smirnov no mostró evidencia de distribución de porcentajes diferente en ambos grupos (p=0,74) por encima de ese punto.
Se diagnosticaron 11 niños con riesgo de déficit del DPM (≤253puntos). Siete fueron PT (7,9%) y cuatro RNAT (3%), superior en PT pero no significativo (pFisher=0,1; OR2,7 [0,8-9,7]). De estos 11niños, ocho tuvieron al menos algún dominio afectado (<2DE según el manual). De los siete PT, seis tuvieron algún dominio afectado, principalmente motor grueso y/o fino, y tres más de un dominio alterado. También se observaron alteraciones en los dominios socio-individual y comunicación no vistos en RNAT. De los cuatro RNAT, dos tuvieron algún dominio alterado, uno motor grueso y otro motor fino. No se encontró alteración en dominio resolución de problemas en ningún niño.
Los siete PT con riesgo de déficit del DPM fueron varones: en tres se diagnosticó hipoglucemia en el periodo neonatal (como única patología reseñable), tres tuvieron antecedente de CIR, y solo uno precisó ingreso en la unidad de cuidados intensivos neonatales (UCIN) por CIR de 1.500g.
En los cuatro RNAT con riesgo de déficit de DPM la mitad fueron varones: tres tuvieron algún antecedente neonatal, ninguno de ellos con ingreso en la UCIN: dos ictericias (uno con anemia) y un distrés respiratorio transitorio. No se encontró patología fetal o materna importante en estos niños.
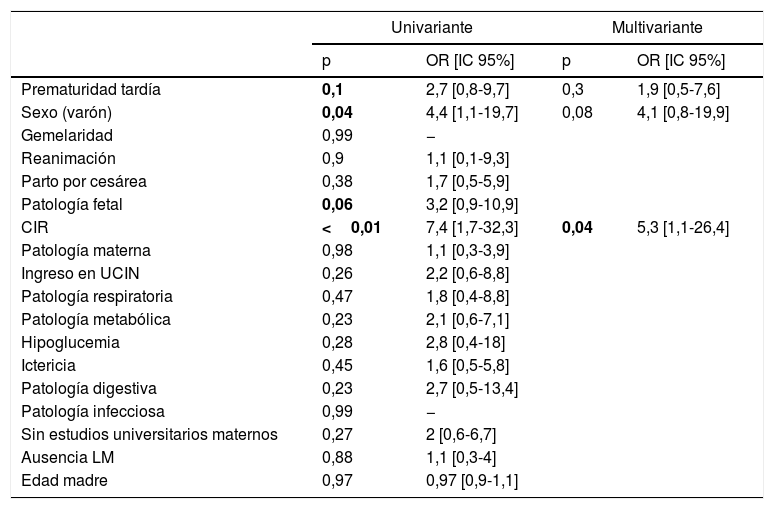
En el análisis univariante, que incluía posibles factores de riesgo de DPM, solo resultaron significativas las variables sexo (varón) y CIR (principal patología fetal). PT estuvo cerca de la significación. En el análisis multivariante (variables p≤0,1) solo CIR resultó ser significativo (tabla 6).
Regresión logística univariante y multivariante (incluyendo las variables del análisis univariante con p≤0,1) de posibles factores asociados a niños con riesgo de déficit en el desarrollo psicomotor con ASQ3
| Univariante | Multivariante | |||
|---|---|---|---|---|
| p | OR [IC 95%] | p | OR [IC 95%] | |
| Prematuridad tardía | 0,1 | 2,7 [0,8-9,7] | 0,3 | 1,9 [0,5-7,6] |
| Sexo (varón) | 0,04 | 4,4 [1,1-19,7] | 0,08 | 4,1 [0,8-19,9] |
| Gemelaridad | 0,99 | − | ||
| Reanimación | 0,9 | 1,1 [0,1-9,3] | ||
| Parto por cesárea | 0,38 | 1,7 [0,5-5,9] | ||
| Patología fetal | 0,06 | 3,2 [0,9-10,9] | ||
| CIR | <0,01 | 7,4 [1,7-32,3] | 0,04 | 5,3 [1,1-26,4] |
| Patología materna | 0,98 | 1,1 [0,3-3,9] | ||
| Ingreso en UCIN | 0,26 | 2,2 [0,6-8,8] | ||
| Patología respiratoria | 0,47 | 1,8 [0,4-8,8] | ||
| Patología metabólica | 0,23 | 2,1 [0,6-7,1] | ||
| Hipoglucemia | 0,28 | 2,8 [0,4-18] | ||
| Ictericia | 0,45 | 1,6 [0,5-5,8] | ||
| Patología digestiva | 0,23 | 2,7 [0,5-13,4] | ||
| Patología infecciosa | 0,99 | − | ||
| Sin estudios universitarios maternos | 0,27 | 2 [0,6-6,7] | ||
| Ausencia LM | 0,88 | 1,1 [0,3-4] | ||
| Edad madre | 0,97 | 0,97 [0,9-1,1] | ||
CIR: crecimiento intrauterino restringido; LM: lactancia materna durante al menos un mes; UCIN: unidad de cuidados intensivos neonatales.
En negrita, p<0,1 (univariante) y p<0,05 (multivariante).
Con las combinaciones de niños PT varones y PTCIR se encontró un riesgo significativo (p<0,01; OR7,1 [2-25,5] y p<0,01; OR8,3 [1,9-36,6], respectivamente).
DiscusiónEn este estudio la tasa de PT es similar a la encontrada en la literatura reciente de países desarrollados3. En 34 hospitales españoles29 entre 2011 y 2016 se encontró una tasa de PT del 5,9%, algo inferior a la nuestra (7,6%). Aunque durante el periodo neonatal los PT no tienen morbilidad tan importante como los prematuros de menor edad gestacional, el número total de PT es suficientemente grande para que supongan un impacto asistencial y económico reseñable en las unidades de neonatología5.
El incremento de PT en los últimos años se atribuyó a varias razones, incluidas la mayor vigilancia materna (detectando más problemas fetales y/o maternos e indicando finalización prematura del embarazo), mayor número de intervenciones obstétricas, embarazos multifetales, técnicas de reproducción asistida, edad materna y complicaciones1,2. En nuestro estudio se observó una mayor proporción de embarazos múltiples, problemas maternos y fetales en PT respecto a RNAT, lo que en muchos casos fue la causa prematura del parto y un posible factor asociado de morbilidad.
La inmadurez corporal y fisiológica de los PT puede llevar a complicaciones tanto a corto plazo como a largo plazo4,5,30. En este estudio se ha encontrado mayor morbilidad neonatal en comparación con RNAT, coincidente con otros estudios4.
Aunque en este estudio solo se encontró mortalidad en el grupo PT, no fue significativamente superior respecto a RNAT. Una muestra mayor probablemente mostraría resultados más concluyentes, como se indica en algunas revisiones5,30.
En cuanto al DPM en PT, las revisiones apuntan a mayores alteraciones motoras, cognitivas y comportamentales comparados con RNAT7-10. McGowan et al.9 realizaron una revisión sistemática de 10estudios que evaluaban el DPM en PT entre el año y los 7años de edad. Aunque la medición de las variables y la exclusión de algunos PT en los estudios fueron dispares, se observaron más alteraciones de DPM (definidas como parálisis cerebral, retraso general del desarrollo, discapacidad intelectual o problemas del lenguaje). Otra revisión con evaluaciones entre los 2 y los 36años encontró un pequeño pero significativo incremento de resultados adversos cognitivos y educacionales e hizo mención de que los PT podrían beneficiarse de un mayor seguimiento del DPM y escolar10. Las diferencias en desarrollo entre PT y RNAT en los primeros años de vida parecen más notables, pero a edades superiores no son tan marcadas y algunos estudios no han encontrado resultados concluyentes a los 8-11años31 y a los 4-15años (con PT «sanos»)32. Este «catch up» en el desarrollo en los primeros años de vida podría indicar que algunas alteraciones encontradas son transitorias, e incluso que algunas habilidades mejoran al entrar en la escuela33.
La frecuente falta de tiempo en la consulta pediátrica y las complejas herramientas «profesionales» para la evaluación del DPM pueden retrasar o infradiagnosticar a niños en riesgo, y ASQ parece una alternativa muy útil27.
Un estudio español realizado con ASQ en PT y RNAT a los 24 y 48meses observó que tener alterados al menos dos dominios a los 24meses se correlacionaba significativamente, especialmente en los PT, con riesgo de déficit del DPM a los 48meses. Además, a los 24meses solo se encontraron niños con dos o más dominios alterados en el grupo PT25.
Demestre et al.14 publicaron una menor puntuación media total y por dominios en PT respecto a RNAT a los 4años de edad, pero sin diferencias significativas, al igual que nuestro estudio. Sí detectaron significativamente mayor riesgo de déficit del DPM en PT (ASQ global ≤251 puntos). En nuestro estudio la proporción de PT con riesgo de déficit del DPM frente a RNAT fue más del doble, aunque no se encontró diferencia significativa. Probablemente sea necesaria una muestra mayor o que estas diferencias disminuyan a los 5años de edad. Los dominios motores fueron los más alterados en ambos grupos, pero se observaron más alteraciones en PT incluso con más de un dominio alterado en varios PT.
Es interesante recalcar que Hornman et al.33 han encontrado patrones de persistencia, aparición o desaparición en riesgo de déficit del DPM, y parece que varían según la edad, el niño y la intervención. Observaron patrones similares en RNAT y pretérminos moderados (32-35semanas de edad gestacional) entre los 4 y los 5años de edad, a diferencia de prematuros <32semanas, que tuvieron más problemas persistentes y emergentes. La diferencia significativa que se encontró a los 4años en prematuros moderados con peor ASQ global y dominio de comunicación respecto a RNAT desapareció a los 5años. Por otra parte, sí se observó un empeoramiento en dominios motores y mejoría en comunicación, apuntando que la combinación de menor actividad física en casa y el tiempo limitado de ejercicio en la escuela podría explicar estos problemas motores en prematuros tras la entrada en el colegio.
Kerstjens et al.34 apunta que, además de la propia prematuridad, las alteraciones en el DPM en PT están influenciadas por otros factores. Entre los más destacados están sexo varón, cesárea, preeclampsia, bajo peso para la edad gestacional, gemelaridad, ingreso en la UCIN, bajo nivel socioeconómico y ausencia de lactancia materna12,17,34-36. El ingreso en unidad de neonatología va asociado a los diferentes protocolos hospitalarios, y por ello parece más adecuado utilizar la variable ingreso en UCI neonatal. Similar a nuestro estudio, Kerstjens et al.13 no encontraron peores resultados de ASQ a los 43-49meses entre prematuros de 32-35semanas que precisaron y no UCIN, aunque estuvo cerca de la significación. En cambio, Baron et al.37 sí encontraron mayor déficit cognitivo (Differential Ability Scales 2.a edición en edad preescolar) en estos PT. Las patologías neonatales, como la patología respiratoria hipóxica, los problemas metabólicos y las sepsis frecuentes en la UCIN, podrían influir en el daño neurológico en los PT8. En nuestro estudio se observó hipoglucemia e hiperbilirrubinemia en el periodo neonatal en algunos niños con riesgo de déficit del DPM, aunque no se pudieron asociar a este riesgo, como indican otros estudios13,38. Otras variables asociadas en algunos estudios, como ausencia de lactancia materna14,17, cesárea35, patología materna gestacional como la preclampsia17, reanimación en paritorio39, educación parental16, edad materna baja40 o gemelaridad36, no se encontraron en nuestro estudio. Aun así, esos mismos estudios no encuentran siempre hallazgos iguales entre sí y esas variables no influyen, aparentemente, en el DPM de manera consistente.
Sí se apuntó a un mayor riesgo de déficit de DPM ser varón y, sobre todo, CIR, que aumentaría el riesgo que se supone a los niños PT. Estas dos variables son frecuentemente encontradas en varios estudios como factor asociado, aunque algunos usan la variable bajo peso para la edad gestacional, que su mayoría será CIR12,15,16,34,37.
Es posible que muchos de los hallazgos del DPM encontrados en los PT sean alteraciones sutiles y que con una simple vigilancia sin intervención desaparezcan. Pero parece adecuado detectarlas con este simple cuestionario y así monitorizar a este grupo de riesgo, como indica el grupo especializado español SEN34-3628. Además, los 4-5años serían el último peldaño para la detección de los problemas del DPM susceptible del beneficio de una terapia.
Al usar ASQ hay que reseñar que considerar el riesgo de déficit de DPM por dominios disminuye la sensibilidad y aumenta la especificidad, y es por ello que algunos autores optan, como es este estudio, por utilizar la puntuación total. En efecto, en este estudio se encontraron más niños con riesgo de déficit tomando el criterio de puntuación global alterada, y además estos incluyeron a todos los niños con alteración en algún dominio, lo que supondría a priori mayor sensibilidad con el criterio elegido.
Entre las limitaciones del estudio se encuentra la escasa respuesta de los niños que enviaron ASQ3. Podría influir el sesgo de que solo hubieran respondido los padres que estuvieran preocupados por algún problema de desarrollo de sus hijos. Por otro lado, no está recogida la posible terapia en los centros de atención temprana que podría influir en el desarrollo.
ConclusiónEl subgrupo de PT es numeroso, tiene mayor patología perinatal que los RNAT y necesita un seguimiento del DPM específico durante los primeros años de vida. Los factores sexo varón y problemas fetales como CIR parecen influir negativamente en el riesgo que ya tienen per se los PT. Este estudio apunta que, aunque a los 5años la diferencia con RNAT parece igualarse al no evidenciar diferencias significativas con ASQ3, existe una discreta desventaja del DPM en PT, ya que los valores obtenidos son algo menores y, además, existe más riesgo de alteraciones en dominios motores grueso y fino. Las alteraciones sutiles son difíciles de detectar, por ello el cuestionario ASQ puede ser una herramienta complementaria a la evaluación clínica, de fácil manejo, que implica a los padres y ayuda a descubrir los aspectos problemáticos para trabajar sobre ellos y minimizar las secuelas a largo plazo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.