En el presente trabajo, pretendemos definir el porcentaje de lactantes, hijos de madre VIH−+, pertenecientes a la cohorte prospectiva madrileña Fundación para la Investigación y la Prevención del SIDA en España y expuestos a tratamiento antirretroviral intraútero y perinatal, que presentan hiperlactacidemia u otros marcadores de posible daño mitocondrial, como hipertransaminasemia, o hiperamilasemia, durante los 3 primeros meses de vida, así como establecer una correlación entre los fármacos usados y el porcentaje de lactantes con dichos efectos adversos.
MétodosSe realizó el análisis de las analíticas disponibles de 623 niños no infectados nacidos en el periodo 2000–2005, fijándose los límites para hiperlactacidemia, hipertransaminasemia e hiperamilasemia de las tablas de toxicidad pediátrica para ensayos relativos al VIH (tablas ACTG), de manera global y para cada fármaco usado durante la gestación.
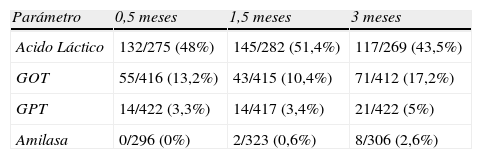
ResultadosLos porcentajes de niños con hiperlactacidemia a los 0,5, 1,5 y 3 meses fueron del 48, 51,4 y 43%, de entre los lactantes con analítica disponible el porcentaje de niños con elevación de GOT a los 0,5, 1,5 y 3 meses fue del 13,2, 10,4 y de 17,2%. Respectivamente, la proporción de lactantes con elevación de GPT fue del 3,3, 3,4 y 5%. No se encontró hiperamilasemia en ningún niño en el análisis de los 15 días de vida. La proporción de niños con hiperamilasemia a las 6 semanas y a los 3 meses fue de 0,6 y 2,6%. No hubo diferencias significativas al realizar la comparación de los porcentajes de hiperlactacidemia, hipertransaminasemia o hiperamilasemia según el fármaco usado intraútero.
ConclusionesHemos encontrado un alto porcentaje de lactantes expuestos a tratamiento antirretroviral intraútero con hiperlactacidemia, acorde con los resultados de otras series, sin que se haya comunicado morbimortalidad asociada a este fenómeno y no hemos podido asociar mayor prevalencia de hiperlactacidemia, hipertransaminasemia o hiperamilasemia a ninguno de los fármacos usados en la gestación.
In this study, we attempt to find out the percentage of uninfected infants born to HIV-infected women and exposed in-utero and perinatally to Antiretroviral Treatment (ART) that show high lactate levels, or any other mitochondrial damage markers (such as hypertransaminasaemia or hyperamylasaemia), during the first three months of age. We shall also establish whether certain drugs used in-utero are associated with higher lactate, transaminase or amylase levels.
MethodsWe analysed the available data from 623 uninfected infants born in the Spanish FIPSE cohort that were born in the period 2000–2005. The normal values for lactate, transaminases and amylase were set according to AIDS Clinical Groups Trials toxicity tables for infants.
ResultsThe percentages of children with high lactate levels at 0.5; 1.5 and 3 months of age were 48%, 51.4% and 43% among those infants with available data. Respectively, the percentages of children with high AST values were 13.2; 10.4 and 17.2%. The values for high ALT were 3.3%; 3.4% and 5%. The percentages for hyperamylasaemia were 0%; 0.6% and 2.6%. We found no significant difference among the drugs used in utero for the four analysed biochemical markers along the first three months of age.
ConclusionsWe have found a high proportion of hyperlactataemia among infants exposed in-utero to ART, as shown in other cohorts of similar characteristics. No morbidity or mortality was communicated to the cohort analysis group. No ART drug among those used in-utero was statistically associated with a higher proportion of high lactate levels in these infants.
Los efectos beneficiosos del tratamiento antirretroviral (TAR) durante la gestación, junto a otras medidas como la realización de cesárea programada en casos seleccionados, han reducido la transmisión vertical (TV) del virus de la inmunodeficiencia humana hasta cifras cercanas al 1% en los países occidentales1–3. Sin embargo, la preocupación actual concierne la toxicidad del TAR en la gestante, el feto y el RN4–6. Hay suficiente evidencia para definir efectos adversos del TAR como daño del ADN mitocondrial y la producción de otros efectos metabólicos como colestasis hepática, pancreatitis, lipodistrofia, dislipemias, resistencia insulínica y disminución de la densidad mineral ósea, además de efectos hematológicos como citopenias4–6. El propio virus VIH puede producir daño mitocondrial, produciendo niveles aumentados de citoquinas proinflamatorias, como el factor de necrosis tumoral ¿, que podrían inhibir la función mitocondrial y promover la apoptosis tumoral. Además, proteinas virulentas del virus han demostrado in vitro producir daño mitocondrial y apoptosis7–11.
Los inhibidores de la transcriptasa inversa análogos a los nucleósidos pueden producir daño mitocondrial inhibiendo la enzima polimerasa gamma, fundamental en la replicación del ADN mitocondrial. Ello conlleva una disminución del ADN mitocondrial8–10. In vitro, el orden de poder de inhibición de los fármacos es el siguiente: zalcitabina>>>didanosina>estavudina>zidovudina>>>tenofovir=emtricitabina=abacavir8. Este parece ser el mecanismo más importante y más estudiado, en relación con el aumento del acido láctico, asociado o no a alteraciones hepáticas. La hiperlactacidemia y otras determinaciones bioquímicas como la hipertransaminasemia, serían entonces los marcadores de daño mitocondrial. La toxicidad mitocondrial es la causa más importante de miopatía, neuropatía, lipoatrofia y acidosis láctica inducida por los inhibidores de la transcriptasa inversa análogos a los nucleósidos. Sin embargo, no parece estar tan clara la asociación con otras manifestaciones clínicas tales como la pancreatitis o la mielodepresión8–11. La hiperlactacidemia se define como la presencia de cifras mayores a 2,5mmol/l, aunque las manifestaciones clínicas suelen estar ausentes si las cifras de lactato no superan los 5mmol/l10. La hiperlactacidemia transitoria en niños expuestos a TAR en las primeras semanas de vida está bien definida en varios pequeños estudios, alcanzando cifras de hasta el 90% de los lactantes estudiados en algunos de ellos10,11. La clínica, si aparece, es inespecífica: astenia, pérdida de peso, nauseas, mialgias, disnea y otros. Puede encontrarse aumento moderado de las transaminasas y de las enzimas musculares, hipoalbuminemia, hiperglucemia, descenso del bicarbonato y en algunos casos, acidosis. En el estudio perinatal francés se describieron grupos de niños expuestos perinatalmente a inhibidores de la transcriptasa inversa análogos a los nucleósidos, que presentaban síntomas neurológicos, así como alteraciones bioquímicas y signos histológicos de disfunción mitocondrial (incidencia del 0,3% a los 18 meses de vida). En ese estudio, 8 niños expuestos perinatalmente a zidovudina, o zidovudina más lamivudina, presentaron signos de daño mitocondrial, 2 de los cuales fallecieron como consecuencia de dicho fenómeno12,13. Sin embargo, en otras series amplias, tanto europeas como africanas y americanas, que incluyen datos de más de 20.000 lactantes expuestos a TAR intraútero, no se han definido efectos adversos tan graves, ni mortalidad secundaria a ese fenómeno14–21.
En el presente trabajo, pretendemos definir el porcentaje de lactantes, hijos de madre VIH−+, pertenecientes a la cohorte prospectiva madrileña Fundación para la Investigación y la Prevención del SIDA en España (FIPSE) y expuestos a TAR intraútero y perinatal, que presentan hiperlactacidemia u otros marcadores de posible daño mitocondrial, como hipertransaminasemia o hiperamilasemia, durante los 3 primeros meses de vida, así como establecer una correlación entre los fármacos usados y el porcentaje de lactantes con dichos efectos adversos.
MétodosPoblación de estudio. La base FIPSELa cohorte FIPSE, proyecto 36531/05, se inició en el año 2000 con el objetivo de seguir prospectivamente a gestantes infectadas por el VIH y a sus hijos hasta la edad de 3 años, para determinar la tasa de TV dentro de la cohorte y para evaluar los efectos adversos y malformaciones congénitas del tratamiento antirretroviral tanto en la madre como en el feto, el RN y el lactante. La base constaba, cuando se realizó el análisis, de datos de 623 niños no infectados nacidos en el periodo 2000–2005 (desde el inicio de la base en mayo de 2000 hasta diciembre de 2005, eliminándose del análisis los 9 niños que resultaron infectados), recogidos en 8 hospitales de la Comunidad de Madrid (Hospital 12 de Octubre, Hospital La Paz, Hospital Gregorio Marañón, Hospital Universitario de Getafe, Hospital Severo Ochoa, Hospital de Móstoles, Hospital Príncipe de Asturias y Hospital Fundación Alcorcón). Se incluyeron en la base a las gestantes VIH positivas identificadas antes de la gestación, durante la misma o en las 48h posteriores al parto. Ningún lactante tomó lactancia materna.
VariablesEn el seguimiento de los niños se realiza una exploración física detallada, se registran las características antropométricas, el tratamiento recibido y los datos clínicos y analíticos correspondientes a cada visita. Se recogen datos bioquímicos (perfil bioquímico general y hepatorrenal) al nacimiento 0,5; 1,5 y 3 meses. Se consideró parto prematuro si presentaba <37 semanas de gestación. La anemia materna se definió, siempre según las tablas de toxicidad de los ACTG22, como una cifra de Hb en el tercer trimestre igual o inferior a 9,5g/dl. Se consideró madre adicta a drogas a las consumidoras de cocaina, heroína y/o metadona. Los valores límite para los distintos parámetros bioquímicos se establecieron según las tablas arriba mencionadas22 (a efectos prácticos, se consideró hiperlactacidemia a un valor superior a 2,5mmol/l; hipertransaminasemia a un valor superior a 50mU/ml, tanto para la ASAT (GOT) como para la ALAT (GPT) e hiperamilasemia a valores superiores a 160mU/ml.). No se analizaron los valores de lipasa por estar este valor recogido de manera muy irregular. Se realizó el análisis de los datos bioquímicos tomados a las 2 semanas de vida, a las 6 semanas de vida y a los 3 meses de edad. No se consideraron los análisis realizadas en las primeras 48h de vida por varias razones: en primer lugar, los valores neonatales de transaminasas y otros parámetros metabolicos suelen estar elevados y en segundo lugar, factores como el sufrimiento fetal pueden alterar los parámetros de funcionalidad mitocondrial, en las primeras horas de vida. No se han publicado los valores de GGT ya que este valor no indica tanto daño hepático como colestasis, fenómeno muy común y fisiológico en las primeras semanas de vida. Para el análisis de proporciones generales, se consideraron los 623 niños no infectados arriba mencionados, aunque no siempre se dispuso de muestras de este total, por lo que en cada análisis se indica el número de muestras disponibles. Para el análisis fármaco a fármaco, solo se escogieron los lactantes no prematuros y no expuestos intraútero a drogas de abuso.
Análisis estadísticoLas variables categóricas se expresaron como frecuencias y porcentajes mientras que las variables numéricas se presentan como medias, medianas, desviación típica y rango intercuartílico. Se compararon las variables categóricas usando el test X2 y X2 de tendencia lineal o el test exacto de Fischer cuando fue apropiado. Todos los valores de p son bilaterales y se consideró estadísticamente significativo p<0,05. Los IC se fijaron al 95%. Para el análisis de los datos se empleó el programa SPSS (Chicago, IL) para Windows, versión 15.0.
ResultadosCaracterísticas generalesLas características globales de la base, tanto las características basales de las madres como de los niños se indican en las tablas 1 y 2. La tasa de TV fue de 1,42 (IC95%: 0,71–2,68) La tasa de prematuridad fue de 22,5% (IC95%: 19,3–25,9). La tasa de niños con CIR fue del 26,8% (IC 23,4–30,5). La tasa entre la población de niños no prematuros fue de 19,8% (IC95% 16,3–23,8).
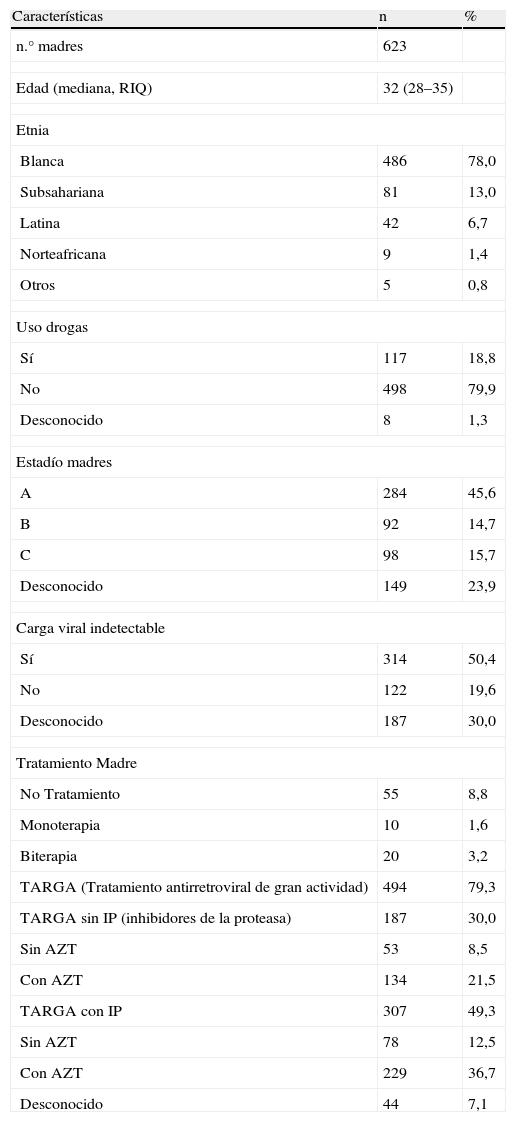
Características de las madres de la población estudiada
| Características | n | % |
| n.° madres | 623 | |
| Edad (mediana, RIQ) | 32 (28–35) | |
| Etnia | ||
| Blanca | 486 | 78,0 |
| Subsahariana | 81 | 13,0 |
| Latina | 42 | 6,7 |
| Norteafricana | 9 | 1,4 |
| Otros | 5 | 0,8 |
| Uso drogas | ||
| Sí | 117 | 18,8 |
| No | 498 | 79,9 |
| Desconocido | 8 | 1,3 |
| Estadío madres | ||
| A | 284 | 45,6 |
| B | 92 | 14,7 |
| C | 98 | 15,7 |
| Desconocido | 149 | 23,9 |
| Carga viral indetectable | ||
| Sí | 314 | 50,4 |
| No | 122 | 19,6 |
| Desconocido | 187 | 30,0 |
| Tratamiento Madre | ||
| No Tratamiento | 55 | 8,8 |
| Monoterapia | 10 | 1,6 |
| Biterapia | 20 | 3,2 |
| TARGA (Tratamiento antirretroviral de gran actividad) | 494 | 79,3 |
| TARGA sin IP (inhibidores de la proteasa) | 187 | 30,0 |
| Sin AZT | 53 | 8,5 |
| Con AZT | 134 | 21,5 |
| TARGA con IP | 307 | 49,3 |
| Sin AZT | 78 | 12,5 |
| Con AZT | 229 | 36,7 |
| Desconocido | 44 | 7,1 |
Características basales de las madres del estudio: Descripción breve de las características de las gestantes. AZT: zidovudina; IP: inhibidores de la proteasa; RIQ: rango intercuartil; TARGA: tratamiento antirretroviral de gran actividad.
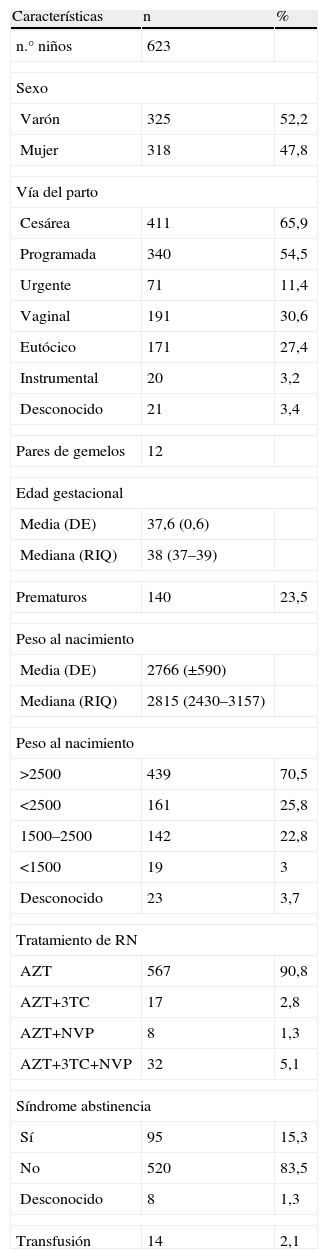
Características basales de los niños del estudio
| Características | n | % |
| n.° niños | 623 | |
| Sexo | ||
| Varón | 325 | 52,2 |
| Mujer | 318 | 47,8 |
| Vía del parto | ||
| Cesárea | 411 | 65,9 |
| Programada | 340 | 54,5 |
| Urgente | 71 | 11,4 |
| Vaginal | 191 | 30,6 |
| Eutócico | 171 | 27,4 |
| Instrumental | 20 | 3,2 |
| Desconocido | 21 | 3,4 |
| Pares de gemelos | 12 | |
| Edad gestacional | ||
| Media (DE) | 37,6 (0,6) | |
| Mediana (RIQ) | 38 (37–39) | |
| Prematuros | 140 | 23,5 |
| Peso al nacimiento | ||
| Media (DE) | 2766 (±590) | |
| Mediana (RIQ) | 2815 (2430–3157) | |
| Peso al nacimiento | ||
| >2500 | 439 | 70,5 |
| <2500 | 161 | 25,8 |
| 1500–2500 | 142 | 22,8 |
| <1500 | 19 | 3 |
| Desconocido | 23 | 3,7 |
| Tratamiento de RN | ||
| AZT | 567 | 90,8 |
| AZT+3TC | 17 | 2,8 |
| AZT+NVP | 8 | 1,3 |
| AZT+3TC+NVP | 32 | 5,1 |
| Síndrome abstinencia | ||
| Sí | 95 | 15,3 |
| No | 520 | 83,5 |
| Desconocido | 8 | 1,3 |
| Transfusión | 14 | 2,1 |
Características basales de los niños del estudio. AZT: zidovudina; NVP: nevirapina; RIQ: rango intercuartil; 3TC: lamivudina.
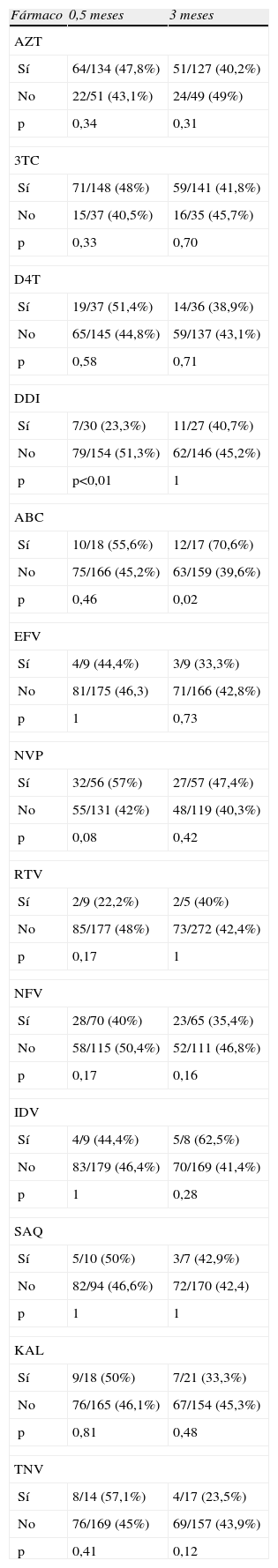
Los porcentajes de niños con hiperlactacidemia a los 0,5, 1,5 y 3 meses fueron del 48, 51,4 y 43%, de entre los lactantes con analítica disponible (tabla 3). No hubo diferencias significativas en el porcentaje de lactantes con hiperlactacidemia al dividirlos entre expuestos a AZT intraútero o no, en los análisis de los 3 primeros meses de vida. Tampoco hubo diferencias significativas en el análisis de fármacos antirretrovirales, es decir, no se encontró ninguna tendencia a la hiperlactacidemia con el empleo de ningún antiretroviral en concreto, en ninguno de los análisis a los 15 días de vida, mes y medio y 3 meses, con la excepción del análisis del empleo de 2 fármacos: abacavir, donde se observa más proporción de hiperlactacidemia en los expuestos, en el análisis del mes y medio de vida (73,7 vs. 47,6%, p=0,03) y a los 3 meses (70,6 vs. 39,6%, p=0,02). Asimismo, existe menor porcentaje de hiperlactacidemia en los que usaron ddI (23,3 vs. 51,3, p<0,01) en el análisis a los 0,5 meses. Los resultados del análisis a los 0,5–3 meses se exponen en tabla 4.
Proporción de lactantes con elevación de parámetros bioquímicos
| Parámetro | 0,5 meses | 1,5 meses | 3 meses |
| Acido Láctico | 132/275 (48%) | 145/282 (51,4%) | 117/269 (43,5%) |
| GOT | 55/416 (13,2%) | 43/415 (10,4%) | 71/412 (17,2%) |
| GPT | 14/422 (3,3%) | 14/417 (3,4%) | 21/422 (5%) |
| Amilasa | 0/296 (0%) | 2/323 (0,6%) | 8/306 (2,6%) |
Porcentajes de hiperlactacidemia en lactantes según el fármaco empleado intraútero
| Fármaco | 0,5 meses | 3 meses |
| AZT | ||
| Sí | 64/134 (47,8%) | 51/127 (40,2%) |
| No | 22/51 (43,1%) | 24/49 (49%) |
| p | 0,34 | 0,31 |
| 3TC | ||
| Sí | 71/148 (48%) | 59/141 (41,8%) |
| No | 15/37 (40,5%) | 16/35 (45,7%) |
| p | 0,33 | 0,70 |
| D4T | ||
| Sí | 19/37 (51,4%) | 14/36 (38,9%) |
| No | 65/145 (44,8%) | 59/137 (43,1%) |
| p | 0,58 | 0,71 |
| DDI | ||
| Sí | 7/30 (23,3%) | 11/27 (40,7%) |
| No | 79/154 (51,3%) | 62/146 (45,2%) |
| p | p<0,01 | 1 |
| ABC | ||
| Sí | 10/18 (55,6%) | 12/17 (70,6%) |
| No | 75/166 (45,2%) | 63/159 (39,6%) |
| p | 0,46 | 0,02 |
| EFV | ||
| Sí | 4/9 (44,4%) | 3/9 (33,3%) |
| No | 81/175 (46,3) | 71/166 (42,8%) |
| p | 1 | 0,73 |
| NVP | ||
| Sí | 32/56 (57%) | 27/57 (47,4%) |
| No | 55/131 (42%) | 48/119 (40,3%) |
| p | 0,08 | 0,42 |
| RTV | ||
| Sí | 2/9 (22,2%) | 2/5 (40%) |
| No | 85/177 (48%) | 73/272 (42,4%) |
| p | 0,17 | 1 |
| NFV | ||
| Sí | 28/70 (40%) | 23/65 (35,4%) |
| No | 58/115 (50,4%) | 52/111 (46,8%) |
| p | 0,17 | 0,16 |
| IDV | ||
| Sí | 4/9 (44,4%) | 5/8 (62,5%) |
| No | 83/179 (46,4%) | 70/169 (41,4%) |
| p | 1 | 0,28 |
| SAQ | ||
| Sí | 5/10 (50%) | 3/7 (42,9%) |
| No | 82/94 (46,6%) | 72/170 (42,4) |
| p | 1 | 1 |
| KAL | ||
| Sí | 9/18 (50%) | 7/21 (33,3%) |
| No | 76/165 (46,1%) | 67/154 (45,3%) |
| p | 0,81 | 0,48 |
| TNV | ||
| Sí | 8/14 (57,1%) | 4/17 (23,5%) |
| No | 76/169 (45%) | 69/157 (43,9%) |
| p | 0,41 | 0,12 |
Proporción de niños con hiperlactacidemia a los 0,5 meses de vida y a los 3 meses, según el fármaco usado en la gestación. ABC: abacavir; AZT: zidovudina; DDI: didanosina; D4T: estavudina; EFV: efavirenz; IDV: indinavir; KAL: kaletra; NFV: nelfinavir; NVP: nevirapina; RTV: ritonavir; SAQ: saquinavir; 3TC: lamivudina; TNF: tenofovir.
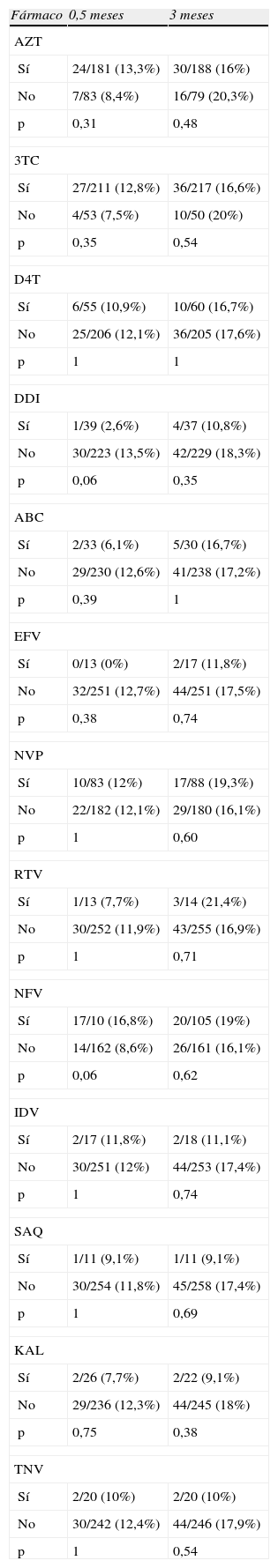
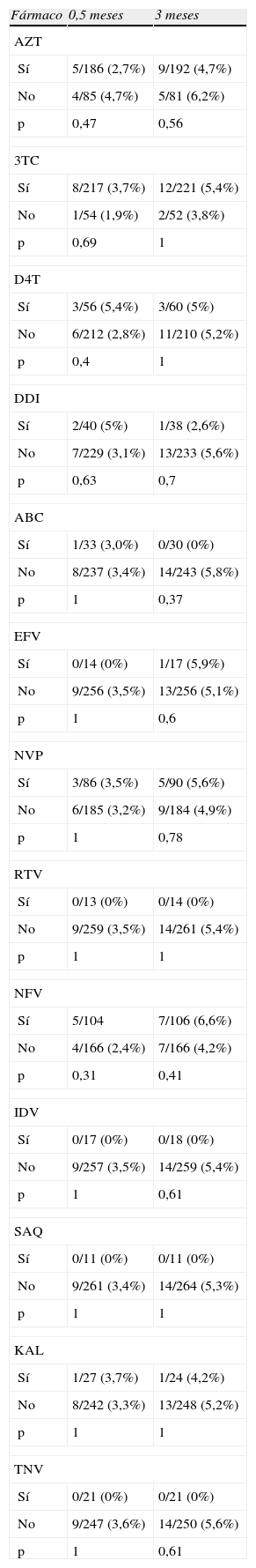
El porcentaje de niños con elevación de GOT a los 0,5, 1,5 y 3 meses fue del 13,2, 10,4 y de 17,2%. Respectivamente, la proporción de lactantes con elevación de GPT fue del 3,3, 3,4 y 5%. Ver tabla 4 (valores de GOT y GPT a los 0,5–3 meses). Respecto al tipo de fármaco, no se han encontrado diferencias significativas respecto a la proporción de lactantes con hipertransaminasemias según el tipo de fármaco empleado durante la gestación (tablas 5 y 6).
Porcentajes de hipertransaminemia (GOT) en lactantes según el fármaco empleado intraútero
| Fármaco | 0,5 meses | 3 meses |
| AZT | ||
| Sí | 24/181 (13,3%) | 30/188 (16%) |
| No | 7/83 (8,4%) | 16/79 (20,3%) |
| p | 0,31 | 0,48 |
| 3TC | ||
| Sí | 27/211 (12,8%) | 36/217 (16,6%) |
| No | 4/53 (7,5%) | 10/50 (20%) |
| p | 0,35 | 0,54 |
| D4T | ||
| Sí | 6/55 (10,9%) | 10/60 (16,7%) |
| No | 25/206 (12,1%) | 36/205 (17,6%) |
| p | 1 | 1 |
| DDI | ||
| Sí | 1/39 (2,6%) | 4/37 (10,8%) |
| No | 30/223 (13,5%) | 42/229 (18,3%) |
| p | 0,06 | 0,35 |
| ABC | ||
| Sí | 2/33 (6,1%) | 5/30 (16,7%) |
| No | 29/230 (12,6%) | 41/238 (17,2%) |
| p | 0,39 | 1 |
| EFV | ||
| Sí | 0/13 (0%) | 2/17 (11,8%) |
| No | 32/251 (12,7%) | 44/251 (17,5%) |
| p | 0,38 | 0,74 |
| NVP | ||
| Sí | 10/83 (12%) | 17/88 (19,3%) |
| No | 22/182 (12,1%) | 29/180 (16,1%) |
| p | 1 | 0,60 |
| RTV | ||
| Sí | 1/13 (7,7%) | 3/14 (21,4%) |
| No | 30/252 (11,9%) | 43/255 (16,9%) |
| p | 1 | 0,71 |
| NFV | ||
| Sí | 17/10 (16,8%) | 20/105 (19%) |
| No | 14/162 (8,6%) | 26/161 (16,1%) |
| p | 0,06 | 0,62 |
| IDV | ||
| Sí | 2/17 (11,8%) | 2/18 (11,1%) |
| No | 30/251 (12%) | 44/253 (17,4%) |
| p | 1 | 0,74 |
| SAQ | ||
| Sí | 1/11 (9,1%) | 1/11 (9,1%) |
| No | 30/254 (11,8%) | 45/258 (17,4%) |
| p | 1 | 0,69 |
| KAL | ||
| Sí | 2/26 (7,7%) | 2/22 (9,1%) |
| No | 29/236 (12,3%) | 44/245 (18%) |
| p | 0,75 | 0,38 |
| TNV | ||
| Sí | 2/20 (10%) | 2/20 (10%) |
| No | 30/242 (12,4%) | 44/246 (17,9%) |
| p | 1 | 0,54 |
Proporción de niños con hipertransaminasemia (GOT) a los 0,5 meses de vida y a los 3 meses, según el fármaco usado en la gestación. ABC: abacavir; AZT: zidovudina; DDI: didanosina; D4T: estavudina; EFV: efavirenz; IDV: indinavir; KAL: kaletra; NFV: nelfinavir; NVP: nevirapina; RTV: ritonavir; SAQ: saquinavir; 3TC: lamivudina; TNF: tenofovir.
Porcentajes de hipertransaminasemia (GPT) en lactantes según el fármaco empleado intraútero
| Fármaco | 0,5 meses | 3 meses |
| AZT | ||
| Sí | 5/186 (2,7%) | 9/192 (4,7%) |
| No | 4/85 (4,7%) | 5/81 (6,2%) |
| p | 0,47 | 0,56 |
| 3TC | ||
| Sí | 8/217 (3,7%) | 12/221 (5,4%) |
| No | 1/54 (1,9%) | 2/52 (3,8%) |
| p | 0,69 | 1 |
| D4T | ||
| Sí | 3/56 (5,4%) | 3/60 (5%) |
| No | 6/212 (2,8%) | 11/210 (5,2%) |
| p | 0,4 | 1 |
| DDI | ||
| Sí | 2/40 (5%) | 1/38 (2,6%) |
| No | 7/229 (3,1%) | 13/233 (5,6%) |
| p | 0,63 | 0,7 |
| ABC | ||
| Sí | 1/33 (3,0%) | 0/30 (0%) |
| No | 8/237 (3,4%) | 14/243 (5,8%) |
| p | 1 | 0,37 |
| EFV | ||
| Sí | 0/14 (0%) | 1/17 (5,9%) |
| No | 9/256 (3,5%) | 13/256 (5,1%) |
| p | 1 | 0,6 |
| NVP | ||
| Sí | 3/86 (3,5%) | 5/90 (5,6%) |
| No | 6/185 (3,2%) | 9/184 (4,9%) |
| p | 1 | 0,78 |
| RTV | ||
| Sí | 0/13 (0%) | 0/14 (0%) |
| No | 9/259 (3,5%) | 14/261 (5,4%) |
| p | 1 | 1 |
| NFV | ||
| Sí | 5/104 | 7/106 (6,6%) |
| No | 4/166 (2,4%) | 7/166 (4,2%) |
| p | 0,31 | 0,41 |
| IDV | ||
| Sí | 0/17 (0%) | 0/18 (0%) |
| No | 9/257 (3,5%) | 14/259 (5,4%) |
| p | 1 | 0,61 |
| SAQ | ||
| Sí | 0/11 (0%) | 0/11 (0%) |
| No | 9/261 (3,4%) | 14/264 (5,3%) |
| p | 1 | 1 |
| KAL | ||
| Sí | 1/27 (3,7%) | 1/24 (4,2%) |
| No | 8/242 (3,3%) | 13/248 (5,2%) |
| p | 1 | 1 |
| TNV | ||
| Sí | 0/21 (0%) | 0/21 (0%) |
| No | 9/247 (3,6%) | 14/250 (5,6%) |
| p | 1 | 0,61 |
Proporción de niños con hipertransaminasemia (GPT) a los 0,5 meses de vida y a los 3 meses, según el fármaco usado en la gestación. ABC: abacavir; AZT: zidovudina; DDI: didanosina; D4T: estavudina; EFV: efavirenz; IDV: indinavir; KAL: kaletra; NFV: nelfinavir; NVP: nevirapina; RTV: ritonavir; SAQ: saquinavir; 3TC: lamivudina; TNF: tenofovir.
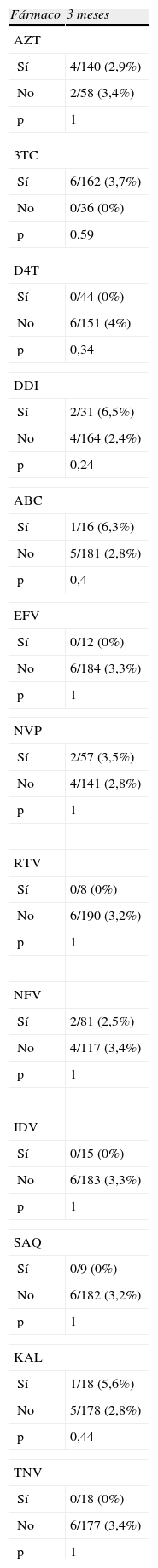
No se encontró hiperamilasemia en ningún niño en el análisis de los 15 días de vida. La proporción de niños con hiperamilasemia a las 6 semanas y a los 3 meses fue de 0,6 y 2,6%. No hubo diferencias significativas al realizar la comparación de los porcentajes según el fármaco usado intraútero, en ninguno de los análisis de los controles a los 0,5, 1,5 y 3 meses. Se exponen en tabla 7 solo los valores del análisis de los 3 meses de vida.
Porcentajes de hiperamilasemia en lactantes según el fármaco empleado intraútero
| Fármaco | 3 meses |
| AZT | |
| Sí | 4/140 (2,9%) |
| No | 2/58 (3,4%) |
| p | 1 |
| 3TC | |
| Sí | 6/162 (3,7%) |
| No | 0/36 (0%) |
| p | 0,59 |
| D4T | |
| Sí | 0/44 (0%) |
| No | 6/151 (4%) |
| p | 0,34 |
| DDI | |
| Sí | 2/31 (6,5%) |
| No | 4/164 (2,4%) |
| p | 0,24 |
| ABC | |
| Sí | 1/16 (6,3%) |
| No | 5/181 (2,8%) |
| p | 0,4 |
| EFV | |
| Sí | 0/12 (0%) |
| No | 6/184 (3,3%) |
| p | 1 |
| NVP | |
| Sí | 2/57 (3,5%) |
| No | 4/141 (2,8%) |
| p | 1 |
| RTV | |
| Sí | 0/8 (0%) |
| No | 6/190 (3,2%) |
| p | 1 |
| NFV | |
| Sí | 2/81 (2,5%) |
| No | 4/117 (3,4%) |
| p | 1 |
| IDV | |
| Sí | 0/15 (0%) |
| No | 6/183 (3,3%) |
| p | 1 |
| SAQ | |
| Sí | 0/9 (0%) |
| No | 6/182 (3,2%) |
| p | 1 |
| KAL | |
| Sí | 1/18 (5,6%) |
| No | 5/178 (2,8%) |
| p | 0,44 |
| TNV | |
| Sí | 0/18 (0%) |
| No | 6/177 (3,4%) |
| p | 1 |
Proporción de niños con hiperamilasemia a los 3 meses, según el fármaco usado en la gestación. ABC: abacavir; AZT: zidovudina; DDI: didanosina; D4T: estavudina; EFV: efavirenz; IDV: indinavir; KAL: kaletra; NFV: nelfinavir; NVP: nevirapina; RTV: ritonavir; SAQ: saquinavir; 3TC: lamivudina; TNF: tenofovir.
Los estudios publicados acerca de la toxicidad mitocondrial asociada al TAR en niños expuestos intraútero muestran resultados muy dispares10–21. La mayor parte de estos trabajos no asocian una toxicidad clínicamente relevante, a excepción del estudio publicado desde la cohorte perinatal francesa, donde se observaron casos con clínica significativa incluso en lactantes no infectados de 18 meses de edad expuestos intraútero y perinatalmente e incluso 2 casos fatales de acidosis láctica secundaria a toxicidad mitocondrial12. Muchos de los trabajos publicados no muestran resultados ajustados al abuso de drogas durante la gestación, la presencia de prematuridad, el estado inmunovirológico de la madre o el fármaco usado. En este estudio pretendíamos analizar la toxicidad mitocondrial de manera general y de cada fármaco por separado, para detectar diferencias entre los distintos fármacos que se emplean actualmente durante la gestación para prevenir la TV del VIH.
Hemos encontrado un alto porcentaje de hiperlactacidemia entre los lactantes menores de 3 meses de la cohorte FIPSE, sin que se halla notificado a la base morbimortalidad asociada. Los porcentajes de hiperlactacidemia, entre los lactantes de los que se dispone de datos analíticos, oscilan entre el 48% (a los 15 días de vida) y el 51% (al mes y medio de vida). Debido a la estructura de recogida de datos en la base, en la que no se solicitó bioquímica más allá de los 3 meses, no se ha podido conocer la evolución de estos porcentajes. La prevalencia de hiperlactacidemia en lactantes expuestos intraútero ha sido descrita hasta en el 92% de los tratados10, por lo que existen autores que afirman que la presencia aislada de hiperlactacidemia asintomática no es un marcador precoz de acidosis láctica, por lo que se debería de considerar no solicitar esta prueba en este tipo de cohortes, siempre que el lactante se encontrara asintomático19. Por otra parte, se ha demostrado que estos valores pueden permanecer elevados hasta más allá de los 6–18 meses en un porcentaje pequeño de lactantes (0,26%)12, por lo que existe también controversia respecto a la indicación de seguir la evolución de estas hiperlactacidemias y de su significado a largo plazo. En el análisis fármaco a fármaco, no hemos objetivado diferencias significativas en la prevalencia de hiperlactacidemia en los lactantes según el fármaco empleado por la gestante, con la excepción del abacavir, hecho que contrasta con la consabida escasa toxicidad mitocondrial de este ITIAN8. Estos casos no asociaron clínica de acidosis láctica. En otras series se ha descrito mayor proporción de hiperlactacidemia en los expuestos a didanosina intraútero, pero en nuestra base objetivamos precisamente menor porcentaje de hiperlactacidemia entre los expuestos a ddI, aunque solamente en el análisis de los 15 días de vida. Es probable que el pequeño tamaño del grupo (n=30) de los expuestos justifique este hallazgo no esperado.
Respecto a la elevación de las transaminasas, no encontramos casos significativos de esteatosis hepática ni esteatohepatitis secundaria a toxicidad mitocondrial, ni tampoco hemos hallado ningún fármaco usado intraútero que asocie mayor proporción de hipertransaminasemia en el lactante a lo largo de sus 3 primeros meses de vida. La prevalencia de hipertransaminasemia (para GOT o GPT) oscila en nuestra cohorte entre el 3–17%, según hemos comentado, valores que se sitúan en el rango descrito por otras cohortes (6–30%)23–25. En un estudio realizado en 152 niños y adolescentes infectados, se encontró un porcentaje de toxicidad hepática del 19,7%, de grado 1 en todos ellos y de los cuales la mitad presentó esteatohepatosis demostrada ecográficamente. Todos ellos recibían TARGA26. En otro estudio realizado en Madrid entre 222 adultos infectados por VIH que recibían TAR, el porcentaje de hipertransaminasemia fue del 9% y las variables más fuertemente asociadas fueron la coinfección por VHC, el abuso de alcohol y la edad25.
La presencia de pancreatitis en niños no infectados con VIH, pero expuestos a TAR perinatal para prevención de la TV ha sido descrita aisladamente como manifestación de daño mitocondrial, aunque la pancreatitis ocurre más habitualmente en niños contagiados por el VIH y sometidos a TAR, hasta en un 24% en algunas series27,28. En este estudio no hemos encontrado ninguna pancreatitis que hubiera sido comunicada a la base, si bien se encontraron 8 casos aislados de elevación de amilasa (sin elevación significativa de lipasa y sin manifestaciones clínicas).
En este estudio no hemos podido obtener las cifras de la bioquímica más allá de los 3 meses de vida, por el diseño previo de la base, en la que ya no se solicitaban datos bioquímicos a partir de esta edad y dado que el análisis, (aunque el diseño de la base es prospectivo), se ha hecho de manera retrospectiva. Hemos eliminado del análisis para cada fármaco a los niños prematuros y a los expuestos intraútero a sustancias de abuso, por ser los factores que más pueden influenciar el metabolismo mitocondrial basal y no hemos ajustado por características inmunovirológicas de la madre, ni otras características de la gestación, ya que los grupos de tratamiento de cada fármaco, son ya de por sí, pequeños, y estratificar los grupos según estas variables produciría grupos de comparación demasiado pequeños.
En conclusión, hemos encontrado un alto porcentaje de lactantes expuestos a TAR intraútero con hiperlactacidemia, acorde con los resultados de otras series, sin que se halla comunicado morbimortalidad asociada a este fenómeno y no hemos podido asociar mayor prevalencia de hiperlactacidemia en los lactantes, a ningún fármaco de los usados en la gestación. Por otro lado, en nuestra base no hay evidencia de hepatitis o pancreatitis secundaria a fármacos o como expresión de daño mitocondrial.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.