En los últimos años se han experimentado cambios en el manejo de los pacientes con trombocitopenia inmune primaria. En este estudio se revisan las características de los pacientes con trombocitopenia inmune primaria del Hospital Infantil Universitario Niño Jesús y su evolución. Además, analizamos los cambios en el abordaje de los pacientes diagnosticados antes y después de 2011, año en el que se publicó la guía de la Sociedad Española de Pediatría.
Material y métodosSe han revisado retrospectivamente los datos de pacientes con trombocitopenia inmune primaria en seguimiento en nuestro hospital desde el año 2000. El paquete estadístico utilizado para el análisis fue SPSS Statistics 22.0 (IBM Corp, Chicago, IL, EE.UU.).
ResultadosSe han revisado 235 pacientes pediátricos con trombocitopenia inmune primaria, observando que algunas características al diagnóstico, como la edad menor de 5años y los antecedentes previos de infección, pueden influir en la probabilidad de recuperación. Con respecto al cambio de manejo de los pacientes, a partir de 2011 las dosis de esteroides recibidas durante el primer mes y el primer año se han reducido de forma significativa, así como el número de días del primer ingreso, pasando de 5 a 3días. Las esplenectomías también se han reducido significativamente.
ConclusionesDesde el año 2011 se han producido cambios en el abordaje de nuestros pacientes: reciben una menor dosis de esteroides, permanecen menos días ingresados y se ha reducido el número de esplenectomías sin aumentar los sangrados y sin disminuir la tasa de respuestas. Además, observamos que la edad menor de 5años y el antecedente de infección previa al diagnóstico están relacionados con una mayor tasa de recuperación.
In recent years, there have been changes in the management of patients with primary immune thrombocytopenia. In this study, a review is presented of the characteristics and outcomes of children with primary immune thrombocytopenia in a children's hospital (Hospital Infantil Niño Jesús, Madrid, Spain). Moreover, an analysis is made of the changes in the care of these patients diagnosed before and after 2011, when new guidelines were published by the Spanish Society of Paediatric Haematology Oncology (SEHOP).
Material and methodsData from a cohort of primary immune thrombocytopenia patients followed up in this hospital have been retrospectively reviewed. The statistical package used for the analysis was SPSS Statistics 22.0 (IBM Corp, Chicago, IL, USA).
ResultsA review is presented on the clinical data from 235 paediatric patients diagnosed with primary immune thrombocytopenia. It was observed that some features at diagnosis, such as age younger than 5years and a previous history of infection, influenced the probability of cure. Regarding the changes in the management of patients since 2011, the steroid doses received during the first month and the first year, and the number of days corresponding to the patient's first admission have both significantly decreased. Splenectomies were also significantly reduced.
ConclusionsSince 2011, there have been changes in the medical care of our primary immune thrombocytopenia patients: they receive lower doses of steroids, they stay fewer days in the hospital, and the number of splenectomies has decreased without increasing bleeding or worsening the clinical evolution. Furthermore, it was observed that age younger than 5years and a history of infection prior to diagnosis were related to higher chances of recovery.
La trombocitopenia inmune primaria (PTI), previamente conocida como púrpura trombocitopénica idiopática o inmune, vio modificada su denominación en el año 2009, cuando el grupo internacional de trabajo de la PTI publicó las recomendaciones de estandarización de la terminología, definiciones y criterios de respuesta para adultos y niños. Se elimina la palabra púrpura, ya que en algunos pacientes el sangrado cutáneo o mucoso está ausente o es mínimo, si bien se aconseja mantener el acrónimo PTI por su amplia difusión1.
Junto al cambio de denominación de la PTI, se han añadido varias actualizaciones en guías tanto nacionales como internacionales. En la actualización de 2009 se establece el nivel de corte de la cifra de plaquetas en 100×109/l para el diagnóstico de PTI, dados los recuentos frecuentes entre 100 y 150×109/l en individuos sanos. La clasificación se modifica dado que en la infancia la posibilidad de remisión de la PTI es alta entre los 3 y 12meses, considerándose PTI crónica más allá de los 12meses. Posteriormente, en enero de 2010 se publicó el consenso internacional para el diagnóstico y manejo de la PTI2. Como concepto importante de este consenso se destaca la importancia de conseguir una adecuada calidad de vida con la mínima toxicidad asociada al tratamiento.
La PTI cuenta con un amplio registro internacional y un gran número de proyectos de investigación, pero la información clínica en pediatría no es tan extensa. Hay varios temas en constante debate y de los que difícilmente se encontrarán respuestas sin el estudio de amplias series de pacientes2.
La Sociedad Española de Hematología y Oncología Pediátrica (SEHOP) publicó en 2011 unas nuevas directrices para el diagnóstico y el tratamiento de la PTI3, pero desde entonces no existen trabajos que hayan analizado si la publicación de estas guías ha supuesto un cambio en la atención de estos pacientes. Además, no se ha analizado si, de haberse producido cambios, estos han supuesto alguna complicación o mejora para los niños.
En este estudio se revisan las características clínicas de la serie pediátrica de nuestro centro de manera retrospectiva y se analizan los cambios en el abordaje de los pacientes diagnosticados antes y después de 2011, año en el que se publica la nueva guía. Se utilizan distintas variables para comparar si tras esta publicación se han obtenido beneficios para los pacientes sin aumentar el número de complicaciones. También se han tomado como referencia guías anteriores a modo de comparación, de 1994 y 2004, y las directrices sugeridas por la American Society of Hematology (ASH)4, vigentes en el momento de la publicación de la guía de 2011.
Material, pacientes y métodosSe han revisado retrospectivamente las historias clínicas de 235 pacientes diagnosticados de PTI y que, en alguna ocasión o de manera constante, han sido evaluados y tratados en el Hospital Infantil Universitario Niño Jesús (HIUNJ) desde enero del año 2000. Este estudio ha sido aprobado por el Comité Ético del mismo centro. En todos los casos identificados como trombocitopenias inmunes se recogieron las siguientes variables:
- •
Relacionadas con el paciente: sexo, fecha de nacimiento y antecedentes personales de enfermedades autoinmunes.
- •
Relacionadas con el diagnóstico: fecha de diagnóstico, antecedentes de infección o administración de vacunas, inicio del cuadro clínico, presencia y tipo de hemorragias al diagnóstico, recuento hematológico al diagnóstico, estudios serológicos, determinación de anticuerpos antinucleares (ANA) y título en caso de positividad y cuantificación de inmunoglobulinas (IgG, IgA, IgM).
- •
Relacionadas con el manejo del cuadro: realización de aspirado de médula ósea o no, ingreso hospitalario al diagnóstico, días de ingreso hospitalario al diagnóstico, indicación de tratamiento y tipo de tratamiento empleado.
- •
Relacionadas con la evolución de los pacientes: tratamiento recibido en el primer mes tras diagnóstico y dosis de esteroides en ese periodo; dosis de esteroides y ciclos de inmunoglobulinas recibidos en el primer año de seguimiento; tipos de hemorragias diagnosticadas en el primer año de seguimiento, número de episodios hemorrágicos, hemorragias graves, recuento de plaquetas a los 6meses, al año y a los 2años del diagnóstico; último recuento de plaquetas realizado, fecha en que los pacientes alcanzan un recuento de plaquetas mayor de 100×109/l tras un mes sin tratamiento. Se recoge la fecha de la esplenectomía, si fue realizada.
Las hemorragias se han clasificado en cuatro grupos: pacientes sin sangrado, pacientes con sangrado únicamente cutáneo, pacientes con sangrado mucoso o cutaneomucoso y pacientes con hemorragias graves. Como hemorragias graves se incluyen las que precisan medidas terapéuticas adicionales. La curación de la enfermedad se define al alcanzar recuentos plaquetarios superiores a 100×109/l mantenidos en ausencia de tratamiento. Los casos sometidos a esplenectomía se censuran como ausencia de evento (entendiendo evento como un recuento plaquetario superior a esa cifra) hasta la fecha de la cirugía. Los pacientes que no llegaron a 100×109/l pasado un año de seguimiento son considerados como PTI crónica.
Además, todas las variables se han estudiado en busca de diferencias antes y después de 2011, año de la publicación del protocolo de estudio y tratamiento de la PTI por la SEHOP.
El análisis estadístico se ha realizado utilizando el paquete SPSS Statistics 15.0 y 22.0 (IBM Corp, Chicago, IL, EE.UU.). Las variables cualitativas se representan con su distribución de frecuencias. Las variables cuantitativas de distribución normal se presentan con su media y desviación estándar. El análisis de normalidad se realizó con la prueba de Kolmogorov-Smirnov. Para las variables normales se hizo el test de la t de Student cuando la variable categórica es dicotómica y el análisis de la varianza (ANOVA) cuando la variable categórica tiene tres o más grupos.
Las variables que no cumplen el criterio de normalidad se representan mediante su mediana y su rango y se compararon mediante pruebas no paramétricas: el test de U de Mann-Whitney para las variables dicotómicas y la prueba de Kruskal-Wallis para las variables no dicotómicas.
Para las variables no dicotómicas que siguen una distribución normal y que fueron significativas en los ANOVA se realizaron pruebas post hoc de comparaciones múltiples por el método de Bonferroni para así poder establecer entre qué grupos se encuentran las diferencias. Las comparaciones de variables cualitativas se realizaron mediante tablas de contingencia y el estadístico de chi-cuadrado de Pearson. La estimación del riesgo para los factores predictivos se expresa mediante la odds ratio y su intervalo de confianza. Se ha usado el test de Kaplan-Meier para calcular la incidencia acumulada de distintos factores estudiados. Mediante Logrank se han comparado las curvas de incidencia de varias poblaciones atendiendo a dichos factores.
ResultadosCaracterísticas de los pacientes al diagnósticoSon 235 pacientes diagnosticados con PTI desde el año 1991 que han sido seguidos en el HIUNJ desde enero del año 2000. La mediana de edad de la serie es de 4años (3meses-17años). El ratio de varones/mujeres es 1,12 (124 varones y 111 mujeres). Esta diferencia es mayor en los niños menores de 5años, con un ratio de 1,39, y se invierte en los mayores de 9años, con un ratio de 0,69.
Un total de 215 pacientes (92,3%) presentaron algún tipo de cuadro hemorrágico al diagnóstico. En 129 casos (55,4%) se trató solo de hemorragias cutáneas, en 80 pacientes se extendieron también a mucosas (34,3%) y solo 6 casos (2,6%) presentaron sangrado de otro tipo. Siete pacientes (3%) tenían antecedentes de alguna otra enfermedad autoinmune, por lo que podrían ser trombocitopenias inmunes secundarias. La más frecuente era hipotiroidismo, con 4casos. En 204 casos (87,5%) describían un inicio del cuadro agudo, frente a 29 casos (12,5%) en que el inicio fue insidioso. En 114 casos (48,5%) se hizo referencia a un antecedente infeccioso o a la administración de vacunas previamente al diagnóstico.
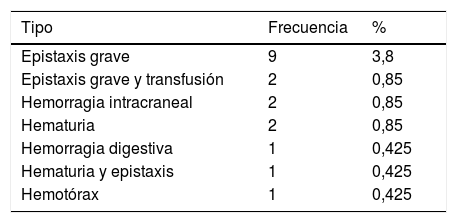
Hemorragias durante el primer año de seguimientoLas hemorragias aisladas cutáneas son la manifestación hemorrágica más frecuente a lo largo del primer año. Solo 12 pacientes (5,5%) no presentaron ninguna clínica de sangrado en ese periodo de seguimiento. El máximo de episodios hemorrágicos que ha sufrido un paciente fue de 8. Se recogieron episodios de hemorragias graves en 18 pacientes (7,6%). En dos casos se demostró hemorragia intracraneal, ambas resueltas sin complicaciones (tabla 1).
Episodios hemorrágicos graves en el primer año de seguimiento. Porcentaje respecto al total de pacientes estudiados
| Tipo | Frecuencia | % |
|---|---|---|
| Epistaxis grave | 9 | 3,8 |
| Epistaxis grave y transfusión | 2 | 0,85 |
| Hemorragia intracraneal | 2 | 0,85 |
| Hematuria | 2 | 0,85 |
| Hemorragia digestiva | 1 | 0,425 |
| Hematuria y epistaxis | 1 | 0,425 |
| Hemotórax | 1 | 0,425 |
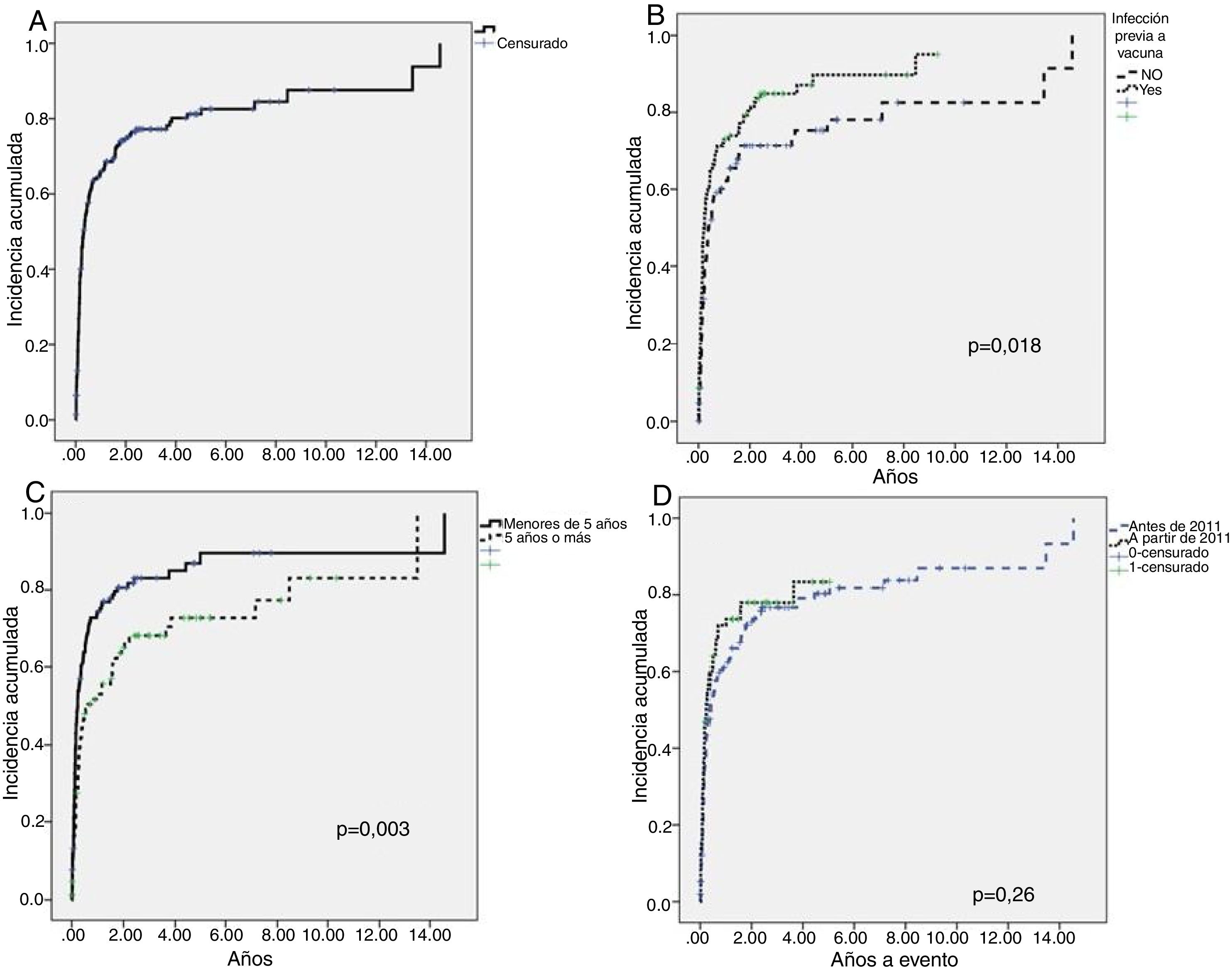
La mediana de tiempo hasta alcanzar recuentos mayores de 100×109/l fue de 3,84meses (0,12-174,72) (fig. 1A). Únicamente resultaron significativas dos variables relacionadas con la probabilidad de recuperación: la presencia de antecedentes de infección en el debut del cuadro (fig. 1B) y la edad menor de 5años (fig. 1C).
Evolución de los pacientes hasta recuento mayor de 100×109/l (curación)
A)Curva de incidencia acumulada de la cohorte total. Mediana a curación, 3,84meses. B)Estudio log Rank de las cohortes según la presencia o no de infección previa o vacuna (la mediana de tiempo hasta la recuperación fue distinta para los pacientes con antecedente de infección o vacunas [0,23años o 2,76meses] y aquellos sin antecedente infeccioso o vacuna [0,38años o 4,56meses], p=0,018). C)Estudio log Rank de las cohortes de acuerdo a la edad (la mediana de tiempo hasta la recuperación fue distinta para los pacientes menores de 5años [0,23años o 2,76meses] y los mayores de 5años [0,62años o 7,44meses], p=0,003). D)Estudio log Rank comparativo de ambas cohortes temporales donde se demuestra que no existen diferencias significativas.
El análisis multivariado demostró la asociación de ambas variables con la probabilidad de superar el recuento de 100×109 plaquetas/l. Los pacientes con antecedentes de infección o vacunas tienen 1,36 veces más posibilidades de superar 100×109 plaquetas/l que aquellos sin ese antecedente previo al diagnóstico (1-1,185; p=0,05). Los pacientes menores de 5años de edad tienen 1,58 más posibilidades de alcanzar esas cifras de plaquetas que los mayores (1,14-2,18; p=0,005).
Para la valoración final de la evolución de la serie se perdieron un total de 22 casos. En total, los pacientes que finalmente evolucionaron hasta la curación, sin esplenectomía, fueron 155. Fueron esplenectomizados 16 pacientes, de los que se consideran curados el 62,5% (10 pacientes). De los casos esplenectomizados, 15 fueron pacientes diagnosticados antes de 2011, frente a un único caso de esplenectomía después de 2011, marcando una clara diferencia entre periodos (p=0,04).
Diferencias en el manejo de los pacientes en función de los periodos estudiadosNo existen diferencias estadísticamente significativas en las características demográficas ni en los hemogramas realizados entre los 166 pacientes en seguimiento antes del 2011 y los 69 pacientes diagnosticados después de dicho año.
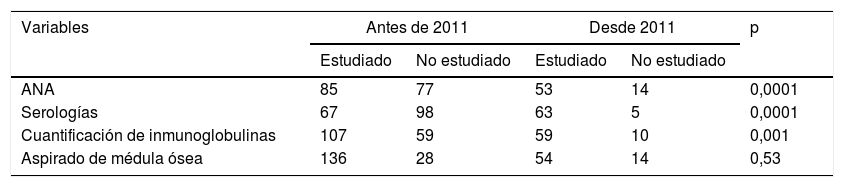
Los estudios realizados en cada periodo de tiempo sí son diferentes, siendo más frecuente la realización de serologías, la cuantificación de inmunoglobulinas y la determinación de anticuerpos antinucleares en los pacientes diagnosticados desde 2011 (tabla 2).
La realización de aspirados de médula ósea se ha mantenido estable. En el periodo previo a 2011 se realizó aspirado al 82,9% de los pacientes (136/164) y desde 2011 al 79,4% (54/68) (p=0,53).
Entre estos dos periodos de tiempo no se demuestran diferencias significativas en la presencia de hemorragias al diagnóstico ni en el tipo de hemorragias. Tampoco existen diferencias en el porcentaje de pacientes que reciben tratamiento al diagnóstico, ni en el tipo de tratamiento empleado en la primera semana ni en el primer mes de seguimiento.
Referente al tratamiento durante el primer año, no existen diferencias en el número de ciclos de inmunoglobulinas, pero sí existe diferencia significativa en la dosis de esteroides recibida el primer mes y en el primer año, siendo menor a partir de 2011 (tabla 3).
Variables estudiadas relacionadas con el tratamiento de esteroides y días del primer ingreso según periodo de diagnóstico
| Variables | Hasta 2011 | Desde 2011 | p |
|---|---|---|---|
| Dosis de esteroides primer mes (mg/kg) | n=88 | n=36 | 0,001 |
| 49,5 (4-150) | 10 (2-50) | ||
| Dosis de esteroides primer año (mg/kg) | n=91 | n=41 | 0,001 |
| 53 (4-414) | 16 (2-105) | ||
| Días del primer ingreso | n=143 | n=56 | 0,001 |
| 5 (1-28) | 3 (1-14) |
Tampoco existe diferencia en el número de pacientes que ingresan al diagnóstico, pero sí existe diferencia en los días transcurridos durante dicho ingreso, con una mediana de 5días antes de 2011 y una mediana de 3días a partir de 2011 (p=0,001) (tabla 3).
No hay diferencia en el desarrollo de PTI crónica entre los dos periodos de tiempo. En el primer periodo evolucionan a crónica el 29,5% de los pacientes, mientras que en el segundo periodo lo hacen el 21,7% (p=0,13). Tampoco existen diferencias significativas en la evolución de los pacientes para alcanzar recuentos mayores de 100×109/l (curación) entre ambas cohortes (fig. 1D).
En el número de episodios hemorrágicos tampoco existen diferencias (p=0,92), ni en la aparición de hemorragias graves en el primer año de seguimiento. Se diagnosticaron 12 episodios graves en la primera fase, frente a 6 en la serie posterior a 2011 (p=0,84).
DiscusiónLa PTI es la causa de trombocitopenia más frecuente en niños previamente sanos. Se han publicado varias guías y protocolos con el fin de homogeneizar los criterios de diagnóstico y manejo de los pacientes pediátricos con PTI. Sin embargo, muchas veces no se analiza si los cambios en los protocolos conllevan un beneficio en la evolución y en la calidad de vida de nuestros pacientes.
Tras la actualización de las guías en el manejo de los pacientes con PTI de 2011, en nuestro centro se pudieron constatar dos principales cambios que afectaron positivamente a los pacientes: la disminución de la dosis de esteroides y la reducción de días del primer ingreso hospitalario. Para alcanzar estas conclusiones se han analizado los datos retrospectivos pertenecientes a pacientes en seguimiento por PTI en el HIUNJ desde el año 2000. Se han comparado el abordaje y la evolución de estos pacientes antes y después de la publicación de las directrices de 2011. Estos estudios retrospectivos son de gran utilidad para saber si la aplicación de los cambios recomendados en las nuevas guías de diagnóstico y tratamiento van acompañados de un beneficio para los pacientes.
Las características generales de los pacientes estudiados se corresponden con los resultados publicados en diferentes series pediátricas5. La mayoría de los pacientes diagnosticados de PTI son menores de 9años. Existe un ligero predominio de la PTI en los varones menores de 5años (ratio varones/mujeres 1,39), y esta distribución se invierte en los pacientes mayores de 9años, siendo a esa edad más frecuente en las mujeres (ratio varones/mujeres 0,69). Estos ratios son similares a los descritos por otros autores6,7. La mayoría de los pacientes de nuestra serie (87,5%) debutaron de forma brusca, y el porcentaje es similar a los descritos en otras series8,9. No se han encontrado diferencias significativas con otras series en cuanto al número y a la gravedad de los sangrados, manteniéndose el sangrado cutáneo como el más común al diagnóstico. En nuestro estudio, además, observamos que la edad menor de 5años y el antecedente de infección previa al diagnóstico están relacionados con una mayor tasa de recuperación.
El diagnóstico de la PTI es de exclusión, por lo que la historia clínica y las exploraciones complementarias son importantes en el momento inicial. Sin embargo, no existe una clara indicación de qué pruebas deben realizarse de manera habitual al diagnóstico además del hemograma y del frotis. Algunas pruebas complementarias pueden darnos información sobre la posible etiología o ayudarnos a realizar un diagnóstico diferencial correcto y temprano. En este sentido los estudios complementarios sí han aumentado, siendo más frecuentes las serologías, la cuantificación de inmunoglobulinas y la determinación de anticuerpos antinucleares en el periodo posterior a 2011. Estas determinaciones son importantes para poder descartar otras enfermedades autoinmunes, tales como el lupus eritematoso sistémico, y discriminar mejor entre PTI y trombocitopenia inmune secundaria. El porcentaje de pacientes a los que se les ha realizado un aspirado de médula ha sido similar tanto antes como después de 2011. Puede deberse al mantenimiento de los criterios de realización de dicha prueba, enfocados en PTI atípicas y orientado especialmente a descartar leucemias. Cabe destacar que el estudio de médula no es imprescindible para el diagnóstico de PTI típica. En nuestro centro esta prueba se realiza en un amplio porcentaje de pacientes debido a la disponibilidad de la misma y a la definición poco precisa de PTI clásica o típica. Sería interesante en una nueva actualización de estas guías definir con mayor claridad los criterios para diferenciar una PTI clásica de una que no lo es, tema que no se aborda en la última guía publicada de la SEHOP10. Además, los profesionales deberíamos revisar cuidadosamente los criterios para las indicaciones de realizar el estudio de médula ósea para evitar someter al paciente a este procedimiento si no es necesario.
No se ha hallado una reducción significativa en la proporción de niños que ingresan en el momento de ser diagnosticados antes y después de 2011. Las hospitalizaciones no se vieron reducidas pese al mejor conocimiento de la enfermedad y a la baja frecuencia de complicaciones graves. Sin embargo, sí se ha encontrado una reducción significativa en la duración de dichos ingresos, siendo la mediana de 5días antes de 2011 y de 3días después. Se trata de una pequeña diferencia que podría influir positivamente en la calidad de vida del paciente y sus familiares, reduciendo las molestias que pueda causar un ingreso prolongado.
En el caso de necesitar tratamiento, se encontró diferencia en el uso de esteroides. Su dosis se ha reducido durante el primer mes y el primer año de tratamiento, disminuyendo a menos de la mitad respecto a los valores previos a 2011. Los protocolos de la Sociedad Española de Hematología y Hemoterapia (SEHH) de 1996 y 2004 aconsejaban el tratamiento de la PTI con una pauta descendente de esteroides durante 28días. A partir de 2010, y de acuerdo con el conocimiento general de las eficacias y toxicidades de este tratamiento y la similitud en la eficacia, la posología de los esteroides se modifica y se reduce a 5-7días, lo que explicaría esta diferencia. La disminución en las esplenectomías también ha sido una clara diferencia dentro de los tratamientos en nuestro centro, reduciéndose significativamente. En el caso de tratamiento quirúrgico, en los protocolos españoles en 1997 y 2004 los pacientes con plaquetas inferiores a 20×109/l durante más de 6meses o aquellos con menos de 50×109/l a los 12meses eran candidatos a la cirugía, mientras que en las directrices de 2011 la esplenectomía está indicada como tratamiento de segunda línea en sujetos con PTI persistente o crónica grave siempre que no esté contraindicada. Actualmente se sugiere retrasar la intervención al menos 12meses desde el diagnóstico, a no ser que el niño presente hemorragias graves o una importante alteración en la calidad de vida. Ya no se recomienda su realización antes de que transcurran 6meses desde el diagnóstico debido a la posibilidad de mejorías o remisiones espontáneas en una pequeña proporción de pacientes. Esta es la causa principal de la evolución de los datos de este estudio referentes a la esplenectomía. Además, con la aparición de los agonistas del receptor de la trombopoyetina existen nuevas opciones que han aumentado la posibilidad de tratar las PTI crónicas, lo que habrá influido en el número de cirugías realizadas a partir de 2011. No se ha abordado en este estudio el uso de los agonistas del receptor de la trombopoyetina, ya que en nuestro centro su uso se ha realizado en este periodo casi siempre en el seno de diferentes ensayos clínicos.
En resumen, desde el año 2011 se han producido diversos cambios en el abordaje de nuestros pacientes: de un lado reciben una menor dosis de esteroides, además permanecen menos días ingresados, y finalmente se ha reducido el número de esplenectomías. Todo ello se ha conseguido sin aumentar los sangrados y sin modificar la probabilidad de evolución a PTIc. Todos estos cambios podrían afectar positivamente a la calidad de vida del paciente y de sus familias, para lo que harían falta estudios prospectivos con las herramientas adecuadas para verificarlo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.




![Evolución de los pacientes hasta recuento mayor de 100×109/l (curación) A)Curva de incidencia acumulada de la cohorte total. Mediana a curación, 3,84meses. B)Estudio log Rank de las cohortes según la presencia o no de infección previa o vacuna (la mediana de tiempo hasta la recuperación fue distinta para los pacientes con antecedente de infección o vacunas [0,23años o 2,76meses] y aquellos sin antecedente infeccioso o vacuna [0,38años o 4,56meses], p=0,018). C)Estudio log Rank de las cohortes de acuerdo a la edad (la mediana de tiempo hasta la recuperación fue distinta para los pacientes menores de 5años [0,23años o 2,76meses] y los mayores de 5años [0,62años o 7,44meses], p=0,003). D)Estudio log Rank comparativo de ambas cohortes temporales donde se demuestra que no existen diferencias significativas. Evolución de los pacientes hasta recuento mayor de 100×109/l (curación) A)Curva de incidencia acumulada de la cohorte total. Mediana a curación, 3,84meses. B)Estudio log Rank de las cohortes según la presencia o no de infección previa o vacuna (la mediana de tiempo hasta la recuperación fue distinta para los pacientes con antecedente de infección o vacunas [0,23años o 2,76meses] y aquellos sin antecedente infeccioso o vacuna [0,38años o 4,56meses], p=0,018). C)Estudio log Rank de las cohortes de acuerdo a la edad (la mediana de tiempo hasta la recuperación fue distinta para los pacientes menores de 5años [0,23años o 2,76meses] y los mayores de 5años [0,62años o 7,44meses], p=0,003). D)Estudio log Rank comparativo de ambas cohortes temporales donde se demuestra que no existen diferencias significativas.](https://static.elsevier.es/multimedia/16954033/0000009500000002/v2_202108060539/S1695403320304173/v2_202108060539/es/main.assets/thumbnail/gr1.jpeg?xkr=ue/ImdikoIMrsJoerZ+w95erwEulN6Tmh1xJpRhO+VE=)


