Los corticosteroides prenatales disminuyen la morbimortalidad neonatal, sin embargo, existen pocos estudios en países en vías de desarrollo, con resultados no consistentes. El objetivo fue cuantificar la frecuencia del uso de corticosteroides prenatales y estimar su efecto en la morbimortalidad de recién nacidos prematuros.
MétodosEstudio de cohorte retrospectivo; se seleccionaron los recién nacidos prematuros de un censo realizado entre enero de 2016 y agosto de 2017. De los expedientes maternos se registró el uso de corticosteroides; y de los expedientes de los neonatos se indagó las variables dependientes. La asociación se analizó con regresión logística, ajustada a la edad gestacional y el peso.
ResultadosSe estudiaron 1.083 prematuros, el 53,3% de género masculino; la edad gestacional promedio fue 33,4 semanas. Recibieron corticosteroides el 42%, con latencia≥24horas el 23,6% y≥48horas el 13,8%. Presentaron síndrome de dificultad respiratoria el 35% (379/1083), sepsis neonatal temprana el 4,4% (48/1083), sepsis neonatal tardía el 10,7% (116/1083), hemorragia intraventricular el 15,1% (137/908), enfermedad pulmonar crónica el 51,4% (165/321) y muerte el 22,3% (242/1083). Los corticosteroides prenatales disminuyeron el riesgo de muerte en menores de 34 semanas (OR: 0,63, IC 95%: 0,40-0,98); el decremento fue mayor si presentaron latencia ≥48horas (OR: 0,40; IC 95%: 0,20-0,80). El resto de variables dependientes no se modificó por la intervención.
ConclusionesEl 42% de los prematuros recibe corticosteroides prenatales. En menores de 34 semanas se observó una disminución del riesgo de muerte sin modificación en la morbilidad.
Prenatal corticosteroids reduce neonatal mortality and morbidity; however, there are few studies in developing countries, and with inconsistent results. The purpose of this study was to quantify the frequency of the use of prenatal corticosteroids and to estimate its effect on the morbidity and mortality of premature newborns.
MethodsA retrospective cohort study was performed on premature newborns selected from a census conducted between January 2016 and August 2017. The use of corticosteroids was taken from the maternal records, and the dependent variables from the neonatal records. An analysis was made of the relationship using logistic regression, adjusted to gestational age and weight.
ResultsThe study included 1083 premature infants of which 53.3% were male. The mean gestational age was 33.4 weeks. Corticosteroids were received by 42%, with latency ≥24hours in 23.6% and ≥48hours in 13.8%. Respiratory distress syndrome was observed in 35% (379/1083), early neonatal sepsis in 4.4% (48/1083), late neonatal sepsis in 10.7% (116/1083), intraventricular haemorrhage in 15.1% (137/908), chronic lung disease in 51.4% (165/321), and death in 22.3% (242/1083). Prenatal corticosteroids decreased the risk of death in children under 34 weeks (OR 0.63, 95% CI 0.40-0.98). The decrease was greater if they presented with latency ≥48hours (OR 0.40, 95% CI 0.20-0.80). The rest of the dependent variables were not modified by the intervention.
ConclusionsIn preterm infants, 42% received antenatal corticosteroids. In those with less than 34 weeks, there was a decrease in the risk of death without changes in morbidity.
En las últimas décadas, en el ámbito mundial, el riesgo de muerte durante el periodo neonatal ha disminuido en un 28%, de 33,2 a 23,9 muertes por 1.000 nacidos vivos1; sin embargo, el número de eventos sigue siendo mayor en países de bajos recursos económicos2. Entre las intervenciones sugeridas durante el trabajo de parto para reducir la mortalidad neonatal se encuentra el uso de corticosteroides prenatales3.
La administración del medicamento se recomienda principalmente en madres de productos menores de 34 semanas de gestación4–6, pero aun en recién nacidos (RN) prematuros tardíos se han descrito efectos beneficiosos7,8. Se ha observado que su administración disminuye de forma significativa el riesgo de muerte perinatal, síndrome de dificultad respiratoria (SDR), hemorragia intraventricular (HIV), enterocolitis necrosante, retinopatía del prematuro, infecciones sistémicas9–11, alteraciones en el neurodesarrollo y parálisis cerebral12, pero la mayoría de estudios se han realizado en países del primer mundo, por lo que los resultados en países en vías de desarrollo podrían ser diferentes9,13.
Los corticosteroides que atraviesan la barrera fetoplacentaria, y que pueden ser utilizados, son betametasona y dexametasona5,14–16; su mayor efecto se presenta después de 24 a 48horas de su administración6, pero en ocasiones se han utilizado esquemas incompletos o con un intervalo corto de dosificación, con resultados inconsistentes17.
El objetivo de este estudio fue medir la frecuencia del uso de corticosteroides prenatales y estimar su efecto sobre la morbimortalidad de RN pretérmino en una unidad de cuidados neonatales del occidente de México.
MétodosSe realizó estudio de cohorte retrospectivo, en el Hospital Civil de Guadalajara Dr. Juan I. Menchaca (HCGJIM), de la Ciudad de Guadalajara, Jalisco. La institución otorga servicios de salud a población abierta de escasos recursos económicos. El servicio de obstetricia está integrado por el área de toco-cirugía (12 camas, 3 quirófanos y 3 salas para la atención de partos) y hospitalización (91 camas); el servicio de neonatología cuenta con 18 cunas de terapia intensiva neonatal y 57 cunas de terapia intermedia.
Los pacientes estudiados fueron seleccionados de una cohorte registrada entre el 25 de enero de 2016 y el 31 de agosto de 2017, la cual contiene información demográfica, clínica, de morbimortalidad de todos los nacidos en la institución (fecha de nacimiento, género, peso, edad gestacional, valoración de Apgar a los 5 minutos de vida, vía de nacimiento, uso de antibióticos prenatales, muerte durante la hospitalización, causa de muerte, factores de riesgo maternos para la infección y edad materna).
Del total de la muestra se seleccionaron para el estudio los RN con edad gestacional menor a 37 semanas y que fueron ingresados; no se estudiaron neonatos procedentes de otras unidades hospitalarias o que hubieran nacido fuera del periodo de estudio. La estimación del tamaño de la muestra se realizó con la intención de identificar una OR de 0,59, y conociendo que en la institución la prevalencia de muerte en RN hospitalizados es del 12,5%18 se utilizó un alfa de 0,05 y potencia de 0,80.
De forma retrospectiva se indagó en los expedientes maternos la prescripción y administración de corticosteroides prenatales (tipo de corticosteroides, posología, número de dosis y periodo de latencia; se definió como periodo de latencia al número de horas transcurridas entre la administración de la primera dosis y el nacimiento). La prescripción del medicamento se realizó por los médicos gineco-obstetras en función de las recomendaciones de las Guías de práctica clínica de la Secretaría de Salud (betametasona o dexametasona 2 dosis intramusculares de 12mg en un intervalo de 12 a 24horas)19.
De los expedientes de los neonatos se averiguó si presentaron durante su estancia hospitalaria: SDR, HIV, sepsis neonatal temprana (SNTe), sepsis neonatal tardía (SNTa) y enfermedad pulmonar crónica (EPC).
DefinicionesLa información sobre las variables SDR, HIV, SNTe, SNTa y EPC fueron obtenidas del expediente clínico, siendo los médicos tratantes quienes realizaron el diagnóstico, orientado por las siguientes definiciones:
- -
Síndrome de dificultad respiratoria: dificultad respiratoria progresiva desde los primeros minutos de vida, con incremento en las necesidades de oxígeno y con manifestaciones radiográficas asociadas a la disminución de la tensión de la superficie alveolar.
- -
Hemorragia intraventricular: sangrado confinado al sistema ventricular cerebral; el diagnóstico se realizó mediante rastreo ultrasonográfico por el médico radiólogo y el grado de severidad se clasificó de acuerdo a la clasificación de Papille.
- -
Sepsis neonatal: presencia de crecimiento microbiano en cultivos de sangre o de líquido cefalorraquídeo (LCR) de los pacientes con datos clínicos sugestivos de infección. Cuando la bacteria aislada en sangre o LCR fue Staphylococcus coagulasa negativa se requirieron 2 o más hemocultivos positivos o estudio citoquímico de LCR con leucocitos y glucosa anormales. Si la sepsis se presentó en las primeras 72horas de vida se clasificó como temprana y el resto tardías.
- -
Enfermedad pulmonar crónica: dependencia de oxígeno a las 36 semanas de vida posmenstrual o al alta hospitalaria en prematuros menores de 32 semanas; en pacientes de 32 o más semanas de gestación se diagnosticó si hubo dependencia de oxígeno por más de 28 días de vida.
- -
Causa de la muerte (causa básica): es la enfermedad o lesión que inició la cadena de acontecimientos patológicos que condujeron a la muerte; esta fue analizada por 3 neonatólogos pediatras; la causa fue asignada si 2 o más de estas evaluaciones eran concordantes.
Se realizó análisis descriptivo para el total de la muestra y posteriormente la cohorte se clasificó en función del antecedente de corticosteroides prenatales. De las variables cualitativas se cuantificaron frecuencias y porcentajes; de las variables cuantitativas se estimaron media, desviación estándar (DE) y rangos. Para comparar proporciones se usó la prueba Chi cuadrado y para medias la prueba «t» de Student o prueba exacta de Fisher; se consideró significación estadística cuando se obtuvo un valor de p<0,05.
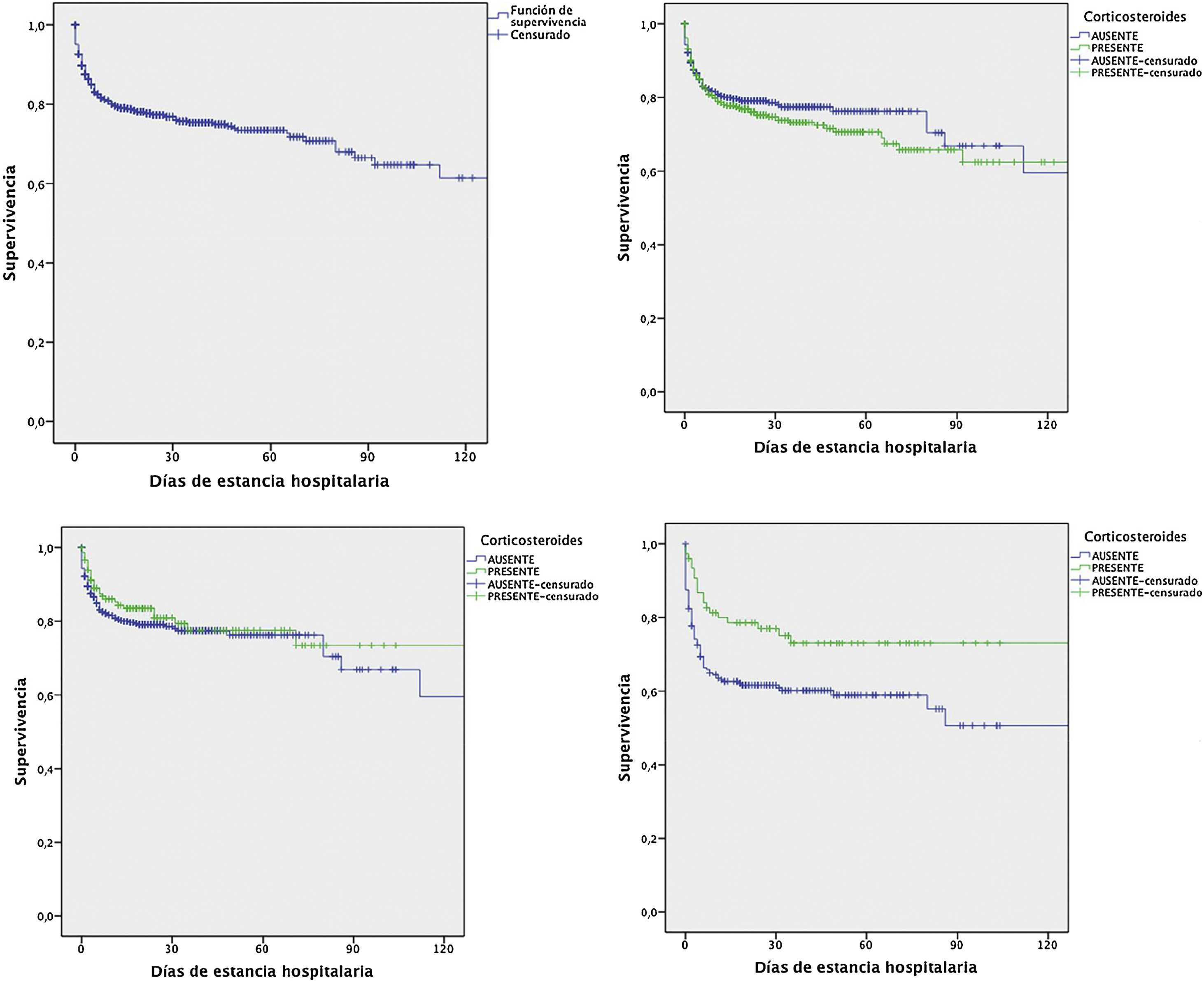
El análisis de asociación entre corticosteroides prenatales y las variables dependientes se realizó con prueba Chi cuadrado, posteriormente se efectuó regresión logística, ajustando los grupos en función del peso y la edad gestacional. El análisis se realizó para el total de la muestra y para el subgrupo de pacientes<34 semanas. Para evaluar la influencia de los corticosteroides a través del tiempo se realizó análisis de supervivencia mediante curvas de Kaplan-Meier y se usó prueba Log Rank para contraste de hipótesis.
Se utilizó programa IBM SPSS Statistics Versión 20. El proyecto fue aprobado por los Comités de Ética e Investigación del HCGJIM, con registro 0184/17.
ResultadosDurante el periodo de estudio se ingresaron 1.083 prematuros, el 53,3% (n=577) fueron de género masculino, el 46,4% (n=503) femenino y 3 presentaron genitales ambiguos. El promedio de edad gestacional fue de 33,4 semanas (máxima 36,6, mínima 24, DE 2,73); el 46,6% (n=505) fueron menores de 34 semanas y el 25,3% (n=274)≤32. La media de peso al nacer fue de 1.765,1g (máximo 3.775, mínimo 410, DE: 606,8). El 70,7% (n=766) nació por cesárea.
Recibió corticosteroides prenatales el 42% (455/1083), dexametasona el 76,9% (n=350) y betametasona el 23,1% (n=105); solo en el 61,3% (279/455) se administró el esquema completo. En menores de 34 semanas de gestación se prescribió corticosteroides al 53,7% (271/505).
Presentaron SDR el 35% (n=379), SNTe el 4,4% (n=48) y SNTa el 10,7% (n=116). Se realizó ultrasonograma transfontenelar al 83,8% (n=908), y se identificó HIV en el 15,1% (137/908), fueron grado i, ii, iii y iv el 33,5%, 27%, 23,4% y 16,1% respectivamente.
El 29,6% (n=321) tuvo≥28 días de estancia hospitalaria; en este grupo el 51,4% (165/321) presentó EPC; en los prematuros egresados antes de los 28 días de vida se descartó el diagnóstico, ya que todos se egresaron sin oxígeno suplementario.
La mortalidad fue del 22,3% (n=242), las principales causas fueron enfermedades infecciosas en el 28,9% (n=70), síndrome de dificultad respiratoria en el 23,6% (n=57), malformaciones o enfermedades genéticas en el 20,7% (n=50) y HIV en el 8,7% (n=21).
En la comparación de subgrupos según su edad gestacional (<28 semanas [n=50], 28 a 32 semanas [n=224], 32,1 a 33,9 semanas [n=231] y ≥34 semanas [n=578]) se observó diferencia significativa en la mortalidad (94%, 44,2%, 17,3%, 9,7%, p<0,001); SDR (76%, 77,2%, 38,5%, 13,7%, p<0,001); EPC en ≥28 días de vida (42,9%, 56%, 21,2%, 7,6%, p<0,001) y HIV (66,7%, 35,7%, 9,3%, 6,1%, p<0,001).
Al comparar las características clínicas y demográficas en función de la administración de corticosteroides prenatales se identificó que quienes recibieron la intervención cursaron con menor edad gestacional y peso al nacimiento; también fue más frecuente el nacimiento por cesárea o la presencia de factores de riesgo maternos para infección (infección urinaria, corioamnionitis, rotura prematura de membranas o fiebre durante el trabajo de parto) (tabla 1).
Características clínicas y demográficas de recién nacidos prematuros hospitalizados, en función de la administración de corticosteroides prenatales
| Con corticosteroidesn=455 | Sin corticosteroidesn=628 | p | |
|---|---|---|---|
| Peso (gramos, media)a | 1.599,3 | 1.884,9 | <0,001 |
| Edad gestacional (semanas, media)a | 32,66 | 33,87 | <0,001 |
| Escala de Apgar 5minutos (media)a | 8,03 | 7,86 | 0,11 |
| Género masculino (%)b | 53,8 | 52,9 | 0,33 |
| Nacimiento por cesárea (%)b | 77,4 | 65,9 | <0,001 |
| Factores de riesgo maternob,c (%) | 41,8 | 15,8 | <0,001 |
Al analizar la frecuencia de SDR, SNTe, SNTa, HIV, EPC y muertes en función del uso de corticosteroides prenatales, cualquiera que fuera el esquema o posología, no se observó efecto protector, incluso, hubo mayor ocurrencia de SDR, HIV y muerte en los pacientes con corticosteroides (tabla 2). Al analizar la intervención ajustada por edad gestacional y peso al nacimiento, para el total de la muestra y en subgrupo de menores de 34 semanas de gestación, solo se identificó disminución de la mortalidad (37%) en menores de 34 semanas (tabla 3).
Morbimortalidad en recién nacidos prematuros hospitalizados en función del uso de corticosteroides prenatales
| Corticosteroides prenatalesn=455 | Sin corticosteroidesn=628 | pa | |
|---|---|---|---|
| Síndrome de dificultad respiratoria (%) | 43,5 | 28,8 | <0,001 |
| Sepsis neonatal temprana (%) | 5,5 | 3,7 | 0,15 |
| Sepsis neonatal tardía (%) | 12,1 | 9,7 | 0,21 |
| Hemorragia intraventricular (%) | 17,9 | 12,9 | 0,04 |
| Displasia broncopulmonar (%) | 24,0 | 15,2 | 0,001 |
| Mortalidad (%) | 25,3 | 20,2 | 0,04 |
Morbimortalidad de recién nacidos prematuros hospitalizados y en subgrupo de menores de 34 semanas en función del uso de corticosteroides prenatales (ajustado por edad gestacional y peso al nacimiento mediante regresión logística)
| Total de la muestra n=1.083 OR (IC 95%) | Menores de 34 semanas n=505 OR (IC 95%) | |
|---|---|---|
| Síndrome de dificultad respiratoria | 1,16 (0,85-1,57) | 1,25 (0,84-1,87) |
| Sepsis neonatal temprana | 1,53 (0,84-2,77) | 1,05 (0,44-2,48) |
| Sepsis neonatal tardía | 1,09 (0,73-1,62) | 1,08 (0,66-1,77) |
| Hemorragia intraventriculara | 0,81 (0,53-1,23) | 0,76 (0,47-1,25) |
| Displasia broncopulmonarb | 0,94 (0,59-1,50) | 1,02 (0,59-1,80) |
| Mortalidad | 0,73 (0,52-1,04) | 0,63 (0,40-0,98) |
Entre los pacientes con la intervención, el 51,9% (236/455) tuvo periodos de latencia ≥24horas, y solo el 32,9% (150/455) ≥48horas; con la información del expediente clínico en 32 pacientes no fue posible estimar la latencia. Al comparar pacientes con corticosteroides con latencia ≥48 y sin medicamento se observó disminución del riesgo de muerte (60%) en menores de 34 semanas de gestación, sin efecto sobre el resto de variables dependientes (tabla 4), también se observó tendencia a un efecto protector de HIV grado iii y iv en pacientes<34 semanas (OR: 0,35, IC 95%: 0,11-1,07; p=0,06). Al analizar las variables dependientes en función de un periodo de latencia ≥24 horas, no hubo diferencias a los resultados de comparar pacientes con y sin corticoides.
Morbimortalidad de recién nacidos prematuros hospitalizados y en subgrupo de menores de 34 semanas en función del uso de corticosteroides prenatales con periodo de latencia ≥48horas (ajustado por edad gestacional y peso al nacimiento mediante regresión logística)
| Total de la muestra n=778a OR (IC 95%) | Menores de 34 semanas n=310a OR (IC 95%) | |
|---|---|---|
| Síndrome de dificultad respiratoria | 0,89 (0,57-1,40) | 0,87 (0,48-1,57) |
| Sepsis neonatal temprana | 1,75 (0,78-3,92) | 0,61 (0,13-2,87) |
| Sepsis neonatal tardía | 1,41 (0,83-2,40) | 1,62 (0,84-3,12) |
| Hemorragia intraventricularb | 0,66 (0,35-1,24) | 0,65 (0,31-1,37) |
| Broncodisplasia pulmonarc | 1,0 (0,53-1,91) | 1,19 (0,56-2,54) |
| Mortalidad | 0,59 (0,35-1,03) | 0,40 (0,20-0,80)a |
No se observaron diferencias significativas en morbimortalidad, al comparar pacientes que recibieron betametasona o dexametasona con latencia ≥48horas, sin embargo fueron pocos pacientes.
Mediante análisis de Kaplan-Meier se evaluó el efecto del uso de corticosteroides prenatales sobre la supervivencia en pacientes prematuros hospitalizados en el HCGJIM, y se observó que el mayor beneficio de la intervención se registra en pacientes menores de 34 semanas con periodos de latencia ≥48 horas (fig. 1).
Supervivencia de recién nacidos prematuros hospitalizados en función de la administración de corticosteroides prenatales, con latencia ≥48horas, y en subgrupo de pacientes<34 semanas.
Supervivencia de pacientes prematuros hospitalizados (n=1.083)
RN prematuros con corticosteroides vs. sin corticosteroides (n=1.083) p=0,30 (Log Rank)
RN prematuros con corticosteroides con latencia≥48h vs. sin corticosteroides (n=778) p=0,34 (Log Rank)
RN<34 semanas con corticosteroides con latencia≥48h vs. RN<34 semanas sin corticosteroides (n=310) p=0,009 (Log Rank).
A nivel mundial se estima que un 10% de los RN son prematuros20, los cuales presentan mayores tasas de morbimortalidad en comparación con pacientes a término18. En México, de acuerdo a este indicador y a los nacimientos registrados de 2014 a 2016,21 el promedio anual de RN prematuros es de 237.000.
Desde el año 1972 se informó que en pacientes prematuros los esteroides prenatales disminuyen el riesgo de muerte neonatal por su efecto inductor de la madurez pulmonar fetal4,9, sin embargo, hasta la fecha, la implementación de la recomendación es variable. En este estudio se cuantificó que menos del 50% de los RN prematuros reciben corticosteroides prenatales, el 25,8% reciben esquema completo y solo el 13,8% esquema completo con periodo de latencia ≥48horas.
Berrueta et al.22 observaron que en países de bajos ingresos económicos, a pesar de contar con guías de tratamiento, se administran corticosteroides prenatales del 2% al 44% de las madres de prematuros, y las tasas más bajas se presentan en países de África.
Aleman et al.23 observaron que en México el 70% de las mujeres con trabajo de parto pretérmino reciben corticosteroides prenatales, siendo menor cuando se presentaron comorbilidades maternas (39% a 62,2%); en El Salvador y Ecuador la frecuencia de su uso fue significativamente mayor.
Roberts et al. estimaron que los corticosteroides prenatales, en comparación con placebo, disminuyen el riesgo de muerte perinatal (RR: 0,72, IC 95%: 0,- 0,89), SDR (RR: 0,66, IC 95%: 0,56-0,77), HIV (RR: 0,55, IC 95%: 0,40-0,76), e infecciones sistémicas en las primeras 48horas de vida (RR: 0,60, IC 95%: 0,41-0,88); concluyeron que existe suficiente evidencia para recomendar la intervención, sin embargo, debido a que la mayoría de estudios se realizaron en países desarrollados existe poca evidencia de los resultados en países de bajos recursos económicos, donde la incidencia de infecciones es alta9.
Se ha descrito que el máximo beneficio de los corticosteroides se observa si el nacimiento es 24 a 48horas después de la primera dosis6,24. En nuestro estudio, en pacientes<34 semanas se observó una disminución significativa del riesgo de muerte (37%) con el uso de corticosteroides prenatales, pero al analizar los que además presentaron latencia ≥48horas el decremento del riesgo fue mayor (60%); no se observó diferencia significativa en la ocurrencia de SDR, SNTe, SNTa, HIV y EPC.
Es probable que en pacientes del HCGJIM el pobre efecto sobre la morbilidad neonatal esté relacionado con la baja proporción de prematuros que reciben la intervención con periodos de latencia mayores a 24 a 48horas, pero es necesario evaluar el efecto de otras intervenciones, como son el control prenatal, el tratamiento de comorbilidades maternas, la implementación oportuna de cuidados intensivos neonatales, el uso del factor surfactante y la cafeína profiláctica.
Al evaluar el efecto de la intervención en subgrupos por edad gestacional, sin ajustar a otras variables, se identificó que los RN de 32 a 33,9 semanas de gestación (n=231) presentan el mayor beneficio sobre la mortalidad neonatal (OR: 0,41, IC 95%: 0,20-0,85). No se observó modificación de la morbilidad en ningún subgrupo. Similar a nuestros resultados, Gyamfi-Bannerman et al.8 no observaron modificación de la mortalidad de prematuros tardíos con el uso de corticosteroides prenatales; sin embargo, sí notaron menor frecuencia de enfermedades respiratorias.
Norman et al.25 evaluaron el efecto de los corticosteroides prenatales en función del tiempo entre la primera dosis y el nacimiento; observaron mayor efecto sobre la mortalidad cuando el periodo de latencia fue mayor a 24horas (OR: 0,5; IC 95%: 0,4-0,6), sin embargo, sugieren que con 3horas puede haber reducción del riesgo (26%). En pacientes con latencias mayores a 7 días no se observó disminución de morbilidad.
Althabe et al.26, en países de escasos recursos económicos, no observaron decremento del riesgo de muerte neonatal (RR: 0,96, IC 95%: 0,87-1,06) después de incrementar la aplicación de corticoides prenatales del 10% al 45%, pero en pacientes expuestos la tasa de mortalidad poblacional se incrementó un 12,7% (de 23,9 defunciones/1.000 nacidos vivos a 27,4 defunciones/1.000 nacidos vivos; p=0,01). También hubo aumento de infecciones maternas (RR: 1,45; IC 95%: 1,33-1,58).
En un segundo análisis se sugiere que el aumento de la mortalidad se relacionó con defunciones por infecciones bacterianas (RR: 1,36; IC 95%: 1,12-1,65)27. En pacientes del HCGJIM se observó que a menor edad gestacional se incrementa el riesgo de muerte por infecciones bacterianas (RR: 1,17; IC 95%: 1,09-1,26), sin mostrar asociación con el uso de corticoides prenatales (RR: 1,34; IC 95%: 0,81-2,20).
Similar a nuestros resultados Sasaki et al.10 describieron en prematuros<34 semanas de gestación frecuencia del uso de corticoides del 40,6%; observaron disminución significativa de la mortalidad neonatal, sin decremento del SDR. Al analizar a los pacientes según la vía del nacimiento se identificó que los esteroides prenatales disminuyen el riesgo de SDR en los que nacen por vía vaginal. En pacientes del HCGJIM al ajustar los resultados por la vía de nacimiento no se observó modificación del riesgo de SDR (OR 1,12; IC 95% 0,82-1,53).
Las limitaciones de este estudio son el reducido número de pacientes con esquema de corticosteroides prenatales a dosis completas y con periodos de latencia>48horas; dado que solo se incluyeron pacientes prematuros que fueron ingresados al nacimiento, es probable un sesgo de selección, sin embargo el subgrupo de pacientes con edad gestacional<34 semanas y peso bajo al nacimiento fueron ingresados en su totalidad.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.