Introducción
La etapa neonatal es el período de la vida donde más infrecuentemente se diagnostica patología oncológica. Sin embargo, en los últimos años, ha aumentado su incidencia debido a la mejora de las técnicas ultrasonográficas, incrementándose progresivamente los diagnósticos prenatales, aunque este hecho no ha mejorado el pronóstico 1-8.
Los tumores neonatales difieren en la incidencia, historia natural y respuesta al tratamiento respecto a sus homólogos en niños más mayores 2,5,9-11.
Actualmente, constituyen un 0,5-2,5 % de las neoplasias malignas infantiles y provocan un total de 6,26 muertes por millón de recién nacidos vivos 1,9,12.
La práctica totalidad son tumores sólidos, siendo la leucemia el principal representante de los casos no sólidos y el que más mortalidad produce, junto a los tumores del sistema nervioso central (SNC) 1,5,8-11,13-19.
La asociación entre tumores neonatales y malformaciones congénitas es bien conocida, y se puede ver hasta en un 15 % de los casos 1.
En general, la historia natural del cáncer neonatal es más benigna que en otras épocas de la infancia; aunque podríamos decir que el patrón histológico (maligno/benigno) no es tan determinante como en otras edades, pues existen tumores malignos que se comportan de forma menos agresiva, incluso regresan espontáneamente 1-5,9,20 y otros benignos que por su localización pueden tener riesgo vital, malignizarse o recidivar de forma más agresiva 1,4-7,18,21-24.
Revisamos nuestra experiencia con los tumores malignos o potencialmente malignos diagnosticados en el Hospital Universitario de Canarias (HUC) en los últimos 25 años.
Pacientes y métodos
Se realizó una revisión retrospectiva y descriptiva de los 16 casos de neoplasias diagnosticadas durante la época neonatal (niños < 28 días de vida) en los últimos 25 años (entre enero de 1980 a septiembre de 2005) en nuestro centro (hospital de tercer nivel, referencia de la zona norte de la provincia de Santa Cruz de Tenerife).
Se analizaron las siguientes variables: porcentaje de neoplasias neonatales sobre el total de las diagnosticadas y registradas en nuestra Unidad de Oncohematología Pediátrica y su incidencia acumulada, sexo, año de diagnóstico, edad en el momento del diagnóstico clínico, y si se realizó prenatalmente, tipo de tumor (diagnóstico histológico), asociación a síndromes u otras malformaciones congénitas, tratamiento recibido (cirugía resección total, parcial o biopsia y/o quimioterapia) y su evolución posterior (respuesta al tratamiento, supervivencia y secuelas a largo plazo).
Los datos epidemiológicos se extrajeron del registro interno de nuestra unidad, del Registro Nacional de Tumores Infantiles (RNTI) de la Sociedad Española de Oncología Pediátrica (SEOP) y del Registro de Nacimientos del Servicio de Neonatología del HUC. Estos datos se compararon con los observados en la literatura médica de otras series similares y con los aportados por el RNTI en el período comprendido entre 1980-2004. Los datos clínicos y evolutivos se obtuvieron de la revisión de las historias clínicas de los casos y se obtuvieron estadísticas descriptivas de cada variable. Para el análisis estadístico de la supervivencia global (SG) actuarial se utilizó la curva de supervivencia observada, estimada por el método de Kaplan y Meier.
Resultados
Del total de 260 tumores malignos o potencialmente malignos diagnosticados, registrados y mayoritariamente atendidos en nuestra unidad en menores de 14 años, en los últimos 25 años; 6,1 % (n = 16) fueron diagnosticados durante los primeros 28 días de vida. La incidencia de cáncer neonatal, en dicho período, en nuestro centro ha sido de 276,5 casos por cada 10 6 recién nacidos (RN) vivos. La distribución anual de nuevos casos se mantiene constante durante el período de estudio (entre 0-2 casos/ año) salvo en 1983, en el que se diagnosticaron 3 nuevos casos.
De entre los neonatos afectados, el 56,2 % (n = 9) eran mujeres y el 43,8 % (n = 7) varones.
El diagnóstico se hizo prenatalmente en 5 casos; un 31,2 % del total (2 teratomas cervicales, otro sacrococcígeo, un nefroma mesoblástico y un tumor vascular cardíaco). Los diagnósticos previos al parto tuvieron lugar hasta en un 60 % (3/5 casos) en los últimos 7 años. Ninguno de los neuroblastomas se diagnosticó prenatalmente.
La edad media al diagnóstico clínico fue a los 5,5 días de vida (límites entre 1 y 28 días). En cuanto a la cronología del diagnóstico posparto, 5 neonatos (31,2 %) fueron diagnosticados en la exploración física inicial en paritorio o en el nido, tres (18,8 %) durante la primera semana de vida y en los tres restantes se demoró el diagnóstico hasta la segunda-tercera semana (un hemangiopericitoma de espalda, un tumor de fosa posterior y un neuroblastoma pélvico). Hasta en un 62,5 % tenían un diagnóstico clínico el primer día de vida. La forma clínica de presentación más frecuente fue el hallazgo de una masa en el neonato; habitualmente abdominal (37,5 %), presacra o cervical.
En los tumores en los que se demoró el diagnóstico más allá del primer día de vida se añadieron otros síntomas inespecíficos en la etapa neonatal como vómitos, irritabilidad, palidez y/o hepatoesplenomegalia. Como ejemplo, el único tumor cerebral de nuestra serie, ingresó a los 20 días de vida con vómitos proyectivos tras cada toma, clínica sugestiva de estenosis pilórica no confirmada ecográficamente, siendo dado de alta cuando mejoró la tolerancia oral, reingresando 4 días más tarde por irritabilidad, fontanela abombada y aumento del perímetro craneal. Los test de imagen confirmaron la existencia de un proceso expansivo intracraneal.
Los diagnósticos histopatológicos y la localización de los tumores estudiados fueron los siguientes (tabla 1): 5 neuroblastomas (2 estadios I localizados, uno en la glándula suprarrenal izquierda y el otro en la derecha; 2 estadios II, uno localizado en la suprarrenal izquierda y el otro paravertebral en la región pélvica izquierda a nivel de L4-S1; y un estadio IV-S en el que el tumor primario estaba en la suprarrenal izquierda), representando un 31,2 % del total; 4 teratomas/tumores de células germinales (TCG) (25 %) de los cuales 2 eran cervicales (ambos inmaduros) y 2 sacrococcígeos (maduros, uno de ellos con áreas de tumor del seno endodérmico); 3 tumores de partes blandas no rabdomiosarcomas (un fibrosarcoma congénito en el muslo derecho y 2 hemangiopericitomas, uno localizado en la espalda y el otro cardíaco) resultando un 18,8 %; un tumor renal (nefroma mesoblástico); un tumor cerebral localizado en la fosa posterior (ependimoblastoma); un melanoma in situ asociado a un nevo melanocítico congénito gigante y una leucemia congénita, en una paciente afectada de síndrome de Down. El 93,8 % eran tumores sólidos y sólo uno era una neoplasia hematológica.
Respecto a los tratamientos administrados (tabla 1), una mayoría recibieron únicamente cirugía (n = 10; 62,5 %) con resección completa macroscópica de la tumoración primaria inicialmente en todos ellos, en otros (n = 5; 31,3 %) se utilizó quimioterapia tras la cirugía total (hemangiopericitoma de espalda y fibrosarcoma congénito), parcial (2 neuroblastomas) o la biopsia inicial (hemangiopericitoma cardíaco), y la leucemia no llegó a recibir quimioterapia. En ninguno se utilizó radioterapia.
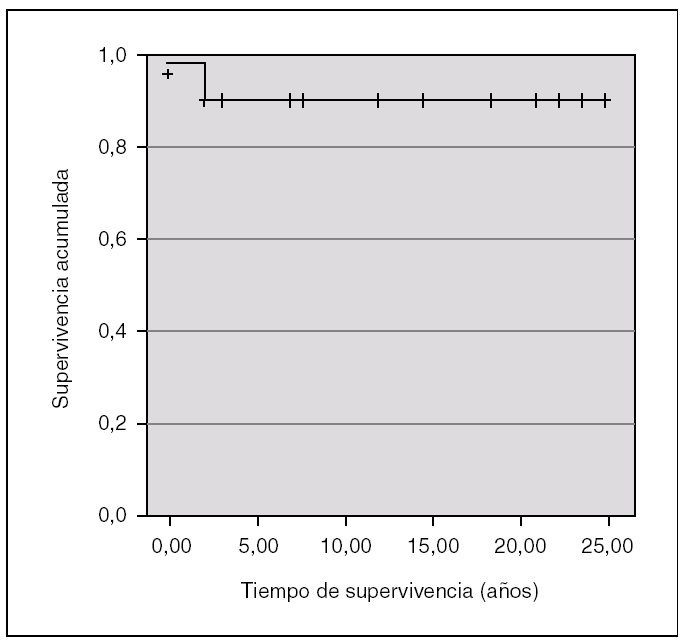
La mayor parte evolucionaron favorablemente, encontrándose en la actualidad 14 casos vivos (SG: 87,5 %), de los cuales 12 se hallan libres de enfermedad (75 %), un neuroblastoma IV-S presenta una enfermedad mínima tras 3 años del diagnóstico y el hemangiopericitoma cardíaco (diagnóstico histológico y tratamiento en otro centro [Hospital Materno-Infantil La Paz de Madrid]) con una remisión parcial en el momento actual (fig. 1). Uno de los teratomas cervicales recayó localmente en el suelo de la cavidad oral 2,5 años después, precisando una nueva intervención quirúrgica, encontrándose desde entonces en remisión completa.
Figura 1. Curva de supervivencia a 25 años de los tumores neonatales malignos y potencialmente malignos en el Hospital Universitario de Canarias (supervivencia global = 87,5 %).
Cuatro del total de los supervivientes libres de enfermedad (33,3 %) presentan algún tipo de secuela: defectos estéticos locales y/o asimetrías-contracturas secundarios a la resección quirúrgica el hemangiopericitoma de espalda, el teratoma cervical que recidivó y el fibrosarcoma congénito, y el neuroblastoma pélvico quedó con una paresia permanente de la extremidad inferior izquierda (pie equino) y una hipoacusia neurosensorial moderada secundaria a toxicidad por el cisplatino. Todos ellos han requerido cirugías reparadoras y/o rehabilitación para su control.
Han fallecido 2 pacientes: la leucemia congénita, en el año 1986, que inició el tercer día de vida con una leucocitosis (máximo 48,7 ×10 9/l), blastos en sangre periférica, anemia y trombocitopenia, revirtiendo a las 11 semanas sin tratamiento específico, desarrollando a los 11 meses una leucemia megacarioblástica, y falleciendo 8 meses más tarde por progresión de la enfermedad, y el ependimoblastoma que falleció a los 2 meses y 3 semanas de vida a consecuencia de una sepsis y meningitis por Klebsiella pneumoniae, coincidiendo con una recaída local.
Discusión
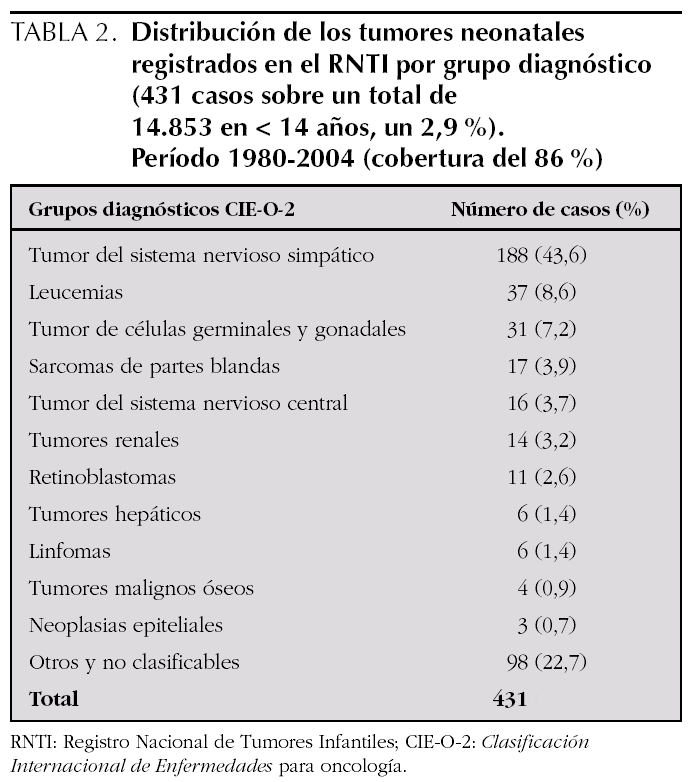
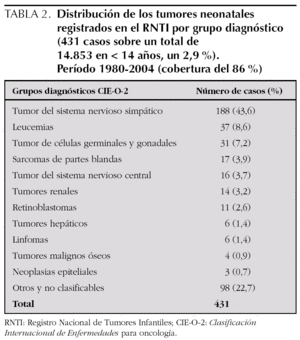
Las neoplasias neonatales son muy poco frecuentes; no obstante, es difícil definir su incidencia exacta porque las diferentes series siguen criterios distintos, sobre todo con respecto a la edad al diagnóstico (antes de los 28 días o del mes o incluso de los 6 meses de vida, al incluir el concepto de tumor congénito) y según los tipos histológicos incluidos 1,5,9-10,13,16. En nuestra serie, el 6,1 % del total de neoplasias en menores de 14 años se presentaron antes de los 28 días de vida, proporción más elevada a la referida en otras series (0,5-2,5 %) 1,5,16 y en el RNTI (2,9 %) en el mismo período de nuestro estudio (tabla 2). Escasas series presentan una proporción mayor (17 %) 9. Los casos nuevos por año varían desde 0,33 hasta 38,5 1; siendo 17,2 en el RNTI y 0,64 en nuestra serie. La tasa de incidencia acumulada observada (1 caso por cada 3.617 RN vivos) es bastante superior a la de otros (1 por cada 12.500-27.500 RN vivos) 1,9,10, debido a que hemos incluido sólo el número total de neonatos nacidos en nuestro centro y no el total de nuestra área de cobertura asistencial. Predominan ligeramente en el sexo femenino 1,10,13,16, como en nuestra serie, debido a que los teratomas son más frecuentes en niñas 7,21,22,24.
La generalización de la ecografía prenatal, la mejor resolución de las imágenes y las habilidades de los ecografistas están adelantando su diagnóstico 1-8,25, como ocurre en nuestro estudio en los últimos 7 años, con un 60 % de diagnósticos prenatales (31,2 % en todo el período). En otras revisiones los diagnósticos prenatales oscilan entre un 33,3-48 % 5,10. Esta detección precoz nos puede precipitar a tratar tumores que, dejados a su evolución nunca dieran clínica o cuya historia natural fuera la involución espontánea, como ocurre en algunos neuroblastomas 1-5,8,20,26.
Respecto a la cronología diagnóstica, el 68,8 % de los nuestros, incluyendo los prenatales; fueron diagnosticados el primer día de vida y hasta el 81,2 % durante la primera semana. En otras revisiones, el 50-85,5 % se diagnostican el primer día de vida 5,9,10,16,20. Diversos programas de cribado han conseguido detectar tumores más pronto; pero sin influir en su pronóstico a largo plazo 1,2,26.
Se conoce que la incidencia relativa de los diferentes tipos de tumores y el patrón de localización anatómica en el neonato difieren de la observada en otras edades pediátricas, en las que prevalecen en primer lugar las leucemias y en segundo lugar los tumores cerebrales 2,9,19,27. La mayoría de los tumores neonatales son sólidos y su clínica de presentación es la de una masa palpable y/o visible 1,2,5,8-10,14-16. En nuestra serie los tipos histológicos más frecuentes han sido en primer lugar los neuroblastomas, seguidos de los teratomas/TCG, tal como se refleja en diversas series 5,9,15,28 y en el RNTI (tabla 2); aunque en otras revisiones los teratomas/TCG son los más frecuentes, seguidos por los neuroblastomas, sarcomas y tumores cerebrales 1,6,10,13,16,21,24. El tumor que más se diagnostica en el primer mes de vida es el teratoma sacrococcígeo con una incidencia de 1 por cada 35.000 RN vivos 6-8,10,21,22,24, que en nuestro grupo representa 1 por cada 28.932 RN vivos. El neuroblastoma de origen suprarrenal es el más diagnosticado prenatalmente, la mayor parte estadios I 1,3,4,20,28; aunque en nuestra serie ninguno se diagnosticó intraútero. También como masa abdominal podemos encontrar tumores renales, destacando en esta edad, el nefroma mesoblástico, que posee escasa malignidad 4,8,10,14,29 y tumores hepáticos, teniendo en cuenta que el hepatoblastoma es el único maligno de forma primaria en el neonato 5,16,17.
Los sarcomas de partes blandas constituyen un grupo muy heterogéneo, que pueden desarrollarse en cualquier parte del cuerpo. De éstos, el fibrosarcoma congénito suele presentarse como una masa firme solitaria y localizada (80 %), sobre todo en muslo, con un crecimiento infiltrante característico de las tumoraciones malignas, pero sin metastatizar, y el hemangiopericitoma puede desarrollarse en cualquier sitio donde haya capilares; siendo más frecuente en las extremidades 15,18. En nuestra serie uno estaba localizado en la espalda y el otro cardíaco. De los tumores cardíacos que suelen diagnosticarse en neonatos, hemos encontrado un único caso de hemangiopericitoma referido en la literatura especializada 4,30.
Los tumores cerebrales son muchísimo menos frecuentes en RN que en niños más mayores. El síntoma más frecuente de presentación es la macrocefalia. Existen diversos tipos histológicos y presentan una alta mortalidad (SG del 28 %) 19.
La biología y las características clínicas de las leucemias congénitas difieren con las que se presentan en otras edades, y el pronóstico es generalmente sombrío (SG al año del 23 %). Las leucemias agudas no linfoblásticas son más frecuentes que las linfoblásticas y en las primeras se logran conseguir más remisiones completas 9,11,31. Los RN con síndrome de Down pueden presentar un tipo particular de leucemia que se ha asociado a un alto porcentaje de remisiones espontáneas (trastorno mieloproliferativo transitorio). De éstos, un 13-33 % desarrollarán durante los primeros 3 años una leucemia megacarioblástica 11,32, como sucedió en nuestra paciente.
El melanoma congénito maligno es excepcional, y lesiones melanocíticas benignas a veces se asocian con nevos melanocíticos congénitos gigantes 33-35.
La importancia de los factores genéticos en la carcinogénesis fetal queda patente cuando se objetiva que hasta un 15 % de estas neoplasias están asociadas a distintos síndromes o malformaciones congénitas, siendo los que más influyen en su etiopatogenia. El riesgo de desarrollar cáncer durante el primer año de vida es seis veces mayor en los que presentan malformaciones congénitas, lo que obliga seguir a estos pacientes de por vida, aún libres de enfermedad 1,13. Los afectados de síndrome de Down (10-20 veces mayor riesgo de desarrollar leucemia), y los que presentan alteraciones del SNC o de las vías urinarias, son los que más riesgo presentan 11,25,29,31,32,36. Existe una escasa repercusión de los factores ambientales tras el nacimiento, aunque sí que existen factores intrauterinos involucrados de exposición ambiental (radiaciones ionizantes, radionúclidos, fármacos, tóxicos o infecciones) y de transmisión transplacentaria (leucemia y melanoma neonatal de origen materno) 1,9,37-39. Nuestra serie tiene las peculiaridades de carecer de retinoblastomas, como prototipo de tumor congénito 1,13 y de presentar un porcentaje de asociación a malformaciones congénitas ligeramente inferior (12,5 %) a otras.
En cuanto a su seguimiento terapéutico, hay que conocer que los tipos histológicos y su comportamiento son en general más favorables en este período que en otras edades, lo que permite reducir mucho la utilización de quimioterapia y/o radioterapia 1,2,5-9. La cirugía tiene un papel fundamental y es el tratamiento de elección cuando el tumor está localizado 5,6,8-10,15,23,24,27,28. Especial riesgo presentan los teratomas cervicales, que aunque la mayoría son benignos, asocian un riesgo elevado por obstrucción de la vía aérea superior, por lo que requieren una pronta resección quirúrgica 3,4,23. Hasta un tercio de las neoplasias neonatales precisan quimioterapia sola 11,31 o asociada a cirugía 5,13,15,17,22, como en nuestra serie. Hay que tener especial precaución y conocimiento de las particularidades del neonato (mayor proporción de agua corporal), para de esta forma evitar en lo posible las toxicidades agudas y a largo plazo, derivadas de la quimioterapia. Es preferible dosificarla por kilogramo de peso; ya que la farmacocinética es diferente a otras edades 2,8-11,28. La radioterapia, al tratarse de una edad muy delicada respecto a las complicaciones derivadas de ella, debe ser evitada en lo posible en esta época de la vida 2,8,10,13,20.
El cáncer neonatal provoca 6,26 muertes por millón de RN vivos y su mortalidad es la más baja de la oncología pediátrica 1,9,12. Las recaídas/progresión de la enfermedad y las complicaciones relacionadas con el tratamiento son las causas más frecuentes de muerte 9-11,13,16,18,19,27. En nuestra serie la mortalidad representa un 12,5 %, siendo particularmente favorable la escasa referida a tumores sólidos (7 %), encontrándose resultados menos optimistas (20-60 %) en otros trabajos 5,10,12,15,16. Es destacable que actualmente el 75 % de nuestros pacientes, algunos ya adultos, se encuentran libres de enfermedad; aunque un tercio presentan secuelas derivadas del tratamiento o de la propia enfermedad, datos similares o incluso menores a los referidos en otras series 3,5,15,19,21.
A la vista de los resultados observados en nuestra limitada serie, concluimos que las neoplasias neonatales son cada vez más frecuentemente diagnosticadas intraútero, la mayoría son tumores sólidos, de los cuales los tipos histológicos más frecuentes son el neuroblastoma y los teratomas/TCG, predominan algo más en el sexo femenino, y su historia natural, a excepción de las leucemias y los tumores cerebrales, es más benigna que en otras épocas de la vida, por lo que precisan tratamientos menos agresivos, siendo la cirugía el más utilizado, y evolucionando una mayoría hacia la curación. Por lo tanto, para su óptimo tratamiento se requiere un diferente abordaje que en otras épocas de la vida, de forma multidisciplinar y en centros especializados.
Agradecimientos
Al RNTI por los datos nacionales aportados y a los doctores Juan Mario Troyano Luque y Matilde Teresa Clavijo Rodríguez del Servicio de Ginecología y Obstetricia (Unidad de Fisiopatología Fetal) del Hospital Universitario de Canarias, por su inestimable colaboración en el diagnóstico prenatal de nuestros pacientes.
Correspondencia: Dr. R. López Almaraz.
Servicio de Pediatría. Unidad de Oncohematología Pediátrica.
Hospital Universitario de Canarias.
Ctra. Ofra, s/n. La Cuesta. 38320 La Laguna. Santa Cruz de Tenerife. España.
Correo electrónico: rlopez@huc.canarias.org
Recibido en diciembre de 2005.Aceptado para su publicación en julio de 2006.