La corticoterapia continúa siendo la piedra angular en el tratamiento del síndrome nefrótico. El manejo de los pacientes que desarrollan dependencia a esteroides es complejo, implicando distintas pautas de fármacos inmunosupresores. El rituximab, anticuerpo monoclonal anti-CD20, parece tener efectos beneficiosos en pacientes con síndrome nefrótico córtico-dependiente de difícil manejo clínico, si bien aún no está bien definido su papel en esta entidad. Con el fin de aportar información útil sobre el papel del rituximab en esta patología, presentamos nuestra experiencia personal en pacientes pediátricos tratados con este fármaco en los últimos años.
Materiales y métodosEstudio retrospectivo en pacientes con síndrome nefrótico idiopático córtico-dependiente controlados en la Sección de Nefrología Pediátrica de un hospital terciario español, y que habían recibido, al menos, un ciclo de tratamiento con rituximab durante cualquier momento de la evolución de la enfermedad.
ResultadosSe incluyeron en el estudio ocho pacientes. Todos habían recibido terapia inmunosupresora previamente. El rituximab se administró por vía intravenosa a una dosis de 375 mg/m2, y todas las dosis se administraron en situación de remisión de la enfermedad. Se confirmó la depleción completa de linfocitos B (CD 19%), tras la primera dosis de rituximab en todos, excepto en uno, en el que el recuento fue del 1%. El período de depleción fue de 10,3 meses (mediana; rango 6,5-16 meses), y solamente en uno de los pacientes se registró una recaída de la enfermedad durante este período. Tras el inicio del tratamiento, se observó una reducción en el número de recaídas (3,6 recaídas/año en el año previo al inicio del tratamiento vs. 0,1 recaídas/año durante el primer año posrituximab). La supervivencia libre de recaída en el primer año fue del 83,3% en los pacientes, con más de una recaída (75% de los pacientes), sin existir recaídas tras el inicio del tratamiento en dos pacientes. En un 87,5% de los pacientes se pudieron retirar uno o más fármacos tras el primer ciclo de rituximab. Tras el tratamiento con rituximab, se consiguió una reducción del 96,5% de las dosis de corticoides administrados (28,5 mg/m2/día en los tres meses pretratamiento vs. 1 mg/m2/día en los tres últimos meses de seguimiento en los pacientes tratados). Tras el período de seguimiento posrituximab (mediana 46,5 meses, rango 5-97 meses), no se observaron efectos adversos significativos atribuibles al fármaco.
ConclusionesLos resultados favorables reportados tras el tratamiento con rituximab en nuestros pacientes parecen confirmar la eficacia del fármaco en el síndrome nefrótico córtico-dependiente y lo hacen considerar como una opción terapéutica válida en casos de difícil manejo clínico en la edad pediátrica. Aun así, parece recomendable diseñar estudios apropiados que traten de aclarar, entre otros, el régimen óptimo de tratamiento (dosis, intervalo y número de ciclos), repercusión clínica y potenciales efectos adversos a largo plazo.
Corticosteroids have had a central role in the treatment of nephrotic syndrome. The management of these patients who become dependent to steroids is complex, involving different immunosuppressive drugs patterns. The monoclonal antibody anti CD20, Rituximab, is likely to have beneficial effects in cases of steroid-dependent nephrotic syndrome patients with no easy resolution, even when we cannot make a statement about the specific role in the impact. We bring our personal experience in pediatric patients treated with this medication during the last years, to provide a thorough overview and useful information about the role of Rituximab in this pathology.
MethodsRetrospective study in patients with steroid-dependent idiopathic nephrotic syndrome controlled in the division of Pediatric Nephrology of a spanish tertiary hospital in those patients who had received at least one treatment cycle of Rituximab, at any moment along the evolution of the disease.
ResultsThe study involved 8 patients. All of them previously received immunosuppressive therapy. The Rituximab were administered as an intravenous infusion, in a dose of 375 mg/m2, and all doses were administered in a period during which the disease was in remission. The depletion of lymphocytes B (CD 19%) were confirmed after the first dose of Rituximab except for one, with a lymphocyte count of 1%. The period of depletion lasts 10.3 months (median; range 6.5-16 months), and only one of the patients registered a relapse of the disease in this period. A reduction of relapses suffered by patients has been shown after the treatment began (3.6 relapses/year in the previous year to the start of the treatment vs. 0.1 relapses/year during the first year post-rituximab). The relapse-free survival in the first year reached 83.3% in patients who suffered more than one relapse (75% of patients), and without a relapse after the treatment began in 2 cases. One or more drugs could be removed in 87.5% of patients after the first cycle of rituximab. After the rituximab treatment, we reached a 96.5% decrease in the corticosteroids doses administered (28.5 mg/m2/day during the 3 months pre-treatment vs. 1 mg/m2/day in the last 3 months of patient monitoring). Not a significant observed adverse effect attributed to the drug after the post-rituximab monitoring period (median 46.5 months, range 5-97 months).
ConclusionThe favorable results reported after rituximab treatment in our patients seems to confirm the effectiveness of this drug in the steroid-dependent nephrotic syndrome, making that therapeutic option into consideration and legitimating the use of the drug in complex cases involving pediatric patients. Even so, it seems recommendable to design pertinent studies to clarify, among others, the optimum regimen of the treatment (dose, interval and cycles), clinical repercussion and potential adverse effects in long terms.
El síndrome nefrótico (SN) es la enfermedad glomerular crónica más frecuente en pediatría. Se define como una glomerulopatía que cursa con proteinuria mayor de 40 mg/m2/h, hipoalbuminemia inferior a 2,5 g/dL y edemas. Tiene una incidencia de 2-7 nuevos casos por 100.000 niños por año y una prevalencia más alta (15 casos por 100.000 niños), como consecuencia del curso prolongado de la enfermedad. Es más frecuente en varones (2:1) y se da sobre todo en edades comprendidas entre los dos a ocho años, con un pico de incidencia entre los tres a cinco años. El SN idiopático constituye el 90% de los SN en la infancia, suponiendo la enfermedad por cambios mínimos (ECM) el tipo histológico más frecuente, seguida de la glomeruloesclerosis focal y segmentaria (GEFS).
La corticoterapia supone la base del manejo del SN. La mayoría de los niños responde a esteroides, aunque un 20% desarrollan resistencia terapéutica durante algún momento de la evolución de la enfermedad. Alrededor del 50% de los pacientes con SN sensible a los corticoides desarrollan recaídas frecuentes (más de dos recaídas en los seis primeros meses, o más de tres en un año en cualquier momento evolutivo), de los cuales aproximadamente 50-60% las presentan durante el tratamiento esteroideo o en el período inicial de su supresión, lo que define al SN córtico-dependiente.
Para tratar de reducir o eliminar la terapia esteroidea y sus efectos adversos, se utilizan agentes inmunosupresores como ciclofosfamida, clorambucilo, levamisol, micofenolato de mofetilo, ciclosporina A y/o tacrolimus, si bien no existe un consenso en cuanto a la elección, duración y secuencia de estos fármacos de segunda línea. En el 2004, se comunicó por primera vez que el rituximab (RTX), un anticuerpo monoclonal anti-CD20 quimérico, que inhibe la proliferación y diferenciación de células B mediadas por CD20, podría tener efectos beneficiosos en el SN. Los mecanismos terapéuticos del RTX no son completamente conocidos en esta enfermedad, pero además de su actividad sobre los linfocitos B, incluyen dianas potenciales a nivel de infocitos T, citoquinas inflamatorias e, incluso, los propios podocitos1.
Desde el año 2004, diferentes estudios han ofrecido resultados alentadores sobre el papel de este anticuerpo en los pacientes con SN de difícil control clínico, si bien aún no se han establecido de forma adecuada sus indicaciones específicas, una pauta terapéutica consensuada, o sus efectos a largo plazo. Con el fin de aportar información útil para definir el papel de RTX en el SN idiopático córtico-dependiente presentamos nuestra experiencia en pacientes pediátricos tratados con este fármaco en los últimos años.
Material y métodosEstudio retrospectivo en pacientes con SN idiopático córtico-dependiente controlados en la Sección de Nefrología Pediátrica de un hospital terciario español, y que habían recibido, al menos, un ciclo de tratamiento con RTX durante cualquier momento de la evolución de la enfermedad.
Protocolo de tratamiento con RTXPreviamente a la primera infusión de cada ciclo de RTX, se solicitó hemograma, bioquímica sanguínea, serología de virus de hepatitis B y C, recuento de subpoblaciones linfocitarias, niveles de inmunoglobulinas y radiografía de tórax (solo en el primer ciclo). Siguiendo recomendaciones previas2,3, todas las dosis de RTX se administraron en situación de remisión de la enfermedad, inducida esta mediante pautas convencionales de tratamiento esteroideo, de tal forma que en el momento de la infusión de RTX todos los pacientes recibían una dosis de prednisona de 40 mg/m2/48 h. El resto de inmunosupresores fueron suspendidos antes del tratamiento con RTX.
El RTX se administró en régimen de hospital de día, por vía intravenosa (en solución salina fisiológica, concentración 1 mg/mL), a una dosis de 375 mg/m2. Todos los pacientes recibieron premedicación, 30-60 min antes de la administración del fármaco, con paracetamol (15 mg/kg) y dexclorfeniramina (0,1 mg/kg) orales y esteroide intravenoso (hidrocortisona, 4 mg/kg o metilprednisolona, 1-1,5 mg/kg), con el objetivo de minimizar los potenciales efectos secundarios. La primera infusión del fármaco fue administrada en 4-6 h, con un ritmo inicial de 25 mL/h, con aumento progresivo hasta 150-200 mL/h, en caso de tolerancia adecuada. En dosis posteriores, el fármaco se administró a un ritmo superior, en un período aproximado de 3 h.
Una semana después de la primera dosis del fármaco, y una vez comprobada la depleción de linfocitos B, se inició profilaxis con trimetoprima-sulfametoxazol vs. Pneumocystis y se inició descenso progresivo de la dosis esteroidea (habitualmente 10 mg/m2 cada dos semanas), hasta su completa suspensión. Los primeros pacientes incluidos en el estudio recibieron, asimismo, tratamiento electivo con micofenolato de mofetilo a partir de los tres meses de la primera infusión de RTX.
La respuesta a RTX se vigiló mediante controles clínicos trimestrales y recuento de linfocitos B, inmunoglobulinas y hemograma, aproximadamente con la misma periodicidad, hasta comprobar la normalización de subpoblaciones linfocitarias. En caso de persistir hipogammaglobulinemia, se repitieron niveles de inmunoglobulinas en cada revisión posterior del paciente.
En todos los pacientes incluidos en el estudio, la pauta de tratamiento ante una recaída fue inducir la remisión exclusivamente con esteroides y pautar un nuevo ciclo de RTX en ese momento.
Datos clínicos analizadosA partir de las historias clínicas se recopilaron los siguientes datos: (1) características del paciente y del SN (sexo, edad al diagnóstico y evolución del SN, histología, función renal, inmunosupresores recibidos desde el debut, edad al inicio del tratamiento con RTX); (2) situación basal al inicio del RTX (recaídas en el último año, dosis de inmunosupresores recibidas en los últimos tres meses); (3) características descriptivas del tratamiento con RTX (número de dosis y ciclos administrados, profilaxis antibiótica durante el mismo, fármacos, inmunosupresores administrados durante el tratamiento, efectos adversos durante la infusión, valoración del período de depleción de linfocitos B); y (4) respuesta al mismo, estimada con base en los períodos de remisión o recaída de la enfermedad, necesidad de dosis posterior de RTX, esteroides y otros inmunosupresores.
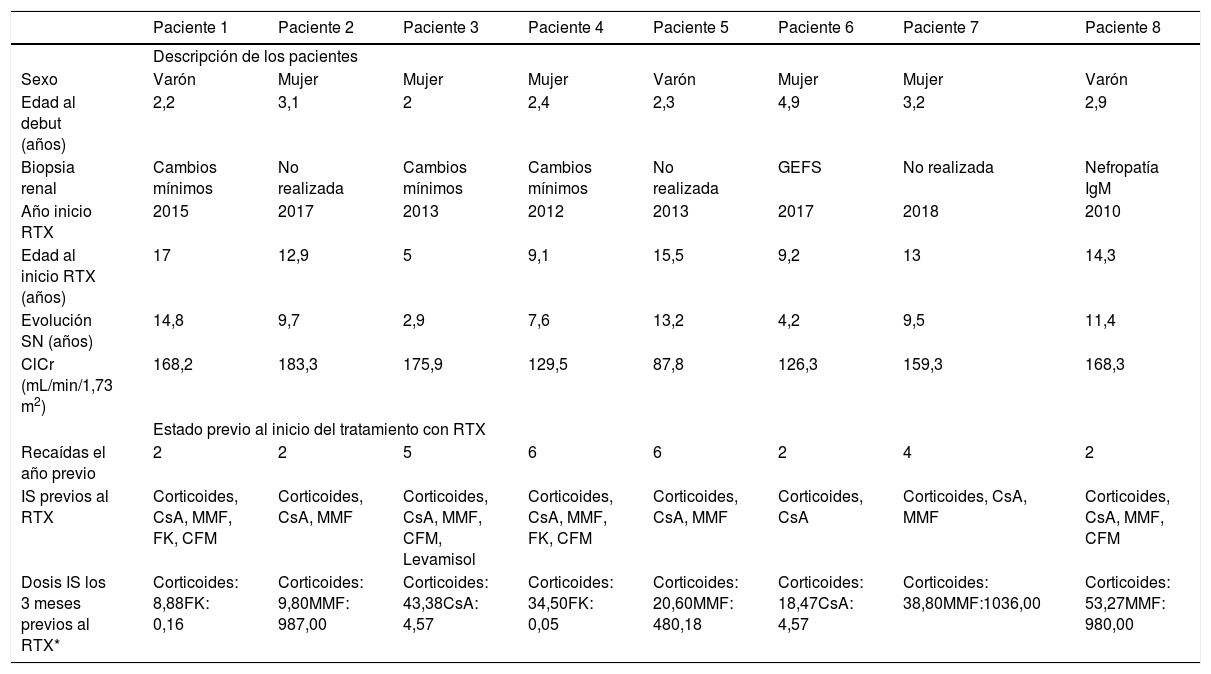
ResultadosDescripción basal de los pacientesSe incluyeron en el estudio ocho pacientes (cinco mujeres, tres varones), con medianas de edad al debut y evolución del SN antes del inicio del tratamiento con RTX de 2,7 (rango 2,0-4,9) y 9,6 (rango 2,9-14,8) años, respectivamente. Todos los pacientes incluidos en el estudio estaban diagnosticados de SN córtico-dependiente. Cinco de los ocho pacientes tenían realizada una biopsia renal previa al tratamiento con RTX: tres pacientes presentaban un diagnóstico histológico compatible con cambios mínimos, uno con glomeruloesclerosis segmentaria y focal y otro con nefropatía IgM. Todos los pacientes presentaban un filtrado glomerular estimado en rango normal para su edad en el momento de la primera dosis de RTX (tabla 1).
Descripción de los pacientes
| Paciente 1 | Paciente 2 | Paciente 3 | Paciente 4 | Paciente 5 | Paciente 6 | Paciente 7 | Paciente 8 | |
|---|---|---|---|---|---|---|---|---|
| Descripción de los pacientes | ||||||||
| Sexo | Varón | Mujer | Mujer | Mujer | Varón | Mujer | Mujer | Varón |
| Edad al debut (años) | 2,2 | 3,1 | 2 | 2,4 | 2,3 | 4,9 | 3,2 | 2,9 |
| Biopsia renal | Cambios mínimos | No realizada | Cambios mínimos | Cambios mínimos | No realizada | GEFS | No realizada | Nefropatía IgM |
| Año inicio RTX | 2015 | 2017 | 2013 | 2012 | 2013 | 2017 | 2018 | 2010 |
| Edad al inicio RTX (años) | 17 | 12,9 | 5 | 9,1 | 15,5 | 9,2 | 13 | 14,3 |
| Evolución SN (años) | 14,8 | 9,7 | 2,9 | 7,6 | 13,2 | 4,2 | 9,5 | 11,4 |
| ClCr (mL/min/1,73 m2) | 168,2 | 183,3 | 175,9 | 129,5 | 87,8 | 126,3 | 159,3 | 168,3 |
| Estado previo al inicio del tratamiento con RTX | ||||||||
| Recaídas el año previo | 2 | 2 | 5 | 6 | 6 | 2 | 4 | 2 |
| IS previos al RTX | Corticoides, CsA, MMF, FK, CFM | Corticoides, CsA, MMF | Corticoides, CsA, MMF, CFM, Levamisol | Corticoides, CsA, MMF, FK, CFM | Corticoides, CsA, MMF | Corticoides, CsA | Corticoides, CsA, MMF | Corticoides, CsA, MMF, CFM |
| Dosis IS los 3 meses previos al RTX* | Corticoides: 8,88FK: 0,16 | Corticoides: 9,80MMF: 987,00 | Corticoides: 43,38CsA: 4,57 | Corticoides: 34,50FK: 0,05 | Corticoides: 20,60MMF: 480,18 | Corticoides: 18,47CsA: 4,57 | Corticoides: 38,80MMF:1036,00 | Corticoides: 53,27MMF: 980,00 |
GEFS: glomeruloesclerosis focal y segmentaria; RTX: rituximab; ClCr: aclaramiento de creatinina; IS: inmunosupresores; CsA: ciclosporina A; MMF: micofenolato de mofetilo; FK: tacrolimus; CFM: ciclofosfamida.
La mediana de edad a la primera dosis de RTX fue de 12,9 años (rango 5,0-17,0 años). Antes del primer ciclo de RTX, todos los pacientes habían recibido tratamiento con esteroides y diferentes inmunosupresores, entre los que se incluían, por orden de frecuencia, ciclosporina A (100%), micofenolato de mofetilo (87,5%), ciclofosfamida (50%), tacrolimus (25%) y levamisol (12,5%). Durante el año anterior al inicio de RTX, los pacientes habían presentado una media de 3,6 recaídas al año, que fueron tratadas de forma convencional con esteroides durante cada uno de los episodios. En los tres meses previos, además de corticoides todos los pacientes habían recibido otro inmunosupresor, cuatro micofenolato de mofetilo (dosis media de 870,8 mg/m2/día), dos ciclosporina A (dosis media de 3,6 mg/kg/día) y dos tacrolimus (dosis media de 0,1 mg/kg/día).
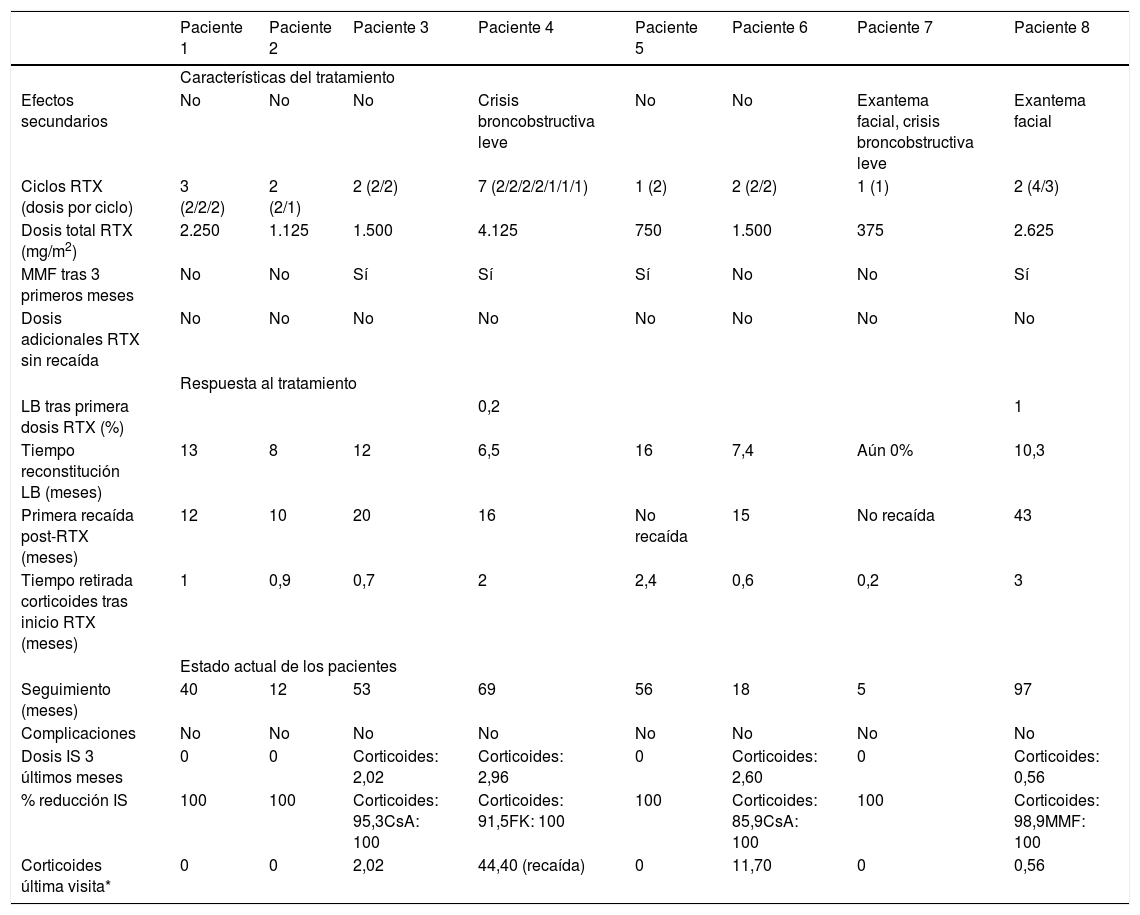
Tratamiento con RTX y respuesta clínicaLa pauta terapéutica inicial consistió en un ciclo de dos infusiones semanales de RTX en seis pacientes, una única infusión en un paciente y cuatro infusiones semanales en otro paciente. Tras esta pauta inicial, dos pacientes no requirieron nuevas dosis de RTX, mientras que seis pacientes requirieron nuevos ciclos de RTX (rango 2-7 ciclos), con el objetivo de mantener a los pacientes en remisión (tabla 2).
Características del tratamiento
| Paciente 1 | Paciente 2 | Paciente 3 | Paciente 4 | Paciente 5 | Paciente 6 | Paciente 7 | Paciente 8 | |
|---|---|---|---|---|---|---|---|---|
| Características del tratamiento | ||||||||
| Efectos secundarios | No | No | No | Crisis broncobstructiva leve | No | No | Exantema facial, crisis broncobstructiva leve | Exantema facial |
| Ciclos RTX (dosis por ciclo) | 3 (2/2/2) | 2 (2/1) | 2 (2/2) | 7 (2/2/2/2/1/1/1) | 1 (2) | 2 (2/2) | 1 (1) | 2 (4/3) |
| Dosis total RTX (mg/m2) | 2.250 | 1.125 | 1.500 | 4.125 | 750 | 1.500 | 375 | 2.625 |
| MMF tras 3 primeros meses | No | No | Sí | Sí | Sí | No | No | Sí |
| Dosis adicionales RTX sin recaída | No | No | No | No | No | No | No | No |
| Respuesta al tratamiento | ||||||||
| LB tras primera dosis RTX (%) | 0,2 | 1 | ||||||
| Tiempo reconstitución LB (meses) | 13 | 8 | 12 | 6,5 | 16 | 7,4 | Aún 0% | 10,3 |
| Primera recaída post-RTX (meses) | 12 | 10 | 20 | 16 | No recaída | 15 | No recaída | 43 |
| Tiempo retirada corticoides tras inicio RTX (meses) | 1 | 0,9 | 0,7 | 2 | 2,4 | 0,6 | 0,2 | 3 |
| Estado actual de los pacientes | ||||||||
| Seguimiento (meses) | 40 | 12 | 53 | 69 | 56 | 18 | 5 | 97 |
| Complicaciones | No | No | No | No | No | No | No | No |
| Dosis IS 3 últimos meses | 0 | 0 | Corticoides: 2,02 | Corticoides: 2,96 | 0 | Corticoides: 2,60 | 0 | Corticoides: 0,56 |
| % reducción IS | 100 | 100 | Corticoides: 95,3CsA: 100 | Corticoides: 91,5FK: 100 | 100 | Corticoides: 85,9CsA: 100 | 100 | Corticoides: 98,9MMF: 100 |
| Corticoides última visita* | 0 | 0 | 2,02 | 44,40 (recaída) | 0 | 11,70 | 0 | 0,56 |
RTX: rituximab; MMF: micofenolato de mofetilo; FK: tacrolimus; LB: linfocitos B; IS: inmunosupresores; CsA: ciclosporina A.
Se confirmó la deplección completa de linfocitos B (CD 19%), tras la primera dosis de RTX en todos los pacientes, excepto en uno, en el que el recuento fue del 1%. El período de depleción de linfocitos B fue de 10,3 meses (mediana; rango 6,5-16 meses), y solamente en un paciente se registró una recaída de la enfermedad durante el período de depleción de los linfocitos.
Tras la administración del RTX, se observó una reducción en el número de recaídas (3,6 recaídas/año en el año previo al inicio del tratamiento vs. 0,1 recaídas/año durante el primer año post-RTX). En los pacientes que tuvieron recaídas tras iniciar el tratamiento con RTX (75% de los mismos), la supervivencia libre de recaída durante el primer año post-RTX fue del 83,3%. La mediana de tiempo de la primera recaída tras la primera infusión de RTX fue de 15,5 meses (rango 10-43 meses). Con todo ello, la mediana de tiempo de decalaje entre la reconstitución observada de linfocitos B y la primera recaída post-RTX fue de 7,8 meses (rango 1-32,7 meses).
En todos los pacientes se retiraron los inmunosupresores, coincidiendo con la administración de RTX. En la mitad de ellos, especialmente en los primeros casos en los que se administró el RTX, se asoció micofenolato de mofetilo (400-600 mg/m2/12 h), a partir de los tres meses de la primera infusión del fármaco, manteniéndose de forma ininterrumpida hasta la aparición de una nueva recaída. Esta indicación está basada en estudios previos publicados4-6, donde se observó cómo la combinación de RTX con micofenolato de mofetilo mejoraba la eficacia del tratamiento, al retrasar este último la repleción de los linfocitos B, lo que se sugiere también en nuestros resultados (p 0,05). Posteriormente (y desde el inicio en el 50% de pacientes restantes en los que no se administró MMF), no se tuvieron que iniciar otros inmunosupresores, más allá de los esteroides. Comparando las dosis de corticoides recibidas por los pacientes los tres meses previos al inicio del RTX, con respecto a los últimos tres meses de seguimiento (mediana 46,5 meses, rango 5-97 meses), se consiguió una reducción del 96,5% (media de 28,5 mg/m2/día vs. media de 1 mg/m2/día).
Efectos adversosTres pacientes (37,5%) sufrieron efectos adversos leves durante la infusión de RTX (un broncoespasmo leve y dos reacciones cutáneas). En todos los casos, la clínica se resolvió tras la suspensión transitoria del fármaco, pudiendo completarse posteriormente la infusión del RTX. Durante el período de seguimiento no se documentaron complicaciones infecciosas, ni de otra índole atribuibles al tratamiento con RTX.
DiscusiónLos datos publicados en estudios recientes han señalado que el tratamiento con RTX es eficaz en niños con SN de difícil manejo clínico, tanto por el control del número de recaídas de la enfermedad, como por su potencial ahorrador de esteroides y otros inmunosupresores. Con la limitación inherente a las características metodológicas del estudio (diseño retrospectivo), estas apreciaciones parecen confirmarse en nuestra serie de pacientes tratados con el fármaco.
Por un lado, observamos una marcada reducción en el número de recaídas de la enfermedad, tras el tratamiento con RTX, pasando de 3,6 recaídas/año en el año previo al primer ciclo, a 0,1 recaídas/año en el primer año postratamiento, con siete de los ocho pacientes del estudio libres de recaídas durante este mismo período. Este beneficio del RTX en el SN ya ha sido comunicado de forma repetida en los últimos años7-16, llegándose incluso a proponer como fármaco de primera línea de tratamiento en SN córtico-dependientes17-19, con base en su comparación de eficacia frente a otros inmunosupresores clásicamente utilizados en esta patología. Actualmente, se está llevando a cabo un ensayo multicéntrico, doble ciego, aleatorizado y controlado con placebo, que pretende evaluar la eficacia y seguridad del RTX, en pacientes diagnosticados de síndrome nefrótico dependiente de corticoides/recaídas frecuentes, no complicados en etapas iniciales, y que no han recibido previamente otros inmunosupresores20.
Por otro lado, el tratamiento con RTX facilitó la disminución en el uso de otros fármacos inmunosupresores, utilizando únicamente esteroides tras el inicio del tratamiento, con una reducción del 96,5% en la dosis de los mismos en los tres últimos meses del seguimiento evolutivo. Estos resultados también se asemejan a otras publicaciones8 y son particularmente destacables si se tiene en cuenta su indicación en pacientes con SN de difícil control clínico, en la mayor parte de las ocasiones, refractarios a múltiples terapias de primera y segunda línea.
Ya que su uso en el SN no está incluido en ficha técnica del fármaco, aún no están uniformemente establecidas las indicaciones precisas ni la posología óptima del tratamiento con RTX en esta entidad, con un número de dosis por ciclo, intervalo y ciclos totales de tratamiento altamente variables en función de la fuente consultada. En nuestra serie se utilizó una dosis estándar de RTX de 375 mg/m2 de superficie corporal y, salvo en un paciente al que se administraron cuatro dosis semanales en un ciclo, el resto recibió 1-2 dosis semanales por ciclo, siguiendo la pauta más empleada por otros a autores8,20. Este esquema terapéutico, de entrada, frente a las dosis diarias de otros inmunosupresores, puede ser una opción válida y eficaz en aquellos casos donde la adherencia medicamentosa sea cuestionable.
Varias publicaciones4,21-23 han demostrado una asociación directa entre número de dosis de RTX, mayor duración de depleción de linfocitos B y menor riesgo de recaídas de la enfermedad. Esta tendencia, también observada en nuestros pacientes, ha generado recomendaciones específicas respecto a la readministración inmediata de RTX, una vez documentada la normalización de los linfocitos B, sin necesidad de una nueva recaída24, aunque no es en la actualidad una práctica de uso generalizado. Paralelamente, otra observación clínica descrita relativa al RTX en el tratamiento del SN, como es la tendencia a una normalización más precoz de los linfocitos B a menor edad de los individuos tratados4, también parecen confirmarse a raíz de los datos de nuestro estudio. Finalmente, nuestros datos también confirman una correlación positiva entre la edad de inicio de RTX y la duración del mantenimiento de linfocitos B (LB) deplecionados (y por tanto, en los períodos libres de recaída), tendencia ya observada en estudios previos4,11.
No obstante, la relación entre la recuperación de linfocitos B y la aparición de recaídas no fue absoluta en nuestros pacientes, por cuanto existió un significativo decalaje entre ambos factores (más de siete meses). Esto sugiere mecanismos de acción del RTX no dependientes de forma directa del recuento global de linfocitos B, y esto también ha sido descrito previamente25-27. En nuestra serie no se administraron nuevas dosis de RTX exclusivas, en función únicamente del criterio biológico de recuperación de linfocitos B, siendo la presencia de una nueva recaída de la enfermedad, tras documentarse la repleción de linfocitos B, el escenario clínico más habitual para la indicación de un nuevo ciclo de RTX. Otros marcadores biológicos (cambios en los subconjuntos de células T y otros) pueden tener potencial utilidad en el manejo práctico de los enfermos nefróticos tratados con RTX27.
Existen diversos estudios en los que se describe una mejoría de la eficacia del tratamiento con RTX, si este se asocia con MMF4-6, lo que también sugieren nuestros resultados, a pesar de la escasa muestra de pacientes. Recientemente, Takahashi et al.7 llegaron a una conclusión similar, al administrar pulsos de mizoribina (inhibidor de la purina) tras el tratamiento con RTX. Actualmente, esta práctica clínica no está generalizada entre los nefrólogos y queda por establecer de forma sólida su indicación.
Tras el período de seguimiento post-RTX (mediana de 46,5 meses, rango 5-97 meses), no se observaron efectos adversos significativos atribuibles al RTX en nuestros pacientes, ni de tipo infeccioso ni de otra índole. Obviamente, tanto el escaso número de pacientes incluidos en el estudio como el período de seguimiento de nuestros pacientes limita esta apreciación y sus implicaciones clínicas a largo plazo8,11,28,29.
En conclusión, el RTX ofreció resultados favorables en nuestra serie de pacientes pediátricos con SN córtico-dependiente, lo que confirma su eficacia y lo hace considerar como un agente terapéutico válido para casos de difícil manejo clínico. Aunque a corto plazo el RTX no se asoció con efectos adversos ni complicaciones infecciosas evidentes, es preciso diseñar estudios apropiados que traten de aclarar, entre otros, el régimen óptimo de tratamiento (dosis, intervalo y número de ciclos), repercusión clínica y potenciales efectos adversos a largo plazo.
FinanciaciónEste trabajo no ha recibido ningún tipo de financiación.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.