La analgosedación es una prioridad en el cuidado de pacientes en unidades de intensivos pediátricos. La combinación de ketamina y propofol puede ser una alternativa para aquellos pacientes con necesidad de sedación prolongada, con dificultad para la sedación y para disminuir el empleo de benzodiacepinas y opiáceos. El objetivo de este estudio es analizar la eficacia y seguridad de la combinación de ketamina y propofol en perfusión continua para la analgosedación en unidades de cuidados intensivos pediátricos.
Materiales y métodosEstudio de cohorte única prospectivo observacional en pacientes de 1 mes a 16 años ingresados en unidades de cuidados intensivos pediátricos entre 2016 y 2018 que recibieron tratamiento con ketamina y propofol en perfusión continua para analgosedación. Se recogieron datos clínicos y demográficos, scores de analgesia y sedación (MAPS, COMFORT-B y SOPHIA), parámetros hemodinámicos y efectos adversos.
ResultadosTreinta y dos pacientes fueron incluidos. La dosis máxima de ketamina fue de 1,5mg/kg/h (RI 1-2mg/kg/h) y la duración, 5 días (RI 3-5 días). La dosis máxima de propofol fue de 3,2mg/kg/hora (RI 2,5-3,6mg/kg/hora) y la duración, 5 días (RI 3-5 días). Treinta pacientes (93,7%) habían recibido midazolam y 29 (90,6%) fentanilo previamente. Tras el inicio de la perfusión de ketamina y propofol la puntuación en la escala de analgesia no se modificó. El COMFORT-B mostró un incremento estadísticamente significativo, pero se mantuvo dentro del rango de sedación adecuada (12-17). Se produjo una leve disminución en la presión arterial media tras una hora de administración, que fue estadísticamente significativa (de 64mmHg a 60mmHg; P=0,006) así como en la presión arterial diastólica (de 50,5 a 48mmHg; P=0,023). Esta diferencia desapareció a las 12 horas del inicio y no requirió uso de drogas vasoactivas. No se detectaron efectos adversos graves durante la administración.
ConclusionesLa combinación de ketamina y propofol en perfusión continua es un tratamiento seguro en cuidados intensivos pediátricos que permite un adecuado nivel de analgosedación sin repercusión hemodinámica significativa.
Analgesia and sedation are a priority in paediatric intensive care. The combination of ketamine and propofol is a possible option in patients requiring prolonged or difficult sedation and to reduce the use of benzodiazepines and opiates. The aim of this study was to assess the efficacy and safety of combination ketamine and propofol in continuous infusion for prolonged analgesia/sedation in the paediatric intensive care setting.
Patients and methodsProspective, observational single-group cohort study in patients aged 1 month to 16 years admitted to the paediatric intensive care unit in 2016–2018 that received ketamine and propofol in continuous infusion for analgesia and sedation. We collected data on demographic and clinical characteristics, analgesia and sedation scores (MAPS, COMFORT-B and SOPHIA), haemodynamic parameters and adverse events.
ResultsThe study included 32 patients. The maximum dose of ketamine was 1.5mg/kg/h (interquartile range [IQR], 1–2mg/kg/h) and the infusion duration was 5 days (IQR, 3–5 days). The maximum dose of propofol was 3.2mg/kg/h (IQR, 2.5–3.6mg/kg/h) and the infusion duration, 5 days (IQR, 3–5 days). Thirty (93.7%) patients had previously received midazolam and 29 (90.6%) fentanyl. Analgesia scores did not change after initiation of the ketamine and propofol infusion. There was a statistically significant increase in the COMFORT-B score, but the score remained in the adequate sedation range (12–17). There were small but statistically significant decreases in the mean arterial pressure (from 64mmHg to 60mmHg; P=.006) and the diastolic blood pressure (from 50.5 to 48mmHg; P=.023) 1h after the initiation of the ketamine and propofol infusion, but this difference was not observed 12h later and did not require administration of vasoactive drugs. No other major adverse events were detected during the infusion.
ConclusionsThe combination of ketamine and propofol in continuous infusion is a safe treatment in critically ill children that makes it possible to achieve an appropriate level of analgesia and sedation without relevant haemodynamic repercussions.
La ketamina actúa como antagonista de los receptores N-metil D-aspartato (NMDA) en el sistema nervioso central, induciendo un estado de anestesia disociativa. En dosis bajas tiene un efecto analgésico y antihiperalgésico. Entre sus propiedades también se encuentra la unión a receptores opioides. Aunque esta unión no conlleva un efecto analgésico, podría estar relacionada con su utilidad para reducir la necesidad de opioides y evitar el síndrome de abstinencia1,2. Estudios sobre el uso de ketamina para procedimientos han mostrado un buen perfil hemodinámico con menor efecto depresor cardiovascular lo que constituye una ventaja en pacientes con inestabilidad hemodinámica como en el postoperatorio de cirugía cardiaca3–7. Sin embargo, faltan estudios sobre su eficacia y seguridad en administraciones prolongadas ya que los trabajos publicados son fundamentalmente retrospectivos y con escaso número de pacientes8–11. Otros subgrupos de pacientes, como los neurocríticos, podrían también beneficiarse, ya que, aunque se ha sugerido que la ketamina podría aumentar la presión intracraneal, evidencias recientes sugieren un efecto beneficioso en este subgrupo de pacientes disminuyendo la presión intracraneal12,13.
El propofol actúa a través de la unión del neurotransmisor GABA a su receptor produciendo un efecto hipnótico y sedante. Sus características lipofílicas permiten un rápido efecto sobre el sistema nervioso central y la redistribución del compartimento central al periférico hace que el efecto desaparezca rápidamente. Produce un descenso en la presión arterial por disminución de las resistencias vasculares periféricas y una disminución de la frecuencia cardiaca14. Estos efectos hacen que sea menos utilizado en pacientes hemodinámicamente inestables. Sin embargo, las características contrapuestas de la ketamina y el propofol hacen que la administración conjunta pueda presentar un mejor perfil de efectos adversos15,16.
Las guías de sedación en UCIP de la Society of Critical Care Medicine de 2022 recomiendan el uso de ketamina como terapia adyuvante en pacientes pediátricos con inadecuada sedación con los fármacos habituales, pero siguen siendo más restrictivos con el empleo del propofol en niños17. El objetivo de este estudio es analizar la eficacia y seguridad de la combinación ketamina y propofol en perfusión continua como parte de un protocolo estándar para analgosedación prolongada en UCIP.
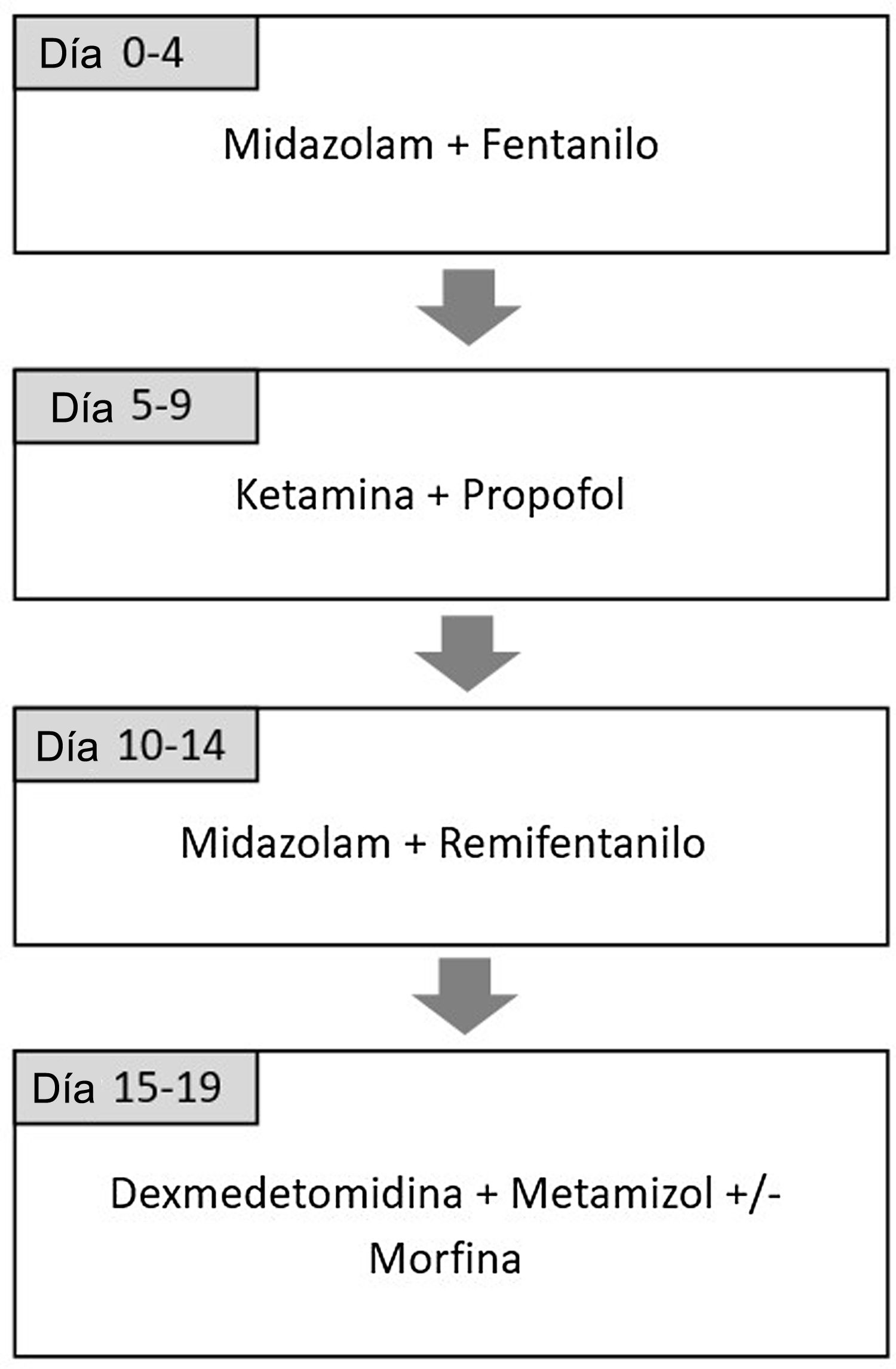
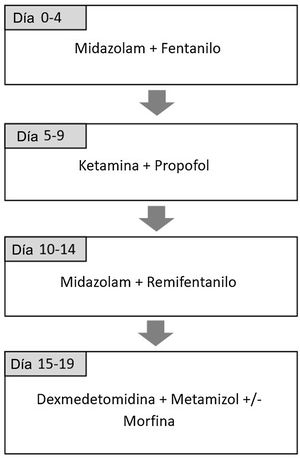
Pacientes y métodosSe diseñó un estudio prospectivo observacional para evaluar la eficacia y seguridad de la combinación de ketamina y propofol en perfusión continua en la UCIP de un centro terciario entre septiembre 2016 y enero de 2018. Esta combinación forma parte del protocolo de rotación de analgosedación que se implementó en 2012 con el objetivo de reducir el síndrome de abstinencia en pacientes críticos con sedación prolongada18. Está basado en el uso de diferentes combinaciones de fármacos analgésicos y sedantes considerando la farmacocinética y el mecanismo de acción de cada uno de manera que alterna analgésicos opioides con no opioides y sedantes del grupo de benzodiacepinas con sedantes de otros grupos19,20. Incluye la administración de ketamina (dosis de 1-2mg/kg/hora) y propofol (dosis de 1-4mg/kg/hora) durante cinco días. La secuencia completa se incluye en la figura 1. El protocolo se utiliza en todos los pacientes, aunque se permite su adaptación en función del criterio del médico a cargo del paciente. El estudio cumple con la Declaración de Helsinki de 1975, revisada en 2000 y fue aprobado por el Comité de Revisión Institucional del hospital con el código de estudio EVOLUCION UCIP 1.2. Se recogió consentimiento informado de las familias para la recogida de datos para fines de investigación.
Criterios de inclusiónSe incluyeron pacientes entre 1 mes y 16 años ingresados en la UCIP durante el periodo de estudio en los que se utilizó perfusión continua de ketamina y propofol como parte del protocolo de analgesia y sedación. Pacientes tratados con perfusión de ketamina y propofol por otras causas fueron excluidos.
Recogida de datos y variablesSe recogieron datos demográficos (edad y sexo) y clínicos, incluyendo escalas de analgosedación, parámetros hemodinámicos y analíticos (ácido láctico, triglicéridos), diagnóstico de ingreso, PRIMSIII, antecedente de ingreso previo en UCIP con necesidad de sedación o analgesia en perfusión continua, necesidad de ventilación mecánica de técnicas de depuración extrarrenal y de técnicas de circulación extracorpórea.
Se registraron las dosis máximas y medias y la duración de la infusión de ketamina y propofol. Se recogió información sobre la administración concomitante de analgésicos y sedantes en perfusión continua. El equipo de enfermería registró 3 veces la calidad de la analgosedación con las siguientes escalas validadas: 1) Escala multidimensional de valoración de la analgesia (MAPS); 2) COMFORT-B (sedación) y 3) SOPHIA (síndrome de abstinencia)21–24. Se recogieron las puntuaciones del día previo al inicio de la perfusión y hasta 24 h después de su finalización. Se consideró sedación adecuada un COMFORT-B de entre 12 y 17 y analgesia adecuada la puntuación de entre 0 y 1. Se definió síndrome de abstinencia como una puntuación SOPHIA mayor o igual a 4.
Se registraron parámetros hemodinámicos como presión arterial sistólica (PAS), diastólica (PAD), media (PAM), frecuencia cardiaca (FC) y la necesidad de tratamiento vasoactivo utilizando el índice inotrópico-vasoactivo (VIS) o antihipertensivo. Estos datos se recogieron en tres momentos, una hora antes, una hora después y doce h después del inicio de la combinación de ketamina y propofol.
Se registraron los efectos adversos relacionados con la perfusión de ketamina (hipertensión, taquicardia, arritmias, broncorrea, nistagmo, agitación y delirium) y de propofol (aquellos característicos del síndrome de infusión de propofol como arritmias, acidosis, trigliceridemia, rabdomiólisis y hepatomegalia). La broncorrea se definió como un aumento de secreciones respiratorias y la broncorrea significativa cuando este incremento interfería con una adecuada ventilación. Se clasificó como efecto adverso grave la hipotensión o hipertensión con necesidad de tratamiento y la aparición de síntomas de síndrome por infusión de propofol.
Análisis estadísticoEl análisis estadístico se realizó con el programa SPSS statistical software versión 25.0 (IBM Corp, Armonk, NY). Las variables categóricas se expresan como frecuencias y porcentajes y las variables continuas como medianas y rango intercuartílico (RI). Para comparar variables continuas entre grupos independientes se utilizó el test de Kruskal Wallis. Para estudiar la variación antes y después del inicio de la ketamina se utilizó el test de Wilcoxon para muestras relacionadas. Se estableció como límite de la significación estadística el valor p 0,05.
ResultadosTreinta y dos pacientes recibieron tratamiento con ketamina y propofol en perfusión continua durante más de 24 h durante el periodo de estudio. La mediana de edad fue de seis meses (RI 2-48,5 meses) y la mediana de PRISM III de 8 (RI 3-12). Diecinueve pacientes (59,4%) tenían una cardiopatía congénita. Otras características basales de la muestra se pueden observar en la tabla 1.
Treinta (93,7%) recibieron midazolam y 29 (90,6%) recibieron fentanilo en los 5 días previos a la introducción de la ketamina y propofol. La mediana de dosis de midazolam fue 2 mcg (mcg)/kg/minuto (RI 2-3,2 mcg/kg/minuto), (máximo 6 mcg/kg/minuto) y la mediana de dosis de fentanilo fue 2 mcg/kg/hora (RI 1-2,2 mcg/kg/hora, máximo 5 mcg/kg/hora). La mediana de dosis de ketamina al inicio del tratamiento fue de 1mg/kg/h (RI 1-1,5mg/kg/hora). La mediana de dosis máxima fue de 1,5mg/kg/hora (RI 1-2mg/kg/hora) y la mediana de dosis máxima total (incluyendo bolos de sedación) fue 1,6mg/kg/hora (1,2-2mg/kg/hora). La dosis máxima fue 2mg/kg/hora, utilizada en un 43,8% de los casos. La mediana de duración de la perfusión fue 5 días (RI 3-5 días). La duración máxima fue de 8 días. La mediana de tiempo de retirada de la ketamina fue de 2 h (RI 1-5 h) con un máximo de 24 h. No hubo diferencias significativas en la dosis máxima de ketamina en función de la edad (lactantes 1,5mg/kg/hora y mayores de 12 meses 1,5mg/kg/hora, p=0,785), ni entre pacientes con y sin ingresos previos en UCIP (1,5mg/kg/hora frente a 1,5mg/kg/hora, p=0,468).
Siguiendo el protocolo institucional de analgosedación, 32 pacientes (100%) recibieron propofol en perfusión continua simultáneamente con la ketamina. La mediana de dosis máxima de propofol (perfusión continua y bolos) fue de 3,2mg/kg/hora (RI 2,5-3,6mg/kg/hora). Se sustituyó el propofol por midazolam en tres pacientes y por dexmedetomidina en uno. Un paciente fue tratado con midazolam y ketamina simultáneamente. Veinticuatro pacientes (74,2%) no necesitaron tratamientos concomitantes durante el tratamiento con ketamina y propofol. Ocho pacientes (25,8%) recibieron otros tratamientos concomitantes durante más de 24 h durante la perfusión de ketamina y propofol. En dos pacientes estos tratamientos concomitantes ya estaban presentes durante el tratamiento con fentanilo y midazolam previamente a la introducción de la perfusión de ketamina y propofol y no se suspendieron al iniciar la misma. Los otros 6 pacientes (19%) requirieron la introducción de otro tratamiento adyuvante tras el inicio de ketamina y propofol en perfusión continua. Estos tratamientos adyuvantes fueron: perfusión continua de metamizol (n=3, 9%), midazolam (n=1, 3%), dexmedetomidina (n=4, 12,5%), morfina en perfusión continua (n=1, 3%), sevofluorano inhalado (n=1, 3%), fentanilo (n=1, 3%) y remifentanilo (n=1, 3%). En el caso del metamizol, la dosis máxima fue de 6,6mg/kg/h mientras que en el caso de la dexmedetomidina la dosis máxima fue de 1,2 mcg/kg/hora. La dosis máxima de morfina fue 20 mcg/kg/hora y de remifentanilo fue 12 mcg/kg/hora.
La mediana de las escalas MAPS, COMFORT-B y SOPHIA antes de la combinación de ketamina y propofol y a lo largo de los 5 días tras su introducción se muestran en el material suplementario. No hubo diferencias significativas en la mediana de MAPS y SOPHIA antes y después del inicio de la perfusión (días 1 a 5) (MAPS 0-2 y SOPHIA menor de 4) (material suplementario). La puntuación en la escala de analgesia no varió con la introducción de la ketamina y el propofol (puntuación 1). El COMFORT-B aumentó significativamente al comparar los días 1 a 5 con el día previo a la introducción de ketamina y propofol pero se mantuvo en el rango 12-17 (material suplementario). El propofol y la ketamina se interrumpieron en un paciente debido a que el nivel de analgosedación no fue adecuado, introduciéndose remifentanilo y dexmedetomidina. Cuatro pacientes presentaron una puntuación SOPHIA mayor de 4 en las 48 h tras la finalización de la ketamina y el propofol (12,9%).
Los parámetros hemodinámicos medidos durante la administración de la infusión de ketamina y propofol se muestran en la tabla 2. No hubo diferencias estadísticamente significativas en el VIS antes y después del inicio de ketamina y propofol (P=0,888). Hubo diferencias estadísticamente significativas entre la PAM antes y una hora después (64mmHg frente a 60mmHg; P=0,023) y en la PAD antes y una hora después de la ketamina y el propofol (50,5 frente a 48mmHg; P=0,023). No se objetivaron cambios entre antes y 12 h del inicio de la ketamina y el propofol (tabla 2). Un paciente requirió tratamiento con noradrenalina 12 h después del inicio de la ketamina y el propofol. Ningún paciente requirió tratamiento antihipertensivo.
Parámetros hemodinámicos antes y después del inicio de la perfusión de ketamina y propofol
| Antes del inicio de la perfusión | 1 hora tras el inicio de la perfusión | p | 12 horas tras el inicio de la perfusión | p | |
|---|---|---|---|---|---|
| VISn=32 | 11,5 (0-16,5) | 11,5 (0-16,5) | 0,66 | 11,5 (0-16,5) | 0,89 |
| PAS (mmHg)n=29 | 85 (72-99) | 84 (71-98,5) | 0,35 | 87,5 (73,3-98,8) | 0,46 |
| PAM (mmHg)n=30 | 63 (56,8-71) | 59,5 (52,8-68) | 0,01* | 63 (54,5-71) | 0,49 |
| PAD (mmHg)n=29 | 50 (45,5-58) | 48 (43,5-54) | 0,04* | 49 (43,3-58,5) | 0,49 |
| FC (lpm)n=30 | 130 (110-146,3) | 130 (108,8-140) | 0,85 | 125 (112,5-152,5) | 0,14 |
Los datos se expresan en forma de medianas y rango intercuartílico.
No se objetivaron diferencias en parámetros hemodinámicos o cambios en el VIS en los 5 pacientes en ECMO (tabla 3).
Parámetros hemodinámicos en pacientes con circulación extracorpórea antes y después del inicio de la perfusión de ketamina y propofol
| N=5 | Antes de la perfusión | 1 hora tras el inicio de la perfusión | p | 12 horas tras el inicio de la perfusión | p |
|---|---|---|---|---|---|
| VIS | 17 (9-38) | 17 (9-38) | 1,00 | 15 (9-33) | 0,18 |
| PAS (mmHg) | 86 (75,5-114,5) | 84 (67-115) | 0,69 | 82 (61,5-127,5) | 0,89 |
| PAM (mmHg) | 65 (63-74) | 66 (56-70,5) | 0,28 | 69 (53-79) | 0,69 |
| PAD (mmHg) | 58 (49-64) | 54 (48-60) | 0,42 | 50 (48,5-68,5) | 0,89 |
| FC (lpm) | 130 (117,5-162,5) | 140 (122,5-140) | 0,58 | 135 (117,5-137,5) | 0,27 |
Los datos se expresan en forma de medianas y rango intercuartílico.
FC: frecuencia cardiaca; Lpm: latidos por minuto; MmHg: milímetros de mercurio; PAD: presión arterial diastólica; PAM: presión arterial media; PAS: presión arterial sistólica; VIS: vasoactive index score.
El efecto adverso más frecuente durante la perfusión de ketamina y propofol fue la broncorrea (n=12, 37,5%) aunque en la mayoría de los casos no fue significativa (11 pacientes, 91,6%). Tres pacientes sufrieron agitación. En uno de estos casos el propofol y la ketamina se suspendieron y se reintrodujeron el midazolam y el fentanilo dada la falta de eficacia del propofol y ketamina para controlar la agitación. En los otros 2 pacientes se inició una perfusión de opiáceo (morfina y remifentanilo). No hubo casos de nistagmo o arritmias. No se encontró asociación entre la dosis máxima de ketamina y propofol o la duración de ketamina y propofol con la presencia de eventos adversos. La combinación ketamina y propofol produjo un aumento significativo de triglicéridos (127mg/dl frente a 206mg/dl; p<0,001). Los valores de láctico también aumentaron ligeramente (1mg/dl a 1,8mg/dl; p<0,001). Ningún paciente desarrolló rabdomiólisis ni hepatomegalia. No se reportó ningún fallecimiento durante la perfusión de ketamina y propofol.
DiscusiónPresentamos uno de los pocos estudios que describe el uso prolongado de la combinación ketamina y propofol en perfusión continua en una UCIP. Este trabajo aporta evidencia de la utilidad de la ketamina y el propofol como pauta de analgosedación de mantenimiento incluyendo pacientes en ECMO y en terapia de depuración extrarrenal.
La dosis de ketamina y propofol utilizada por nosotros fue similar a otros estudios publicados8–11,15,25. La duración de la perfusión de ketamina varía en los estudios publicados entre 2 y 6 días siendo de 5 días en nuestro caso1,2,8,26.
La ketamina en combinación con propofol proporcionó un efecto analgésico y sedante similar a los tratamientos previos (fentanilo y midazolam). El efecto analgésico, evaluado mediante escalas validadas se consideró adecuado (MAPS menor de 2). Aunque la puntuación de la escala de COMFORT-B se incrementó tras la introducción de ambos fármacos, el efecto sedante se mantuvo en el rango considerado como sedación adecuada (12-17)21. Estos resultados se encuentran en consonancia con estudios previos que muestran un adecuado nivel de analgosedación en UCIP con ambos fármacos por separado, aunque faltan estudios sobre la utilización conjunta para analgesia prolongada1,2,8,27,28. Es importante subrayar que en el 81% de los casos se consiguió un grado adecuado de analgosedación sin necesidad de añadir tratamientos adyuvantes. El 19% restante recibió otro tratamiento intravenoso en perfusión continua además del propofol y la ketamina. En estos casos se podría considerar que la ketamina y el propofol no alcanzaron el nivel de sedación deseado. Es posible que la abstinencia al fentanilo represente un papel importante en estos pacientes ya que en la mayoría de los trabajos publicados el tratamiento con ketamina se inició manteniendo el tratamiento opioide previo8,10,11, mientras que en el nuestro se suspendió el opioide al iniciar la ketamina y el propofol.
En un paciente la ketamina y el propofol se interrumpieron debido a una inadecuada analgosedación por agitación. La agitación ha sido previamente reportada como efecto adverso de la ketamina en sedación para procedimientos, aunque es más frecuente con otros fármacos como las benzodiacepinas29.
Aunque la evidencia en pediatría es limitada, parece que el impacto hemodinámico de la ketamina responde a dos mecanismos opuestos; un efecto inotrópico negativo directo y un efecto inotrópico positivo indirecto inducido por el incremento en la concentración de catecolaminas endógenas30. El propofol produce un descenso de la presión arterial por una disminución en el tono vascular, contractilidad cardiaca y control autonómico del gasto cardiaco15. La combinación de ketamina y propofol para procedimientos en pacientes pediátricos ha demostrado ser segura, sin descensos significativos en la frecuencia cardiaca o la presión arterial, pero faltan estudios que evalúen su efectividad y seguridad en sedación prolongada15,31,32. Son escasos los estudios publicados hasta la fecha que incluyan pacientes con cardiopatías congénitas. Es importante considerar la posible repercusión hemodinámica en estos pacientes a la hora de evaluar el efecto de la ketamina y el propofol en perfusión continua. Un estudio para analgosedación de pacientes pediátricos durante cateterismo cardiaco mostró que la combinación ketamina y propofol reduce la cantidad de propofol administrado y mantiene la presión arterial media16.
Nuestros resultados muestran una pequeña, pero estadísticamente significativa, disminución de la PAM y la PAD en la primera hora de la perfusión de ketamina y propofol que desaparece posteriormente sin necesidad de incrementar el soporte vasoactivo o administrar carga de volumen. Esto apoyaría la ausencia de repercusiones hemodinámicas significativas asociadas al uso de la ketamina y propofol en perfusión continua incluso en pacientes con patología cardiaca.
En este estudio, ningún paciente presentó efectos adversos graves relacionados con la administración de ketamina y propofol. La broncorrea se presentó en más de un tercio de los pacientes, efecto que está descrito con el empleo de la ketamina, pero sin impacto significativo en la función respiratoria y sin requerir tratamiento anticolinérgico. Otros estudios muestran hallazgos similares8,10,26. Series de casos clínicos han reportado el síndrome de infusión por propofol en población pediátrica, fundamentalmente con dosis muy superiores a 4mg/kg/h. El síndrome de infusión de propofol se caracteriza por bradicardia, acidosis metabólica, hipertrigliceridemia, rabdomiólisis y hepatomegalia33. Ninguno de los pacientes presentó bradicardia, rabdomiólisis ni hepatomegalia, y el aumento en triglicéridos y ácido láctico, aunque significativo, no fue clínicamente relevante.
Otros efectos adversos descritos en la literatura (hipertensión intracraneal o incremento de la presión intraocular) no pudieron registrarse. Esto limita la extrapolación de estos datos a pacientes con riesgo de desarrollar estos efectos adversos34–36.
El 12,5% de los casos (4 pacientes) presentaron síndrome de abstinencia tras la finalización de la ketamina y el propofol. Sin embargo, estos datos se deben interpretar con precaución dado el uso concomitante de otros agentes.
Una de las limitaciones del estudio es el escaso número de pacientes incluido. Sin embargo, es uno de los pocos estudios de carácter prospectivo y el número de pacientes es mayor que el de artículos previos. Se trata de un estudio observacional que recoge la práctica habitual en cuanto a analgosedación en nuestro centro. La naturaleza observacional y la falta de grupo control son limitaciones que deben tenerse en cuenta al interpretar los resultados.
Es importante considerar el uso de otros analgésicos y sedantes al interpretar los resultados. Sin embargo, esta limitación es inevitable ya que en la práctica clínica comúnmente se precisan fármacos adyuvantes para la sedación de niños críticos. Otra limitación es la falta de información sobre la administración de analgésicos o sedantes por vía enteral.
ConclusionesLa ketamina en combinación con propofol en perfusión continua puede ser un tratamiento adecuado para pacientes pediátricos ingresados en unidades de cuidados intensivos, consiguiendo un buen nivel de analgosedación y permitiendo suspender el tratamiento con opiáceos y benzodiacepinas. La ketamina y el propofol presentan un buen perfil de seguridad sin repercusiones hemodinámicas significativas y sin eventos adversos graves. Sin embargo, es esencial llevar a cabo estudios prospectivos controlados con mayor número de pacientes.
FinanciaciónLa presente investigación no ha recibido ayudas específicas provenientes de agencias del sector público, sector comercial o entidades sin ánimo de lucro.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Los autores expresan su agradecimiento al equipo de médicos y enfermeras del servicio de cuidados intensivos por su participación en el cuidado de los pacientes y su colaboración en el registro y la recogida de datos.
Parte de este estudio fue presentado como comunicación corta en el XXXIII Congreso Anual de la SECIP que tuvo lugar del 10 al 13 de junio de 2018 en Granada, España.