Tras una encefalitis herpética (EH), una cuarta parte de los pacientes con EH tiene una recaída de la enfermedad que, excepcionalmente, se manifiesta como un síndrome extrapiramidal de tipo coreoatetósico. La base fisiopatológica de este tipo de recaída es desconocida, pero se hipotetiza que puede ser un cuadro inmunitario mediado. Se presenta el caso de un niño de 8 meses con EH por virus del herpes simple tipo 1 que en la tercera semana de evolución tuvo una recaída caracterizada por un síndrome extrapiramidal con coreoatetosis y balismo. El cuadro se interpretó como postinfeccioso, inmunitario mediado. Se trató al paciente con corticoides en altas dosis e inmunoglobulinas, además de un nuevo ciclo de aciclovir. La coreoatetosis fue tan grave y resistente a los fármacos que obligó a sedorrelajar al paciente inicialmente. Posteriormente, se ensayó tratamiento con tetrabenazina.
Se estudió a escala molecular una mutación en el receptor tipo Toll 3, que se ha relacionado con la susceptibilidad de presentar la enfermedad, que resultó ser negativa.
After Herpes simplex encephalitis, 25% of cases may have a relapse, rarely as a choreoathetosic movement disorder. The anatomic basis for herpes simplex virus encephalitis-associated movement disorders remains poorly understood, but the hypothesis is that it may be due to a post-infectious immune-mediated process. We report an 8-month-old boy, with herpes simplex encephalitis type 1, who started with an extrapyramidal Syndrome, presenting with choreoathetosis and ballistic movements, three weeks after onset. These new symptoms were attributed to a post-infectious immune-mediated process. We treated our patient with corticosteroids at high dose and gamma-globulins, in addition to a new course of Acyclovir. Sedation was required to control the intense choreoathetosic movements. Tetrabenazine was also tried, unsuccessfully. We studied a mutation on the toll like receptors (TLR3), which has been related to susceptibility for the disease, which was negative.
La encefalitis herpética (EH) es la causa más frecuente de encefalitis esporádica fatal en pacientes mayores de 6 meses en el mundo occidental. Su incidencia es de uno por 750.000 a 1.500.000 habitantes al año en la población infantil. Presenta más del 70% de mortalidad sin tratamiento y aproximadamente un 10% de curación completa sin secuelas con el tratamiento adecuado. Una cuarta parte de los pacientes con EH tiene una recaída que, excepcionalmente, se manifiesta con un síndrome extrapiramidal de tipo coreoatetósico, por lo que se postula la posibilidad de un patrón bifásico de la enfermedad; la recaída tardía tendría un mecanismo inmunitario mediado. Se presenta un lactante con un síndrome coreoatetósico tras una EH.
Caso clínicoNiño de 8 meses sano que acudió a urgencias por alteración brusca del nivel de consciencia, falta de respuesta a estímulos, hipotonía y desviación de la mirada hacia la izquierda. Tras el episodio quedó somnoliento y con menor movilidad en el hemicuerpo izquierdo. En las últimas 24h había tenido fiebre y vómitos.
A su llegada estaba febril, letárgico, con una puntuación 13/15 en la escala de coma de Glasgow y con leve hemiparesia izquierda. Se observó una crisis focal motora en hemicara izquierda, que cedió con midazolam intravenoso (i.v.).
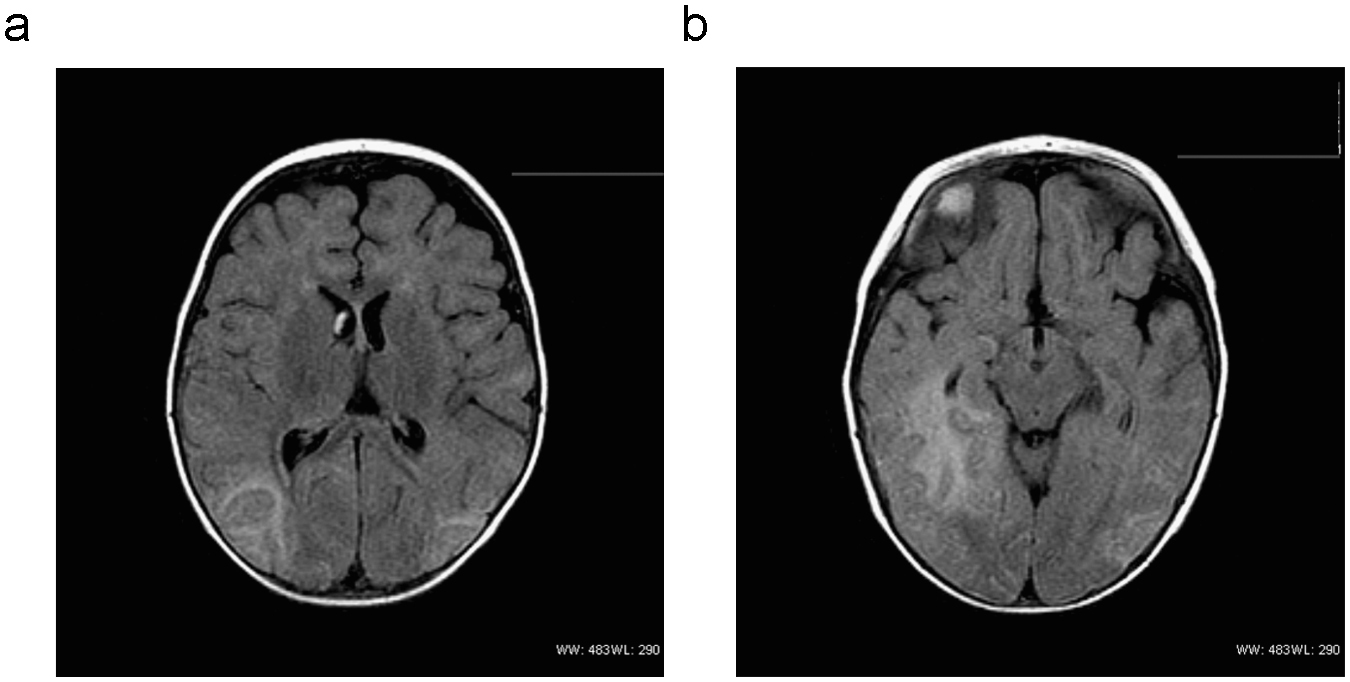
Se realizó hemograma, coagulación, perfil hepatorrenal y gasometría, con resultados normales. La tomografía computarizada craneal fue normal. El líquido cefalorraquídeo (LCR) mostraba un recuento de leucocitos de 41céls./mm3 (el 60% polimorfonucleares), glucosa de 66mg/dl y proteínas de 0,63g/l; se recogieron muestras para cultivo de bacterias y PCR (polymerase chain reaction 'reacción en cadena de la polimerasa') para virus. El paciente ingresó en la unidad de cuidados intensivos donde se inició tratamiento con cefotaxima, aciclovir y ácido valproico. La PCR para el virus del herpes simple (VHS) tipo 1 en LCR fue positiva y se mantuvo el tratamiento con aciclovir 20mg/kg i.v. cada 8h durante 21 días. El electroencefalograma (EEG) mostró PLED (periodic lateralized epileptiform discharges ‘descargas epileptiformes lateralizadas periódicas’) en la región temporoparietal derecha. En la resonancia magnética (RM) (figura 1) se observó afectación parenquimatosa corticosubcortical muy extensa en el hemisferio derecho y el tálamo. Al alta, el paciente presentaba un nivel de consciencia y seguimiento visual normales y se mantenía sentado, aunque persistía una interacción escasa e inatención y hemiparesia izquierdas. Al tercer día, tras finalizar el tratamiento, en el paciente se desarrolló un violento síndrome extrapiramidal con corea generalizada, balismo en los 4 miembros, protrusiones linguales y extrema irritabilidad, que sólo desaparecían con el sueño. Se añadió un deterioro neurológico global con pérdida del contacto visual y del control axial e hipotonía global. Se realizó otra RM sin que se observaran nuevas lesiones y punción lumbar con PCR negativa para el VHS. Se interpretó el cuadro como una recaída tardía de probable origen autoinmunitario, por lo que se lo trató con un ciclo de esteroides en altas dosis y un ciclo de inmunoglobulinas en dosis de 1mg/kg, sin mejoría evidente. Aunque no parecía una reactivación de la infección vírica, el paciente recibió aciclovir i.v. Se realizó vídeo-EEG, en el que no se observó actividad crítica asociada a los movimientos anormales. Los movimientos extrapiramidales eran tan continuos que obligaron a mantener al niño intubado y sedorrelajarlo inicialmente. Posteriormente, se lo trató con neurolépticos (haloperidol y tetrabenacina en altas dosis) sin clara respuesta. Se estudió la mutación (c.1660C>T) en el gen TLR3 (Toll like receptor 3 ‘receptor tipo Toll 3’), relacionada con la susceptibilidad de presentar encefalitis por VHS, pero el paciente no era portador.
Figura 1. a y b). Estudio de resonancia magnética. Planos axiales a través de (a) ambos hemisferios cerebrales y (b) del mesencéfalo y la fosa posterior en secuencia FLAIR (fluid attenuated inversion recovery). Obsérvese alteración de la señal, con prolongación de los tiempos de relajación (hiperintensidad) que afecta a los lóbulos temporales, especialmente al derecho (b), y a los occipitoparietales (a).
Con el paso del tiempo, los movimientos anormales fueron atenuándose hasta prácticamente desaparecer al cabo de 6 meses. Sin embargo, ha persistido una encefalopatía grave, con mal contacto visual y ausencia de lenguaje, una hipotonía axial y un retraso madurativo global.
DiscusiónLa presentación clásica de la EH consiste en fiebre, alteración del nivel de consciencia, crisis epilépticas y déficit neurológico focal. El LCR suele mostrar pleocitosis de predominio mononuclear (inicialmente puede ser polimorfonuclear, como en el caso aquí presentado) con proteínas y glucosa normales. La PCR es el método de referencia diagnóstico por su alta sensibilidad y especificidad cuando se lleva a cabo en condiciones óptimas. Realizada de manera muy precoz, puede ser falsamente negativa por no haber suficiente replicación vírica para su detección1,2; esto es más frecuente en niños3. La RM detecta típicamente hiperseñal focal en secuencias T2 en lóbulos frontales y temporales. En el EEG es característico encontrar asimetría interhemisférica con PLED o enlentecimiento focal en la región frontotemporal.
Hay pocos casos descritos de movimientos anormales, habitualmente coreoatetosis, tras encefalitis por VHS4. En ninguno de ellos se había demostrado afectación de los ganglios basales en las pruebas de imagen5,6,7,8, pero recientemente Kullinat et al9 han publicado el primer caso de movimientos extrapiramidales tras una encefalitis por VHS con lesiones en los ganglios basales observadas en la RM, hecho que coincide con la fase aguda del empeoramiento.
El mecanismo mediante el cual se produce la coreoatetosis tras una EH permanece sin esclarecer; se especula que el daño de los lóbulos frontales, parietales y temporales pueden afectar sus conexiones con los ganglios basales y las estructuras talámicas5,7,10.
En 1998, Hargrave y Webb8 publicaron el estudio más amplio de movimientos involuntarios asociados a EH. Dieciocho casos tuvieron una recaída en forma de movimientos extrapiramidales. Los ganglios basales y el tálamo eran normales en todos los casos estudiados (n = 16), tanto en el momento agudo como en el momento de la recaída. El VHS se aisló en 2 niños con recaída precoz, definida como la que se producía en las 2 primeras semanas desde el inicio del cuadro; en cambio, se aisló tan sólo en uno de los 13 casos que tuvieron la recaída tras un mes desde el inicio del cuadro. Los autores concluyen que ni el tratamiento antivírico inadecuado ni los efectos secundarios de la medicación antiepiléptica fueron la causa de la recaída en forma de movimientos extrapiramidales. Finalmente, hipotetizan que se trata de un patrón bifásico de la enfermedad que indica un fenómeno postinfeccioso inmunitario mediado como causa de los movimientos extrapiramidales observados tras una EH.
Un estudio ha mostrado la presencia de anticuerpos antiganglios basales en el LCR de un niño de 2 años que ingresó por corea 3 semanas tras el inicio de una EH; la PCR para el VHS en el LCR fue negativa11 y la RM resultó normal. Este artículo arroja luz sobre la posible etiología de origen inmunitario de este cuadro post-EH.
Las teorías actuales respecto a la recurrencia implican 2 mecanismos causantes: reactivación o reinfección por VHS con replicación vírica activa o un proceso postinfeccioso inmunitario mediado. De Tiège et al5 comunican 6 casos de recaídas de síntomas neurológicos de los 42 casos de EH revisados, entre los años 1990 y 1997. Distinguen 2 entidades bien diferenciadas. Se piensa que la primera se debe a «replicación vírica»: clínicamente cursa con fiebre, hay nuevas lesiones necrohemorrágicas en las pruebas de imagen, un aumento de proteínas en el LCR y aumento de síntesis de interferón (IFN) intratecal, aunque no se demostró PCR positiva para VHS en el LCR; esta nueva entidad tiene buena respuesta al aciclovir y cursa con síntomas neurológicos no extrapiramidales. Se piensa que la segunda es un fenómeno postinfeccioso inmunitario mediado, cursa con coreoatetosis y no hay nuevas lesiones necrohemorrágicas en las pruebas de neuroimagen; la PCR para el VHS en el LCR es negativa y no hay respuesta al aciclovir. El caso que aquí se presenta coincide con esto último.
Se ha refutado la posibilidad de que los fármacos antiepilépticos tengan una implicación en la aparición de un síndrome extapiramidal porque los pacientes presentan los síntomas tras haber recibido tratamiento con anticomiciales diversos y porque continúan con síntomas a pesar de suspender el tratamiento11.
La distinción entre la forma precoz y la tardía es crucial, puesto que condiciona el tratamiento, ya que en las formas precoces por reinfección-reactivación, la base del tratamiento sería el aciclovir, y en las tardías de base inmunitaria, aunque no hay estudios al respecto, la base del tratamiento serían corticoides, inmunoglobulinas o incluso plasmaféresis6,12. Al paciente del presente caso se lo trató con inmunoglobulinas i.v. y corticoides en altas dosis, con escasa mejoría. La tetrabenazina, particularmente eficaz en el caso del balismo13, tampoco fue eficaz para su control en este paciente.
Por último, cabe preguntarse si las recaídas tardías son realmente por susceptibilidad genética y por qué, si la infección por VHS tipo 1 es tan frecuente en la población general, tan sólo en unos pocos se desarrolla EH. Recientemente, el grupo de Casanova describe varios pacientes con EH que presentan mutaciones bien del gen UNC93B114 o del gen TLR315. Las alteraciones moleculares de estos genes provocan una respuesta antivírica deficiente frente a la infección por VHS con una producción disminuida del IFN-α, IFN-β e IFN-λ. Se piensa que las proteínas codificadas por los genes UNC93B1 y TLR3 son fundamentales en la inmunidad natural frente al VHS tipo 1. También se conoce que la penetrancia clínica de la deficiencia de estos genes descritos es incompleta, por lo que probablemente otros factores podrían afectar a la penetrancia, como son la edad de infección por VHS, el inóculo vírico y otros genes modificadores. Si esto se confirmara en un futuro, abriría la puerta a nuevos tratamientos basados en el IFN junto con el aciclovir en las EH. Se estudió la mutación descrita en el gen TLR3, pero el paciente de este caso no era portador de esa mutación (c.1660C>T).