El proceso de investigación biomédica debe seguir unos criterios de calidad en su diseño y elaboración que garanticen que los resultados son creíbles y fiables. Una vez finalizado, llega el momento de escribir un artículo para su publicación. Este debe presentar con suficiente detalle, y de forma clara y transparente, toda la información del trabajo de investigación realizado. De esta forma, los lectores, tras una lectura crítica de lo publicado, podrán juzgar la validez y la relevancia del estudio, y si lo consideran, utilizar los hallazgos.
Con el objetivo de mejorar la descripción del proceso de investigación para su publicación, se han desarrollado una serie de guías que, de forma sencilla y estructurada, orientan a los autores a la hora de elaborar un manuscrito. Se presentan en forma de lista, diagrama de flujo, o texto estructurado, y son una ayuda inestimable a la hora de escribir un artículo.
Este artículo presenta las guías de elaboración de manuscritos de los diseños más habituales, con sus listas de verificación.
The biomedical research process must follow certain quality criteria in its design and development to ensure that the results are credible and reliable. Once completed, the time comes to write an article for publication. The article must present in sufficient detail, and in a clear and transparent manner, all the information on the research work that has been carried out. In this way, readers, after a critical reading of the published content, will be able to judge the validity and relevance of the study and, if they so wish, make use of the findings.
In order to improve the description of the research process for publication, a series of guidelines have been developed which, in a simple and structured way, guide authors in the preparation of a manuscript. They are presented in the form of a list, flowchart, or structured text, and are an invaluable aid when writing an article.
This article presents the reporting guidelines for the most common designs along with the corresponding checklists.
En las últimas décadas ha habido un aumento exponencial del número de publicaciones biomédicas y, de forma paralela, también una preocupación creciente sobre la calidad de la comunicación de estas. En los años noventa del pasado siglo aparecieron, inicialmente en relación con los artículos de ensayos clínicos aleatorizados, una serie de iniciativas dirigidas a la mejora de la calidad de la elaboración del contenido de las publicaciones científicas. Estas iniciativas se fueron materializado en una serie de guías con recomendaciones estructuradas sobre qué información debía constar en la publicación de un artículo según el tipo de diseño del estudio.
Su denominación en inglés, Reporting guidelines, se ha traducido al castellano de varias formas: «listas-guía», «lista de directrices», «directrices para la comunicación», «directrices de presentación de informes»… Esto ha contribuido a que se produzca cierta confusión en torno a ellas y a su finalidad, que es mejorar la comunicación de los estudios. Con frecuencia, también se hace referencia a ellas de forma genérica como «listas de verificación» y se confunden con otro tipo de guías o herramientas cuyo objetivo es la evaluación de sesgos y aplicabilidad de los artículos ya publicados. Existen múltiples herramientas con esta finalidad. Un ejemplo serían las guías que utilizan los autores de las revisiones sistemáticas para valorar el riesgo de sesgos de los estudios primarios que las conforman (Quadas-21, RoB-22, Newscastle-Otawa3…). También, y en este caso orientadas a los lectores, podemos citar las guías de usuario de la literatura médica de la revista JAMA4, las guías equivalentes del BMJ, basadas en las recomendaciones del Evidence-Based Medicine Working Group, o los instrumentos para la lectura crítica CASPe5. Un paso más allá iría el sistema GRADE6, que, además de evaluar la calidad de la evidencia, gradúa la fuerza de las recomendaciones en el contexto de desarrollo de guías de práctica clínica, revisiones sistemáticas o evaluación de tecnologías sanitarias.
Centrándonos en las Reporting guidelines, que hemos denominado en este estudio «guías para la elaboración de manuscritos» (siguiendo su propia definición)7, su principal objetivo es intentar que los artículos publicados describan lo mejor posible la metodología aplicada en cada una de las fases de la investigación realizada con transparencia y exactitud. Están orientadas a los autores de los artículos para su uso en la fase de elaboración y también a los revisores y a los editores de las revistas. Se puede decir que estas guías buscan la excelencia en la comunicación de los estudios realizados, independientemente de la calidad que tengan. Puede darse el caso de un estudio con un diseño, realización y evaluación de resultados óptimos, pero mal comunicado porque no proporciona información clave respecto a su metodología y resultados. Esto generaría problemas en la valoración posterior del riesgo de sesgos, su aplicabilidad o su incorporación a una revisión sistemática, que hubieran sido fácilmente evitables con una descripción más detallada.
La primera guía para la elaboración de manuscritos, y la más conocida, fue CONSORT8 (para ensayos clínicos aleatorizados). Posteriormente aparecieron guías como STARD9 (para estudios de pruebas diagnósticas), PRISMA10 (para revisiones sistemáticas), STROBE11 (para estudios observacionales)… y extensiones de estas que, dentro de cada tipo de estudio, se focalizan en aspectos concretos.
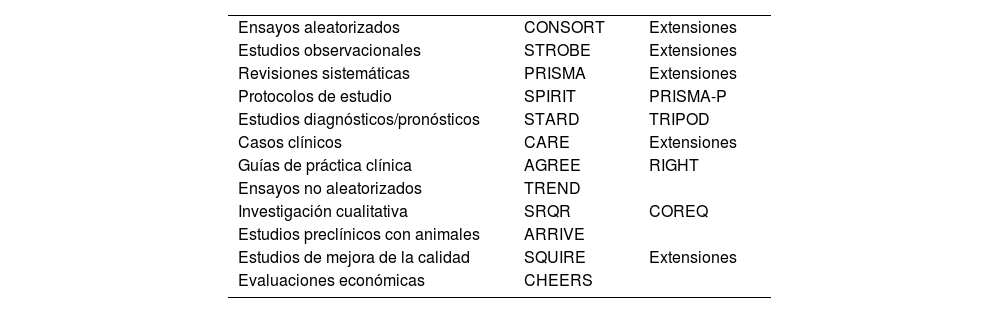
La proliferación de este tipo de guías propició otra iniciativa Enhancing the QUAlity and Transparence Of health Research (EQUATOR)12 (disponible en https://www.equator-network.org/). En uso desde 2006, su finalidad es recoger todas las guías para la elaboración de manuscritos válidas, de cualquier ámbito, promover su uso y evaluar la literatura científica que se publica (tabla 1). Constituye el primer intento de coordinar los problemas de publicación inadecuada en una escala global. Agrupa investigadores, editores de revistas médicas, revisores, elaboradores de guías, grupos de financiación de investigación, y otros colaboradores interesados en mejorar la calidad de las publicaciones y la investigación. Además, en su apartado «caja de herramientas»13 proporciona ayuda práctica y recursos para los profesionales en diferentes procesos.
Guías para la elaboración de manuscritos de los principales tipos de estudios
| Ensayos aleatorizados | CONSORT | Extensiones |
| Estudios observacionales | STROBE | Extensiones |
| Revisiones sistemáticas | PRISMA | Extensiones |
| Protocolos de estudio | SPIRIT | PRISMA-P |
| Estudios diagnósticos/pronósticos | STARD | TRIPOD |
| Casos clínicos | CARE | Extensiones |
| Guías de práctica clínica | AGREE | RIGHT |
| Ensayos no aleatorizados | TREND | |
| Investigación cualitativa | SRQR | COREQ |
| Estudios preclínicos con animales | ARRIVE | |
| Estudios de mejora de la calidad | SQUIRE | Extensiones |
| Evaluaciones económicas | CHEERS |
Modificado de: https://www.equator-work.org/
En este artículo se presentan las guías que consideramos de más interés, por el tipo de estudio y por su frecuencia de uso, para las personas interesadas en publicar artículos, para las que realizan revisiones por pares, para editores y para los lectores de la literatura científica en general.
¿Qué debe incluir un artículo de un ensayo clínico aleatorizado?Los ensayos clínicos aleatorizados (ECA) bien diseñados y realizados correctamente son el estándar de oro para producir evidencia primaria que ayude en la toma de decisiones clínicas sobre intervenciones.
Preocupados por una abrumadora evidencia de que la calidad de las publicaciones de ECA estaban lejos de ser óptimas, un grupo de científicos y editores desarrolló la declaración Consolidated Standards of Reporting Trials (CONSORT) para mejorar la calidad de los artículos de ECA para su publicación. La primera versión apareció en 1996. Desde el documento inicial se han llevado a cabo dos revisiones, CONSORT 2001 y CONSORT 2010, y se han publicado múltiples extensiones complementarias. En 2022 se han presentado extensiones muy interesantes para valorar con más detalle las variables de resultado (The CONSORT-Outcomes 2022)14 y los efectos adversos de las intervenciones (CONSORT Harms 2022)15.
En la web EQUATOR8 podemos encontrar la declaración CONSORT 2010, su lista de verificación, la plantilla del diagrama de flujo de los participantes y el imprescindible documento de ayuda (CONSORT 2010 Explanation and Elaboration)16. La lista de verificación consta de 25 ítems (algunos con subapartados) que, por su gran relevancia, deberían aparecer siempre en los artículos publicados de cualquier ECA. Están organizados en 6 secciones: Título y resumen, Introducción, Métodos, Resultados, Discusión y Otra información. La extensión CONSORT-Outcomes 2022 añade 17 ítems más como subapartados de la lista CONSORT 2010, aumentando el detalle de los apartados de Resultados (ítem 6a), Tamaño muestral (ítem 7a), Métodos estadísticos (ítem 12a) y Análisis secundarios (ítem 18).
En la tabla 2 se expone la lista de verificación CONSORT 2010, traducida al español.
Lista de verificación CONSORT 2010
| Sección/tema | ítem n.° | Ítem de la lista de verificación |
|---|---|---|
| Título y resumen | 1a | Identificación como un ensayo clínico aleatorizado en el título |
| 1b | Resumen estructurado del diseño, métodos, resultados y conclusiones del ensayo (para más detalles consulte CONSORT Abstracts) | |
| Introducción | ||
| Antecedentes y objetivos | 2a | Antecedentes científicos y justificación |
| 2b | Objetivos específicos o hipótesis | |
| Métodos | ||
| Diseño del ensayo | 3a | Descripción del diseño del ensayo (por ejemplo, paralelo, factorial), incluida la razón de asignación |
| 3b | Cambios importantes en los métodos después de iniciar el ensayo (por ejemplo, criterios de selección) y su justificación | |
| Participantes | 4a | Criterios de elegibilidad de los participantes |
| 4b | Ámbito y lugar en que se recogieron los datos | |
| Intervenciones | 5 | Las intervenciones para cada grupo con detalles suficientes para permitir la replicación, incluidos cómo y cuándo se administraron realmente |
| Resultados | 6a | Especificación a priori de las variables respuesta (o desenlace) principal(es) y secundarias, incluidos cómo y cuándo se evaluaron |
| 6b | Cualquier cambio en las variables respuesta tras el inicio del ensayo, junto con los motivos de la(s) modificación(es) | |
| Tamaño muestral | 7a | Cómo se determinó el tamaño muestral |
| 7b | Si corresponde, explicar cualquier análisis intermedio y las reglas de interrupción | |
| Aleatorización | ||
| Generación de la secuencia | 8a | Método utilizado para generar la secuencia de asignación aleatoria |
| 8b | Tipo de aleatorización; detalles de cualquier restricción (como bloques y tamaño de los bloques) | |
| Mecanismo de ocultación de la asignación | 9 | Mecanismo utilizado para implementar la secuencia de asignación aleatoria (como contenedores numerados de modo secuencial), describiendo los pasos realizados para ocultar la secuencia hasta que se asignaron las intervenciones |
| Implementación | 10 | Quién generó la secuencia de asignación aleatoria, quién seleccionó a los participantes y quién asignó los participantes a las intervenciones |
| Enmascaramiento | 11a | Si se realizó, a quién se mantuvo cegado después de asignar las intervenciones (por ejemplo, a participantes, cuidadores, evaluadores del resultado) y de qué modo |
| 11b | Si es relevante, descripción de la similitud de las intervenciones | |
| Métodos estadísticos | 12a | Métodos estadísticos utilizados para comparar los grupos en cuanto a la variable de respuesta principal y las secundarias |
| 12b | Métodos de análisis adicionales, como análisis de subgrupos y análisis ajustados | |
| Resultados | ||
| Flujo de participantes (se recomienda encarecidamente un diagrama de flujo) | 13a | Para cada grupo, el número de participantes que se asignaron aleatoriamente, que recibieron el tratamiento propuesto y que se incluyeron en el análisis principal |
| 13b | Para cada grupo, pérdidas y exclusiones después de la aleatorización, junto con los motivos | |
| Reclutamiento | 14a | Fechas que definen los periodos de reclutamiento y de seguimiento |
| 14b | Causa de la finalización o de la interrupción del ensayo | |
| Datos basales | 15 | Una tabla que muestre las características basales demográficas y clínicas para cada grupo |
| Números analizados | 16 | Para cada grupo, número de participantes (denominador) incluidos en cada análisis y si el análisis se basó en los grupos inicialmente asignados |
| Variables de Resultado y estimación | 17a | Para cada respuesta o variable de resultado final principal y secundario, resultados para cada grupo, y el tamaño del efecto estimado y su precisión (como intervalo de confianza del 95%) |
| 17b | Para las respuestas dicotómicas, se recomienda la presentación de los tamaños del efecto tanto absoluto como relativo | |
| Análisis secundarios | 18 | Resultados de cualquier otro análisis realizado, incluido el análisis de subgrupos y los análisis ajustados, diferenciando entre los especificados a priori y los exploratorios |
| Daños (perjuicios) | 19 | Todos los daños (perjuicios) o efectos no intencionados en cada grupo (para una orientación específica, véase CONSORT for harms) |
| Discusión | ||
| Limitaciones | 20 | Limitaciones del ensayo clínico, abordando las fuentes de posibles sesgos, las de imprecisión y, si procede, la multiplicidad de análisis |
| Generalización | 21 | Posibilidad de generalización (validez externa, aplicabilidad) de los hallazgos del ensayo |
| Interpretación | 22 | Interpretación consistente con los resultados, con balance de beneficios y daños, y considerando otras evidencias relevantes |
| Otra información | ||
| Registro | 23 | Número de registro y nombre del registro de ensayos |
| Protocolo | 24 | Dónde puede accederse al protocolo completo del ensayo, si está disponible |
| Financiación | 25 | Fuentes de financiación y otras ayudas (como suministro de medicamentos), papel de los financiadores |
Modificado de: Cobos-Carbó A, Augustovski F. Declaración CONSORT 2010: actualización de la lista de comprobación para informar ensayos clínicos aleatorizados de grupos paralelos. Med Clin (Barc). 2011;137:213-5.
Aunque la realización de un ensayo clínico (EC) aleatorizado y controlado es la mejor opción para demostrar la eficacia de una intervención, no siempre es posible llevarlo a cabo. A menudo encontramos publicaciones científicas cuyos resultados se basan en EC no aleatorizados. Este tipo de estudios se llevan a cabo cuando no es ético realizar un EC aleatorizado, cuando el objetivo de la investigación es analizar la efectividad en condiciones de práctica clínica real, cuando interesa analizar el coste-efectividad de una intervención terapéutica, o cuando la cadena casual del efecto de la intervención es muy compleja. En estas situaciones estaría indicada la realización de un EC no aleatorizado, que aún no tiene el reconocimiento que debería tener. Es cierto que los EC aleatorizados tienen la gran ventaja de controlar sesgos o errores sistemáticos no tenidos en cuenta en el diseño del estudio por desconocimiento previo, pero en los EC no aleatorizados el problema de la aleatorización se podría compensar con métodos bayesianos que cuantifiquen en qué medida los resultados podrían explicarse por posibles sesgos de selección de pacientes17.
Muchas de las decisiones en las que basamos nuestra práctica diaria o las decisiones de salud pública se basan en EC no aleatorizados. Por ello es muy importante la transparencia, el detalle y la claridad en la comunicación de los estudios con este diseño. Para ayudarnos contamos con la guía Transparent Reporting of Evaluation with Non Randomized Designs (TREND)18,19.
La primera versión de esta guía se publicó en 2004 en la revista The American Journal of Public Health17, promovida por los Center for Disease Control and Prevention (CDC)20 y varios editores de revistas. La finalidad era dar recomendaciones para autores, revisores y editores sobre lo que debe incluir una publicación sobre un EC no aleatorizado. Consta de 22 ítems divididos en cinco apartados: Título, Introducción, Métodos, Resultados y Discusión. En la tabla 3 se puede ver la lista de comprobación en su versión más actual.
Lista de verificación TREND
| Apartado de la publicación/Tema | Ítem n.° | Descriptor |
|---|---|---|
| Título y Resumen | ||
| Título y Resumen | 1 | Información sobre cómo las unidades se asignaron a las intervenciones |
| Resumen estructurado recomendado | ||
| Información de la población objetivo o de la muestra del estudio | ||
| Introducción | ||
| Antecedentes | 2 | Antecedentes científicos y justificación del método empleado |
| Teorías en las que se basa el diseño de intervenciones sobre el comportamiento | ||
| Métodos | ||
| Participantes | 3 | Criterios de elegibilidad de los participantes, incluidos criterios de inclusión en los diferentes niveles de reclutamiento y el plan de muestreo (por ejemplo, ciudades, clínicas, sujetos) |
| Métodos de reclutamiento (por ejemplo, derivación, autoselección), incluido el método de muestreo si se utilizó un plan sistemático de muestreo | ||
| Ámbito de reclutamiento | ||
| Ámbito y localización en que se efectuó el registro de datos | ||
| Intervenciones | 4 | Detalles de las intervenciones propuestas para cada alternativa en estudio, y cómo y cuándo se administraron realmente, incluyendo específicamente: |
| • Contenido; ¿qué se administró? | ||
| • Método de administración: ¿cómo se administró? | ||
| • Unidad de administración: ¿cómo se agrupó a los sujetos durante el proceso de administración? | ||
| • ¿Quién administró la intervención? | ||
| • Ámbito en el que se administró la intervención | ||
| • Cantidad y duración de la exposición: ¿cuántas sesiones o episodios o acontecimientos se propusieron? ¿Cuánto tiempo se propuso que duraran? | ||
| • Cronología: ¿cuánto tiempo se consideró necesario para administrar la intervención a cada unidad? | ||
| • Medidas propuestas para mejorar el cumplimiento o la adhesión al estudio (por ejemplo, incentivos) | ||
| Objetivos | 5 | Objetivos específicos e hipótesis |
| Variables | 6 | Variables principales y secundarias que miden la respuesta, claramente definidas |
| Métodos utilizados para registrar los datos y todos los métodos utilizados para mejorar la calidad de las determinaciones | ||
| Información sobre los instrumentos validados, tales como propiedades psicométricas o biométricas | ||
| Tamaño muestral | 7 | Forma de determinar el tamaño muestral y, cuando resulte adecuado, descripción de los análisis intermedios y de las reglas de finalización del estudio |
| Método de asignación | 8 | Unidad de asignación (si la unidad que se asigna a cada alternativa en comparación es un individuo, un grupo o una comunidad) |
| Procedimiento usado para asignar las unidades a las intervenciones en estudio, incluyendo detalles de cualquier restricción (por ejemplo, formación de bloques, estratificación, minimización) | ||
| Inclusión de los métodos utilizados para reducir los sesgos potenciales por no haber distribuido la muestra de forma aleatoria (por ejemplo, apareamiento) | ||
| Enmascaramiento | 9 | Especificación de si los participantes, los que administraron la intervención y los que valoraron los resultados desconocían o no la asignación de los participantes a las alternativas estudiadas. En caso afirmativo, información acerca de cómo se realizó el enmascaramiento y cómo se evaluó |
| Unidad de análisis | 10 | Descripción de la unidad más pequeña analizada para valorar los efectos de la intervención (por ejemplo, individuo, grupo o comunidad) |
| Si la unidad analizada difiere de la unidad asignada en el estudio, qué método analítico se ha usado para controlar esta diferencia (por ejemplo, ajustando las estimaciones del error estándar por el efecto de diseño o utilizando análisis multinivel) | ||
| Métodos estadísticos | 11 | Métodos estadísticos empleados para analizar las variables principales, incluidos los métodos complejos para datos correlacionados |
| Métodos estadísticos utilizados para análisis adicionales, como análisis de subgrupos y análisis ajustados | ||
| Métodos para la imputación de los valores faltantes, si se usaron | ||
| Programas estadísticos utilizados | ||
| Resultados | ||
| Flujo de participantes | 12 | Flujo de participantes en las diferentes etapas del estudio: reclutamiento, asignación, inclusión y exposición a la intervención, seguimiento y análisis (se recomienda vivamente utilizar un diagrama) |
| • Reclutamiento: número de participantes evaluados para su elegibilidad, los que resultaron elegibles y no elegibles, los que declinaron participar y los incluidos en el estudio | ||
| • Asignación: número de participantes asignados a cada intervención del estudio | ||
| • Inclusión y exposición a la intervención: número de participantes asignados a cada alternativa del estudio y número de participantes que las recibieron realmente | ||
| • Seguimiento: número de participantes que completaron y no completaron el seguimiento en cada una de las alternativas en estudio (es decir, las pérdidas en el seguimiento) | ||
| • Análisis: número de participantes incluidos y excluidos del análisis principal, para cada alternativa estudiada | ||
| Descripción de las desviaciones del protocolo, junto con los motivos | ||
| Reclutamiento | 13 | Fechas establecidas para los periodos de reclutamiento y de seguimiento |
| Datos basales | 14 | Datos demográficos y características clínicas basales de los participantes según cada alternativa del estudio |
| Datos basales de cada variable de estudio relevante para estudios específicos sobre prevención de enfermedades | ||
| Comparación de los datos basales de los participantes perdidos en el seguimiento y de los que completaron el estudio, en conjunto y según las alternativas estudiadas | ||
| Comparación entre la población de estudio al inicio y la población diana de interés | ||
| Datos demográficos y características clínicas basales de los participantes según cada alternativa del estudio | ||
| Equivalencia basal | 15 | Información sobre la equivalencia basal de los grupos estudiados y métodos estadísticos utilizados para controlar las diferencias basales |
| Números analizados | 16 | Número de participantes (denominador) incluidos en el análisis de cada alternativa del estudio, especialmente cuando los denominadores cambian en diferentes resultados; presentación de los resultados en cifras absolutas cuando sea posible |
| Indicación de si la estrategia del análisis se basa en la «intención de tratar» o, en caso contrario, descripción de cómo se analizaron los participantes no cumplidores | ||
| Variables y estimaciones | 17 | Para cada variable principal y secundaria, un resumen de los resultados de cada alternativa del estudio, junto con la estimación del tamaño del efecto y un intervalo de confianza para indicar la precisión de su estimación |
| Inclusión de los resultados nulos o negativos | ||
| Inclusión de los resultados obtenidos en la comprobación de los mecanismos causales preespecificados que se supone que explican el efecto de la intervención, si existen | ||
| Análisis secundarios | 18 | Resumen de otros análisis efectuados, incluidos análisis de subgrupos o análisis restringidos, indicando si estaban previstos o son de carácter exploratorio |
| Efectos adversos | 19 | Resumen de todos los acontecimientos adversos importantes o de los efectos no esperados en cada alternativa del estudio (incluyendo medidas de tendencia central, estimación del tamaño del efecto e intervalos de confianza) |
| Discusión | ||
| Interpretación | 20 | Interpretación de los resultados, teniendo en cuenta las hipótesis del estudio, las fuentes potenciales de sesgos, la imprecisión de las determinaciones, los análisis repetitivos y otras limitaciones o debilidades del estudio |
| Discusión de los resultados, considerando los mecanismos mediante los que actúa la intervención (vías causativas), o los mecanismos o explicaciones alternativas | ||
| Discusión de los éxitos y dificultades para implementar la intervención, fidelidad de la implementación | ||
| Discusión sobre la investigación, programática, o implicaciones para las políticas públicas | ||
| Generalización | 21 | Posibilidad de generalización (validez externa) de los resultados del ensayo, considerando: población estudiada, características de la intervención, duración del seguimiento, incentivos, proporción de cumplimiento, lugares/ámbitos específicos que han participado en el estudio, y otros aspectos relacionados con este contexto |
| Evidencia general | 22 | Interpretación general de los resultados en el contexto de la evidencia existente actualizada y de las teorías vigentes |
Traducido de TREND Statement checklist (pdf). Disponible en: https://www.cdc.gov/trendstatement/pdf/trendstatement_trend_checklist.pdf
TREND se considera como un complemento de CONSORT (guía para la elaboración de manuscritos de EC aleatorizados), con elementos coincidentes y otros específicos y diferentes a ella. Los datos que se presentan en este apartado están actualizados por los CDC en septiembre de 2018 y por EQUATOR21 en noviembre de 2021.
¿Qué debe incluir un artículo de un estudio observacional?Una de las definiciones de la epidemiología es «el estudio de la distribución y de los determinantes de las enfermedades en una población específica, y la aplicación de estos conocimientos al control de los problemas de salud». El objetivo de los estudios epidemiológicos es tratar de responder a preguntas acerca de la frecuencia y la tendencia de una enfermedad determinada, qué intervenciones preventivas son efectivas, qué beneficios representa la modificación de una determinada pauta diagnóstica o terapéutica, etc.
Para responder a estas preguntas la epidemiología ha desarrollado una metodología propia, fundamentada en la observación. El tipo de diseño epidemiológico responderá, por tanto, a la pregunta que los investigadores hagan de la población y de la condición (enfermedad, factores de riesgo o preventivo, actividad asistencial, etc.) a estudiar22. Así, para establecer un pronóstico el diseño más adecuado es un estudio observacional longitudinal, y para la investigación etiológica, un estudio de cohortes o de casos y controles.
Los estudios observacionales están sujetos, por el propio diseño, a diferentes errores sistemáticos o sesgos que afectan a su validez interna, y por estos (y otros factores) se pueden ver afectadas la validez externa o la capacidad de generalización de los resultados. Además, con frecuencia, los artículos publicados de estudios observacionales no presentan información suficientemente clara y detallada de la investigación realizada, lo que dificulta su evaluación.
Para mejorar la publicación de los estudios de investigación observacionales se desarrolló la iniciativa Strengthening the Reporting of Observational Studies in Epidemiology (STROBE), una guía que presentaba una serie de recomendaciones sobre qué datos se deberían incluir en un artículo completo y preciso de un estudio observacional. La iniciativa STROBE se publicó en 2007 y se puede consultar en EQUATOR11 o en su propia web23.
Proporciona listas de verificación para los tres diseños más importantes de la epidemiología analítica observacional: estudios de cohortes, estudios de casos y controles, y estudios transversales. Asimismo, existe una lista de verificación combinada que se puede utilizar para cualquiera de los tres diseños (tabla 4)24, y un artículo que explica y detalla la elaboración de cada ítem de la lista, y ofrece el contexto metodológico y ejemplos (STROBE: explanation and elaboration)25.
Lista de verificación STROBE
| Ítem n° | Recomendación | |
|---|---|---|
| Título y resumen | 1 | (a) Indique, en el título o en el resumen, el diseño del estudio con un término habitual(b) Proporcione en el resumen una sinopsis informativa y equilibrada de lo que se ha hecho y lo que se ha encontrado |
| Introducción | ||
| Contexto/fundamento | 2 | Explique las razones y el fundamento científicos de la investigación que se comunica |
| Objetivos | 3 | Indique los objetivos específicos, incluida cualquier hipótesis preespecificada |
| Métodos | ||
| Diseño del estudio | 4 | Presente al principio del documento los elementos clave del diseño del estudio |
| Contexto | 5 | Describa el marco, los lugares y las fechas relevantes, incluido los períodos de reclutamiento, exposición, seguimiento y recogida de datos |
| Participantes | 6 | (a) Estudios de cohortes: proporcione los criterios de elegibilidad, así como las fuentes y el método de selección de los participantes. Especifique los métodos de seguimientoEstudios de casos y controles: proporcione los criterios de elegibilidad, así como las fuentes y el proceso diagnóstico de los casos y el de selección de los controles. Proporcione las razones para la elección de casos y controlesEstudios transversales: proporcione los criterios de elegibilidad y las fuentes y métodos de selección de los participantes |
| (b) Estudios de cohortes: en los estudios apareados, proporcione los criterios para la formación de parejas y el número de participantes con y sin exposiciónEstudios de casos y controles: en los estudios apareados, proporcione los criterios para la formación de las parejas y el número de controles por cada caso | ||
| Variables | 7 | Defina claramente todas las variables: de respuesta, exposiciones, predictoras, confusoras y modificadoras del efecto. Si procede, proporcione los criterios diagnósticos |
| Fuentes de datos/medidas | 8a | Para cada variable de interés, proporcione las fuentes de datos y los detalles de los métodos de valoración (medida). Si hubiera más de un grupo, especifique la comparabilidad de los procesos de medida |
| Sesgos | 9 | Especifique todas las medidas adoptadas para afrontar fuentes potenciales de sesgo |
| Tamaño muestral | 10 | Explique cómo se determinó el tamaño muestral |
| Variables cuantitativas | 11 | Explique cómo se trataron las variables cuantitativas en el análisis. Si procede, explique qué grupos se definieron y por qué |
| Métodos estadísticos | 12 | (a) Especifique todos los métodos estadísticos, incluidos los empleados para controlar los factores de confusión |
| (b) Especifique todos los métodos utilizados para analizar subgrupos e interacciones | ||
| (c) Explique el tratamiento de los datos ausentes (missing data) | ||
| (d) Estudio de cohortes: si procede, explique cómo se afrontan las pérdidas en el seguimientoEstudios de casos y controles: si procede, explique cómo se aparearon casos y controlesEstudios transversales: si procede, especifique cómo se tiene en cuenta en el análisis la estrategia de muestreo | ||
| (e) Describa los análisis de sensibilidad | ||
| Resultados | ||
| Participantes | 13a | (a) Describa el número de participantes en cada fase del estudio; por ejemplo: cifras de los participantes potencialmente elegibles, los analizados para ser incluidos, los confirmados elegibles, los incluidos en el estudio, los que tuvieron un seguimiento completo y los analizados |
| (b) Describa las razones de la pérdida de participantes en cada fase | ||
| (c) Considere el uso de un diagrama de flujo | ||
| Datos descriptivos | 14a | (a) Describa las características de los participantes en el estudio (por ejemplo, demográficas, clínicas, sociales) y la información sobre las exposiciones y los posibles factores de confusión |
| (b) Indique el número de participantes con datos ausentes en cada variable de interés | ||
| (c) Estudios de cohortes: resuma el período de seguimiento (por ejemplo, promedio y total) | ||
| Datos de las variables | 15a | Estudios de cohortes: describa el número de eventos resultado, o bien proporcione medidas resumen a lo largo del tiempo de resultado |
| Estudios de casos y controles: describa el número de participantes en cada categoría de exposición, o bien proporcione medidas resumen de exposición | ||
| Estudios transversales: describa el número de eventos resultado, o bien proporcione medidas resumen | ||
| Resultados principales | 16 | (a) Proporcione estimaciones no ajustadas y, si procede, ajustadas por factores de confusión, así como su precisión (por ejemplo, intervalos de confianza del 95%). Especifique los factores de confusión por los que se ajusta y las razones para incluirlos |
| (b) Si categoriza variables continuas, describa los límites de los intervalos | ||
| (c) Si fuera pertinente, valore acompañar las estimaciones del riesgo relativo con estimaciones del riesgo absoluto para un período de tiempo relevante | ||
| Otros análisis | 17 | Describa otros análisis efectuados (de subgrupos, interacciones o sensibilidad) |
| Discusión | ||
| Resultados clave | 18 | Resuma los resultados principales de los objetivos del estudio |
| Limitaciones | 19 | Discuta las limitaciones del estudio, teniendo en cuenta posibles fuentes de sesgo o de imprecisión. Razone tanto sobre la dirección como sobre la magnitud de cualquier posible sesgo |
| Interpretación | 20 | Proporcione una interpretación global prudente de los resultados considerando objetivos, limitaciones, multiplicidad de análisis, resultados de estudios similares y otras pruebas empíricas relevantes |
| Generabilidad | 21 | Discuta la posibilidad de generalizar los resultados (validez externa) |
| Otra información | ||
| Financiación | 22 | Especifique la financiación y el papel de los patrocinadores del estudio y, si procede, del estudio previo en el que se basa el presente artículo |
Proporcione esta información por separado para casos y controles en los estudios con diseño de casos y controles. Si procede, también de los grupos con y sin exposición en los estudios de cohortes y en los transversales.
Tomado de: Von Elm E, Altman DG, Egger M, Pocock S, Gotzsche PC, Vandenvroucke JP. Declaración de la iniciativa STROBE (Strengthenig the Reporting of Observational studies in Epidemiology): directrices para la comunicación de estudios observacionales. Gac Sanit. 2008;22:144-50.
Las listas contienen 22 ítems clasificados en seis secciones: Título y resumen, Introducción, Métodos, Resultados, Discusión y Otra información (Financiación). En la lista combinada, 18 ítems son comunes y 4 son específicos para cada diseño.
¿Qué debe incluir un artículo de un estudio de precisión diagnóstica?Los artículos de precisión diagnóstica deberían presentar toda la información esencial necesaria para que los lectores juzguen la importancia y la credibilidad de sus conclusiones, así como una comunicación completa y rigurosa de sus resultados. Solo así, si toda la información necesaria aparece en la publicación, será posible posteriormente evaluar los posibles riesgos de sesgo del estudio y su aplicabilidad. Sin embargo, múltiples revisiones muestran que los estudios de precisión diagnóstica, con frecuencia, no presentan de forma adecuada información esencial sobre los pacientes incluidos, sobre el diseño del estudio o sobre la totalidad de los resultados. Asimismo, es frecuente que las conclusiones sobre la prueba estudiada sean demasiado optimistas26.
En 2003, siguiendo el ejemplo de CONSORT, se publicó la guía para la elaboración de manuscritos de precisión diagnóstica Standards for Reporting Diagnostic Accuracy (STARD). La guía apareció en importantes revistas médicas generales y de especialidad. Constaba de una lista de 25 ítems, un diagrama de flujo y un documento explicativo, en el que se exponían la significación y el fundamento de cada uno de los ítems, y se revisaba brevemente la evidencia respecto a estos27. Su publicación se acompañó de varios editoriales en los que se recomendaba su aceptación por parte de los editores de revistas y de los comités de revisión.
En el año 2015 se realizó una actualización con el objetivo de incluir nuevas evidencias sobre causas de sesgo y variabilidad, y facilitar su uso.
En la tabla 5 se presenta la traducción al español de la lista de 30 ítems de la guía STARD 2015. Estos se clasifican de acuerdo con los apartados habituales de los artículos originales: Introducción, Métodos, Resultados y Discusión, con una sección previa (Título y resumen) y una posterior (Otra información).
Lista de verificación STARD 2015
| Sección y tema | n.° | Ítem |
|---|---|---|
| Título o resumen | ||
| 1 | Identificación como un estudio de precisión diagnóstica utilizando al menos una medida de precisión (como sensibilidad, especificidad, valores predictivos o ROC) | |
| Resumen | ||
| 2 | Resumen estructurado del diseño del estudio, métodos, resultados y conclusiones (consultar STARD para resúmenes) | |
| Introducción | ||
| 3 | Antecedentes científicos y clínicos, incluidos el uso previsto y la función clínica de la prueba índice | |
| 4 | Objetivos del estudio e hipótesis | |
| Métodos | ||
| Diseño del estudio | 5 | Si la recogida de datos se planificó antes de realizar la prueba índice y el estándar de referencia (estudio prospectivo) o después (estudio retrospectivo) |
| Participantes | 6 | Criterios de elegibilidad |
| 7 | Sobre qué base se identificaron los participantes potencialmente elegibles (síntomas, resultados de pruebas anteriores, inclusión en el registro) | |
| 8 | Dónde y cuándo se identificaron los participantes potencialmente elegibles (ámbito, lugar y fechas) | |
| 9 | Si los participantes formaron una serie consecutiva, aleatoria o de conveniencia | |
| Metodología de las pruebas | 10a | Prueba índice, con suficiente detalle para permitir la replicación |
| 10b | Estándar de referencia, con suficiente detalle para permitir la replicación | |
| 11 | Justificación para elegir el estándar de referencia (si existen alternativas) | |
| 12a | Definición y justificación de los puntos de corte de positividad de la prueba o categorías de resultados de la prueba índice, distinguiendo los preespecificados de los exploratorios | |
| 12b | Definición y justificación de los puntos de corte de positividad de la prueba o categorías de resultados del estándar de referencia, distinguiendo lo especificado previamente de lo exploratorio | |
| 13a | Si la información clínica y los resultados del estándar de referencia estaban disponibles para los realizadores o lectores de la prueba índice | |
| 13b | Si la información clínica y los resultados de la prueba índice estaban disponibles para los evaluadores del estándar de referencia | |
| Análisis | 14 | Métodos para estimar o comparar medidas de precisión diagnóstica |
| 15 | Cómo se trataron los resultados indeterminados de la prueba índice o del estándar de referencia | |
| 16 | Cómo se trataron los datos faltantes en la prueba índice y el estándar de referencia | |
| 17 | Cualquier análisis de variabilidad en la precisión diagnóstica, distinguiendo lo preespecificado de lo exploratorio | |
| 18 | Tamaño de muestra previsto y cómo se determinó | |
| Resultados | ||
| Participantes | 19 | Flujo de participantes, usando un diagrama |
| 20 | Características demográficas y clínicas iniciales de los participantes | |
| 21a | Distribución de la gravedad de la enfermedad en aquellos con la condición objetivo | |
| 21b | Distribución de diagnósticos alternativos en aquellos sin la condición objetivo | |
| 22 | Intervalo de tiempo y cualquier intervención clínica entre la prueba índice y el estándar de referencia | |
| Resultados de la prueba | 23 | Tabulación cruzada de los resultados de la prueba índice (o su distribución) por los resultados del estándar de referencia |
| 24 | Estimaciones de la exactitud diagnóstica y su precisión (como IC del 95%) | |
| 25 | Cualquier evento adverso por realizar la prueba índice o el estándar de referencia | |
| Discusión | ||
| 26 | Limitaciones del estudio, incluidas las fuentes de sesgo potencial, la incertidumbre estadística y la generalizabilidad | |
| 27 | Implicaciones para la práctica, incluido el uso previsto y la función clínica de la prueba índice | |
| Otra información | ||
| 28 | Número de registro y nombre del registro | |
| 29 | Dónde se puede acceder al protocolo de estudio completo | |
| 30 | Fuentes de financiación y otro tipo de apoyo; papel de los financiadores | |
Traducida de STARD 2015 checklist. Disponible en: https://www.equator-network.org/wp-content/uploads/2015/03/STARD-2015-checklist.pdf
En el apartado sobre Explanation and elaboration papers de STARD 2015, en la web EQUATOR12, el lector puede encontrar el artículo original de Cohen et al.28 con ejemplos comentados y una explicación extensa de cada uno de sus 30 ítems. Con su información se intenta facilitar la redacción de artículos de precisión diagnóstica y conseguir que ofrezcan toda la información importante. Al mismo tiempo, se pretende ayudar a los revisores y editores de las revistas, y a los lectores en general, a verificar que los artículos enviados y publicados sean suficientemente detallados.
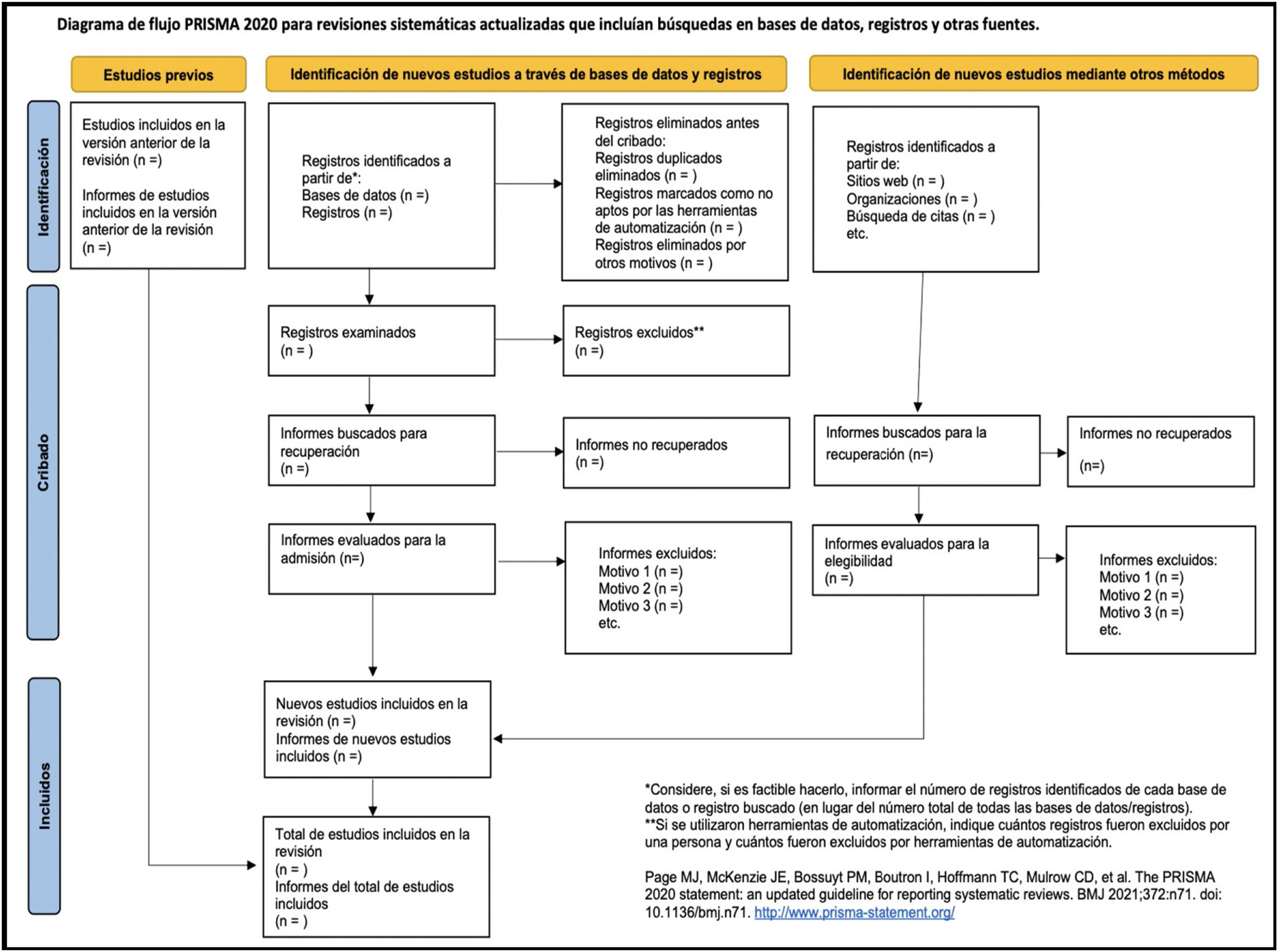
¿Qué debe incluir un artículo de una revisión sistemática?La revisión sistemática (RS) y metaanálisis es un tipo de estudio que sintetiza la evidencia actualizada de un tema concreto. La metodología utilizada en su elaboración sigue un protocolo claramente marcado, estandarizado y replicable que asegura la calidad, la consistencia y la transparencia del proceso de revisión29. A la hora de su publicación es muy importante que todo este proceso de elaboración quede reflejado de forma completa y detallada en el artículo, explicando por qué se realizó, qué se hizo y qué se encontró. La guía PRISMA 2020 proporciona recomendaciones para que esto sea posible incorporando los avances en los métodos para identificar, seleccionar, evaluar y sintetizar los estudios elegibles para su inclusión en las revisiones sistemáticas.
Todo lo relacionado con PRISMA 2020 se puede encontrar en su propia web30, incluido parte de los documentos traducidos al español. Tanto en su web como en la web de EQUATOR31 se pueden encontrar la declaración PRISMA 2020, la lista de verificación de 27 elementos, la plantilla de diagramas de flujo y, para las personas más interesadas que quieran profundizar, una versión más completa y detallada de la lista de verificación, y el documento PRISMA 2020 Explanation and Elaboration32.
Los 27 ítems de los listados de verificación se clasifican en 7 secciones: Título, Resumen, Introducción, Métodos, Resultados, Discusión y Financiación.
En la tabla 6 se presenta la lista de verificación de PRISMA 2020 traducida33 y en la figura 1, una plantilla del diagrama de flujo recomendado.
Lista de verificación PRISMA 2020
| Sección/tema | Ítem n.° | Ítem de la lista de verificación |
|---|---|---|
| Título | ||
| Título | 1 | Identifique la publicación como una revisión sistemática |
| Resumen | ||
| Resumen estructurado | 2 | Vea la lista de verificación para resúmenes estructurados de la declaración PRISMA 2020 (tabla 2) |
| Introducción | ||
| Justificación | 3 | Describa la justificación de la revisión en el contexto del conocimiento existente |
| Objetivos | 4 | Proporcione una declaración explícita de los objetivos o las preguntas que aborda la revisión |
| Métodos | ||
| Criterios de elegibilidad | 5 | Especifique los criterios de inclusión y exclusión de la revisión y cómo se agruparon los estudios para la síntesis |
| Fuentes de información | 6 | Especifique todas las bases de datos, registros, sitios web, organizaciones, listas de referencias y otros recursos de búsqueda o consulta para identificar los estudios. Especifique la fecha en la que cada recurso se buscó o consultó por última vez |
| Estrategia de búsqueda | 7 | Presente las estrategias de búsqueda completas de todas las bases de datos, registros y sitios web, incluyendo cualquier filtro y los límites utilizados |
| Proceso de selección de los estudios | 8 | Especifique los métodos utilizados para decidir si un estudio cumple con los criterios de inclusión de la revisión, incluyendo cuántos autores de la revisión cribaron cada registro y cada publicación recuperada, si trabajaron de manera independiente y, si procede, los detalles de las herramientas de automatización utilizadas en el proceso |
| Proceso de extracción de los datos | 9 | Indique los métodos utilizados para extraer los datos de los informes o publicaciones, incluyendo cuántos revisores recopilaron datos de cada publicación, si trabajaron de manera independiente, los procesos para obtener o confirmar los datos por parte de los investigadores del estudio y, si procede, los detalles de las herramientas de automatización utilizadas en el proceso |
| Lista de los datos | 10a | Enumere y defina todos los desenlaces para los que se buscaron los datos. Especifique si se buscaron todos los resultados compatibles con cada dominio del desenlace (por ejemplo, para todas las escalas de medida, puntos temporales, análisis) y, de no ser así, los métodos utilizados para decidir los resultados que se debían recoger |
| 10b | Enumere y defina todas las demás variables para las que se buscaron datos (por ejemplo, características de los participantes y de la intervención, fuentes de financiación). Describa todos los supuestos formulados sobre cualquier información ausente (missing) o incierta | |
| Evaluación del riesgo de sesgo de los estudios individuales | 11 | Especifique los métodos utilizados para evaluar el riesgo de sesgo de los estudios incluidos, incluyendo detalles de las herramientas utilizadas, cuántos autores de la revisión evaluaron cada estudio y si trabajaron de manera independiente y, si procede, los detalles de las herramientas de automatización utilizadas en el proceso |
| Medidas del efecto | 12 | Especifique, para cada desenlace, las medidas del efecto (por ejemplo, razón de riesgos, diferencia de medias) utilizadas en la síntesis o presentación de los resultados |
| Métodos de síntesis | 13a | Describa el proceso utilizado para decidir qué estudios eran elegibles para cada síntesis (por ejemplo, tabulando las características de los estudios de intervención y comparándolas con los grupos previstos para cada síntesis (ítem n.° 5) |
| 13b | Describa cualquier método requerido para preparar los datos para su presentación o síntesis, tales como el manejo de los datos perdidos en los estadísticos de resumen o las conversiones de datos | |
| 13c | Describa los métodos utilizados para tabular o presentar visualmente los resultados de los estudios individuales y su síntesis | |
| 13d | Describa los métodos utilizados para sintetizar los resultados y justifique sus elecciones. Si se ha realizado un metaanálisis, describa los modelos, los métodos para identificar la presencia y el alcance de la heterogeneidad estadística, y los programas informáticos utilizados | |
| 13e | Describa los métodos utilizados para explorar las posibles causas de heterogeneidad entre los resultados de los estudios (por ejemplo, análisis de subgrupos, metarregresión) | |
| 13f | Describa los análisis de sensibilidad que se hayan realizado para evaluar la robustez de los resultados de la síntesis | |
| Evaluación del sesgo en la publicación | 14 | Describa los métodos utilizados para evaluar el riesgo de sesgo debido a resultados faltantes en una síntesis (derivados de los sesgos en las publicaciones) |
| Evaluación de la certeza de la evidencia | 15 | Describa los métodos utilizados para evaluar la certeza (o confianza) en el cuerpo de la evidencia para cada desenlace |
| Resultados | ||
| Selección de los estudios | 16a | Describa los resultados de los procesos de búsqueda y selección, desde el número de registros identificados en la búsqueda hasta el número de estudios incluidos en la revisión, idealmente utilizando un diagrama de flujo |
| 16b | Cite los estudios que aparentemente cumplían con los criterios de inclusión, pero que fueron excluidos, y explique por qué fueron excluidos | |
| Características de los estudios | 17 | Cite cada estudio incluido y presente sus características |
| Riesgo de sesgo de los estudios individuales | 18 | Presente las evaluaciones del riesgo de sesgo para cada uno de los estudios incluidos |
| Resultados de los estudios individuales | 19 | Presente, para todos los desenlaces y para cada estudio: a)los estadísticos de resumen para cada grupo (si procede) y b)la estimación del efecto y su precisión (por ejemplo, intervalo de credibilidad o de confianza), idealmente utilizando tablas estructuradas o gráficos |
| Resultados de la síntesis | 20a | Para cada síntesis, resuma brevemente las características y el riesgo de sesgo entre los estudios contribuyentes |
| 20b | Presente los resultados de todas las síntesis estadísticas realizadas. Si se ha realizado un metaanálisis, presente para cada uno de ellos el estimador de resumen y su precisión (por ejemplo, intervalo de credibilidad o de confianza) y las medidas de heterogeneidad estadística. Si se comparan grupos, describa la dirección del efecto | |
| 20c | Presente los resultados de todas las investigaciones sobre las posibles causas de heterogeneidad entre los resultados de los estudios | |
| 20d | Presente los resultados de todos los análisis de sensibilidad realizados para evaluar la robustez de los resultados sintetizados | |
| Sesgos en la publicación | 21 | Presente las evaluaciones del riesgo de sesgo debido a resultados faltantes (derivados de los sesgos en las publicaciones) para cada síntesis evaluada |
| Certeza de la evidencia | 22 | Presente las evaluaciones de la certeza (o confianza) en el cuerpo de la evidencia para cada desenlace evaluado |
| Discusión | ||
| Discusión | 23a | Proporcione una interpretación general de los resultados en el contexto de otras evidencias |
| 23b | Argumente las limitaciones de la evidencia incluida en la revisión | |
| 23c | Argumente las limitaciones de los procesos de revisión utilizados | |
| 23d | Argumente las implicaciones de los resultados para la práctica, las políticas y las futuras investigaciones | |
| Otra información | ||
| Registro y protocolo | 24a | Proporcione la información del registro de la revisión, incluyendo el nombre y el número de registro, o declare que la revisión no ha sido registrada |
| 24b | Indique dónde se puede acceder al protocolo, o declare que no se ha redactado ningún protocolo | |
| 24c | Describa y explique cualquier enmienda a la información proporcionada en el registro o en el protocolo | |
| Financiación | 25 | Describa las fuentes de apoyo financiero o no financiero para la revisión y el papel de los financiadores o patrocinadores en la revisión |
| Conflicto de intereses | 26 | Declare los conflictos de intereses de los autores de la revisión |
| Disponibilidad de datos, códigos y otros materiales | 27 | Especifique qué elementos de los que se indican a continuación están disponibles al público y dónde se pueden encontrar: plantillas de formularios de extracción de datos, datos extraídos de los estudios incluidos, datos utilizados para todos los análisis, código de análisis, cualquier otro material utilizado en la revisión |
Tomado de: Page MJ, McKenzie JE, Bossuyt PM, Boutron I, Hoffmann TC, Mulrow CD, et al. Declaración PRISMA 2020: una guía actualizada para la publicación de revisiones sistemáticas. Rev Esp Cardiol. 2021;74:790-9.
El proceso de publicación de un artículo científico culmina cuando este llega al lector al que va dirigido. El lector, sin embargo, no debería ser un mero receptor acrítico de la información que se pone en sus manos. Si el artículo se ha escrito según las recomendaciones de la guía para la elaboración de manuscritos adecuada, tendrá información suficiente para, con una lectura crítica, valorar la posibilidad de sesgos del estudio de investigación y la aplicabilidad de los resultados a su población.
Para ayudar en la lectura crítica de los artículos publicados hay múltiples herramientas. La red CASPe5 ofrece docencia sobre habilidades en lectura crítica y también instrumentos para la lectura crítica en español en su página web https://redcaspe.org/materiales/. Aquí, el lector podrá encontrar unas plantillas que contienen preguntas relevantes que le ayudarán a leer artículos de la mayoría de los tipos de diseño que se han comentado en este artículo. Estas preguntas tienen solo tres respuestas posibles: «Sí», «No» y «No sé». La respuesta «No sé» se debe generalmente a que la información necesaria para responder a la pregunta no se encuentra en el artículo. En ocasiones se debe a un problema en la ejecución del estudio, pero en otras el problema se encuentra en una comunicación deficiente del mismo. La generalización del uso de las guías de elaboración de manuscritos permitiría disminuir la incertidumbre y facilitaría la valoración de los artículos.
Con este artículo, el grupo de Pediatría Basada en la Evidencia anima a los futuros autores a usar las guías de elaboración de manuscritos para comunicar sus estudios de forma completa y estructurada. Esto facilitará posteriormente tanto el proceso editorial del artículo como su lectura crítica por parte de los lectores.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.