La utilización de normas de orientación para la nutrición parenteral neonatal mejora la eficiencia y la seguridad de su prescripción.
ObjetivoEvaluar la práctica de prescripción de nutrición parenteral neonatal en Portugal y el cumplimiento del Consenso Nacional (2008).
MétodosEncuesta de respuesta múltiple sobre la prescripción de nutrición parenteral (NP) enviada a los coordinadores de las 50 unidades de cuidados especiales neonatales portuguesas, tanto públicas como privadas, siendo 25 de nivel ii y 25 de nivel iii.
ResultadosSe prescribe NP en 32 unidades neonatales, habiendo 23 (71,9%) respondido la encuesta. De estas, 19 (82,6%) afirman tener como referencia el Consenso Nacional y las restantes siguen protocolos internos; 17 (73,9%) afirman preferir la prescripción mediante soporte informático. En recién nacidos pretérmino, la mayoría reporta una administración cautelosa de líquidos en la primera semana posnatal; inicio de aminoácidos desde el primer día posnatal con 1,5-3g/kg/día y aumento hasta 3-4g/kg/día; inicio de lípidos en los 3 días posnatales con 1g/kg/día y aumento hasta 3g/kg/día; administración de 40-70mg/kg/día de calcio y fósforo, con un ratio calcio:fósforo de 1,7:1 (mg:mg), y estimación de la osmolaridad de las soluciones y control semanal de la trigliceridemia, uremia, fosforemia y función hepática.
ConclusionesPor la elevada tasa de respuesta la muestra probablemente es representativa de la práctica de prescripción de nutrición parenteral neonatal en Portugal. La mayoría de las unidades tienen como referencia el Consenso Nacional, lo que contribuye a unos mejores cuidados de los recién nacidos.
The use of guidelines for neonatal parenteral nutrition (PN) improves its clinical efficiency and the safety of prescription.
ObjectiveTo evaluate the practices of neonatal parenteral nutrition prescription in Portugal, and the adherence to the National Consensus on neonatal PN (2008).
MethodsA questionnaire based on a multiple choice response on parenteral nutrition prescription was conducted, and sent to the coordinators of the 50 public and private Portuguese neonatal special care units, 25 being level III and 25 level II.
ResultsParenteral nutrition was prescribed in 32 neonatal units, 23 of which (71.9%) responded to the questionnaire. Of the respondents, 19 (82.6%) refer to follow the National Consensus, the remaining following local guidelines; 17 (73.9%) of units referred to using an electronic based system for prescription. In preterm neonates, most mentioned: administering judiciously the fluid intake during the first post-natal week; starting amino acids from the first post-natal day with 1.5-3g/kg/d, increasing up to 3-4g/kg/d; starting lipids from the first three post-natal days with 1g/kg/d, increasing up to 3g/kg/d; administering 40-70mg/kg/d of calcium and of phosphorus with the fixed calcium:phosphorus ratio of 1.7: 1 (mg:mg); and estimating the osmolality of the solutions, and weekly monitoring of serum triglycerides, blood urea, serum phosphorus and liver function.
ConclusionsThe high response rate is probably representative of the practice of PN prescription in Portugal. Most of the units used the National Consensus on neonatal PN as a reference, thus contributing to better nutritional support for neonates.
En recién nacidos muy prematuros, en los que hay limitaciones en la utilización plena de la vía entérica en los primeros días de vida, la administración precoz y adecuada de nutrientes por vía parenteral tiene un importante impacto a corto y a largo plazo en el crecimiento1.
Se reconoce que la utilización de normas de orientación de prescripción de nutrición parenteral (NP) neonatal mejora su eficiencia clínica y su seguridad2. Es deseable que se evalúen regularmente las prácticas e implantación de las recomendaciones de sociedades científicas de NP en las unidades de neonatología. Para ello, la encuesta demostró ser un método útil3–5.
En 2008, la Sociedad Portuguesa de Neonatología revisó y actualizó el Consenso Nacional sobre NP neonatal6. Este consenso se basa, entre otras, en las recomendaciones de la American Society for Parenteral and Enteral Nutrition (ASPEN)2 y en la posición conjunta de las European Society of Paediatric Gastroenterology, Hepatology and Nutrition (ESPGHAN), European Society for Clinical Nutrition and Metabolism y European Society of Paediatric Research7.
El objetivo del presente estudio fue evaluar las prácticas de prescripción de la NP neonatal en Portugal, y el cumplimiento del Consenso Nacional sobre NP neonatal6.
MétodosA solicitud de los autores, la Sociedad Portuguesa de Pediatría proporcionó en inicio de 2009 la lista de los 50 hospitales portugueses, públicos y privados, con unidades de cuidados especiales neonatales: 25 en hospitales de nivel ii y 25 en hospitales de nivel iii. También proporcionó el nombre y el contacto de los respectivos coordinadores clínicos. Se contactó con estos para saber si en sus respectivas unidades se prescribía NP, resultando que lo era en 32 de las 50.
En las unidades donde se prescribía NP se solicitó a los coordinadores que respondiesen una encuesta electrónica con formato de respuesta de selección múltiple, que fue enviado por correo electrónico entre julio y octubre de 2009. En la encuesta se incluyeron preguntas sobre las recomendaciones de prescripción incluidas en el referido Consenso Nacional6. Estas preguntas incidían sobre la administración de líquidos y nutrientes (específicamente dosis de inicio y dosis máximas), así como sobre la vía de administración, estimación de osmolaridad de las soluciones finales, control analítico y adaptación de la NP en situaciones particulares.
Para cada pregunta, se calculó la tasa de cumplimiento del Consenso Nacional6 en función del número de respuestas recibidas.
ResultadosDe las 32 unidades donde se prescribía NP (24 de nivel iii y 8 de nivel ii), 23 (71,9%) respondieron a la encuesta, de las cuales 19 eran de nivel iii y 4 de nivel ii.
Diecinueve unidades (86,4%) afirmaron tener como referencia el Consenso Nacional6 y las restantes afirmaron seguir protocolos internos. Diecisiete (73,9%) refirieron que la prescripción se realiza usando soporte informático, utilizando 13 unidades el programa Microsoft Excel® y 4 los programas el Prepare® y la base de datos 3D®. Veinte unidades (90,9%) respondieron que la prescripción era realizada en formulario tipo con campos específicos para dosis y unidades de medición para cada ingrediente de la NP; en 7 unidades estaba permitido utilizar otras unidades de medición diferentes a las definidas en el formulario.
La tabla 1 muestra las tasas cumplimiento de algunas recomendaciones sobre el aporte de líquidos. Específicamente en el recién nacido < 1.000g durante la primera semana posnatal, en la gran mayoría (82,6%) se prescribe como aporte diario 130-150ml/kg; en caso de persistencia o riesgo de apertura del canal arterial, en el 65,2% unidades se limita el aporte diario a 120-130ml/kg y en el 34,8% a 150ml/kg. En caso de fototerapia, en la mayoría (56,5%) se refuerza el aporte de líquidos entre 11-20%. Para determinar el aporte de líquidos antes de la recuperación del peso al nacer, la gran mayoría (91,3%) utiliza para los cálculos el peso al nacer. La mayoría (78,3%) de las unidades contabiliza en estos cálculos los volúmenes de líquidos necesarios para la dilución de fármacos y para el mantenimiento de vías de acceso. Al calcular el volumen total de NP, en cerca de mitad (58,8%) de las unidades el programa informático permite la sustracción de los volúmenes administrados además de la NP.
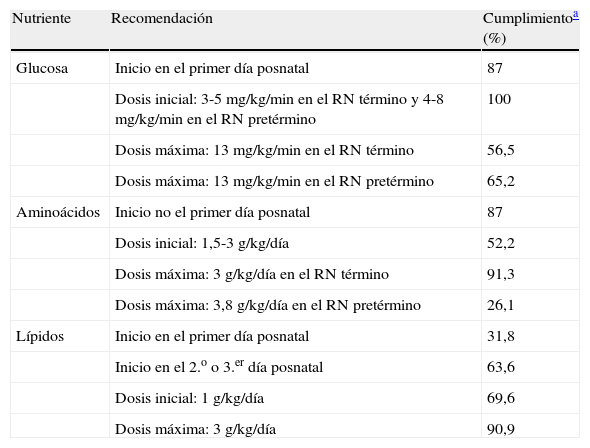
La tabla 2 muestra las tasas de cumplimiento de algunas recomendaciones sobre el aporte de macronutrientes: glucosa, aminoácidos y lípidos, incluidas las dosis iniciales y las dosis máximas administradas en el recién nacido a término y en el pretérmino.
Aporte de macronutrientes y cumplimiento del consenso nacional6
| Nutriente | Recomendación | Cumplimientoa (%) |
| Glucosa | Inicio en el primer día posnatal | 87 |
| Dosis inicial: 3-5 mg/kg/min en el RN término y 4-8 mg/kg/min en el RN pretérmino | 100 | |
| Dosis máxima: 13 mg/kg/min en el RN término | 56,5 | |
| Dosis máxima: 13 mg/kg/min en el RN pretérmino | 65,2 | |
| Aminoácidos | Inicio no el primer día posnatal | 87 |
| Dosis inicial: 1,5-3 g/kg/día | 52,2 | |
| Dosis máxima: 3 g/kg/día en el RN término | 91,3 | |
| Dosis máxima: 3,8 g/kg/día en el RN pretérmino | 26,1 | |
| Lípidos | Inicio en el primer día posnatal | 31,8 |
| Inicio en el 2.o o 3.er día posnatal | 63,6 | |
| Dosis inicial: 1 g/kg/día | 69,6 | |
| Dosis máxima: 3 g/kg/día | 90,9 |
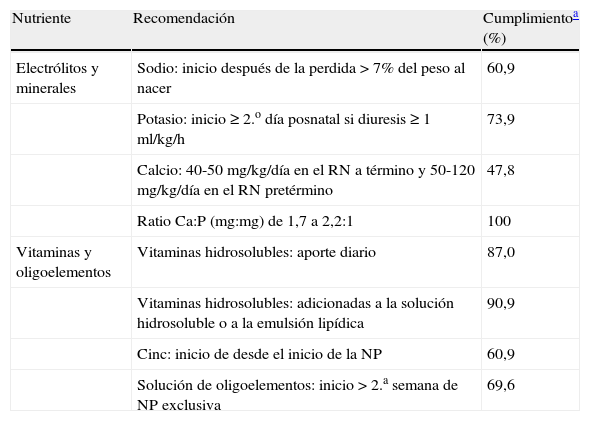
La tabla 3 muestra las tasas de cumplimiento de algunas recomendaciones sobre el aporte de los micronutrientes: sodio, potasio, calcio, fósforo, vitaminas y oligoelementos.
Aporte de micronutrientes y cumplimiento del consenso nacional6
| Nutriente | Recomendación | Cumplimientoa (%) |
| Electrólitos y minerales | Sodio: inicio después de la perdida > 7% del peso al nacer | 60,9 |
| Potasio: inicio ≥ 2.o día posnatal si diuresis ≥ 1 ml/kg/h | 73,9 | |
| Calcio: 40-50 mg/kg/día en el RN a término y 50-120 mg/kg/día en el RN pretérmino | 47,8 | |
| Ratio Ca:P (mg:mg) de 1,7 a 2,2:1 | 100 | |
| Vitaminas y oligoelementos | Vitaminas hidrosolubles: aporte diario | 87,0 |
| Vitaminas hidrosolubles: adicionadas a la solución hidrosoluble o a la emulsión lipídica | 90,9 | |
| Cinc: inicio de desde el inicio de la NP | 60,9 | |
| Solución de oligoelementos: inicio > 2.a semana de NP exclusiva | 69,6 |
En cuanto a la suplementación de la NP con micronutrientes especiales, la cisteína, glutamina y carnitina se prescriben rutinariamente en 2 (8,7%), 1 (4,3%) y 2 (8,7%) unidades, respectivamente.
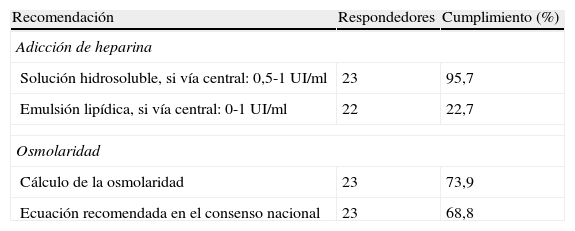
En la gran mayoría (95,5%) de las unidades se administra la solución hidrosoluble (que contiene glucosa, aminoácidos y electrólitos, vitaminas y oligoelementos) y la emulsión lipídica en «sistema Y». En la gran mayoría (95,5%) de las unidades se administra la emulsión de lípidos en infusión continua durante 24 h y en una (4,5%) en infusión durante 20 h. La heparina se adiciona en la gran mayoría (95,7%) de las unidades cuando la solución hidrosoluble es administrada por vía central (tabla 4) y en una minoría (39,1%) cuando esta es administrada por vía periférica. En algunas unidades (13,6%) se adiciona la heparina a la emulsión lipídica. En la mayoría de las unidades (73,9%) se calcula la osmolaridad de la solución hidrosoluble y también en la mayoría (64,7%) el cálculo se realiza utilizando la ecuación recomendada en el Consenso Nacional6 (tabla 4).
Adición de heparina y cálculo de la osmolaridad y consenso nacional6
| Recomendación | Respondedores | Cumplimiento (%) |
| Adicción de heparina | ||
| Solución hidrosoluble, si vía central: 0,5-1 UI/ml | 23 | 95,7 |
| Emulsión lipídica, si vía central: 0-1 UI/ml | 22 | 22,7 |
| Osmolaridad | ||
| Cálculo de la osmolaridad | 23 | 73,9 |
| Ecuación recomendada en el consenso nacional | 23 | 68,8 |
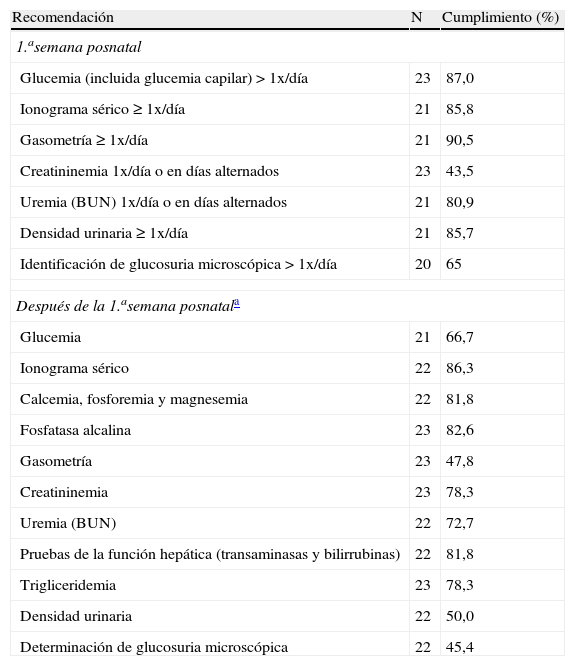
Para el diagnóstico precoz de la osteopenia del prematuro, en el 56,5% unidades se utiliza la fosforemia y en el 30,4% la fosfatasa alcalina; el 8,7% no utiliza ningún marcador. Las prácticas sobre el control analítico se presentan en la tabla 5.
Control analítico y cumplimiento del consenso nacional6
| Recomendación | N | Cumplimiento (%) |
| 1.asemana posnatal | ||
| Glucemia (incluida glucemia capilar) > 1x/día | 23 | 87,0 |
| Ionograma sérico ≥ 1x/día | 21 | 85,8 |
| Gasometría ≥ 1x/día | 21 | 90,5 |
| Creatininemia 1x/día o en días alternados | 23 | 43,5 |
| Uremia (BUN) 1x/día o en días alternados | 21 | 80,9 |
| Densidad urinaria ≥ 1x/día | 21 | 85,7 |
| Identificación de glucosuria microscópica > 1x/día | 20 | 65 |
| Después de la 1.asemana posnatala | ||
| Glucemia | 21 | 66,7 |
| Ionograma sérico | 22 | 86,3 |
| Calcemia, fosforemia y magnesemia | 22 | 81,8 |
| Fosfatasa alcalina | 23 | 82,6 |
| Gasometría | 23 | 47,8 |
| Creatininemia | 23 | 78,3 |
| Uremia (BUN) | 22 | 72,7 |
| Pruebas de la función hepática (transaminasas y bilirrubinas) | 22 | 81,8 |
| Trigliceridemia | 23 | 78,3 |
| Densidad urinaria | 22 | 50,0 |
| Determinación de glucosuria microscópica | 22 | 45,4 |
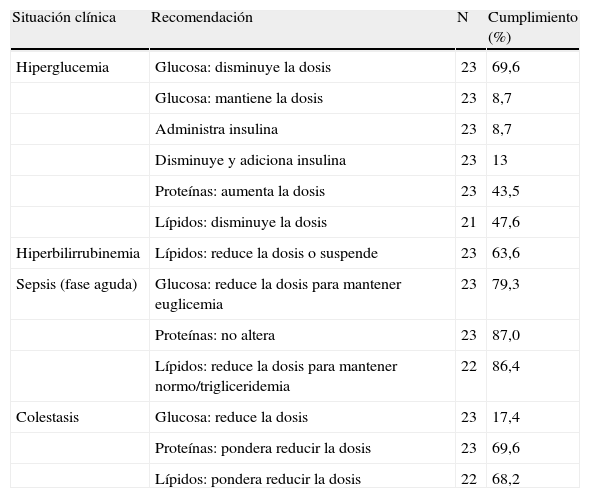
La tabla 6 muestra las tasas de cumplimiento de algunas recomendaciones sobre la adaptación de la provisión de glucosa, aminoácidos, lípidos y oligoelementos en situaciones clínicas particulares: hiperglucemia, hiperbilirrubinemia, sepsis y colestasis.
Adaptación en situaciones clínicas especiales y cumplimiento del consenso nacional6
| Situación clínica | Recomendación | N | Cumplimiento (%) |
| Hiperglucemia | Glucosa: disminuye la dosis | 23 | 69,6 |
| Glucosa: mantiene la dosis | 23 | 8,7 | |
| Administra insulina | 23 | 8,7 | |
| Disminuye y adiciona insulina | 23 | 13 | |
| Proteínas: aumenta la dosis | 23 | 43,5 | |
| Lípidos: disminuye la dosis | 21 | 47,6 | |
| Hiperbilirrubinemia | Lípidos: reduce la dosis o suspende | 23 | 63,6 |
| Sepsis (fase aguda) | Glucosa: reduce la dosis para mantener euglicemia | 23 | 79,3 |
| Proteínas: no altera | 23 | 87,0 | |
| Lípidos: reduce la dosis para mantener normo/trigliceridemia | 22 | 86,4 | |
| Colestasis | Glucosa: reduce la dosis | 23 | 17,4 |
| Proteínas: pondera reducir la dosis | 23 | 69,6 | |
| Lípidos: pondera reducir la dosis | 22 | 68,2 |
No son muchas las encuestas publicadas sobre las prácticas de prescripción de NP neonatal, destacando algunas realizadas en Estados Unidos3,8,9, Reino Unido e Irlanda5,10 y Francia4. La encuesta constituye el método preferido en la evaluación de las prácticas de NP neonatal, ayudando para que los clínicos en ejercicio evalúen su práctica en relación con las recomendaciones de las sociedades científicas3–5. Al igual que en un estudio anterior3, se envió por correo electrónico un cuestionario de respuesta múltiple a los coordinadores de las unidades neonatales. En 3 estudios recientes obtuvieron respuesta de 176 (23%) unidades norteamericanas de nivel iii3, de 172 (58%) unidades francesas de niveles ii y iii4, y de 136 (58%) unidades británicas e irlandesas de niveles ii y iii5. Comparada con esas tasas, puede considerarse que el 71,9% es una respuesta excelente y probablemente representativa de las unidades neonatales portuguesas.
En casi todas las unidades portuguesas la prescripción se realiza en un formulario tipo con campos específicos para las dosis de cada ingrediente de la NP y en un 74% se usa soporte electrónico. Esta práctica es similar a la de algunos otros países5. En comparación con el 9% de unidades británicas e irlandesas, puede considerarse como excelente la adhesión de los neonatólogos portugueses a esta forma de prescripción, lo que permite ahorrar tiempo y reducir el margen de error11.
En la mayoría de las unidades portuguesas existe la preocupación de la administración cautelosa de líquidos en la primera semana posnatal en recién nacidos < 1.000g por los riesgos de sobrecarga hídrica5,12. Cuando hay persistencia o riesgo de apertura del canal arterial, en la mayoría de las unidades el aporte diario se limita a 130ml/kg, como se recomienda13. Cuando se utiliza fototerapia, la mayoría refuerza el aporte hídrico, aunque de forma heterogénea, probablemente porque existen pocos estudios que hayan analizado este problema14.
Se refieren algunas limitaciones de la presente encuesta. Las dosis de nutrientes fueron encuestadas independientemente de que los recién nacidos se encontrasen recibiendo NP exclusiva o NP asociada a nutrición enteral, lo que puede explicar algunas dosis máximas de nutrientes inferiores a lo esperado en NP exclusiva. Al igual que en estudios similares4,5, las preguntas han sido comunes para las unidades de nivel ii y iii, sin estratificar las dosis de los macronutrientes por grupos de peso o de edad gestacional, dado que las unidades de nivel ii no reciben neonatos muy prematuros.
Todas las unidades inician la glucosa en NP a las dosis recomendadas en función de la madurez del recién nacido5,15, tal como en otros países5. En el pretérmino, la mayoría adopta la dosis máxima de 13mg/kg/min, considerado como límite de oxidación de la glucosa5,6. En el caso de la hiperglucemia (> 150mg/dl), la gran mayoría disminuye la dosis de glucosa, casi la mitad disminuye la dosis de lípidos por su efecto neoglucogénico16 y aumenta la dosis de aminoácidos por su efecto insulinogénico8, y una minoría administra insulina. En esta situación, casi todas las unidades norteamericanas usan insulina3, a pesar de los posibles inconvenientes de esta terapéutica en recién nacidos7,17; en las unidades inglesas e irlandesas solo se reduce la dosis de glucosa y/o se administra insulina cuando la glucemia sobrepasa los 180 a 270mg/dl5.
El 87% de las unidades portuguesas inician los aminoácidos el primer día posnatal, como se recomienda6,8,15, lo que fue referido por el 44% de las unidades inglesas e irlandesas5. En el 52% de las unidades portuguesas la dosis diaria inicial es de 1,5-3g/kg, como se recomienda6,15, similar a la utilizada en la mayoría de las unidades norteamericanas (2g/kg)3 y superior a la adoptada en las inglesas e irlandesas (0,1-2g/kg)5 y en la mayoría de las francesas4. Un 48% de las unidades portuguesas y muchas de los otros países utilizan la práctica obsoleta de iniciar con dosis bajas (0,5-1g/kg) y aumentar gradualmente15. La dosis máxima prescrita en las unidades portuguesas es variable, especialmente en el pretérmino, aunque no exceden 3-4g/kg como se recomienda6,18. Para orientar la administración de aminoácidos, la mayoría de las unidades portuguesas usa la determinación semanal de uremia, aunque este no sea un buen indicador en el caso intolerancia a los aminoácidos19. En la mayoría de las unidades británicas e irlandesas también se usa la uremia, aunque una minoría usa el perfil de aminoácidos5.
En casi todas las unidades portuguesas, los lípidos intravenosos se inician en los 3 primeros días posnatales, generalmente en la dosis diaria de 1g/kg y se aumentan hasta 3g/kg, como se recomienda6,15,19; en una de las unidades no se prescriben lípidos intravenosos. En todas las unidades se administra la emulsión lipídica a lo largo de las 24 h, excepto en una en que se infunde en 20 h. Esta opción puede basarse en la posible reducción de la incidencia de colestasis asociada a la NP cuando se administra de forma cíclica20. La mayoría de las unidades británicas e irlandesas inicia lípidos en el primer día a una dosis inferior (0,1-1g/kg). En comparación, la mayoría de unidades norteamericanas vinculadas a universidades y las privadas prescriben los lípidos con más frecuencia y a dosis más elevadas desde el primer día posnatal que las no académicas y públicas3. Cerca del 80% de las unidades británicas e irlandesas inician los lípidos cuando empiezan la NP, pero solo el 44% inician la NP el primer día posnatal5. La mitad de las unidades francesas inicia los lípidos después del tercer día de vida y dos tercios inicialmente prescriben diariamente apenas 0,5g/kg4,21, lo que está lejos de lo recomendado7,15,18. Otra encuesta nacional en Francia, específicamente dedicada a la administración de lípidos intravenosos en recién nacidos, también concluyó que existía un rechazo injustificado a administrarlos cuando solo está disponible la vía periférica21. Retrasar 3 días o más el inicio de lípidos aumenta el riesgo de déficit de ácidos grasos esenciales7,15,18. En caso de aumento de la bilirrubina no conjugada, la mayoría de las unidades portuguesas reduce o suspende la infusión de lípidos, teniendo en consideración que la bilirrubina y los ácidos grasos compiten por la misma unión a la albúmina22. La mayoría de las unidades norteamericanas no considera la ictericia como una contraindicación para iniciar lípidos intravenosos3. En un 78% de las unidades portuguesas se monitoriza la trigliceridemia semanalmente, en comparación con el 59% de las británicas e irlandesas5. En algunas de las norteamericanas, la dosis de lípidos se aumenta en función de la trigliceridemia y no por un protocolo fijo3.
Tal y como se recomienda6,23, la mayoría de las unidades portuguesas solo inicia el aporte de sodio después de la pérdida fisiológica del 7% del peso al nacer e inicia el potasio entre el segundo y tercer día posnatal cuando la diuresis alcanza 1ml/kg/h.
Todavía no existe un consenso en la dosis parenteral de calcio y fósforo15, especialmente en el pretérmino, variando las recomendaciones diarias de calcio entre 40 y 120mg/kg2,7. Esto explica la gran variación de dosis de calcio y fósforo encontrada. Como se recomienda6, en todas las unidades portuguesas se calcula la dosis de fósforo por el ratio calcio:fósforo de 1,7:1 (mg:mg) o sea 1,3:1 (molar), excepto una que no administra fósforo. No administrar fósforo puede afectar significativamente la retención mineral ósea y predisponer a la osteopenia, ya que la retención ósea depende de la administración conjunta de calcio y fósforo24. Para aproximar las concentraciones parenterales de estos minerales a las elevadas concentraciones que el feto recibe en el tercer trimestre, se hicieron varios estudios con el objetivo de optimizar las dosis y las ratios de calcio y fósforo, lo que permite actualmente proporcionar dosis más elevadas sin riesgo de precipitación25–27. Dosis parenterales elevadas y precoces de calcio y fósforo parecen mejorar, por lo menos a corto plazo, la mineralización y la robustez ósea en recién nacidos pretérmino, incluso después de la supresión de la NP28,29. Para el control del aporte mineral, en más del 80% de las unidades portuguesas se determina semanalmente la fosforemia y la fosfatasa alcalina. Aunque la fiabilidad de estos 2 parámetros como indicadores de contenido mineral óseo está lejos de lo deseado30, son los más utilizados en el screening precoz de la osteopenia del prematuro31.
Las vitaminas hidrosolubles y liposolubles se prescriben en todas las unidades excepto en una. Aunque se desconozca el momento ideal para iniciar la suplementación con multivitamínicos, se recomienda su prescripción parenteral en recién nacidos privados de otro aporte por el riesgo de déficit, especialmente en pretérminos que nacen con reservas muy limitadas de vitaminas liposolubles15,18. En relación con los oligoelementos, la mayoría inicia el cinc desde el comienzo de la NP y la solución completa de oligoelementos a partir de las 2 semanas de NP como se recomienda6 y una minoría no administra oligoelementos. Al igual que con los multivitamínicos, no se conoce el momento ideal de iniciar su aporte y hay dudas en relación con la toxicidad de alguno de los oligoelementos15. Muchas unidades norteamericanas suplementan la NP con hierro (en forma de dextrano)3, aunque esta opción implique riesgos importantes32.
A pesar de no haber evidencia científica de las ventajas de la suplementación de NP neonatal con cisteína33, glutamina34 o carnitina35, algunas unidades portuguesas optan por esta suplementación.
En los recién nacidos que están exclusivamente con NP, además de los controles analíticos antes referidos, la mayoría de las unidades monitoriza semanalmente la función hepática (82%) y la renal (78% la uremia y 73% la creatinemia), como se recomienda6.
En la fase aguda de una sepsis, existen mecanismos que predisponen a la hiperglucemia y a la hipertrigliceridemia22. En estos casos, el 84% de las unidades portuguesas ajustan la dosis de lípidos para mantener la normotrigliceridemia y el 79% ajusta el aporte de glucosa para mantener la euglucemia. En estas circunstancias, el 18-31% de las unidades británicas e irlandesas reducen la dosis de lípidos o la suspenden5.
Hay varios nutrientes supuestamente implicados en la colestasis asociada a la NP, especialmente las dosis excesivas de glucosa36, ciertos aminoácidos aromáticos37 y fitoesteroles contenidos en las emulsiones lipídicas de origen vegetal38. En caso de colestasis, el 70% de las unidades portuguesas opta por reducir la dosis de aminoácidos, el 17% reduce la glucosa y el 68% reduce la dosis de lípidos.
Casi la totalidad de las unidades portuguesas adiciona heparina cuando las soluciones de NP se administran por vía central, como se recomienda6. La mayoría de las unidades portuguesas calcula la osmolaridad de la solución hidrosoluble, usando la ecuación validada para soluciones de NP neonatal39 recomendada por el Consenso Nacional6 y por otros autores15,18,36.
Cuando este estudio fue realizado todavía no había comercializadas bolsas standard de NP neonatal40, motivo por el que todas las unidades portuguesas prescribían NP individualizada.
En resumen, la respuesta obtenida de las unidades neonatales portuguesas fue excelente en comparación con estudios similares de ámbito nacional realizados en otros países, y es probablemente representativa de la práctica de la prescripción de NP en Portugal. La mayoría de las unidades manifiesta usar como referencia el Consenso Nacional sobre NP neonatal. Probablemente por ese motivo, la mayoría sigue de modo relativamente uniforme las recientes recomendaciones de las sociedades científicas internacionales sobre la prescripción de la NP neonatal, lo que contribuye a unos mejores cuidados nutricionales. Es de destacar la elevada proporción que utiliza soporte electrónico para la prescripción.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Los autores agradecen la colaboración en la respuesta a la encuesta a los médicos responsables de las unidades de neonatología de: Centro Hospitalar de São João, Centro Hospitalar de Vila Nova de Gaia/Espinho, Centro Hospitalar Padre Américo do Tâmega e Vale do Sousa, Centro Hospitalar da Póvoa do Varzim, Hospital Central do Funchal, Hospital CUF Descobertas, Hospital da Luz, Hospital da Senhora da Oliveira de Guimarães, Hospital de Faro, Hospital Pedro Hispano de Matosinhos, Hospital de S. Francisco Xavier, Hospital de S. Marcos, Hospital de Santo António, Hospital do Divino Espírito Santo de Ponta Delgada, Hospital do Espírito Santo de Évora, Hospital Garcia de Orta, Hospital Pediátrico de Coimbra, Hospital Reynaldo dos Santos de Vila Franca de Xira, Maternidade Bissaya Barreto, Maternidade Dr. Alfredo da Costa, Maternidade Dr. Daniel Matos, Maternidade Júlio Dinis.
Los autores también agradecen al Dr. Daniel Virella, del Centro de Investigación del Centro Hospitalar de Lisboa Central, la revisión crítica del manuscrito.