En las últimas dos décadas se ha producido un aumento en el número de aislamientos de micobacterias no tuberculosas (MNT) en nuestro medio. Sin embargo, las enfermedades producidas por MNT no son de declaración obligatoria, por lo que no existen registros nacionales que nos permitan disponer de datos de prevalencia e incidencia reales en España.
La manifestación clínica más frecuente de la infección por MNT en niños inmunocompetentes es la adenitis cervical, que suele tener un curso crónico con tendencia a la fluctuación, fistulización y posterior cicatrización. Es fundamental establecer el diagnóstico diferencial con Mycobacterium tuberculosis, mucho menos frecuente en nuestro medio, pero con implicaciones epidemiológicas y aproximación terapéutica totalmente diferentes.
Aunque el diagnóstico de sospecha es clínico, apoyándose en los resultados de la prueba de la tuberculina y las nuevas técnicas de diagnóstico inmunológico (interferon gamma release assays), es recomendable la confirmación histológica/microbiológica mediante punción-aspiración con aguja fina o biopsia escisional.
La escisión quirúrgica completa es el tratamiento de elección. No debe realizarse el drenaje de la adenopatía por el riesgo de fistulización crónica y el mayor porcentaje de recidivas. En determinadas circunstancias, la actuación más adecuada será la observación clínica estrecha o el tratamiento médico con o sin cirugía diferida.
Non-tuberculous mycobacteria (NTM) have been increasingly isolated over the last 20 years in Spain. However, as NTM disease is not a notifiable condition, there is no national registry, thus the true prevalence and incidence of these infections in children are difficult to estimate.
Cervical adenitis is the most common clinical manifestation of NTM infection in immunocompetent children. The clinical course can be sub-acute or chronic, and is often associated with fluctuation, fistulisation, and scarring at a later stage. Although much less common, it is important to consider Mycobacterium tuberculosis in the differential diagnosis, as the management and the epidemiological implications of tuberculous lymphadenitis are completely different.
Diagnosis of NTM cervical lymphadenitis is based on a high level of clinical suspicion, supported by results of the tuberculin skin test and interferon-gamma release assays (IGRA). Fine needle aspiration or excisional biopsy is usually required for histological and microbiological confirmation.
Complete surgical excision of the affected nodes is the treatment of choice. Incision and drainage is not recommended, due to the high risk of chronic fistulisation and recurrence rate. Antibiotic treatment or conservative wait-and-see therapy may be indicated in certain circumstances.
Las micobacterias no tuberculosas (MNT) pueden producir una gran variedad de manifestaciones clínicas1,2 en el niño. Este documento de consenso se centrará específicamente en el diagnóstico y el tratamiento de la adenitis cervical, la afectación más frecuente en el niño inmunocompetente. A pesar de ser una infección emergente en países industrializados, no disponemos en nuestro país de un registro que nos permita conocer su incidencia real. Además, son escasos los ensayos clínicos controlados que valoran la eficacia de las diferentes opciones terapéuticas, de ahí la gran variabilidad de actuaciones sobre esta patología. Los objetivos de este documento son revisar la bibliografía existente sobre epidemiología, así como sobre novedades en el diagnóstico y el tratamiento de las adenitis por MNT, para poder establecer finalmente unas recomendaciones generales del grupo de estudio.
EpidemiologíaLos términos MNT, atípicas o ambientales, hacen alusión a las especies del género Mycobacterium distintas de M. tuberculosis (MT) y M. leprae, que resultan patógenos para el ser humano1,2. Actualmente, gracias a las nuevas técnicas de diagnóstico molecular, se conocen hasta 149 especies diferentes, con múltiples subespecies3. Están distribuidas por todo el mundo, son ubicuas en el ambiente y pueden aislarse en el agua natural y de suministro, así como en los sistemas de conducción y abastecimiento, tierra, polvo, leche, diferentes animales (especialmente aves) e incluso instrumental o soluciones para uso médico o de laboratorio. El mecanismo de transmisión más aceptado en el caso de las adenitis es la ingestión de agua, tierra o alimentos contaminados, encontrándose en algunos casos el antecedente de infección gingival, traumatismo bucal o erupción dentaria previa2. La transmisión de persona a persona es rara, por lo que no es necesario realizar medidas de aislamiento en estos pacientes.
El agente etiológico más frecuente en los países desarrollados es M. avium complex (MAC) (70-80%). El resto de las especies dependen de la zona geográfica; así en la mayor parte de Europa, EE. UU. y Australia4 le siguen M. scrofulaceum (10-20%) y M. kansasii (5%), mientras que en Israel5 y en el norte de Europa6 aparecen con mayor frecuencia M. malmonense y M. haemophilum. En determinadas áreas de nuestro país se está produciendo un aumento en la identificación de determinadas especies, como M. lentiflavum7, descrita en 1996 y que se caracteriza por una tendencia a la afectación múltiple, así como por una alta tasa de fistulización y de resistencia a antibióticos8,9.
La frecuencia de esta infección en la edad pediátrica es máxima entre los 2 y 4 años, en probable relación con la mayor exposición de los niños de menor edad a las MNT a través de la tierra y el agua, resultando rara por encima de los 10 años. En nuestro medio, el hecho de no considerarse una enfermedad de declaración obligatoria condiciona que los datos sobre su incidencia solo puedan ser aproximados y en muchos casos no acordes con la realidad, quedando ligados a la capacidad de diagnóstico microbiológico/molecular de los diferentes laboratorios.
Actualmente, se calcula que las adenopatías por MNT representan entre el 10 y 20% de las adenitis cervicales de curso subagudo-crónico, principalmente entre las submaxilares y preauriculares unilaterales en la edad preescolar1. Sin embargo, la frecuencia de estas infecciones podría estar aumentando en los últimos años. Así, desde los años noventa y de forma progresiva, se ha registrado un aumento considerable del número de infecciones por MNT en nuestro país10–12. En un estudio realizado en un hospital terciario de Madrid entre 1987 y 200412, la frecuencia de adenitis por MNT pasó de 1,2 casos/año hasta mediados de los años noventa a 5,25 casos/año desde entonces, con una disminución significativa de las de origen tuberculoso en el segundo periodo. Esta tendencia puede explicarse por un mejor conocimiento de la enfermedad, por el desarrollo de nuevas técnicas de diagnóstico microbiológico y molecular, el descenso de la vacunación con bacilo de Calmette-Guérin (BCG) y el mejor control de la infección tuberculosa.
Aunque en los últimos años se ha producido en nuestro país un aumento de la incidencia de tuberculosis (TB), principalmente entre población con infección por el VIH, adictos a drogas vía parenteral e inmigrantes procedentes de países con alta endemia de dicha enfermedad, en general, las cifras totales han descendido entre población autóctona respecto a décadas anteriores. Por ello, se considera que parte de las pruebas tuberculínicas (PT) positivas (principalmente en población pediátrica) se podrían deber a un aumento de la sensibilización a MNT, hecho que podría justificar las falsamente elevadas tasas de prevalencia de infección por TB declaradas en diferentes áreas de España. Se estima que entre el 20 y el 50% de los niños con PT positiva y sin factores de riesgo para tuberculosis podrían haber tenido contacto previo con MNT13,14.
DiagnósticoSospecha clínicaEl hallazgo clínico más frecuente es la aparición de una adenopatía indolora, única (en la mayor parte de los casos), de 1-6cm de diámetro, situada a nivel submandibular, cervical anterior o preauricular, y de evolución subaguda o crónica (al menos 3 semanas). Aunque raro, es posible la presencia de adenitis en otras localizaciones como axilar o inguinal. Puede encontrarse infiltración de varias adenopatías en la misma o en distintas cadenas ganglionares, pero la afectación bilateral es muy poco frecuente (5%, aproximadamente). Generalmente, no existe otra sintomatología acompañante en niños inmunocompetentes, aunque se ha descrito la presencia de fiebre coincidiendo con la aparición de la adenopatía en un bajo porcentaje de casos. Evolutivamente, la adenopatía sigue un curso subagudo o crónico durante semanas o incluso meses, aumentando de tamaño gradualmente y sin encontrarse mejoría con los antibióticos convencionales15. Ocasionalmente, el proceso es más rápido e incluso explosivo en varios días, pudiendo ser indistinguible de la adenitis bacteriana. Recientemente, se ha establecido un nuevo sistema de estadificación clínica propuesto por Penn et al.16 en el que queda patente el curso natural de la infección (tabla 1). Con el tiempo, algunos casos pueden involucionar espontáneamente, sufriendo fibrosis y calcificación, aunque lo habitual es que presenten un curso crónico, con fistulizaciones recurrentes y que curen finalmente tras un largo periodo, presentando una cicatriz hipertrófica antiestética tipo queloide (tabla 2).
Evolución clínica de las adenitis por MNT
| Estadio I | Adenopatía indolora y adherida. En ocasiones con eritema de la piel suprayacente y aumento de la vascularización |
| Estadio II | Licuefacción del interior de la adenopatía adoptando aspecto fluctuante |
| Estadio III (4-6 semanas) | Cambios de coloración (violácea) y aspecto brillante/fino de la piel |
| Estadio IV | Descamación de la piel y drenaje/fistulización al exterior |
Modificado de Penn et al.16.
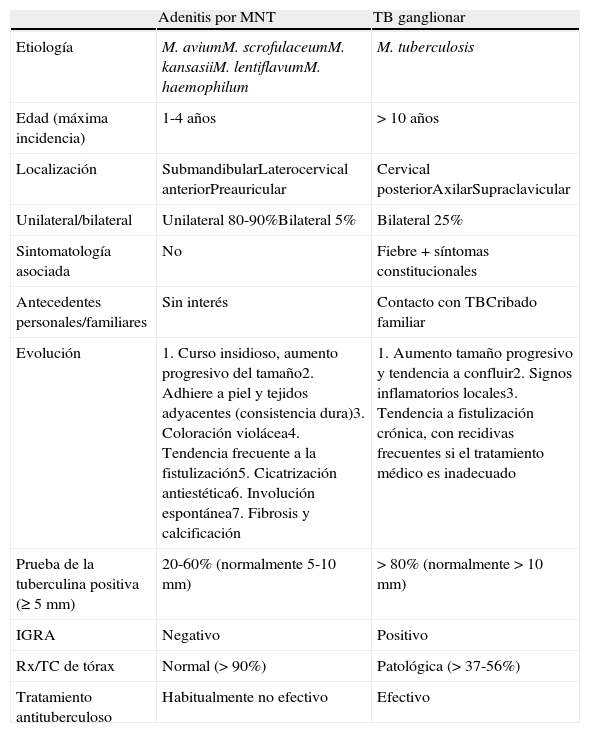
Diagnóstico diferencial entre adenitis por MNT y por MT (TB ganglionar)
| Adenitis por MNT | TB ganglionar | |
| Etiología | M. aviumM. scrofulaceumM. kansasiiM. lentiflavumM. haemophilum | M. tuberculosis |
| Edad (máxima incidencia) | 1-4 años | > 10 años |
| Localización | SubmandibularLaterocervical anteriorPreauricular | Cervical posteriorAxilarSupraclavicular |
| Unilateral/bilateral | Unilateral 80-90%Bilateral 5% | Bilateral 25% |
| Sintomatología asociada | No | Fiebre+síntomas constitucionales |
| Antecedentes personales/familiares | Sin interés | Contacto con TBCribado familiar |
| Evolución | 1. Curso insidioso, aumento progresivo del tamaño2. Adhiere a piel y tejidos adyacentes (consistencia dura)3. Coloración violácea4. Tendencia frecuente a la fistulización5. Cicatrización antiestética6. Involución espontánea7. Fibrosis y calcificación | 1. Aumento tamaño progresivo y tendencia a confluir2. Signos inflamatorios locales3. Tendencia a fistulización crónica, con recidivas frecuentes si el tratamiento médico es inadecuado |
| Prueba de la tuberculina positiva (≥5mm) | 20-60% (normalmente 5-10mm) | >80% (normalmente>10mm) |
| IGRA | Negativo | Positivo |
| Rx/TC de tórax | Normal (>90%) | Patológica (>37-56%) |
| Tratamiento antituberculoso | Habitualmente no efectivo | Efectivo |
IGRA:interferon gamma release assays; MNT:micobacterias no tuberculosas; MT:M. tuberculosis; TB:tuberculosis.
En general, no hay diferencias significativas en la expresividad clínica de las diversas MNT, aunque la debida a M. fortuitum provoca una induración de mayor tamaño en la PT y presenta mayor tendencia a la supuración, al igual que M. lentiflavum.
Pruebas de imagenAunque no siempre es necesaria, la prueba de elección, dada su accesibilidad e inocuidad, es la ecografía cervical. Los hallazgos ecográficos iniciales17 suelen mostrar una o varias adenopatías engrosadas, bien delimitadas y vascularizadas, con mínima o nula infiltración del tejido celular subcutáneo, localizadas en la región submaxilar o laterocervical anterior. Menos frecuente, pero muy característica, es la presencia de adenopatías preauriculares, que con frecuencia asocian afectación parotídea en forma de hipertrofia glandular o adenopatías intraparotídeas. Con el tiempo, el ganglio pierde su morfología regular y aparecen formas polipoideas circunscritas, con centro hipodenso, que se extienden hacia el tejido celular subcutáneo, formándose finalmente colecciones líquidas que fistulizan al exterior. En una tercera parte de los pacientes aparecen focos hiperecogénicos en el interior de las adenopatías que corresponden a calcificaciones.
La realización de una radiografía de tórax puede resultar de utilidad para el diagnóstico diferencial con MT, ya que se puede encontrar alterada en un 37-56% de los niños con adenitis tuberculosa18,19 frente a un 8,5% de los afectados por MNT19. Por ello, será recomendable realizarla en todos los casos, especialmente en los pacientes con: síntomas sistémicos (fiebre, pérdida de peso), síntomas respiratorios, reacción tuberculínica>10mm, interferon-γ release assays (IGRA) positivo, edad mayor de 5 años o contacto tuberculoso conocido.
La TC o la RM no deberían hacerse de rutina, estando indicadas en lesiones extensas, especialmente antes de la cirugía o ante la sospecha de complicaciones, como compresión vásculo-nerviosa u ocupación del espacio retrofaríngeo. Suelen mostrar adenopatías engrosadas junto a masas hipodensas con captación en anillo, que se extienden hacia el tejido celular subcutáneo.
Técnicas de cribado- -
PT: el preparado purificado que se utiliza en la PT (PPD RT23) procede de un cultivo de MT con más de 200 antígenos diferentes. Algunas especies de MNT comparten antígenos con MT, de ahí la utilidad de esta prueba como cribado. Sin embargo, en las adenitis por MNT, la PT solo suele ser mayor de 5mm en el 20-65% de los casos según las distintas series19–21, por lo que la negatividad del test no excluye el diagnóstico. Respecto al tamaño de la induración, se ha visto que hasta la mitad de los casos de adenitis por MNT con PT positiva presentan una induración superior a los 10mm y entre el 10-15% superior a 15mm. Por tanto, el tamaño de la induración no es una condición que nos permita establecer un diagnóstico diferencial con MT y habrá que apoyarse en otros datos clínico-epidemiológicos.
- -
Sensitinas: las sensitinas son proteínas purificadas extraídas de cultivos de diferentes especies de MNT. Habitualmente se utilizaban para realizar el test tuberculínico doble o dual skin testing, que comparaba en paralelo la induración de la PT practicada con PPD RT23 con la obtenida utilizando sensitina específica de MNT, habitualmente de M. avium, que es la especie más frecuente. La induración con mayor tamaño correspondería a la infección dominante. Aunque es un test muy específico, el empleo de sensitinas actualmente se encuentra en desuso, ya que no hay acuerdo sobre cuál debe ser la diferencia en el diámetro entre ambas pruebas y son muy difíciles de conseguir para su aplicación en nuestro medio.
- -
IGRA: las nuevas técnicas de inmunoanálisis que se utilizan para el diagnóstico de la infección tuberculosa pueden resultar de utilidad para realizar un diagnóstico diferencial entre MNT y MT22–24. Son técnicas basadas en la producción de interferón gamma (IFN-γ) por las células T sensibilizadas frente a MT. Se dispone de preparados para medir la cantidad de IFN-γ (QuantiFERON TB-Gold-In tube®; Cellestis, Victoria, Australia) o el número de células que lo producen (T-SPOT.TB®; Immunotec, Oxford, Reino Unido). Para la estimulación celular se utilizan los antígenos ESAT6, CFP10 y TB7.7, que pertenecen a la región genómica RD1, presente en MT complex y en un número escaso de MNT (M. kansasii, M. szulgai, M. marinum y M. flavescens) y ausentes en M. bovis BCG. Por ello, las técnicas IGRA van a contribuir al diagnóstico diferencial de las adenitis por MNT frente a las producidas por MT. Será altamente sugerente de adenitis por MNT si hay reacción tuberculínica positiva e IGRA negativo en un paciente con clínica compatible25, ya que las especies que podrían dar resultado positivo son muy poco frecuentes en nuestro medio.
Es posible diseñar un IGRA en el que se estimule la producción de IFN-γ por antígenos específicos de MNT. En un reciente estudio14, se seleccionó a niños no vacunados de BCG, autóctonos y sin contacto conocido con tuberculosis, que presentaban una prueba de tuberculina ≥ 5mm, con radiografía de tórax normal. A estos pacientes se les realizó una técnica IGRA, estimulando con antígenos específicos de MT, y otra con sensitinas de M. avium. Todos presentaron un IGRA negativo a MT pero el 47,6% tuvo un IGRA positivo a M. avium. Estos hallazgos confirman que estas técnicas específicas, aún no comercializadas, podrían ser de utilidad en el diagnóstico de las infecciones por MNT y aplicarse en el futuro en el diagnóstico diferencial de las adenitis en pediatría.
Estudio histológico- -
Biopsia escisional: este tipo de procedimiento tiene una doble finalidad: diagnóstica, ya que obtiene suficiente cantidad de muestra para realizar cultivo, PCR y estudio anatomopatológico, y terapéutica, ya que la extirpación quirúrgica es el tratamiento de elección. En el análisis anatomopatológico, que suele ser indistinguible de la infección por MT, se suelen observar áreas de necrosis e inflamación, granulomas con o sin caseificación16,26, microabscesos, células gigantes y presencia de bacilos ácido-alcohol resistentes (BAAR) en el 50-60% de los casos26–28.
- -
Punción-aspiración con aguja fina (PAAF): la PAAF de la adenopatía suele permitir un diagnóstico histológico de presunción, ya que los cultivos (técnica de referencia) pueden ser negativos debido a la escasa cantidad de micobacterias presentes en la muestra. El estudio anatomopatológico suele demostrar hallazgos similares a los descritos previamente en la biopsia. Sin embargo, la sensibilidad diagnóstica depende de la experiencia del patólogo, y en el caso de las micobacterias oscila entre el 32 y el 78%28–30. Además, no hay que olvidar que las adenitis por micobacterias no son la única causa infecciosa de adenitis granulomatosa, por lo que se debe excluir serológicamente la posibilidad de toxoplasmosis y enfermedad por arañazo de gato31.
Es necesario tener en cuenta que si tras la realización de una PAAF obtenemos un diagnóstico histológico de presunción y la clínica es compatible con infección por MNT, no debe demorarse la realización de un tratamiento quirúrgico para evitar la fistulización precoz. Del mismo modo, en caso de cuadro clínico compatible pero PAAF no sugestiva de infección por MNT, está indicada la biopsia escisional sin esperar a los resultados de la PCR o el cultivo.
Diagnóstico microbiológicoPuede realizarse en la muestra de PAAF, biopsia escisional o en el material de drenaje de la adenopatía.
- -
Cultivo: la identificación de la especie de micobacteria permite excluir MT y seleccionar la mejor opción terapéutica. Es necesario conseguir una muestra adecuada para cultivo, que debe ser inicialmente descontaminada y homogeneizada, para posteriormente inocularse en medios de cultivo tanto sólidos (Löwestein-Jensen u otros) como líquidos, incubándose durante 45-60 días. En los últimos años, gracias a estos medios líquidos automatizados (Bactec MGIT 960 y MB/BacT) se consigue un aislamiento más rápido de la micobacteria32, especialmente para las MNT (1-2 semanas). La sensibilidad del cultivo depende del método para la obtención de la muestra (PAAF o biopsia) y de las técnicas microbiológicas utilizadas, pero habitualmente sigue siendo baja, entre un 20 y un 75%, según los estudios publicados32–34. Por otro lado, las pruebas de sensibilidad para las MNT de crecimiento lento (antibiogramas) no están bien estandarizadas y no se ha observado una clara correlación entre los estudios in vitro y la eficacia clínica de los tratamientos. Sin embargo, un resultado de sensibilidad in vitro en estos microorganismos nos permitirá instaurar un tratamiento antituberculoso dirigido en los casos en los que sea necesario.
- -
PCR: con las nuevas técnicas de amplificación genómica, en material de biopsia/PAAF podemos realizar un diagnóstico precoz, permitiendo la diferenciación de MT del resto de las micobacterias. Aunque la mayoría de los métodos desarrollados inicialmente se centraron en detectar solo el complejo MT, progresivamente han aparecido técnicas35 (Cobas Amplicor, BD MAX y Speed-oligoDirect) capaces de detectar, por un lado, la presencia de MT y, por otro, el género Mycobacterium, indicando así la presencia de una micobacteria de otra especie distinta. Estas técnicas presentan una alta especificidad (>95%) y sensibilidad variable según la carga bacilar de la muestra, oscilando entre el 50 y el 100% según la baciloscopia sea positiva o negativa, respectivamente. Por otro lado, el sistema Genotype36 detecta simultáneamente la presencia de complejo tuberculosis, M. avium, M. intracellulare, M. kansasii y M. malmoense, con una sensibilidad y especificidad del 92 y el 100%, respectivamente. Estas técnicas se encuentran disponibles solo en centros de referencia, no siendo por tanto imprescindible su realización para el diagnóstico.
En el caso de las adenitis tuberculosas, la realización de una PCR en una muestra histológica puede conseguir una mayor tasa de identificación de MT que los cultivos, con una sensibilidad del 96% y una especificidad del 93%37. Además, las nuevas técnicas de PCR en tiempo real (GeneXpert MTB/RIF) permiten una identificación en horas y detectan precozmente resistencia a rifampicina, aunque la experiencia en muestras de tejido es aún muy limitada38. Por tanto, una PCR para MT negativa en un niño con adenitis subaguda, reacción tuberculínica positiva y resultado de citopatología compatible con micobacterias, hace muy probable el diagnóstico de adenitis por MNT.
Exclusión de enfermedad de baseEn caso de adenitis recurrente, infección diseminada o afectación bilateral extensa, estaría indicado descartar la infección por el VIH y el cribado de inmunodeficiencias congénitas, como el déficit del eje IL-12-INF-γ (especialmente si hay antecedentes de infección recurrente por Salmonella) y la enfermedad granulomatosa crónica2,39,40.
Diagnóstico diferencialEl diagnóstico diferencial más importante de la adenitis por MNT es con la TB ganglionar, que representa únicamente entre el 10 y el 20% de las adenitis por micobacterias en la edad pediátrica, mientras que en la población adulta suponen el 90%. En comparación con la adenitis por MNT, la TB ganglionar suele afectar a niños mayores, con más frecuencia se acompaña de fiebre y otros síntomas constitucionales, suele ser bilateral, puede afectar a las cadenas cervicales posteriores, axilares o supraclaviculares, acompañarse de alteraciones en la radiografía de tórax y suele mostrar una mayor reacción a la PT15,19. En general, las principales características diferenciales entre ambos tipos de adenitis quedan recogidas en la tabla 2.
Además, en la valoración diagnóstica de un niño con adenitis cervical crónica, es obligado descartar otras enfermedades infecciosas, como son la infección por virus de Epstein-Barr, citomegalovirus, adenovirus, toxoplasma o Bartonella.
TratamientoLa exéresis completa del ganglio afectado se considera actualmente el tratamiento de elección41. No obstante, hay publicaciones recientes que plantean otras alternativas terapéuticas en determinadas circunstancias e incluso se ha propuesto un tratamiento individualizado en función del estadio evolutivo de la adenitis.
Tratamiento quirúrgicoEl tratamiento de elección es la extirpación quirúrgica lo más precoz posible42, preferentemente dentro del primer mes de evolución, ya que la adenitis suele fistulizar espontáneamente, dificultando la intervención y asociando una mayor morbilidad quirúrgica y un peor resultado estético (mayor porcentaje de cicatrices queloideas). La mayoría de los autores recomiendan la realización de una exéresis completa, no solo para favorecer la curación precoz y facilitar el acto quirúrgico, sino para obtener material adecuado para el estudio microbiológico e histológico. Si existe licuefacción y la exéresis completa es complicada, pueden emplearse otras técnicas quirúrgicas, como el raspado o las aspiraciones repetidas4,43, aunque la curación se consigue en un menor porcentaje de casos. La exéresis parcial y la incisión-drenaje sin extirpación no deben realizarse, ya que estas técnicas suelen aumentar el riesgo de complicaciones, como fistulización crónica, recidivas y cicatrización patológica antiestética43,44. En caso de afectación múltiple con adenopatías reactivas cercanas a la adenopatía principal, solo deben extraerse los ganglios de mayor tamaño, los fluctuantes y los necróticos, ya que la exéresis completa no disminuye las tasas de recurrencias y aumenta la posibilidad de complicaciones4,43.
Las tasas de aparición de secuelas posquirúrgicas varían de unas series a otras entre el 2-17%, si bien parece que cuando la cirugía se realiza de forma precoz la complicación más habitual, la paresia facial transitoria, es menos frecuente. Un reciente estudio retrospectivo45 ha evaluado los efectos secundarios tras la cirugía en 88 niños con adenopatías por MNT. Entre los niños a los que se realizó extirpación total (51/88), en el 5,8% de casos la disfunción nerviosa fue persistente, mientras que en el 13,7% dicha afectación fue menor y transitoria, siendo la rama mandibular la más afectada (9/10 casos). De la misma forma, en el ensayo clínico llevado a cabo por Lindeboom et al.46 en el que compararon la evolución de los tratados quirúrgicamente frente a los que recibieron tratamiento médico, el nervio facial se vio afectado en el primer grupo hasta en el 14% de los casos, de los cuales solo uno presentó una parálisis facial permanente.
Tratamiento médicoEl tratamiento antituberculoso habitual es muy poco eficaz frente a las MNT, especialmente frente a MAC47,48. Sin embargo, los macrólidos (azitromicina y claritromicina) son muy activos in vitro y han demostrado su eficacia en la infección pulmonar de adultos con neumopatías crónicas y en la infección diseminada de pacientes con infección por el VIH49. Aunque la baja incidencia de adenitis por MNT ha impedido el desarrollo de ensayos clínicos controlados en niños utilizando diferentes regímenes, la claritromicina se ha utilizado sola o en combinación con rifabutina, etambutol o ciprofloxacino50 en las indicaciones que se recogen en la tabla 3.
Posibles indicaciones de tratamiento médico en la adenitis cervical por MNT
| - Imposibilidad de realizar cirugía por negativa de la familia o por criterio del servicio de cirugía- Retraso (> un mes) en la intervención quirúrgica- Localización anatómica de difícil abordaje con alto riesgo de complicaciones (proximidad a estructuras vasculonerviosas)- Extirpación incompleta del ganglio afectado- Adenitis extensas con afectación bilateral- Casos muy evolucionados con múltiples fistulizaciones- Recidiva tras la cirugía |
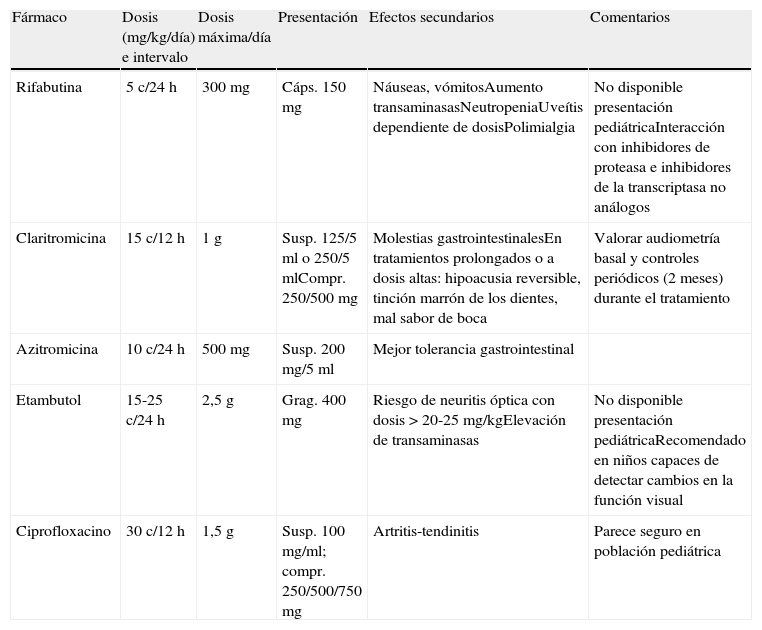
No existen unas directrices bien definidas sobre el régimen de tratamiento empírico más eficaz, aunque debe ser combinado51 para evitar la selección de resistencias y debe incluir, por tanto, un macrólido junto con uno de los siguientes fármacos: rifabutina, ciprofloxacino o etambutol. Si se elige rifabutina o etambutol, habrá que tener en cuenta que no existe presentación pediátrica comercial y, por tanto, será necesaria una formulación farmacéutica para facilitar la adherencia en niños pequeños y el ajuste de dosis. Además, en caso de que el paciente reciba de forma simultánea otros fármacos (inmunosupresores, antirretrovirales,…) deberá valorarse el riesgo de interacciones y, por tanto, el ajuste de dosis.
La dosificación de los fármacos se recoge en la tabla 4.
Dosis y presentación de los fármacos más utilizados en el tratamiento médico de las adenitis por MNT
| Fármaco | Dosis (mg/kg/día) e intervalo | Dosis máxima/día | Presentación | Efectos secundarios | Comentarios |
| Rifabutina | 5 c/24h | 300 mg | Cáps. 150 mg | Náuseas, vómitosAumento transaminasasNeutropeniaUveítis dependiente de dosisPolimialgia | No disponible presentación pediátricaInteracción con inhibidores de proteasa e inhibidores de la transcriptasa no análogos |
| Claritromicina | 15 c/12h | 1 g | Susp. 125/5ml o 250/5mlCompr. 250/500 mg | Molestias gastrointestinalesEn tratamientos prolongados o a dosis altas: hipoacusia reversible, tinción marrón de los dientes, mal sabor de boca | Valorar audiometría basal y controles periódicos (2 meses) durante el tratamiento |
| Azitromicina | 10 c/24h | 500 mg | Susp. 200 mg/5ml | Mejor tolerancia gastrointestinal | |
| Etambutol | 15-25 c/24h | 2,5 g | Grag. 400 mg | Riesgo de neuritis óptica con dosis>20-25 mg/kgElevación de transaminasas | No disponible presentación pediátricaRecomendado en niños capaces de detectar cambios en la función visual |
| Ciprofloxacino | 30 c/12h | 1,5 g | Susp. 100 mg/ml; compr. 250/500/750 mg | Artritis-tendinitis | Parece seguro en población pediátrica |
Tampoco hay consenso sobre la duración total del tratamiento farmacológico. Se considera que debe mantenerse alrededor de 6 meses, hasta conseguir la cicatrización o una disminución significativa del tamaño de la adenopatía. El tratamiento médico a menudo consigue una disminución de la lesión y de la inflamación perilesional que facilita la actividad quirúrgica52 y en caso de adenopatías supuradas, suele alargar el periodo entre fistulizaciones intermitentes. En caso de cirugía no resolutiva o recurrencia/fistulización tras el tratamiento quirúrgico inicial, una duración más corta de tratamiento, entre 3 a 6 meses, se ha mostrado efectiva en la mayoría de los pacientes50.
Además, todos los estudios publicados muestran que la eficacia del tratamiento médico es menor cuando se utiliza como primera opción terapéutica50-53. En uno de ellos53, 10 niños se trataron inicialmente con una combinación de antibióticos que incluía un macrólido durante 2 a 6 meses. De estos, 5 se curaron pero otros 5 precisaron cirugía posterior. Sin embargo, en 3 de estos últimos 5 casos se constató una disminución del tamaño de la adenopatía, lo cual facilitó el tratamiento quirúrgico.
En el único ensayo clínico publicado46 que compara tratamiento quirúrgico (n=50) frente a tratamiento médico con claritromicina y rifabutina (n=50), se observa una curación completa sin recurrencia a los 3-6 meses en el 96% del grupo sometido a extirpación quirúrgica frente al 66% de los que realizaron el tratamiento médico correctamente. Los pacientes que no completaron el tratamiento antibiótico de forma correcta (efectos secundarios u otras razones) se sometieron posteriormente a cirugía, consiguiéndose un 100% de curación sin recurrencias. En cuanto a la tasa de complicaciones, fue de 28% en el grupo tratado con cirugía, de las cuales el 12% fueron infecciones posquirúrgicas (la mayoría leves), el 2% hematomas y el 14% afectación del nervio facial (un 2% con parálisis permanente). El porcentaje de efectos secundarios entre los tratados con claritromicina y rifabutina fue del 78%, siendo los más frecuentes las alteraciones gastrointestinales, astenia, cefalea y exantema, precisando en 2 casos el abandono del tratamiento por reacciones graves.
Los mismos autores publicaron posteriormente54 un estudio comparando los resultados estéticos de ambas intervenciones terapéuticas (cirugía frente a tratamiento antibiótico) después de un año de su realización. Se encontraron mejores resultados estéticos entre los tratados quirúrgicamente, valorando las siguientes variables: coloración (normal frente a pálido/eritematoso), grosor de la piel (normal vs hipertrófico) y aspecto de la superficie (suave/liso frente a irregular). Además, se concluyó que la infección postoperatoria influyó negativamente en el resultado estético, mientras que la especie de micobacteria no lo hizo.
Observación sin tratamientoUn grupo de estudio israelí publicó los resultados de un estudio observacional55 en 92 niños diagnosticados mediante PAAF de adenitis por MNT con cultivo positivo (90% positivos a M. avium o M. hemophilum), cuyos padres optaron por no tratar y observar la evolución del proceso. La mayoría (91,3%) sufrió una fistulización espontánea entre las 3 y 8 semanas de seguimiento. Sin embargo, observaron una curación completa en el 71% a los 6 meses, y de la totalidad de los casos a los 12 meses. A los 2 años del seguimiento solo observaron un cambio leve de coloración o una cicatriz plana en la zona donde se produjo el drenaje, no precisando en ningún caso cirugía reparadora. La principal limitación de este estudio es que se trata de un estudio observacional en el que no se realiza comparación con otras intervenciones terapéuticas. En este sentido, recientemente Lindeboom et al.56 han publicado un ensayo clínico en el que ha incluido a 50 niños con adenitis por MNT (confirmada mediante PCR o cultivo) en estadio avanzado (con fluctuación o cambio de coloración de la piel). Los pacientes fueron aleatorizados a tratamiento médico (claritromicina+rifabutina) durante 3 meses frente a observación sin antibióticos (n=25), comprobando que no había diferencias significativas en cuanto al tiempo medio de resolución (36 semanas frente a 40 semanas). Aunque es el único ensayo clínico comparativo publicado hasta la fecha, hay que tener en cuenta el escaso número de pacientes incluido y el criterio de curación considerado: disminución en el tamaño del 75%, cierre de la fístula y la ausencia de recurrencias o de nuevas lesiones. Sería interesante considerar también la evolución posterior de las cicatrices tras el cierre de las fístulas y el aspecto de la piel para tener una valoración global de los resultados.
Por otro lado, en un estudio prospectivo reciente45 se objetivó que el tiempo hasta la curación fue significativamente mayor entre los pacientes a los que solo se realizó observación frente a los tratados con cualquier técnica quirúrgica. Únicamente en el 3% de los pacientes tratados con cirugía la resolución se produjo después de 6 meses de seguimiento, frente al 25% de los sujetos en que se decidió tratamiento observacional.
En algunos trabajos57 se aboga por seleccionar a los pacientes subsidiarios de tratamiento médico, incluso como primera opción terapéutica. Además, se plantea también la posibilidad de ofrecer tratamiento médico u observacional en las adenopatías profundas frente a la cirugía, que se utilizaría en aquellas de localización superficial y acompañadas de cambios locales en la piel supradyacente. Por otra parte, en el estudio que propone una nueva clasificación según el estadio clínico de la adenitis16, se plantea la posibilidad de un tratamiento individualizado en función del estadio evolutivo de la adenopatía, los potenciales riesgos quirúrgicos, el resultado estético que se prevé y la tolerancia de los padres a una patología de curso clínico prolongado.
SeguimientoAunque el seguimiento dependerá de la evolución de cada paciente y las estrategias terapéuticas empleadas, se considera que estos pacientes deben controlarse durante un año, dada la posibilidad de recurrencia tras la cirugía. En este sentido, existe escasa bibliografía, publicándose recurrencias en torno al 5% de los casos, con un intervalo entre 3,5 meses y 7 años48.
Es conocido que en los niños que han presentado este tipo de adenitis, es relativamente frecuente el desarrollo de cicatrices hipertróficas o queloideas tras 12-18 meses de evolución. Lo ideal sería realizar una adecuada prevención para evitar la aparición de este tipo de cicatrices. Tan pronto como la cicatriz (espontánea tras la fistulización o posquirúrgica) esté completamente cerrada y epitelizada, y antes de que finalice su proceso de maduración, lo apropiado es aplicar métodos de profilaxis58, como la aplicación diaria de aceite de rosa mosqueta o gel de silicona. A partir del primer mes se recomienda aplicar apósitos de silicona59, que se deben llevar las 24h del día durante varios meses. Su continuidad dependerá de la evolución de la cicatriz. Además, es conveniente proteger la cicatriz del sol durante un año para evitar que se pigmente y resulte más antiestética. Si con estos métodos no invasivos no se consigue controlar la cicatrización anormal y se desarrollan hipertrofias y queloides, existen técnicas invasivas que permiten minimizar su aspecto, entre ellas están: cirugía, láser, abrasión dérmica, peeling, inyecciones de colágeno, etc. Para ello, habrá que consultar con el cirujano plástico pediátrico que decidirá la técnica reparadora más adecuada.
En lo que se refiere a las complicaciones neurológicas posquirúrgicas, que ocurren en un 2-14%43,46 de los casos, la afectación del nervio facial suele ser transitoria en la mayoría de los casos, comprobándose la recuperación completa en torno a los 6 meses.
Adenitis por micobacterias no tuberculosas en el niño inmunodeprimido o con infección por el virus de la inmunodeficiencia humanaAunque los niños con infección por VIH o inmunodeficiencia primaria pueden presentar adenitis por MNT de forma aislada, tienen más riesgo de desarrollar enfermedad diseminada por MAC60, cuya incidencia es más elevada en los menores de 2 años y con cifras de CD4<50-75 cél./mm3. Este tipo de infección oportunista también se puede presentar como parte del síndrome de reconstitución inmune que ocurre en los pacientes con infección por el VIH61, manifestándose como fiebre recurrente, pérdida de peso, diarrea crónica, adenopatías generalizadas, hepatoesplenomegalia y pancitopenia en el hemograma. Es fundamental el diagnóstico diferencial mediante hemocultivo, cultivo de biopsia de adenopatías o médula ósea para planificar el tratamiento de forma adecuada. Para el tratamiento médico se utilizarán los mismos fármacos que en niños inmunocompetentes, insistiendo en la necesidad de terapia combinada, habitualmente claritromicina/azitromicina+etambutol+rifabutina. Sin embargo, habrá que tener en cuenta que los niveles de claritromicina pueden modificarse por interacción con fármacos antirretrovirales (elevarse con los inhibidores de proteasa o disminuir con efavirenz), aunque no hay datos disponibles sobre el ajuste de dosis en niños62. La azitromicina no se metaboliza por el citocromo p450, por lo que no interacciona y podría ser de elección en este grupo de pacientes. Respecto de rifabutina, habría que tener en cuenta el riesgo de toxicidad acumulativa e interacciones. Se publicó una serie63 de 22 niños con infección por el VIH en los que fue preciso ajustar la dosis de rifabutina, oscilando finalmente entre 4-18,5 mg/kg/dosis.
Aunque la mejor profilaxis de infección diseminada por MAC es mantener un buen control inmunológico con tratamiento antirretroviral adecuado, a los niños con inmunosupresión grave se les debe ofertar profilaxis farmacológica. Dicha profilaxis40,64 se indicará según la edad del paciente cuando:
Resumen y recomendaciones del grupo de estudioDiagnóstico- •
El diagnóstico de sospecha es clínico, ante la presencia de una o varias adenopatías unilaterales, de evolución subaguda o crónica (>3-4 semanas), sin sintomatología sistémica, sin dolor a la palpación, con coloración violácea progresiva de la piel adyacente y tendencia a la fistulización espontánea en niños menores de 5 años.
- •
El diagnóstico diferencial más importante es con la adenitis tuberculosa, aunque también se deben descartar causas no infecciosas e infecciosas de adenitis prolongada como toxoplasma, adenovirus, citomegalovirus, virus de Epstein-Barr y Bartonella.
- •
Una reacción tuberculínica positiva requiere la realización de técnicas más específicas (IGRA) para establecer un diagnóstico diferencial con MT y una negativa no excluye el diagnóstico de adenitis por MNT (AII).
- •
Una PT positiva con un IGRA negativo apoya el diagnóstico de infección por MNT en paciente con clínica compatible (AII).
- •
La ecografía es la técnica de imagen de elección. La TC o la RM no deben realizarse de forma rutinaria (BII).
- •
La PAAF puede constituir una prueba rápida y sencilla para el diagnóstico en centros experimentados. Permite realizar un diagnóstico histológico de presunción ante la presencia de granulomas y excluir, en ocasiones, otras causas de adenopatía prolongada en el niño.
- •
Si tras la realización de una PAAF se llega a un diagnóstico histológico de presunción y la clínica es compatible con infección por MNT, debe realizarse biopsia escisional precoz para evitar la fistulización (BIII).
- •
Si no se dispone de PAAF o existe un alto índice de sospecha de infección por MNT (PT positiva+IGRA negativo), se debe realizar directamente una biopsia escisional que permite el diagnóstico definitivo y es el tratamiento de elección (BIII).
- •
Por tanto, el grupo de estudio recomienda las siguientes pruebas diagnósticas en caso de sospecha de adenitis por micobacterias (tabla 5).
Tabla 5.Pruebas diagnósticas si sospecha de adenitis por micobacterias
- Ecografía cervical- Radiografía de tórax (AP y lateral)- Prueba de la tuberculina- Técnica IGRA (QuantiFERON/T-SPOT)- Tinción, cultivo, PCR a micobacterias y estudio anatomopatológico en:• PAAF*• Biopsia escisional• Material de drenaje *Se realizará en función del rendimiento diagnóstico de cada centro. Si bajo rendimiento que puede demorar la cirugía, es preferible la biopsia escisional.
- •
La exéresis quirúrgica precoz (<un mes desde el comienzo del cuadro) es el tratamiento de elección de las adenitis por MNT (BII). En caso de afectación múltiple, se extraerán los ganglios de mayor tamaño, los fluctuantes y los necróticos (AII).
- •
La escisión debe intentar realizarse antes de que aparezca fistulización espontánea, ya que esta dificulta la intervención y asocia mayor morbilidad quirúrgica y peor resultado estético (AII).
- •
La exéresis parcial y la incisión-drenaje sin extirpación no deben realizarse, ya que estas técnicas aumentan el riesgo de fistulización crónica y la frecuencia de recidivas (BII).
- •
Se puede plantear el tratamiento médico inicial en adenitis de alto riesgo quirúrgico por la localización anatómica, extensas, bilaterales o con fistulizaciones múltiples que comportan un elevado riesgo de cicatrices antiestéticas (CIII).
- •
Aunque no existe evidencia sobre la pauta antibiótica más eficaz, el tratamiento debe ser combinado y debe incluir un macrólido (azitromicina o claritromicina) junto con uno de los siguientes: rifabutina, ciprofloxacino o etambutol (BII). El grupo de estudio propone la siguiente pauta:
- ∘
Niños<4 años: claritromicina/azitromicina+ciprofloxacino/rifabutina
- ∘
Niños ≥ 4 años: claritromicina/azitromicina+etambutol/ciprofloxacino/rifabutina
- ∘
- •
La duración del tratamiento médico no está establecida de forma unánime pero será individualizada, en función de la respuesta (hasta la cicatrización o disminución significativa del tamaño de la adenopatía) y oscilará entre 3 y 6 meses. En caso de combinarse con cirugía, solo se mantendrá si no ha sido posible la exéresis completa de las adenopatías (CIII).
- •
La observación estrecha sin tratamiento puede ser una alternativa al tratamiento médico en caso de adenopatías pequeñas aunque hubiera cambios de coloración de la piel. En caso de mala evolución podría plantearse la cirugía diferida (CIII).
- •
Ante todos estos datos, el grupo de trabajo ha establecido en cuanto al tratamiento las recomendaciones que se presentan en la tabla 6.
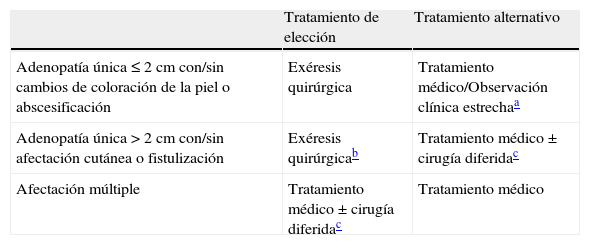
Tabla 6.Recomendaciones del grupo de estudio respecto al tratamiento
Tratamiento de elección Tratamiento alternativo Adenopatía única≤2 cm con/sin cambios de coloración de la piel o abscesificación Exéresis quirúrgica Tratamiento médico/Observación clínica estrechaa Adenopatía única>2 cm con/sin afectación cutánea o fistulización Exéresis quirúrgicab Tratamiento médico±cirugía diferidac Afectación múltiple Tratamiento médico±cirugía diferidac Tratamiento médico - •
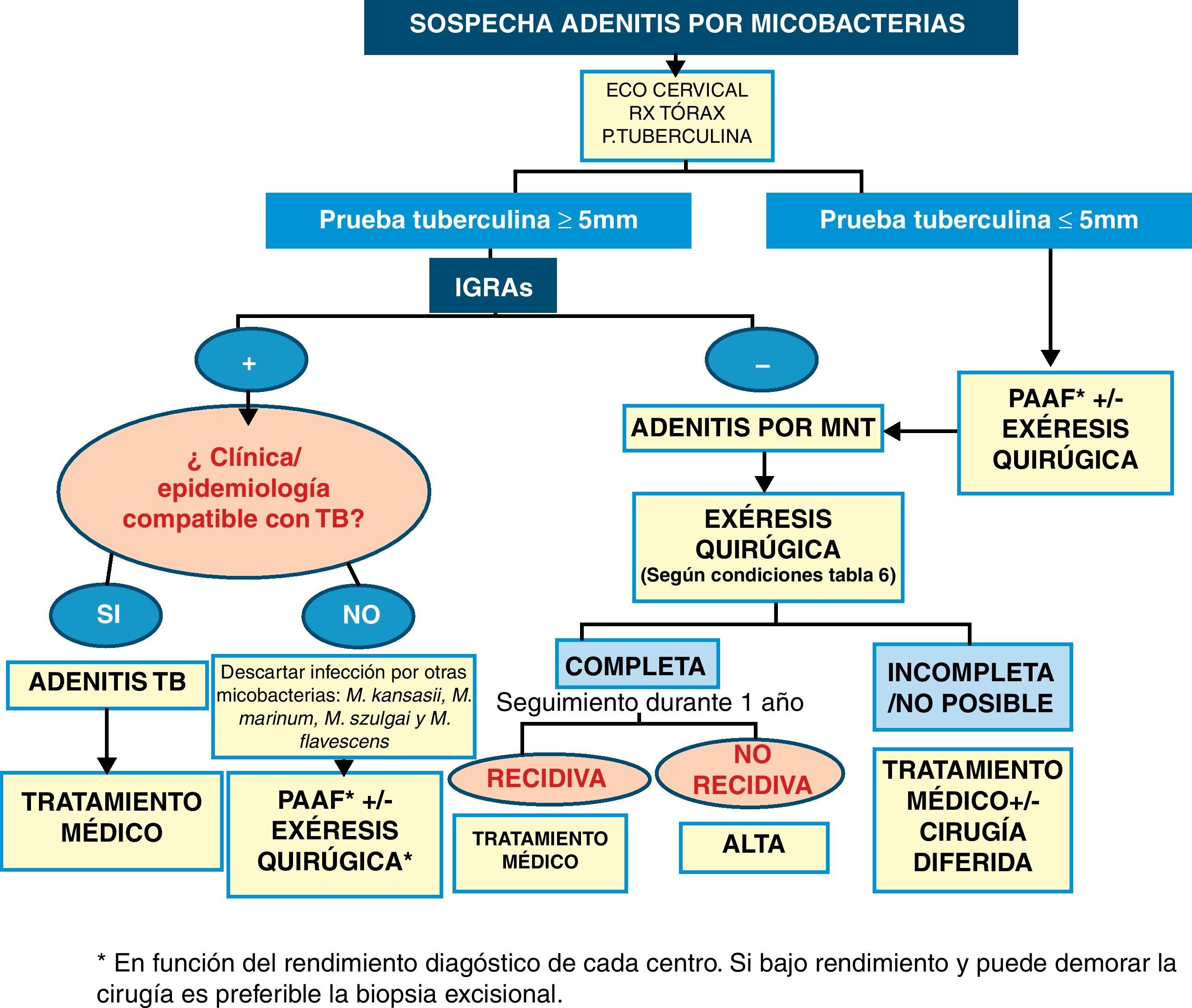
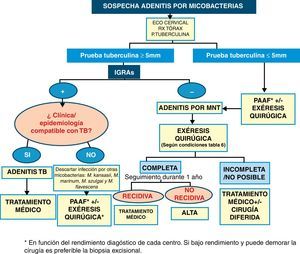
En resumen, y tras las consideraciones previas, planteamos un algoritmo diagnóstico-terapéutico para el manejo de las adenitis por micobacterias (fig. 1).
Los autores declaran que no existe ningún conflicto de intereses.
Miembros del Grupo de Trabajo sobre la infección por micobacterias no tuberculosas de la Sociedad Española de Infectología Pediátrica (SEIP): Cristina Álvarez Álvarez, Servicio de Pediatría, Unidad de Infectología pediátrica, Hospital Universitario Marqués de Valdecilla (Santander); Fernando Álvez González, Servicio de Pediatría, Hospital General Universitario de Santiago (Santiago de Compostela); Fernando Baquero-Artigao, Unidad de Enfermedades Infecciosas Pediátricas, Hospital Universitario La Paz (Madrid); Daniel Blázquez Gamero, Sección de Lactantes e Inmunodeficiencias, Servicio de Pediatría, Hospital Doce de Octubre (Madrid); Teresa Hernández Sampelayo Matos, Sección de Enfermedades Infecciosas pediátricas, Hospital Gregorio Marañón, (Madrid); Andrea Martín-Nalda, Unidad de Patología Infecciosa e Immunodeficiencias de Pediatría, Hospital Universitario Vall de Hebrón-Universitat Autònoma de Barcelona (Barcelona); Olaf Neth, Sección de Enfermedades Infecciosas e Inmunodeficiencia de Pediatría, Hospital Universitario Virgen del Rocío (Sevilla); Antoni Noguera-Julian, Unidad de Infectología, Servicio de Pediatría, Hospital Sant Joan de Déu-Universidad de Barcelona (Barcelona); Esmeralda Núñez Cuadros, Unidad de Infectología Pediátrica e Inmunodeficiencias, Hospital Materno Infantil Carlos Haya (Málaga); Carlos Rodrigo Gonzalo de Liria, Servicio de Pediatría, Hospital GermansTrials i Pujol-Universidad Autónoma de Barcelona, Badalona (Barcelona); Margarita Rodriguez Benjumea, Unidad de Pediatría General e Infectología peduátrica, Hospital Juan Ramón Jiménez (Huelva); José Tomás Ramos, Servicio de Pediatría, Hospital de Getafe (Madrid)
Colaboraciones especiales: Pilar Bermúdez Ruiz, Servicio de Microbiología/Sección Micobacterias, Hospital Carlos Haya (Málaga); Nuria García Soldevilla, Unidad de Cirugía Plástica Pediátrica, UGC Cirugía Pediátrica, Hospital Materno Infantil Carlos Haya (Málaga).
El listado de los miembros del Grupo de Trabajo sobre infección por micobacterias no tuberculosas de la Sociedad Española de Infectología Pediátrica (SEIP) y el resto de autores se presenta en el Anexo 1.