La incidencia del paludismo está creciendo en España y es potencialmente grave en niños. Hay poca información sobre el paludismo infantil en España. El objetivo de este estudio es evaluar las características clínicas y epidemiológicas, así como el tratamiento efectuado en los casos de paludismo en el Hospital Universitario de Getafe .
Pacientes y métodosEstudio descriptivo y retrospectivo de los casos diagnosticados en el hospital desde 1995 hasta 2007. Se analizaron datos sobre epidemiología, clínica, métodos diagnósticos y tratamiento en 2 períodos comparativos de 6 años: antes y después de enero de 2001.
ResultadosSe confirmaron 18 casos de paludismo, con predominio de mujeres (2:1). El rango de edad osciló entre 13 meses y 13 años, con una mediana de 60 meses. Todos habían realizado un viaje reciente a un país endémico. Se detectó un aumento en la incidencia (p<0,01) a partir del año 2001.
La clínica más frecuente fue fiebre y síntomas gastrointestinales, con hepatomegalia o esplenomegalia en el 75%. La trombopenia y la anemia fueron hallazgos frecuentes.
Se realizó un examen microscópico (frotis fino) en el 100% de los casos. La identificación de la especie de Plasmodium se obtuvo mediante PCR (polymerase chain reaction ‘reacción en cadena de la polimerasa’) en 16 casos, y se detectó Plasmodium falciparum en un 89% de éstos. Se trataron con sulfato de quinina y clindamicina un 72% de los casos. No hubo ningún caso de malaria complicada o fallecimiento.
ConclusionesLa incidencia del paludismo importado está aumentando en el área sur de Madrid, y el agente causal mayoritario es el P. falciparum. La visualización del protozoo en el examen microscópico y la detección de su antígeno en sangre son buenos métodos de diagnóstico, pero es fundamental realizar una PCR al ingreso para conocer la especie de Plasmodium y para identificar posibles parasitaciones mixtas. Dada su potencial gravedad en la infancia, se debe tener un alto índice de sospecha para iniciar de forma precoz un adecuado tratamiento, lo que condiciona un mejor pronóstico.
Malaria has increased in Spain, and is potentially severe in children. Information on pediatric malaria in Spain is scarce. The aim is to evaluate the clinical, therapeutic and epidemiological characteristics of children diagnosed with malaria in our hospital.
Patients and methodsA retrospective descriptive study was performed on all pediatric cases of malaria diagnosed in Getafe University Hospital, from January 1995 to November 2006. Epidemiological and clinical features, as well as diagnostic methods, treatments and outcome were studied. An analysis of two comparative periods (before and after January 2000) was carried out.
ResultsEighteen cases of confirmed malaria were identified, twelve girls and six boys. The age range was from 13 months to 13 years with a median age of 60 months. All patients had recently travelled to or from endemic countries. Despite having a stable number of admissions to hospital over time, all but two patients were diagnosed in the second period (P<0.01).
Fever and gastrointestinal symptoms were the most common symptoms, with liver or spleen enlargement in 75%. Thrombocytopenia and anemia were common. No cases of complicated malaria or death occurred.
Plasmodium identification by microscopic examination was used in all cases. Identification of Plasmodium species with PCR was carried out in 16 children. P. falciparum was found in 89% of these cases. Quinine-sulphate and clindamycin were used in 72%.
ConclusionsThe incidence of pediatric malaria is increasing in the southern area of Madrid, with P. falciparum as the most frequently identified species. Microscopic visualization or identification of its antigen are gold-standard diagnostic methods, however, identification with PCR is essential upon admission to determine the species and discard possible multiple infestations. Pediatricians must learn to suspect this potentially severe disease, in order to establish an early treatment that may improve the prognosis.
El paludismo o malaria es una enfermedad producida por protozoos del género Plasmodium, adquirida tras la picadura de la hembra del mosquito Anopheles. Hay 4 especies de Plasmodium: P. falciparum, P. malariae, P. vivax y P.ovale; de éstas, P. falciparum y P. vivax son las más comunes en todo el mundo, pero es P. falciparum la que produce la mayoría de los casos de malaria grave. En el caso de infecciones por P. vivax y P. ovale, pueden ocurrir recidivas por persistencia de la fase hepática1.
El paludismo es endémico en áreas tropicales de todo el mundo, sobre todo en África subsahariana, Centro y Sudamérica, y en el Sudeste asiático1. Casi el 50% de la población vive en áreas de riesgo de transmisión, lo que representa entre 300 y 500 millones de casos anuales y entre 1,5 y 2,7 millones de muertes al año1. Afecta a niños en un 90% de los casos; en éstos es potencialmente más grave, con una evolución más rápida hacia las complicaciones y mayor dificultad diagnóstica por la clínica inicial más inespecífica que presentan2,3.
El número de casos de paludismo importado ha aumentado mucho en las últimas décadas debido al crecimiento en la inmigración, el mayor número de viajes a países endémicos, el aumento de resistencias a los antipalúdicos empleados en la quimioprofilaxis y las crecientes adopciones internacionales de países endémicos2,4,5. El niño inmigrante, sobre todo procedente de África subsahariana, tiene mayor riesgo de contraer determinadas infecciones, no sólo por la elevada prevalencia de éstas en su país de origen, sino también por la pobre situación soicoeconómica en la que se encuentran frecuentemente al llegar a España5. A su vez, el hijo de inmigrantes nacido en España que realiza viajes a zonas endémicas tiene más probabilidades de tener paludismo que sus progenitores, que con frecuencia tendrán únicamente crisis palúdicas leves. Esto es debido a la falta de quimioprofilaxis de los niños en estos viajes y a que los adultos que han nacido y viven en países endémicos adquieren cierta inmunidad parcial (frente a parásitos locales) aunque temporal (se pierde de forma importante al interrumpirse el inóculo)3.
Hay pocos datos de malaria infantil en España actualmente, lo que hace necesario aportar más información de esta enfermedad emergente. El objetivo del trabajo ha sido evaluar las características clínicas y epidemiológicas, así como el tratamiento efectuado y la evolución en los casos de paludismo en este centro en los últimos 12 años.
Material y métodosSe realizó un estudio descriptivo y retrospectivo de todos los casos de paludismo pediátrico (de 0 a 15 años) ingresados en el Servicio de Pediatría del Hospital Universitario de Getafe desde enero de 1995 hasta enero de 2007. Este hospital cubre el área 10 de la Comunidad Autónoma de Madrid, lo que representa una población de 330.000 habitantes, de los cuales 47.000 son niños menores de 15 años. Se consideró caso aquél en el que se visualizó el protozoo en el examen microscópico mediante técnica de frotis fino (tinción Giemsa) o se detectó su antígeno circulante en sangre mediante inmunocromatografía (NOW ICT® Malaria test; Binax, Inc., Portland, Maine).
Se revisaron las historias clínicas del archivo central de los niños con diagnóstico de paludismo y se estudiaron las características epidemiológicas de cada caso (sexo, edad, procedencia, viajes recientes a países endémicos y antecedentes familiares y personales de interés). A su vez, se recogieron datos de la clínica, la exploración física y la analítica al ingreso. Quedan reflejados los métodos diagnósticos empleados y las especies de Plasmodium detectadas. Se evaluaron los tratamientos empleados así como la estancia media hospitalaria. En cuanto a la evolución del cuadro, se determinó el momento de desaparición de la fiebre, la necesidad de transfusión de concentrado de hematíes, la existencia de complicaciones y el cumplimiento del seguimiento posterior al alta hospitalaria.
Se realizó un análisis estadístico descriptivo en el que se compararon 2 períodos equitativos de 6 años: el primero, de enero de 1995 a enero de 2001 y, el segundo, de enero de 2001 a enero de 2007. La división en estos períodos se hizo sobre la base del aumento progresivo de la inmigración de predominio subsahariano a partir del año 2001, fundamentalmente, y a que previo al año 2001 no había disponibilidad en este centro para realizar la detección genómica del Plasmodium ni para la detección de su antígeno en sangre. Para comparar el número de casos diagnosticados en cada uno de los períodos de estudio se empleó el test de la χ2 con corrección exacta de Fisher.
ResultadosDe enero de 1995 a enero de 2007 se detectaron un total de 18 casos de paludismo confirmado, uno de los cuales fue una niña que presentó 2 episodios de malaria distintos a los 6 y a los 7 años. Dos casos de sospecha de paludismo que posteriormente no se confirmaron se excluyeron del estudio. A pesar de que el número de ingresos anuales en el hospital ha permanecido estable, se observó un aumento en el número de casos de malaria en el segundo período de estudio. Así, 2 casos se observaron antes del año 2001, los 16 restantes fueron del segundo período, a partir de enero 2001, lo que demostró un importante aumento en la incidencia (p<0,01). El primer caso data de octubre de 1998, con al menos un caso anual a partir de ese momento y un pico de 8 casos (44%) en el año 2005.
La edad media de presentación fue de 72,5±24,3 meses (intervalo de confianza [IC] del 99,9%), con un rango de edad entre los 13 y los 132 meses, una mediana en 60 meses y un pico aislado de 3 casos entre los 12 y los 24 meses de edad. Doce casos fueron en mujeres frente a 6 en varones (relación 2:1).
Todos los pacientes eran de raza negra, de los cuales 8 niños eran naturales de Guinea Ecuatorial (44%), 9 niños eran hijos de inmigrantes nacidos en España, con familia en África subsahariana y viajes frecuentes a Guinea Ecuatorial, y un único caso procedía de Camerún. El 100% había realizado un viaje en los 2 meses previos a un país endémico (Guinea Ecuatorial en su mayoría), de los cuales un caso fue un traslado de un hospital de Guinea Ecuatorial a este centro por anemia grave y petición de los padres, cuyo lugar de residencia era Getafe. La media de tiempo transcurrido desde el regreso del viaje hasta la aparición de las manifestaciones clínicas fue de 17 días y medio. Doce de los pacientes (67%) tenían antecedentes familiares de malaria (padres, hermanos o abuelos). Dos de ellos habían tenido algún episodio previo tratado en España y 8 casos (44%) habían pasado uno o más episodios tratados en Guinea Ecuatorial.
En cuanto a la clínica de presentación, el 100% presentaba fiebre y hasta un 44% asociaba vómitos. Más de un 70% presentaba órganomegalias, ya fuera hepatomegalia o esplenomegalia (tabla 1).
Signos y síntomas en el ingreso
| Signos y síntomas al ingreso | Número de casos (%) |
| Fiebre | 18 (100) |
| Vómitos | 8 (44) |
| Escalofríos | 4 (22) |
| Cefalea | 3 (16) |
| Dolor abdominal | 3 (16) |
| Astenia | 2 (11) |
| Hepatomegalia o esplenomegalia | 16 (89) |
| Hepatomegalia | 14 (78) |
| Esplenomegalia | 13 (72) |
| Hepatoesplenomegalia | 9 (50) |
| Palidez mucocutánea | 4 (22) |
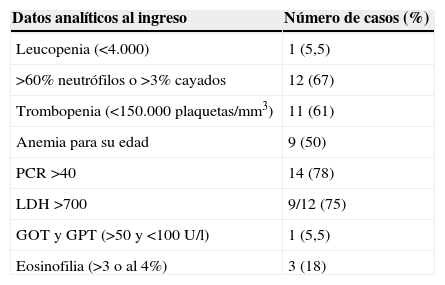
Las alteraciones analíticas al ingreso más destacables fueron una discreta leucocitosis (8.280±2.688 para un IC del 99,9%) con desviación izquierda, trombopenia (<150.000 plaquetas/mm3) en más de un 80% de los casos, anemización con una hemoglobina media al ingreso (10,9±1,4mg/dl; IC del 99,9%), aumento de la proteína C reactiva (93,5±40,2mg/l; IC del 99,9%) y elevación de la lactatodeshidrogenasa (LDH) como dato de hemólisis (tabla 2).
Datos analíticos en el ingreso
| Datos analíticos al ingreso | Número de casos (%) |
| Leucopenia (<4.000) | 1 (5,5) |
| >60% neutrófilos o >3% cayados | 12 (67) |
| Trombopenia (<150.000 plaquetas/mm3) | 11 (61) |
| Anemia para su edad | 9 (50) |
| PCR >40 | 14 (78) |
| LDH >700 | 9/12 (75) |
| GOT y GPT (>50 y <100U/l) | 1 (5,5) |
| Eosinofilia (>3 o al 4%) | 3 (18) |
GOT: glutamic oxaloacetic transaminase 'aminotranferasa glutamicoxalacética'; GPT: glutamic pyruvic transaminase 'aminotranferasa glutámico pirúvica'; LDH: lactatodeshidrogenasa; PCR: polymerase chain reaction 'reacción en cadena de la polimerasa'.
Como método diagnóstico se empleó en primer lugar la visualización del Plasmodium en el examen microscópico en el 100% de los casos al ingreso, y fue positivo en 17 casos (94%). Se repitió a las 72h en el 56% de éstos y en un 22% se realizó al ingreso y al quinto día del tratamiento. Sólo en un caso se realizó al primer y al séptimo día, y en 3 casos (16%) sólo al ingreso.
La detección del antígeno del Plasmodium en sangre al ingreso se empleó a partir del año 2001, por tanto, en 16 casos (89%), ya que 2 fueron anteriores a esta fecha, y fue en todos éstos positivo. En un caso el diagnóstico se obtuvo por este método, aunque el frotis fino había sido negativo.
De forma similar, la detección genómica con PCR (polymerase chain reaction ‘reacción en cadena de la polimerasa’) se realizó al ingreso en 16 casos (el 100% de los casos a partir de 2001); fue positivo en todos y se identificaron las especies de Plasmodium causantes. Se repitieron los controles de la PCR de forma variable al tercer día (67%), al quinto día (28%), al séptimo día (17%) o pasadas 2 semanas (11%). La sistemática empleada fue PCR al ingreso seguido de una PCR de control en el 100% de los casos en un período variable de entre 3 y 7 días tras haberse iniciado el tratamiento. Se solicitó una tercera muestra en aquellos pacientes en los que la muestra de control seguía siendo positiva, lo que ocurrió en 5 casos (27%) (tabla 3).
Pruebas diagnósticas realizadas
| Pruebas diagnósticas | Número de casos (%) |
| Gota gruesa al ingreso | 18 (100) |
| Gota gruesa al ingreso y al 3.er día | 10 (55) |
| Gota gruesa al ingreso y al 5.° día | 4 (22) |
| Gota gruesa al ingreso y al 7.° día | 1 (5) |
| Gota gruesa sólo al ingreso | 3 (16) |
| Antígeno sérico al ingreso | 16 (83) |
| PCR al ingreso | 16 (83) |
| PCR al ingreso y al 3.er día | 13 (67) |
| PCR al ingreso y al 5.° día | 5 (28) |
| PCR al ingreso y al 7.° día | 3 (17) |
| PCR al ingreso y pasadas 2 semanas | 2 (11) |
| Grado de parasitación | 2 (11) |
PCR: polymerase chain reaction 'reacción en cadena de la polimerasa'.
Sólo constan 2 casos en los que se calculó el grado de parasitación, éste fue superior al 5% en ambos, pero es un procedimiento que no se realiza de forma habitual.
El P. falciparum fue el agente causal en un 89% de los casos, en uno de los casos se trató de una parasitación mixta de P. falciparum y de P. malariae. En los 2 casos previos al año 2001 no consta la especie identificada (aquéllos en los que no se pudo realizar la detección de antígeno sérico ni de PCR).
La fiebre desapareció como media a las 28,6h de iniciado el tratamiento. Se precisó transfusión de concentrado de hematíes en 2 casos. Ningún paciente precisó traslado a una unidad de cuidados intensivos pediátricos (UCIP). Consta un caso de malaria complicada (anemia grave y una crisis comicial) que se trasladó de Guinea Ecuatorial por petición de los padres y que precisó una transfusión, pero permaneció estable y con buena evolución, sin necesidad de traslado a la UCIP.
El tratamiento empleado fue la combinación de sulfato de quinina (30mg/kg/día) y clindamicina (20mg/kg/día) con duración variable de entre 3 y 7 días por vía oral en 13 casos (72%). Se asoció primaquina en 3 casos, uno de ellos ingresado en 1998, año en el que aún se desconocía la especie de Plasmodium, y 2 más en el año 2004, posiblemente por sospecha inicial de infección por P. vivax o por P. ovale, aunque posteriormente no se confirmara. En un caso se empleó sulfato de quinina como único tratamiento con una dosis única de pirimetamina con sulfadoxina (tabla 4).
Tratamiento empleado
| Tratamiento seguido | Número de casos (%) |
| Sulfato de quinina y clindamicina de 3 a 7 días por v.o. | 13 (72) |
| Sulfato de quinina y clindamicina de 3 a 7 días por v.o. asociado a primaquina | 3 (17) |
| Sulfato de quinina y clindamicina por i.v. | 3 (17) |
| Sulfato de quinina 3 días y una dosis única de pirimetamina con sulfadioxina | 1 (5,5) |
En 3 casos se realizó el tratamiento por vía intravenosa por intolerancia digestiva o por dificultad de dosificación de antipalúdicos por vía oral, dada la corta edad del paciente.
La estancia media fue de 5,4 días, con una estancia mínima de 3 días y máxima de 7 días, y la necesidad de tratamiento intravenoso por intolerancia digestiva fue la causa mayoritaria de las estancias prolongadas.
Se citó al 100% para seguimiento en consultas externas de pediatría general, de los cuales sólo un 33% acudió a una o más citas, a pesar de los intentos de localizar a las familias en sucesivas consultas.
DiscusiónLa incidencia del paludismo importado está aumentando en el área sur de Madrid, por lo que debe sospecharse ante todo niño con fiebre procedente de un país endémico. La mayoría cursa con fiebre, grado variable de hepatomegalia o esplenomegalia, trombopenia moderada, proteínas C reactivas aumentadas y signos de hemólisis (anemia y aumento de la LDH). En este hospital, el agente causal mayoritario fue el P. falciparum (debido al origen de los niños: el 100% era de África subsahariana, donde el P. falciparum es endémico) sin que se produjeran casos de malaria complicada, aunque en 2 se conocía un grado de parasitación >5% (lo que representa un factor de riesgo para la malaria complicada).
La visualización del protozoo en el examen microscópico y la detección de su antígeno en sangre son buenos métodos de diagnóstico (el primero es el método de referencia) de modo que si resultan positivos, está indicado iniciar tratamiento con antipalúdicos, ya que el tratamiento precoz mejora el pronóstico. Sin embargo, es fundamental realizar una PCR al ingreso para conocer la especie de Plasmodium y porque permite identificar parasitaciones mixtas que de otro modo podrían pasar desapercibidas en el examen microscópico. Parece aconsejable repetirla junto con una nueva muestra para frotis fino a las 48 y a las 72h de haber iniciado el tratamiento para vigilar la respuesta a los antipalúdicos, dada la elevada tasa de resistencia actual. No se precisa detección del antígeno sérico de control ya que éste puede resultar positivo hasta 2 a 4 semanas después de recibir el tratamiento, sin que esto implique fracaso terapéutico6.
La asociación de sulfato de quinina y clindamicina es válida y eficaz, aunque en niños pequeños representa un problema potencial de dosificación por su forma de presentación y por la intolerancia digestiva que puede producir. La duración es de entre 3 y 7 días para el sulfato de quinina. El tratamiento con atovacuona más proguanil está actualmente indicado en malarias no complicadas por P. falciparum o especie no conocida en niños con peso por encima de 5kg, esto reduce la duración del tratamiento a 3 días y, por tanto, la estancia hospitalaria7,8.
La limitación más importante de este estudio es que es retrospectivo, de modo que los datos pueden estar incompletos, y sólo permite aportar datos descriptivos. Hay que considerar la posibilidad de que al no contar con una UCIP en el Hospital de Getafe, posibles casos graves pueden haberse trasladado directamente a hospitales de referencia por parte del servicio de emergencias, casos que no quedarían reflejados en este estudio.
Como conclusión final, hay que destacar el aumento significativo del paludismo en esta área, al igual que en otras áreas de Madrid, reflejo de la creciente inmigración. Por esta razón y debido a la gravedad potencial del paludismo en la infancia, es muy importante conocer esta enfermedad y sospecharla para realizar un tratamiento precoz adecuado.