El soporte nutricional en el paciente crítico es un desafío tanto en la estimación de requerimientos como en el cumplimiento de su prescripción.
ObjetivoEvaluar las relaciones entre la prescripción, el requerimiento y el cumplimiento del soporte nutricional de energía y proteínas según la fase de la enfermedad en el paciente crítico.
Pacientes y métodoEstudio observacional, analítico, de datos obtenidos a través de reclutamiento prospectivo (2020-2021), pacientes de 0-18 años hospitalizados en la unidad de cuidados intensivos o intermedios pediátrica. Se obtuvieron datos demográficos, antropométricos y del estado agudo (FA)/no agudo (FNA) de la enfermedad. Se determinaron la prescripción (P) (indicación nutricional), el gasto energético basal (GEB) (fórmula de Schofield), el cumplimiento (C) de soporte nutricional, el requerimiento (R) proteico, creándose las siguientes relaciones: P/GEB, P/R, C/GEB, C/R, C/P.
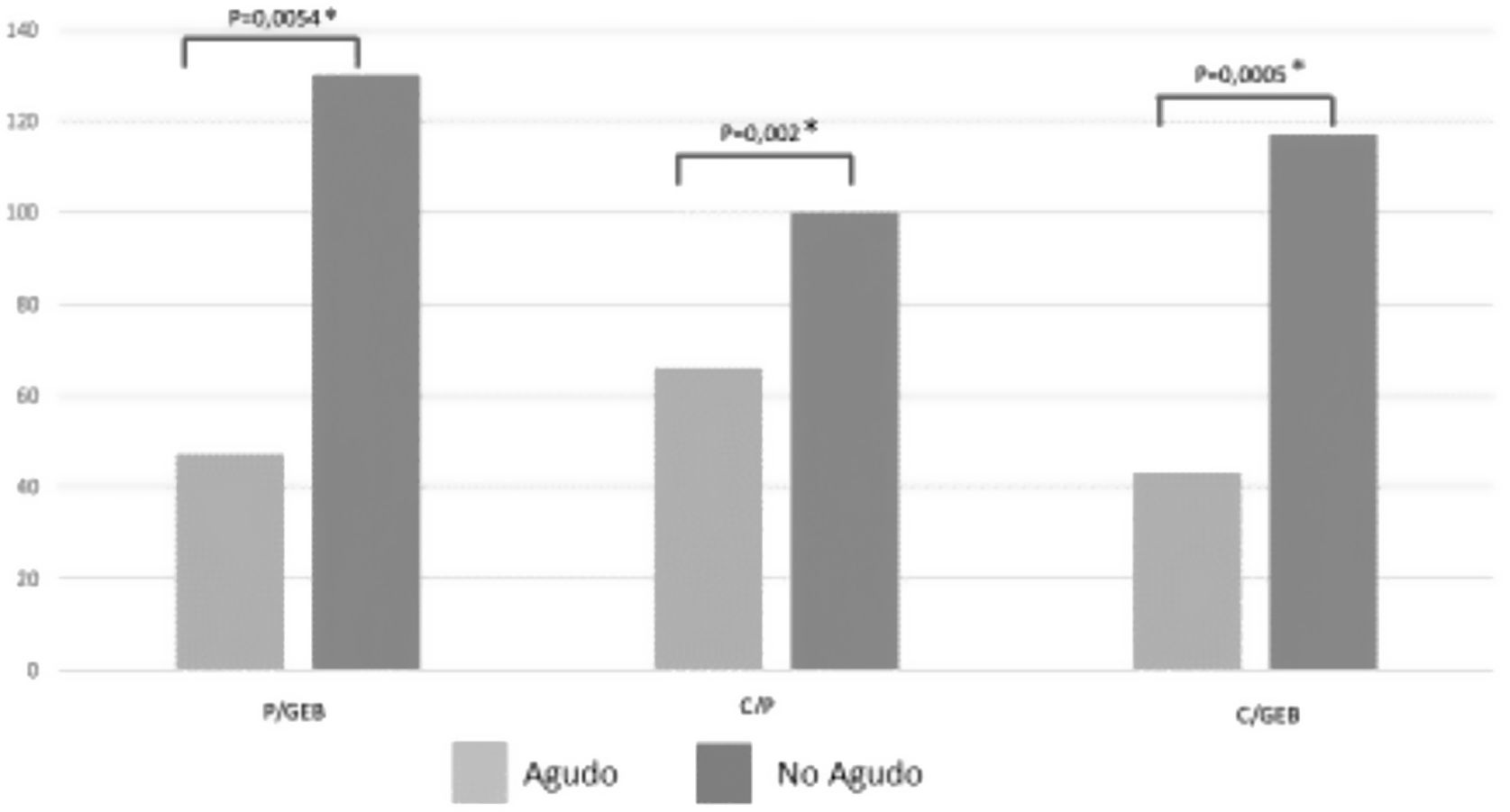
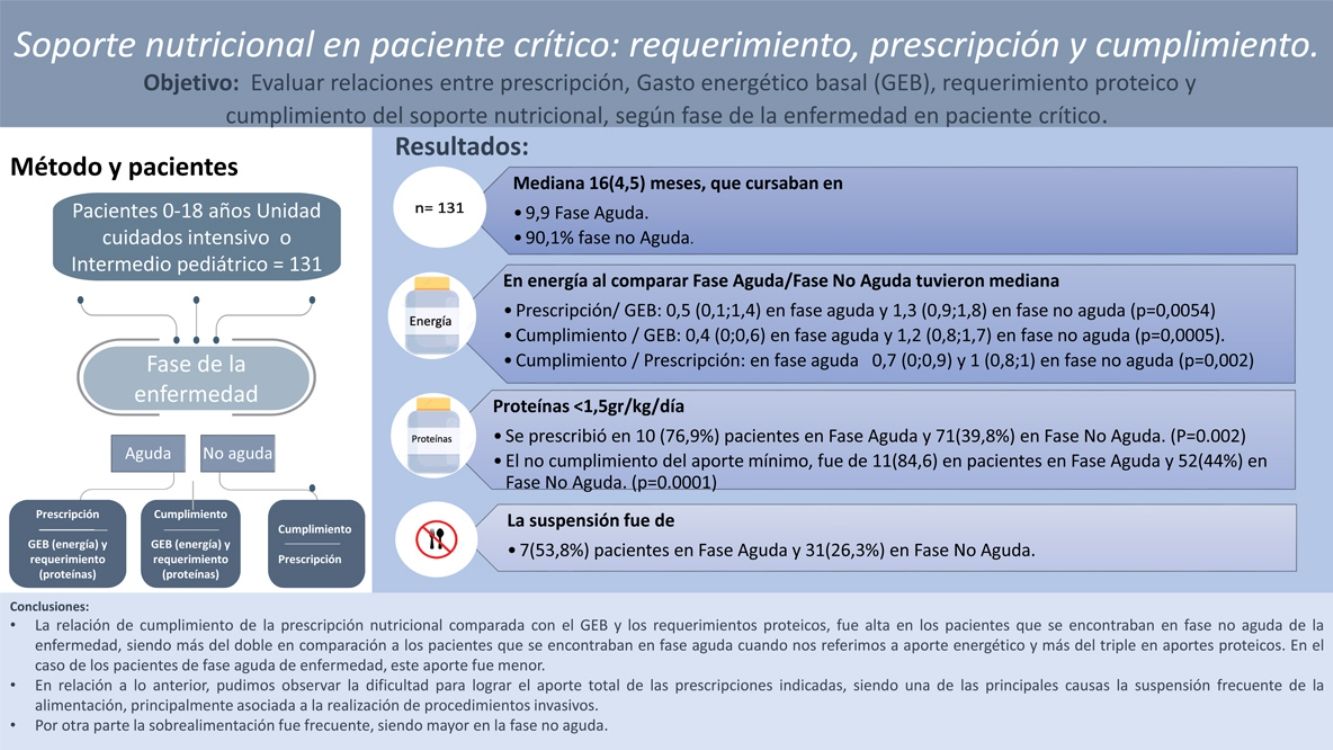
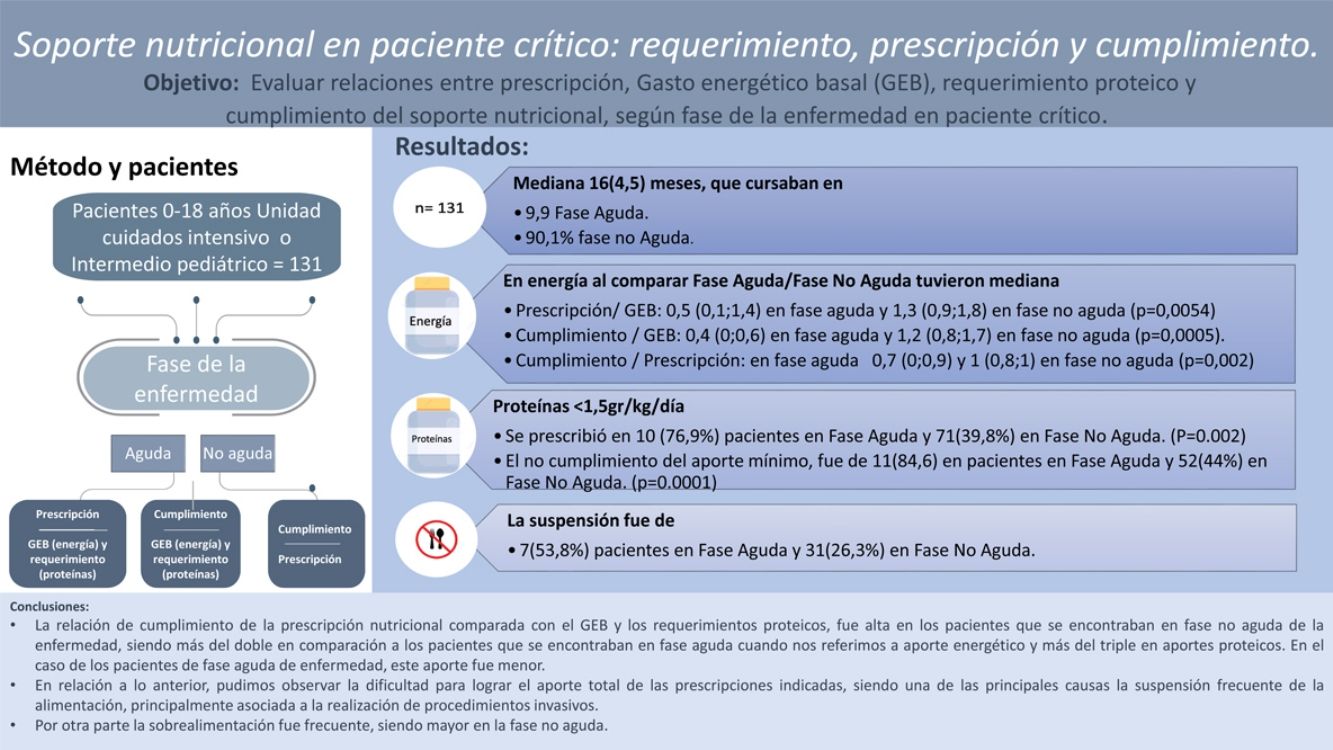
ResultadosSe incluyeron 131 sujetos con una mediana de 16 (4,5) meses; el 97,7% presentaban alguna comorbilidad y el 9,9% cursaban en FA. Al comparar FA/FNA tuvieron mediana (RIC) de energía: P/GEB 0,5 (0,1-1,4)/1,3 (0,9-1,8) (p=0,0054); C/GEB 0,4 (0-0,6)/1,2 (0,8-1,7) (p=0,0005); C/P 0,7 (0-0,9)/1 (0,8-1) (p=0,002). Y proteínas: P/R 0,7 (0-1,1)/1,2 (0,9-1,6) (p=0,0009); C/R 0,3 (0-0,6)/1,1 (0,8-1,5) (p=0,0002); C/P 0,7 (0-1)/1 (0,8-1) (p=0,002). Se encontró para energía FA/FNA >110% en P/GEB en 4 pacientes (30,8%)/72 (61%) (p=0,007), C/GEB en 3 pacientes (23%)/63 (53,4%) (p=0,009) y C/P en 1 (7%)/3 (2,5%) (p=0,007). En proteínas se prescribió >1,5g/kg/día en 3 (23,1%) pacientes en FA y 71 (60,1%) en FNA. El cumplimiento de este aporte fue de 2 (15,4%) pacientes en FA y 66 (56%) en FNA. Se encontró un coeficiente de correlación de 0,6 entre P/GEB de energía con P/R proteico. La suspensión fue de 7 (53,8%) pacientes en FA y 31 (26,3%) en FNA (p=0,002).
ConclusionesLa relación de cumplimiento de la prescripción fue alta en pacientes en FNA de la enfermedad. La sobrealimentación fue frecuente, siendo mayor en FNA. Se observó dificultad para cumplir la prescripción, siendo la causa principal la suspensión de la alimentación.
In critically ill patients, nutritional support is a challenge in terms of both estimating their requirements and ensuring adherence to the prescribed treatment.
ObjectiveTo assess the association between requirements, prescription and adherence to energy and protein supplementation based on the phase of disease in critically ill patients.
Sample and methodsWe conducted a prospective, observational and analytical study in patients aged 0-18years admitted to the paediatric intensive or intermediate care unit in 2020-2021. We collected data on demographic and anthropometric characteristics and the phase of disease (acute phase [AP] vs. non-acute phase [nAP]), in addition to prescribing (P) (indication of nutritional support), basal metabolic rate (BMR, Schofield equation), adherence to nutritional support (A) and protein requirements (R), and calculated the following ratios: P/BMR, P/R, A/BMR, A/R, and A/P.
ResultsThe sample included 131 participants with a median age of 16 (4.5) months, of who 128 (97.7%) had comorbidities and 13 (9.9%) were in the AP. Comparing the phases of disease (AP vs. nAP), the median values for energy supplementation were P/BMR, 0.5 (IQR, 0.1-1.4) vs. 1.3 (IQR, 0.9-1.8) (P=.0054); A/BMR, 0.4 (IQR, 0-0.6) vs. 1.2 (IQR, 0.8-1.7) (P=.0005); A/P, 0.7 (IQR, 0-0.9) vs. 1 (IQR, 0.8-1) (P=.002), and for protein supplementation were P/R, 0.7 (IQR, 0-1.1) vs. 1.2 (0.9-1.6) (P=.0009); A/R 0.3 (IQR, 0-0.6) vs. 1.1 (IQR, 0.8-1.5) (P=.0002); A/P 0.7 (IQR, 0-1) vs. 1(IQR, 0.8-1) (P=.002). We found AP/nAP ratios greater than 110% for energy in the P/BMR (4 patients [30.8%]/72 patients [61%]; P=.007), A/BMR (3 [23%]/63 [53.4%]; P=.009) and A/P (1 [7%]/3 [2.5%]; P=.007). As for supplemental protein, more than 1.5g/kg/day was prescribed in 3patients (23.1%) in the AP and 71 (60.1%) in the nAP. We found adherence to the prescribed intake in 2 (15.4%) patients in the AP and 66 (56%) in the nAP. We found a correlation coefficient of 0.6 between the energy P/R and the protein P/R. Prescribed support was discontinued in 7 patients (53.8%) in the AP and 31 (26.3%) in the nAP (P=.002).
ConclusionsThe proportion of adherence to prescribed nutritional support was high in patients in the nAP of the disease. Overfeeding was frequent, more so in the nAP. We identified difficulties in adhering to prescribed support, chief of which was the discontinuation of feeding.
El soporte nutricional del paciente críticamente enfermo continúa siendo un desafío para el equipo tratante. Existen dificultades en la estimación de sus requerimientos, la vía de administración y su cumplimiento, dado por las características de un paciente complejo, con patologías de curso dinámico y que está sufriendo estrés metabólico, lo que complica aún más el soporte nutricional1. Se han definido tres fases en una enfermedad crítica2. La fase aguda puede durar desde horas a días y está centrada en la mantención de las funciones de órganos vitales e implica, entre otros, el aumento de la inflamación, la participación de hormonas de contrarregulación, el catabolismo proteico y los ácidos grasos, además de la inactivación periférica de hormonas tiroideas e IGF1. Luego viene la fase estable, caracterizada por estabilización o destete de soporte vital de órganos en evolución, que dura desde días a semanas. Y por último está la fase de recuperación, en la cual hay normalización de alteraciones metabólicas, endocrinas, inmunológicas y aumento del anabolismo proteico3. Según la fase en que se encuentre el paciente, existirán variaciones en sus requerimientos energéticos4 y proteicos, en la tolerancia digestiva5,6, en la estabilidad hemodinámica-electrolítica, además de cambios metabólicos y endocrinológicos7.
Las guías internacionales tienen como consenso para el cálculo de requerimiento energético en la fase aguda el uso de calorimetría indirecta, o, en su defecto, la estimación por método factorial (fórmula de Schofield)8,9. Según un metaanálisis, la ecuación de Schofield, ya sea usando solo peso o peso y talla, es capaz de predecir el gasto energético basal (GEB) con un error de ±15%10,11. Con respecto a las proteínas, las guías recomiendan garantizar en el periodo agudo al menos 1,5g de proteínas/kg/día8,12,13.
Lograr un adecuado soporte nutricional en este escenario es difícil, siendo la malnutrición un problema frecuente en el paciente crítico pediátrico. Por una parte, el aumento de aportes nutricionales puede llevar a una sobrealimentación con riesgo de daño celular y alteraciones metabólicas14, y por otra, un menor aporte nutricional está asociado a mayor morbimortalidad y prolongación de la estancia hospitalaria4,15,16. Este aporte insuficiente suele deberse tanto a una menor prescripción como a un menor cumplimiento de ella17,18. Existen múltiples causas de bajo cumplimiento de la prescripción, las cuales pueden estar altamente influenciadas por la fase de la enfermedad en la que se encuentre el paciente; la alteración de la motilidad gastrointestinal es más frecuentes en periodos de fase aguda, al igual que alteraciones de la hemodinamia, metabólicas y endocrinológicas. Lo anterior va a determinar el aumento en el número de procedimientos necesarios, la restricción de volumen, etc.19, que, en resumen, aumentará el número de suspensiones y el menor cumplimiento de la prescripción17. Los estudios describen un amplio rango en relación con el cumplimiento/prescripción, los cuales van desde el 25% al 59% del aporte calórico y entre el 32,7 y el 93,6% en aporte proteico4,11,20-22, variación que depende de la población estudiada, de la experiencia del equipo tratante, del tiempo estimado para alcanzar objetivos nutricionales, de la disponibilidad de equipos de vigilancia nutricional, del uso de protocolos y de la gravedad de los pacientes1,16,23,24.
El objetivo de esta investigación es evaluar las relaciones entre prescripción, requerimiento y cumplimiento del soporte nutricional, específicamente de energía y proteínas, según la fase de la enfermedad en el paciente crítico pediátrico.
Pacientes y métodosEstudio descriptivo, observacional, analítico, de datos obtenidos a través de reclutamiento prospectivo.
Se estudiaron pacientes entre 0 a 18años hospitalizados por más de 24horas en la unidad de cuidado crítico e intermedio pediátrico del Hospital Clínico de la Pontificia Universidad Católica entre agosto de 2020 y enero de 2021. Se excluyeron aquellos pacientes con alimentación oral predominante, definida como mayor al 70% de su aporte indicado, y los pacientes que ingresaron a estudio multidisciplinario sin patología aguda o por un procedimiento electivo.
Se seleccionaron tres días cada mes durante el periodo de estudio, los cuales fueron aleatorizados según el programa Excel. La investigadora principal recogió los datos correspondientes a las últimas 24horas mediante la revisión de la ficha clínica y el registro de enfermería. En total fueron 18días de recolección de datos, que luego fueron codificados y anonimizados para su análisis posterior.
Correspondió a un trabajo exploratorio, muestra por conveniencia.
Se registraron las siguientes variables: sexo, edad (meses cumplidos), peso (kg) y talla (cm) de ingreso, diagnóstico de ingreso (origen respiratorio, cardiovascular, neurológico, infeccioso, traumatológico/ortopédico, hematoncológico, posquirúrgico, otro), antecedentes de comorbilidad (sí/no) definida como presencia de cualquier enfermedad concomitante diferente al diagnóstico de ingreso, tipo de comorbilidad (origen respiratorio, cardiovascular, neurológico, infeccioso, traumatológico/ortopédico, hematoncológico, posquirúrgico, otro). El diagnóstico del estado nutricional fue evaluado con estándares OMS 2006 para 0 a 5años25 y 2007 para mayores de 5años a 18años26, según norma nacional vigente27. Los pacientes con diagnóstico de síndrome de Down fueron evaluados con curvas de Zemel et al.28 para P/E y T/E, pero con OMS P/T e IMC/E en mayores de 5años para diagnósticos de exceso de peso. En pacientes con parálisis cerebral se utilizaron los patrones de Brooks et al.29 ajustado según GMFCS con P/E y T/E. Se definió desnutrición los valores <p10 de P/E, riesgo de desnutrición como valores entre p10 y p25 de P/E, eutrofia como valores entre p25 y p75 de P/E, sobrepeso como valores entre p75 a p95 de P/E y obesidad con p>95 de P/E. Talla baja se definió como T/E<p10 en curvas Zemel y Brooks.
El gasto energético basal (GEB) fue calculado con fórmula de Schofield peso o peso talla. La prescripción nutricional de energía y de proteínas se obtuvo de la indicación del médico tratante y el aporte nutricional recibido (cumplimiento) de la hoja de enfermería, los cuales se expresaron como kcal/kg/día y gramo proteína/kg/día. Se consignaron todos los aportes nutricionales independientemente de la vía.
Se crearon las siguientes relaciones: prescripción/GEB (P/GEB), cumplimiento/GEB (C/GEB), cumplimiento/prescripción (C/P), que se categorizaron para energía como: subalimentación <90%, adecuado 90-110% y sobrealimentación >110%23. Y para aporte proteico, como inadecuado a <1,5g proteína/kg/día y adecuado a >1,5g proteína/kg/día8,12,13.
Se consignaron la vía de alimentación (oral, enteral, parenteral), la forma de administración de la alimentación enteral (bolo, continua), la suspensión de alimentación y la razón de suspensión de alimentación (procedimiento asociado a manejo de vía aérea, disfunción gastrointestinal, procedimiento diagnóstico, problema mecánico).
La fase de enfermedad se definió en aguda y no aguda según una pauta de cotejo realizada por el equipo investigador, la cual incluyó variables fisiológicas y criterios de clasificación por patología por distintos sistemas, considerándose a un paciente en fase aguda con uno o más de los criterios de esta pauta (material suplementario 1).
Comité de éticaEste estudio se realizó cumpliendo con la Declaración de Helsinki. Con la aprobación del comité de ética de la Comité ético científico de Ciencias de la Salud, Facultad de Medicina Pontificia, Universidad Católica de Chile (N.° 200122005) se aceptó dispensa de consentimiento informado en el contexto de ser un estudio observacional, sin contactarse con pacientes ni con sus familias para la obtención de información para la investigación.
Análisis estadísticoLos análisis estadísticos se realizaron utilizando los programas: STATA versión 13, prism 9.0, SPSS 28.0.1.0. Estadística descriptiva de las variables categóricas en frecuencia absolutas y relativas. Se realizó test de Shapiro Wilks para ver el tipo de distribución para las variables cuantitativas continuas, expresándose en medianas y rangos intercuartiles (RIC). Para la comparación de las relaciones prescripción, cumplimiento y GEB entre las dos fases de enfermedad se realizaron inferencias con test de chi cuadrado (exacto de Fisher cuando corresponda) y test de Wilcoxon. Se realizó correlación de Spearman para la relación de prescripción/GEB entre aporte de energía y de proteínas. Se consideró p<0,05 como de significación estadística.
ResultadosSe incluyeron 131 sujetos (en la tabla 1 se muestran sus características demográficas y la información nutricional). Se pudo realizar diagnóstico nutricional en 116 pacientes y evaluación nutricional completa de 94 pacientes, ya que se disponía de los datos de peso y de talla. Del total, 9 correspondían a pacientes con parálisis cerebral GMFSCV y 12 pacientes con síndrome de Down. Destaca que el 32,8% tenían malnutrición por déficit y el 36,6% estaban eutróficos. La principal vía de alimentación fue la nutrición enteral exclusiva (77,1%), y la principal causa de suspensión de la alimentación fue algún procedimiento invasivo.
Características clínicas, demográficas y nutricionales de pacientes estudiados
| Variable | |
|---|---|
| Sexo varón, n (%) | 79 (60,3) |
| Edad (meses), mediana (RIC) | 16 (4-47) |
| Edad, n (%) | |
| 0-12 meses | 58 (44,2) |
| 12-24 meses | 19 (14,5) |
| 2-5 años | 34 (26) |
| 5-10 años | 2 (1,5) |
| 10-18 años | 18 (13,8) |
| Motivo de ingreso, n (%) | |
| Infeccioso | 53 (40,5) |
| Posquirúrgico | 31 (23,7) |
| Cardiovascular | 19 (14,5) |
| Neurológico | 10 (7,6) |
| Respiratorio | 7 (5,3) |
| Otro | 8 (6,1) |
| Hemato-oncológico | 3 (2,3) |
| Presencia de comorbilidad, n (%) | 128 (97,7) |
| Tipo de comorbilidad | |
| Cardiovascular | 49 (38,3) |
| Otro | 42 (32,8) |
| Hemato-oncológico | 20 (15,6) |
| Neurológico | 16 (12,5) |
| Respiratorio | 1 (0,8) |
| Estado de enfermedad aguda, n (%) | |
| Agudo | 13 (9,9) |
| No agudo | 118 (90,1) |
| Diagnóstico nutricionala, n (%) | |
| Desnutrición | 32 (24,4) |
| Riesgo de desnutrición | 11 (8,4) |
| Eutrofia | 48 (36,6) |
| Sobrepeso | 16 (12,2) |
| Obesidad | 9 (6,9) |
| Talla, n (%)b | |
| Talla baja | 35 (37,2) |
| Alimentación, n (%) | |
| Nutrición enteral exclusiva | 101 (77,1) |
| Nutrición enteral +nutrición parenteral | 8 (6,1) |
| Nutrición parenteral | 6 (4,6) |
| Dieta absoluta | 6 (4,6) |
| Nutrición parenteral +vía oral | 5 (3,8) |
| Nutrición enteral +vía oral | 5 (3,8) |
| Suspensión de la alimentación, n (%) | 38 (29,2) |
| Causas de suspensión, n (%) | |
| Procedimiento invasivo | 13 (34,2) |
| Otro | 8 (21) |
| Procedimiento diagnóstico no invasivo | 6 (15,8) |
| Manejo de vía aérea | 6 (15,8) |
| Disfunción gastrointestinal | 4 (10,6) |
| Problema mecánico soporte enteral | 1 (2,6) |
RIC: rango intercuartílico.
El cálculo del GEB se realizó con fórmula de Schofield peso en 39 (29,77%) y Schofield peso-talla en 92 (70,23%) pacientes.
De los pacientes alimentados con nutrición enteral, 24 (21,1%) utilizaron gastrostomía, 76 (66,7%) sonda nasogástrica y 14 (12,3%) sonda nasoyeyunal. Del total, a 67 pacientes (58,8%) se les administró su alimentación en bolo y a 47 pacientes (41,2%) como enteral continua.
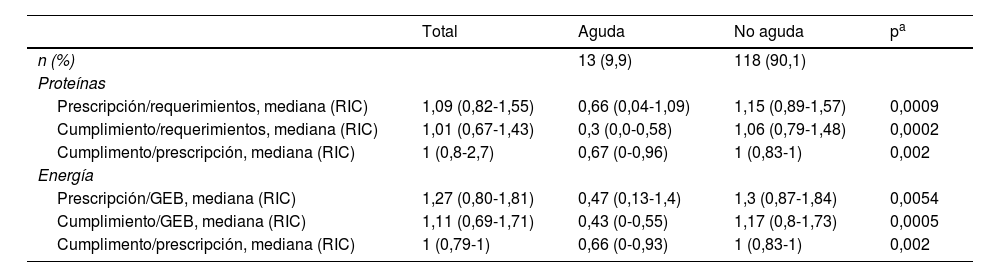
En la tabla 2 se muestran las relaciones entre el GEB, las prescripciones y el cumplimiento para energía y requerimientos de proteínas del total de los pacientes, como también según la fase de la enfermedad. Se encontró un coeficiente de correlación de 0,6 entre P/GEB de energía con prescripción/requerimiento (P/R) proteicos, sin correlación para las otras relaciones requerimiento/cumplimiento (R/C) ni cumplimiento/prescripción (C/P).
Relaciones de requerimientos, prescripciones y cumplimiento de energía y proteínas total y según la fase de la enfermedad
| Total | Aguda | No aguda | pa | |
|---|---|---|---|---|
| n (%) | 13 (9,9) | 118 (90,1) | ||
| Proteínas | ||||
| Prescripción/requerimientos, mediana (RIC) | 1,09 (0,82-1,55) | 0,66 (0,04-1,09) | 1,15 (0,89-1,57) | 0,0009 |
| Cumplimiento/requerimientos, mediana (RIC) | 1,01 (0,67-1,43) | 0,3 (0,0-0,58) | 1,06 (0,79-1,48) | 0,0002 |
| Cumplimento/prescripción, mediana (RIC) | 1 (0,8-2,7) | 0,67 (0-0,96) | 1 (0,83-1) | 0,002 |
| Energía | ||||
| Prescripción/GEB, mediana (RIC) | 1,27 (0,80-1,81) | 0,47 (0,13-1,4) | 1,3 (0,87-1,84) | 0,0054 |
| Cumplimiento/GEB, mediana (RIC) | 1,11 (0,69-1,71) | 0,43 (0-0,55) | 1,17 (0,8-1,73) | 0,0005 |
| Cumplimento/prescripción, mediana (RIC) | 1 (0,79-1) | 0,66 (0-0,93) | 1 (0,83-1) | 0,002 |
GEB: gasto energético basal; RIC: rango intercuartílico.
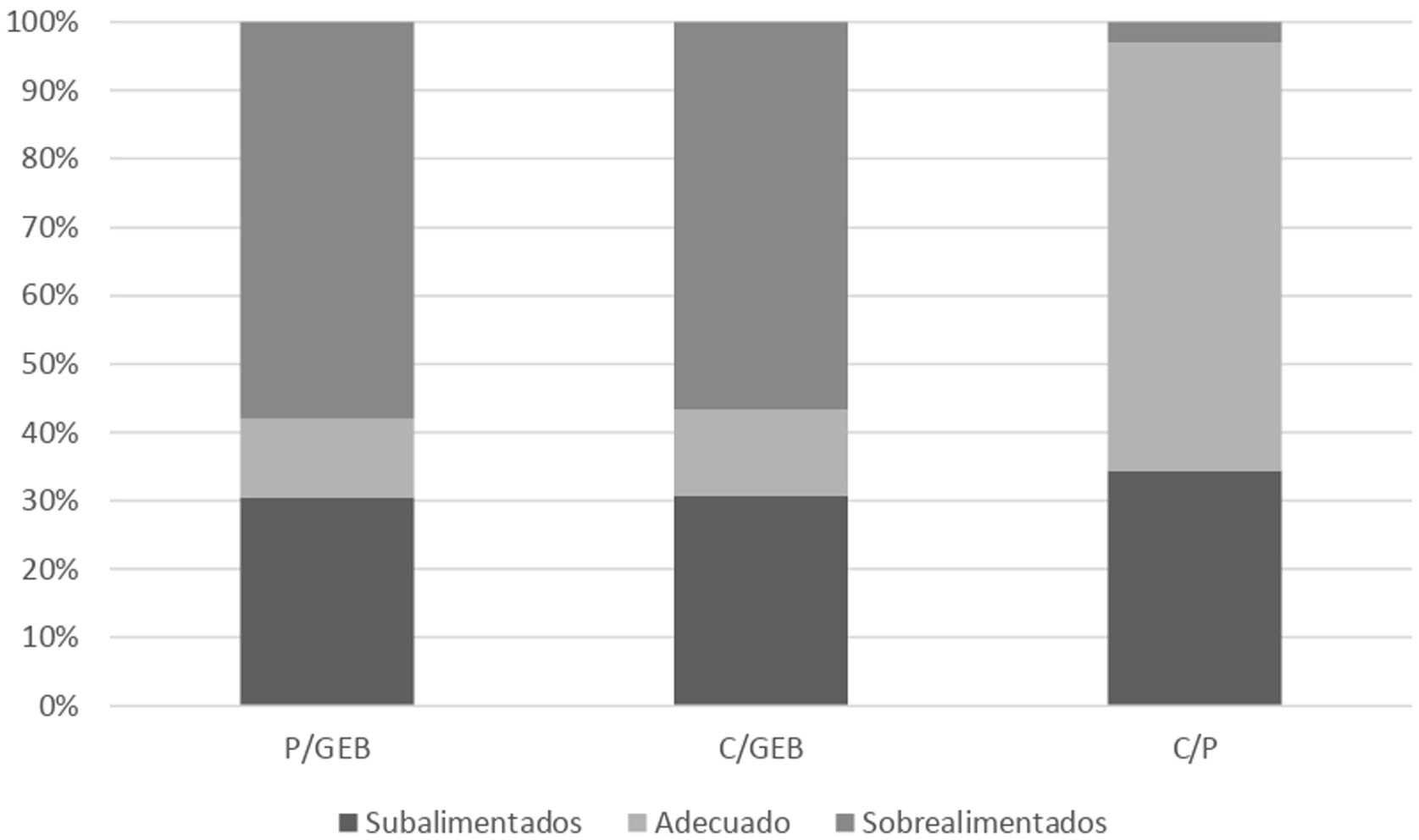
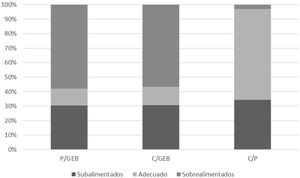
La figura 1 muestra la distribución de la subalimentación, la alimentación adecuada y la sobrealimentación calórica para cada una de las relaciones estudiadas (P/GEB, C/GEB y C/P), mostrando una diferencia estadísticamente significativa (p<0,00001) por una mayor frecuencia de sobrealimentación para todas las relaciones. La tabla 3 muestra esta distribución según la fase de la enfermedad, aguda y no aguda.
Relaciones de requerimiento, prescripción y cumplimiento de energía según la fase de la enfermedad
| Aguda (N=13) | No aguda (N=118) | p | |||||
|---|---|---|---|---|---|---|---|
| <90% | 90-110% | >110% | <90% | 90-110% | >110% | ||
| Prescripción/GEB, n (%) | 9 (69,2) | 0 (0) | 4 (30,8) | 31(26,3) | 15 (12,7) | 72 (61) | 0,007 |
| Cumplimiento/GEB, n (%) | 10 (77) | 0 (0) | 3 (23) | 39 (33) | 16 (13,6) | 63 (53,4) | 0,009 |
| Cumplimiento/prescripción, n (%) | 9 (69) | 3 (23) | 1 (7) | 36 (30,5) | 79 (67) | 3 (2,5) | 0,007 |
GEB: gasto energético basal.
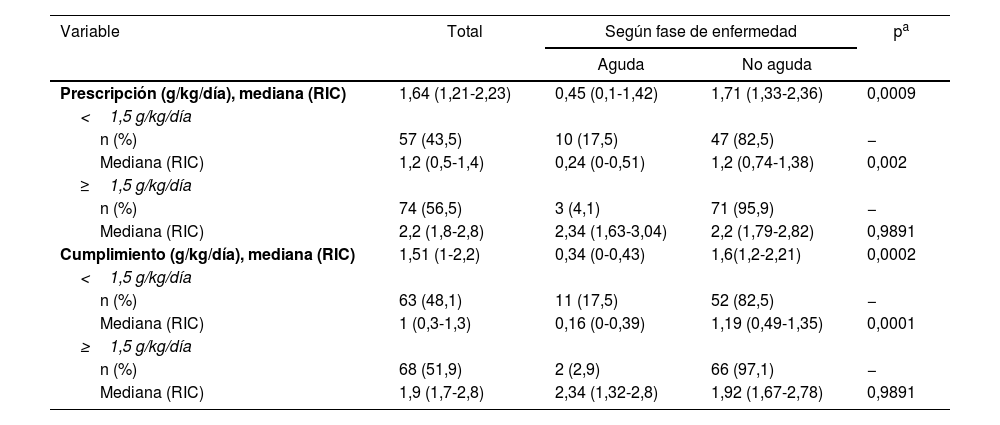
En la tabla 4 se muestra la distribución tanto de la prescripción como del cumplimiento proteico del total de los pacientes, separados por fase de la enfermedad, destacando que el 56,5% del total tenían una prescripción mayor a 1,5g proteína/kg/día y el 51,9% cumplían efectivamente este aporte. Hubo diferencia significativa entre la cantidad de proteína indicada (prescripción) y la administrada (cumplimiento) menor y mayor de 1,5g de proteína/kg/día según la fase aguda y no aguda para la prescripción y la cumplimiento (test de Fisher p=0,016 y p=0,007, respectivamente).
Aporte proteico según la fase de la enfermedad
| Variable | Total | Según fase de enfermedad | pa | |
|---|---|---|---|---|
| Aguda | No aguda | |||
| Prescripción (g/kg/día), mediana (RIC) | 1,64 (1,21-2,23) | 0,45 (0,1-1,42) | 1,71 (1,33-2,36) | 0,0009 |
| <1,5 g/kg/día | ||||
| n (%) | 57 (43,5) | 10 (17,5) | 47 (82,5) | − |
| Mediana (RIC) | 1,2 (0,5-1,4) | 0,24 (0-0,51) | 1,2 (0,74-1,38) | 0,002 |
| ≥1,5 g/kg/día | ||||
| n (%) | 74 (56,5) | 3 (4,1) | 71 (95,9) | − |
| Mediana (RIC) | 2,2 (1,8-2,8) | 2,34 (1,63-3,04) | 2,2 (1,79-2,82) | 0,9891 |
| Cumplimiento (g/kg/día), mediana (RIC) | 1,51 (1-2,2) | 0,34 (0-0,43) | 1,6(1,2-2,21) | 0,0002 |
| <1,5 g/kg/día | ||||
| n (%) | 63 (48,1) | 11 (17,5) | 52 (82,5) | − |
| Mediana (RIC) | 1 (0,3-1,3) | 0,16 (0-0,39) | 1,19 (0,49-1,35) | 0,0001 |
| ≥1,5 g/kg/día | ||||
| n (%) | 68 (51,9) | 2 (2,9) | 66 (97,1) | − |
| Mediana (RIC) | 1,9 (1,7-2,8) | 2,34 (1,32-2,8) | 1,92 (1,67-2,78) | 0,9891 |
RIC: rango intercuartílico.
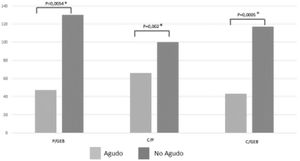
En la figura 2 se comparan los porcentajes de P/GEB, C/P y C/GEB calóricos según la fase de la enfermedad, destacando que se alcanzan relaciones más altas en pacientes no agudos.
Porcentajes de prescripción/gasto energético basal, cumplimiento/prescripción y cumplimiento/gasto energético basal según la fase de la enfermedad.
C/GEB: cumplimiento/gasto energético basal; C/P: cumplimiento/prescripción; P/GEB: prescripción/gasto energético basal.
* Test de Wilcoxon.
Al evaluar variables que influyeron en el cumplimiento de la prescripción energética encontramos que los pacientes con riesgo de desnutrición presentaron con más frecuencia (7/10) subalimentación con respecto a lo prescrito (p=0,001). Por otra parte, los pacientes eutróficos y los pacientes con malnutrición por exceso tienen un cumplimiento de la prescripción del 90-110% (adecuado) con mayor frecuencia (45/73) (p=0,001).
La mayoría de los pacientes agudos (9/13) estaban subalimentados respecto a lo prescrito (<90%). En cambio, en el grupo de pacientes no agudos la mayoría (78/118) presentaron un cumplimiento adecuado (90-110%). Incluso a un número menor (3/118) se les administró más de lo prescrito (>110%) (p=0,007). No se observaron diferencias estadísticamente significativas en frecuencias de pacientes agudos versus no agudos en la causa de la suspensión (p=0,074) ni en el tipo de soporte nutricional (p=0,237).
DiscusiónHay múltiples reportes que indican que en los pacientes ingresados en unidades de cuidados intensivos los requerimientos proteicos y calóricos (C/R y GEB) frecuentemente no logran ser alcanzados durante la fase crítica de la enfermedad18,19,22,24.
En el presente estudio encontramos que tres quintas partes de los pacientes alcanzaron sus GEB y la mitad alcanzaron sus requerimientos proteicos (C/R), siendo mayor aún la relación de cumplimiento de los GEB en los pacientes que se encontraban en fase no aguda de la enfermedad en relación con los agudos, concordante con estudios publicados anteriormente, en los cuales se informa que durante los primeros días de estancia hospitalaria en la unidad de paciente crítico, probablemente cursando la fase aguda de la enfermedad, es más difícil alcanzar el total de los requerimientos23,30,31.
En nuestros resultados destaca que un porcentaje bajo de los pacientes reclutados se encontraba en la fase aguda de la enfermedad, en el contexto de paciente crítico pediátrico.
Al valorar las prescripciones de indicaciones de energía y adoptando el consenso de aportes óptimos en el paciente critico pediátrico, con el gasto energético basal calculado por la fórmula de Schofield8,12, resalta que solo un pequeño porcentaje tenía adecuación energética (P/GEB), siendo para el resto de los pacientes una prescripción sub o sobreestimada, y lo más frecuentemente observado fue sobrealimentación.
Considerando el estado cambiante del metabolismo en fase crítica, cabe destacar que, por sí sola, la fórmula de Schofield no considera la variabilidad del metabolismo posterior a la injuria, sobreestimando los requerimientos de energía, tal como lo describen Mehta et al.32 en un estudio en el cual compararon la medición de calorimetría indirecta con fórmulas de estimación de gasto energético, destacando la sobrestimación de requerimiento por estas fórmulas, debido al hipometabolismo de estos pacientes. Otros estudios, como el de Oosterveld et al.33, no muestran diferencias significativas entre el cálculo del gasto energético en reposo por calorimetría indirecta y por fórmula de Schofield, lo cual nos refuerza el punto anterior, de que se pueden sub o sobreestimar los requerimientos de energía en estos pacientes.
Ahora, al evaluar por fase de la enfermedad, los pacientes en fase aguda tienen una mediana de prescripción que está alrededor de la mitad del GEB (P/GEB), valores similares a lo descrito en trabajos como el de De Jonghe et al17, donde describen en este tipo de pacientes una prescripción del 78% de los requerimientos energéticos, y el de McClave et al.34, quienes describen un porcentaje del 65,6% de los requerimientos estimados.
Como sabemos, la condición de paciente crítico se asocia con catabolismo proteico, lo que trae consigo consecuencias tanto en el aumento de la morbimortalidad asociada como en una mayor dificultad posterior para la recuperación13,35. Al analizar el cumplimiento y la prescripción proteica (P/R) en el total de los pacientes, encontramos que la mayoría de ellos tenían una prescripción y un cumplimiento de esta adecuados a las recomendaciones actuales8,12,13, mayor a lo descrito en otros trabajos; así, Kyle et al.21 describen una ingesta del 40,4% de los requerimientos proteicos, y Wong et al.36 describen valores de tan solo el 13,1% al tercer día de ingreso a la unidad crítica. Cabe destacar la importancia de alcanzar los valores en base a recomendaciones actuales con el fin de evitar malnutrición y balances proteicos negativos37. En pacientes en estado agudo encontramos que el 23% presentaron una prescripción menor a 1,5g/proteína/kg, similar a los trabajos previamente mencionados.
Cuando evaluamos el cumplimiento de las prescripciones de energía (C/P), observamos que un tercio de los pacientes estaban subalimentados, lo cual es menor a lo publicado por De Jonghe et al.17, quienes encontraron una relación de prescripción/cumplimiento del 90,1%, y por Li et al.22, quienes encontraron que esta relación se alcanzaba en el 85%.
Destaca que los pacientes que se encontraban en fase de estrés metabólico agudo solo alcanzaron a cumplir dos tercios de lo indicado en su prescripción nutricional (C/P) tanto energética como proteica. Al evaluar qué variables pudieron influir en esto, encontramos que la mayoría de los pacientes que no alcanzaron una relación de cumplimiento de lo prescrito mayor al 90% tenían el antecedente de suspensiones de su alimentación, siendo los procedimientos invasivos, no invasivos y derivados del manejo de la vía aérea los responsables de más de la mitad de estas. Por otra parte, observamos que la suspensión de la alimentación fue más común en los pacientes que tenían un diagnóstico nutricional de riesgo de desnutrir, sin poder dar una causalidad o una asociación con las variables estudiadas que justifiquen estos resultados. Este hallazgo es importante, ya que estos pacientes estarían más susceptibles a evolucionar con desnutrición.
Estos datos muestran la alta prevalencia de pacientes críticos pediátricos que no alcanzan sus requerimientos, tanto energéticos como proteicos. Los valores obtenidos en esta muestra son superiores a los de otros trabajos descritos en la literatura, lo que nos hace plantear la importancia de implementación de protocolos estandarizados de soporte nutricional en el paciente crítico y su manejo multidisciplinario, los cuales podrían mejorar estos resultados y ser un potencial estudio a futuro24.
Algunas limitaciones de este trabajo son, primeramente, que fue realizado en periodo de pandemia COVID, lo cual cambió la epidemiología de enfermedades agudas en pediatría y, consecuentemente, los motivos de ingreso a la unidad de paciente crítico. Por otro lado, obtuvimos una baja representación de los pacientes en fase aguda; esta definición fue determinada por el cumplimiento de criterios en una lista de chequeo realizada por el equipo de investigación, por no encontrar una que se ajustara a este concepto, lo cual no nos permite comparar si esta baja frecuencia es lo esperable en este tipo de unidades pediátricas. No se obtuvieron los días de hospitalización, de ingreso a la unidad de cuidado crítico o intermedio pediátrica o de soporte nutricional como para dar mayor interpretación de nuestros resultados. Finalmente, otra limitante es que no se comparó con calorimetría indirecta (gold standard) ni con balance nitrogenado para realizar los análisis, lo que podría haber individualizado mejor los requerimientos de cada sujeto. Una fortaleza de este estudio es haber incorporado y relacionado la fase de la enfermedad con la estimación de GEB con la prescripción nutricional y finalmente lo que se pudo cumplir, lo cual es innovador y su descripción aporta mayor comprensión de cuándo, cuánto y cómo realizar un soporte nutricional en un niño en una unidad crítica, tanto por la falta o por el exceso entregado.
ConclusionesEn esta muestra de pacientes en la unidad de cuidado crítico e intermedio pediátrica encontramos que la relación de cumplimiento de la prescripción nutricional comparada con el GEB fue alta en los pacientes que se encontraban en fase no aguda de la enfermedad, siendo más del doble en comparación con los pacientes que se encontraban en fase aguda cuando nos referimos a aporte energético, y más del triple en aportes proteicos. En el caso de los pacientes de fase aguda de la enfermedad, este aporte fue menor.
Con relación a lo anterior, pudimos observar la dificultad para lograr el aporte total de las prescripciones indicadas, siendo una de las principales causas la suspensión frecuente de la alimentación, principalmente asociada a la realización de procedimientos invasivos.
Por otra parte, la sobrealimentación fue frecuente, siendo mayor en la fase no aguda.
Los hallazgos demuestran la dificultad en lograr el equilibrio en el soporte nutricional en el paciente crítico pediátrico, lo que hace necesaria una evaluación constante con parámetros clínicos objetivos que nos orienten a ver el impacto de nuestras prescripciones en relación con el GEB.
FinanciaciónEste trabajo de investigación no contó con ningún tipo de financiamiento.
Conflicto de interesesLos autores no tienen ningún conflicto de intereses que revelar.