Editado por: Fernando Santos-Simarro. Molecular Diagnostic and Clinical Genetics Unit University Hospital Son Espases. Palma de Mallorca. España
Última actualización: Septiembre 2025
Más datosLa medicina genómica ha avanzado significativamente, impulsada por las tecnologías genómicas y su integración en la práctica clínica. Sin embargo, su implementación presenta desafíos, especialmente en el asesoramiento genético (AG) y en la interpretación de datos genómicos. El AG es un proceso de comunicación no directivo que busca ayudar a pacientes y familiares a entender y adaptarse a las implicaciones de un diagnóstico genético. En pediatría, el AG adquiere una relevancia particular, adaptándose a las necesidades de cada etapa del desarrollo infantil. Durante el periodo neonatal, se enfrentan retos en pruebas de cribado y diagnóstico rápido en unidades de cuidados intensivos neonatales. En la infancia, el AG se centra en la comunicación con el paciente menor y su familia, abordando temas éticos complejos como el consentimiento, los estudios predictivos y los hallazgos incidentales. En la adolescencia se plantean retos en relación con su autonomía y la toma de decisiones. La atención multidisciplinar es clave, incluyendo casos sin diagnóstico a lo largo de la conocida «odisea diagnóstica». Este artículo revisa el rol del AG en las diferentes etapas de la atención pediátrica en el contexto de los estudios genómicos actuales.
Genomic medicine has made significant progress, driven by genomic technologies and their integration into clinical practice. However, its implementation presents challenges, particularly in genetic counseling (GC) and the interpretation of genomic data. Genetic counseling is a nondirective communication process aimed at helping patients and families understand and adapt to the implications of a genetic diagnosis. In pediatric care, GC takes on particular importance, adapting to the needs of each child development stage. Challenges arise with genetic newborn screening and rapid tests in intensive care units during the neonatal period. In children, GC focuses on the communication with the young patient and their family, addressing complex ethical issues such as consent, predictive testing and incidental findings. In adolescents, new challenges arise in relation to autonomy and decision-making. Multidisciplinary care is essential, including yet undiagnosed cases still on the journey commonly referred to as the ‘diagnostic odyssey’. This article reviews the role of GC across the stages of paediatric care in the framework of the current evidence on genomics.
Actualmente, lo que conocemos como medicina genómica viene determinado por los grandes avances en las tecnologías, su integración en la práctica clínica y su rol central en la atención médica de los pacientes. Su implementación enfrenta ciertos desafíos, entre los que destacan las dificultades relacionadas con el asesoramiento genético (AG) y la interpretación de los datos genómicos.
El AG se define como un proceso de comunicación no directivo cuya finalidad es ayudar a los pacientes, parejas y familiares que presentan un trastorno genético, a comprender y adaptarse a las implicaciones médicas, psicológicas, reproductivas y familiares de este1. A pesar de que el AG no siempre implica la realización de una prueba genética, el proceso de asesoramiento es una parte fundamental durante la realización de una prueba genética, como el exoma o genoma.
En el entorno pediátrico, distintos aspectos del AG cobran especial importancia y adquieren una dimensión especial que difiere de la atención médica en individuos adultos. Desde el periodo neonatal, pasando por el diagnóstico genético en las etapas de primera y segunda infancia hasta la adolescencia, en este artículo se revisa el papel del AG a lo largo de todas ellas, centrado en la atención dentro de equipos multidisciplinares y en el contexto actual de los estudios genómicos.
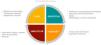
El asesoramiento genético en las etapas de la pediatríaEl proceso de diagnóstico genético en pacientes pediátricos tiene características especiales en cada etapa de su desarrollo, y el papel del AG se adapta a las necesidades particulares de cada momento (fig. 1). Por ejemplo, en el periodo neonatal se plantean retos únicos con las pruebas de cribado, que se dirigen hacia la incorporación de estudios genéticos como primer abordaje, así como en el AG en el proceso de diagnóstico rápido en unidades de cuidados intensivos neonatales (UCIN)2,3. A lo largo de la infancia el proceso de AG se centra principalmente en la comunicación y acompañamiento del paciente menor de edad y sus progenitores/tutores y se adapta a un modelo centrado en la familia (Family Centred Counselling)4. Las necesidades e intereses parentales pueden sumarse o interferir con los del menor, y en ocasiones, temas como el consentimiento/asentimiento, hallazgos no relacionados con el motivo de estudio (hallazgos incidentales o secundarios), y estudios genéticos en casos asintomáticos (estudios predictivos) adquieren una dimensión ética compleja5,6. La comunicación con el paciente pediátrico y adolescente, y cómo las consultas de AG se plantean durante las diferentes etapas, hacen que el rol del asesor genético adquiera una dimensión particular y requiera de conocimientos y habilidades específicas.
Durante estas etapas, la atención multidisciplinar de los equipos integrados por genetistas clínicos, asesores genéticos, gestores de pacientes y otros especialistas es crucial para el diagnóstico y el acompañamiento de las familias.
Etapa neonatalCribado neonatalEl cribado neonatal permite la detección temprana y la identificación de enfermedades tratables en los recién nacidos a partir de un marcador bioquímico, a menudo antes de que los síntomas aparezcan. Se trata de una medida de salud pública de prevención secundaria que permite una intervención rápida para reducir la morbilidad, la mortalidad y las complicaciones potencialmente graves asociadas7. No obstante, existen numerosas enfermedades que no disponen de un marcador bioquímico específico para las que una detección precoz podría cambiar el pronóstico y tratamiento y que podrían ser diagnosticadas mediante un estudio genético.
Durante los últimos años, ha habido iniciativas para incorporar la secuenciación genómica (SG) en los programas de cribado neonatal y su implementación enfrenta ciertos desafíos a nivel médico-asistencial, bioético, social y familiar que deben evaluarse de forma previa a su posible incorporación3,6,8,9. Estudios de investigación a nivel internacional han explorado aspectos relacionados con el posible impacto y las actitudes de los progenitores respecto a la aplicación de la SG en el cribado neonatal, revelando una aceptación de la mayoría de ellos. Sin embargo, existen diferentes preferencias de las familias sobre qué tipos de resultados desearían conocer, desde información de enfermedades de inicio en la infancia prevenibles o tratables hasta enfermedades de inicio en la edad adulta sin tratamiento ni prevención. Muchos de estos proyectos reflejan las inquietudes de los progenitores, reflejan la necesidad de incluir un consentimiento informado previo a la prueba, así como un adecuado AG10–12. Por ello, a día de hoy, todavía son necesarios datos adicionales que exploren el rol del AG en este ámbito, las necesidades de las familias, así como las implicaciones éticas y asistenciales de incorporar la SG en los programas de salud pública.
Diagnóstico rápido en UCINCuando consideramos uno de los primeros momentos claves en los que se puede realizar un diagnóstico genético en un recién nacido, está aquel relacionado con la valoración durante el ingreso en una UCIN. Este escenario particular, en el que hay una alta gravedad y urgencia para la toma de decisiones clínicas, propone distintos retos a la hora de plantear un AG con la familia2,13.
Uno de los elementos importantes en AG para la construcción del vínculo y comunicación (rapport) con el paciente y su familia es cuidar las características del ambiente y ritmo de la consulta. El entorno de una UCIN puede estar muy medicalizado e ir acompañado de interrupciones por otros miembros del equipo clínico. Generalmente, debido a los espacios en los que se realiza la intervención de AG, las conversaciones con la familia pueden tener lugar de pie o al lado de la cama del paciente. Habitualmente, se trata de una interacción rápida, con tiempo limitado para la comunicación y preparación del caso antes de la visita. Este hecho contrasta con la práctica habitual en las consultas de genética, en las que se dedica un mayor tiempo a recopilar información a través de la revisión del historial médico y de la literatura, así como a contactar con los médicos referentes13,14.
Incluso considerando estos factores, se puede conseguir un asesoramiento efectivo mediante modelos de asesoramiento centrado en momentos de crisis o actuaciones rápidas (fig. 2). Es posible que en esa única intervención no se puedan abordar y explorar algunos aspectos psicosociales y emocionales, pero es importante entonces poder establecer un seguimiento en visitas posteriores2,13.
Modelo de asesoramiento genético y valoración psicológica rápida en atención en la unidad de cuidados intensivos. Adaptación de Ayres et al. 2019.13.
En este contexto, durante el proceso diagnóstico se suele realizar un análisis en trío (con muestra del paciente y sus progenitores), que va acompañado de una necesidad de anticipar posibles resultados e implicaciones directas para los progenitores o familiares. Aunque ante una situación de gravedad clínica la prioridad de la familia se centre en realizar un estudio que ayude al manejo de las necesidades del recién nacido, es importante informar de manera adecuada de todas las características y limitaciones de la prueba, así como de la posibilidad de hallazgos incidentales15,16.
InfanciaEl asesoramiento genético en el proceso diagnósticoUno de los aspectos relevantes durante la consulta es la comunicación con el paciente, especialmente cuando se trata de niños/as y/o adolescentes. Ciertas habilidades y consideraciones que son transversales en diferentes áreas de la pediatría se pueden adoptar como herramientas para facilitar el AG. Considerar las diferentes etapas del desarrollo social, cognitivo y emocional (tabla suplementaria) y adaptar tanto las habilidades como las actividades específicas durante las sesiones ayudará en el proceso de comunicación (fig. 3). Algunas de estas habilidades implican la adaptación del lenguaje a la edad y grado de madurez del menor («hablar el idioma del paciente»). Para ello puede ser útil escuchar con atención qué palabras emplea para definir un determinado concepto y utilizar un vocabulario similar. Por otro lado, usar determinadas actividades dentro de la consulta facilitará que el menor pueda compartir información a través del juego o que pueda experimentar y expresar ciertas emociones mediante dibujos o construcciones17. En niños/as con alteraciones del neurodesarrollo es imprescindible tener una sensibilidad y consideraciones especiales. Crear un espacio seguro en la consulta en la que el menor obtenga la suficiente confianza para explorar sus sentimientos y permita mostrarse cómo es facilitará el proceso de AG18.
Habilidades y actividades específicas útiles durante las consultas de asesoramiento genético17.
Durante el proceso de AG el asesor explora las necesidades médicas, psicosociales y emocionales del paciente y su familia. Sin embargo, en el contexto pediátrico, a veces los límites sobre las necesidades de la familia y los del paciente pueden ser difusos. El asesor tiene un papel complejo y esencial en reconocer, validar y responder a las prioridades de los progenitores que, en ocasiones, entran en conflicto con la protección de la autonomía del menor. Parte del proceso de asesoramiento consiste en intentar encontrar el balance entre los aspectos que influyen en los derechos del menor y dar apoyo a las necesidades de la familia. El rapport establecido durante el proceso es crucial para el desarrollo de una buena relación asesor-paciente/familia junto con otros miembros del equipo médico. Este vínculo y relación establecida permitirá un cuidado centrado en la familia efectivo e individualizado a lo largo de la atención del paciente.
En la interacción con menores y adolescentes es importante recordar que no crecen ni toman decisiones sin influencia de su entorno familiar, ya que forman parte de un sistema de relaciones al que impactarán las decisiones y resultados de un proceso diagnóstico. Puede resultar complejo entender la situación del menor sin considerar el contexto en el que se encuentra y sus dinámicas familiares, por ese motivo se intenta pensar en la familia como unidad en la que centrar la atención como profesionales4.
En ocasiones, los deseos de los progenitores al tomar decisiones sobre qué pruebas se realizan a sus hijos/as pueden entrar en conflicto con mantener los estándares de buena práctica clínica en AG19–22. Es común que sientan interés en conocer el estado de portador de sus hijos/as sanos/as, especialmente cuando ya hay un diagnóstico cercano en un familiar. Si bien, generalmente, no se recomienda la realización de estudios genéticos en menores asintomáticos, tiene sentido poder ofrecerlos sólo en los casos de enfermedades de inicio pediátrico en las que hay un beneficio médico en obtener un diagnóstico temprano y existen medidas de intervención. Explorar la motivación de los progenitores para realizar las pruebas, explicar el razonamiento detrás de las recomendaciones profesionales y facilitar un plan para ofrecer pruebas de portador a los hermanos/as cuando puedan tomar una decisión informada puede ayudar a tranquilizarlos. Tener en cuenta la madurez y los deseos del menor, las preocupaciones de los progenitores y las implicaciones para la salud y la reproducción del niño/a serán factores a considerar en el acuerdo que se establezca entre los profesionales y las familias23.
Es importante no olvidar el rol de los hermanos/as y el efecto del diagnóstico genético para ellos. Algunos autores han recogido las experiencias de hermanos/as adolescentes de pacientes con enfermedades minoritarias en las que se resalta el impacto en la construcción de su propia identidad y entre otros los sentimientos de incertidumbre durante el proceso diagnóstico y aspectos sobre el pronóstico futuro24. Los hermanos/as habitualmente son una parte importante y presente durante las visitas clínicas y conversaciones familiares; no atender de manera específica sus dudas o necesidades puede llevar a la malinterpretación y creciente incertidumbre en ellos. Además, durante la adolescencia, y especialmente en la edad adulta, los hermanos/as adoptan generalmente algunas responsabilidades de cuidado y acompañamiento. Parte del rol del asesor genético es capacitar a los progenitores y resaltar la importancia de incluir e informar a los hermanos/as de las implicaciones asociadas a un diagnóstico genético proporcionando el apoyo necesario para atender sus preocupaciones, emociones y dudas25,26.
AdolescenciaLa adolescencia es una fase de transición entre la infancia y la adultez27. Durante esta etapa pueden surgir retos en relación con el desarrollo de la autonomía, las relaciones con sus pares, el comportamiento y la toma de decisiones28,29.
En las consultas de AG con adolescentes, uno de los principales retos es establecer un rapport, así como identificar y valorar adecuadamente su nivel de madurez, cómo involucrarlos en la consulta y cuándo y cómo incluir a sus progenitores18,30.
Aunque pocos estudios se han enfocado en las perspectivas de los adolescentes en este tema, algunos autores han recogido perspectivas de los adolescentes sobre el AG, analizando factores específicos de esta etapa que emergen durante el diagnóstico de una condición genética. Realizar una toma de contacto previa con el adolescente, ofrecer la opción de realizar consultas individualizadas sin la presencia de sus progenitores, respetar su madurez, adaptar el lenguaje para huir de los paternalismos y normalizar el diagnóstico son algunos de los aspectos a considerar durante la práctica clínica31.
El hecho de que los adolescentes perciban una sensación de control y protagonismo en la consulta, decidiendo qué información recibir y quién está presente, ayuda a crear un espacio de confianza que permite la expresión de sentimientos para abordar sus dudas y preocupaciones4. En esta etapa es relevante ser conscientes de su papel como interlocutores principales en la comprensión de la información y en la toma de decisiones. En casos en los que el diagnóstico genético se realiza en la infancia, y probablemente el proceso de AG haya estado dirigido a sus progenitores, será relevante asegurar que se pueda retomar ese AG durante esta etapa adolescente y previo a la adultez.
El consentimiento informadoLa obtención de consentimiento informado (CI) durante el proceso de un estudio genético tiene características e interlocutores distintos a lo largo de las distintas etapas de la atención pediátrica.
El CI no es tan solo un concepto ético y moral sino también legal, y para que sea verdaderamente informado implica que el paciente tenga capacidad de tomar decisiones, que su elección sea voluntaria y que comprenda la información proporcionada. El paciente, o menor de edad, durante la infancia no será la persona que consienta la realización del estudio genético, sino que serán sus progenitores o tutores legales32.
A pesar de este hecho, es importante tener en consideración la opinión y participación del menor a lo largo de todo el proceso de toma de decisión (asentimiento), considerando su madurez en cada etapa de la infancia en la que se lleve a cabo. En España, según el paradigma del menor maduro (12-15 años), deben firmar el CI los progenitores/tutores junto con el asentimiento del menor. Se considera que la mayoría de edad sanitaria se alcanza a los 16 años, de manera que será entonces cuando el paciente pueda ejercer su autonomía mediante la firma del CI33.
La expansión del uso de pruebas genéticas, especialmente la SG, ha traído nuevos retos para los profesionales de la salud con respecto al CI. Esto añade complejidad al proceso ante la posibilidad de hallazgos incidentales y una mayor incertidumbre debido a la identificación de variantes de significado clínico incierto16.
Inevitablemente, la cantidad y complejidad de los resultados genómicos ha aumentado, y esto dificulta poder abordarlos en detalle durante una consulta de AG previa a la realización de la prueba. Una de las principales problemáticas gira en torno a la cantidad adecuada de información y cómo garantizar su comprensión. Aspectos como la reclasificación de variantes, la posibilidad de hallazgos incidentales o secundarios y el circuito de reanálisis de los datos en casos no diagnosticados juegan un papel principal en la conversación previa a la prueba y obtención del consentimiento.
Los asesores genéticos desempeñan un papel crucial al asistir a los pacientes en la comprensión de los resultados, posibles implicaciones, riesgos y beneficios, así como en el acompañamiento en la incertidumbre y complejidad asociada a las pruebas genómicas. La integración de estos profesionales en equipos multidisciplinares es esencial, especialmente ante la emergente incorporación de los estudios genómicos en la práctica clínica34.
Implicaciones de las pruebas genéticas: hallazgos secundarios, incidentales y estados de portadorCon la incorporación de las técnicas genómicas se ha experimentado una creciente detección de hallazgos de significado clínico incierto, estados de portador de enfermedades recesivas, hallazgos secundarios (cribado oportunista de un listado preestablecido de genes con acción preventiva no relacionados con el motivo de estudio) o incidentales (variantes patogénicas inesperadas en genes que no se buscan activamente).
En el contexto pediátrico, la edad de presentación de las enfermedades asociadas a las variantes encontradas, y si son accionables, son clave para establecer criterios de qué variantes se informan y cuáles no. Existen, sin embargo, diferentes posturas por parte de sociedades científicas en el ámbito de la genética alrededor del mundo en relación con la indicación de búsqueda activa de variantes secundarias o criterios para informar hallazgos incidentales y estados de portador de enfermedades recesivas en menores de edad (tabla 1)20,35–40. Actualmente existe poca precisión en relación con el término accionable y la distinción entre hallazgos secundarios e incidentales. La realidad es que, a día de hoy, no existe un consenso a nivel mundial y sigue siendo un tema de gran interés y debate34.
Posicionamientos de diferentes sociedades científicas a los hallazgos incidentales, secundarios y estados de portador en estudios genéticos en menores de edad
| Hallazgos secundarios | Hallazgos incidentales | Estados de portador | |
|---|---|---|---|
| AEGH32(Asociación Española de Genética Humana) | - Reconoce la problemática ética y consenso en rechazar su búsqueda activa- En caso de ofrecerse debe contemplarse en el CI y mediante una consulta de AG pretest | - Variantes patogénicas- Genes accionables en edad pediátrica- Evitar genes de enfermedades de aparición en edad adulta no prevenibles/tratables | - Reportar siempre y cuando se haya anticipado información sobre la posibilidad de este hallazgo- Debe contemplarse en el CI |
| ESHG36(European Society of Human Genetics) | - Recomienda un análisis dirigido a la indicación clínica- Informar de mutaciones en genes de enfermedades de inicio en edad adulta necesita una valoración ética más exhaustiva- Se acepta la búsqueda de variantes asociadas a condiciones de aparición temprana y accionables | - Análisis dirigido para evitar hallazgos incidentales- Se precisan guías para establecer qué hallazgos deberían informarse- Balance entre la autonomía e intereses del menor vs. derecho de los padres y la familia a conocer información beneficiosa para su salud | - La posibilidad de identificar un estado de portador de manera incidental debería anticiparse durante la visita pretest- Opción de los padres a decidir si quieren o no recibir este resultado |
| ACMG37(American College of Medical Genetics) | - Búsqueda activa de una lista mínima de genes (incluyendo de enfermedades de inicio en edad adulta)- Informar de variantes accionables y en genes de alta penetrancia- Misma consideración en adultos y menores- Posibilidad de escoger pretest (opt in/opt out) | - Prevalece el beneficio de informar de variantes accionables para la salud del menor y su familia- Informar de variantes accionables y en genes de alta penetrancia- Posibilidad de escoger pretest (opt in/opt out) | - N/A |
| AGNC38 y BSGM20(Association of Genetic Nurses and Counsellors- UK)(British Society of Genetic Medicine) | - No se debería ofrecer para enfermedades de inicio en edad adulta- En caso de ofrecerse, debería proporcionase AG y posibilidad de escoger en el CI (opt in/opt out)- La lista de genes debería consensuarse por un grupo de expertos | - Reportar en función de si son accionables clínicamente, su penetrancia y clasificación de la variante | - No se recomienda informar de estados de portador |
| SFMPP39(Société Française Médecine Prédictive Personnalisée) | - Queda pendiente el debate en torno a si se acepta la búsqueda activa de genes de predisposición a cáncer- En caso de ofrecerse se propone un modelo de CI en dos pasos (multistep dynamic consent) | - Reportar si son genes accionables- Debe anticiparse esta posibilidad en la visita pretest y durante el CI | - N/A |
| CCMG40(Canadian College of Medical Geneticist) | - No se respalda la búsqueda intencionada de genes no relacionados con la indicación primaria- En caso de ofrecerse debe darse la opción de recibir/no recibir estos hallazgos | - La utilidad clínica de muchos IF está todavía por establecerse- Hasta que se precisen los beneficios de reportarlos, junto con datos empíricos, se recomienda una aproximación cautelosa- Reportar únicamente genes accionables durante la infancia- En los genes de expresión en edad adulta no deben comunicarse a excepción de algunos supuestos | - N/A |
AG: asesoramiento genético; CI: consentimiento informado; N/A: no disponible.
En su documento de recomendaciones, la Sociedad Europea de Genética Humana (ESHG) propone la creación de proyectos e iniciativas que permitan conocer mejor el impacto y percepciones de la posible implementación de un cribado oportunista36.
Existen diferentes estudios realizados al respecto que evalúan el impacto y utilidad de diversos modelos de práctica clínica oportunista en adultos y menores de edad. Diferentes propuestas a modelos de consentimiento y abordaje en la búsqueda de hallazgos secundarios en «dos pasos» o estadios (es decir, tras informar de los hallazgos principales) han sido objeto de algunos proyectos de investigación y han podido contribuir a aportar experiencia y conocimiento a considerar en la revisión de recomendaciones y protocolos futuros de las sociedades científicas41,42.
Ante este contexto, el asesoramiento previo y posterior a la prueba genómica por parte de profesionales especializados es esencial y cobra especial importancia para cualquier paciente que realice una prueba genética.
ConclusiónLa incorporación de la medicina genómica en la práctica clínica supone nuevos retos debido al aumento de la complejidad en la interpretación e implicaciones de las pruebas genéticas. Debido a esto, es importante contar con equipos multidisciplinares, incluyendo a asesores genéticos, dedicados a la atención del paciente pediátrico, que acompañen en la toma de decisiones y en la comunicación con el paciente y su familia.
FinanciaciónNo existe financiación.
Conflicto de interesesNo existe conflicto de intereses.