El objetivo fue evaluar la concordancia entre las pruebas de imagen, la ecografía prenatal y la TC posnatal empleadas en el diagnóstico de malformaciones pulmonares congénitas (MPC) y el estudio anatomopatológico (AP).
Material y métodosEstudio retrospectivo de pacientes diagnosticados prenatalmente de MPC en los que se realizó seguimiento posnatal incluyendo una TC y un estudio AP de la lesión. Las variables estudiadas incluyeron: datos demográficos, edad gestacional al diagnóstico, hallazgos ecográficos y existencia de gestación múltiple. Utilizamos el coeficiente estadístico Kappa para establecer la concordancia entre la ecografía y las pruebas postnatales (TC y AP). Se analizaron de forma pareada la presencia de lesiones, la localización, el tipo y el tamaño, y la presencia de vascularización sistémica.
ResultadosSe incluyeron 56 pacientes con 57 lesiones. La edad gestacional media al diagnóstico fue 22,42±3,94 semanas y el 57% fueron varones. El pulmón izquierdo y los lóbulos inferiores fueron los más afectados. La concordancia entre TC y AP en la detección de lesiones quísticas fue moderada (Kappa=0,55) pero más relevante que la detectada entre ecografía y AP (Kappa=0,10), siendo discreta entre ambas pruebas de imagen. La concordancia TC/AP fue sustancial (Kappa=0,66) en la detección de vascularización sistémica de la lesión y superior a la determinada entre ecografía y AP. Ambas pruebas de imagen demostraron una precisión muy buena en la identificación de la localización de las lesiones.
ConclusionesLa TC posnatal ofrece una concordancia sustancial con el estudio histológico, especialmente en la detección de vascularización, y nos aporta datos predecibles sobre la anatomía de la lesión.
The aim of this study was to evaluate the accuracy of imaging tests (prenatal ultrasound [US] and postnatal computed tomography [CT]) in comparison to histology for diagnosis of congenital lung malformations (CLMs).
Material and methodsRetrospective study of patients with a prenatal diagnosis of CLM whose postnatal followup included thoracic CT scan and histological examination of the lesion. We collected data on demographic variables, gestational age at diagnosis, US findings and the history of multiple gestation. We used the kappa coefficient to determine the level of agreement between the findings of prenatal US and postnatal tests (CT and histology). We analysed paired data on the size of the lesion, its location and the presence or absence of systemic arterial vascularization.
ResultsThe sample included 56 patients with 57 lesions. The mean gestational age at diagnosis was 22.42 weeks (SD, 3.94) and 57% were male. Malformations most frequently involved the left lung and the lower lobes. The agreement between CT and histology in the detection of cystic lesions was moderate (κ=.55) but stronger compared to the agreement between US and histology (κ=.10). The agreement between CT and histology was substantial (κ=.66) in the detection of systemic vascularization of the lesion and stronger compared to the agreement between US and histology. Both imaging methods were highly accurate in the identification of the location of the pulmonary lesions.
ConclusionsPostnatal CT offers a substantial concordance with histological findings, especially in the detection of systemic vascularization, and an accurate prediction of the anatomy of the lesion.
Las malformaciones pulmonares congénitas (MPC) constituyen un grupo heterogéneo de alteraciones del desarrollo pulmonar, con una incidencia que varía entre 1/2.500 y 1/27.400 recién nacidos vivos1–4. En ellas se incluyen las malformaciones congénitas de la vía aérea pulmonar (MCVAP), el secuestro pulmonar intralobar (SIL) y extralobar (SEL), la hiperinsuflación lobar congénita (HLC), el quiste broncogénico (QB) y la atresia bronquial (AB)1,2,5–8. La anomalía más frecuente es la MCVAP, que supone aproximadamente el 95% de todas las MPC, y su incidencia se estima entre 1-5/10.000 nacimientos9,10. La presentación clínica de las MCVAP es muy variada, desde la presencia de pequeñas lesiones pulmonares que permanecen asintomáticas hasta grandes quistes que pueden provocar un distrés respiratorio grave desde el nacimiento11.
Debido a la implementación generalizada del cribado prenatal mediante ecografía, la incidencia de MPC ha aumentado de forma significativa en las dos últimas décadas, a expensas fundamentalmente de la detección precoz de los casos asintomáticos8. Paralelamente, ha ido surgiendo la controversia acerca del tratamiento más adecuado en los pacientes con malformaciones subclínicas. Por un lado, existe la opción de cirugía electiva (antes de los 2años de vida), sustentada por el mayor riesgo de infecciones respiratorias, neumotórax y eventual malignización en algunos casos, así como una mejor y más rápida recuperación postoperatoria12,13. Por el contrario, también existe cierta evidencia a favor de una actitud conservadora basada en el seguimiento clínico-radiológico a largo plazo y justificada por el grado de desconocimiento actual sobre la evolución natural de estas malformaciones y su posible regresión, documentada hasta en el 15% de los casos14. A esto habría que añadir los riesgos asociados a un procedimiento quirúrgico mayor consistente en una toracotomía o toracoscopia con resección pulmonar11–18. En este contexto, son muy relevantes la precisión y la precocidad en el diagnóstico de las MPC para poder instaurar el tratamiento perinatal más adecuado en estos pacientes y ofrecer a las familias una información detallada y basada en la evidencia disponible8. La ecografía es la técnica diagnóstica principal para la detección prenatal de las MPC por ser una prueba segura, reproducible, ampliamente disponible y de bajo coste. En caso de duda diagnóstica puede recurrirse a la resonancia magnética fetal6,8,10,12,19. Ante un diagnóstico de MPC en período prenatal se recomienda la realización precoz de una tomografía computarizada (TC) torácica durante el primer mes de vida en el caso de lesiones grandes, bilaterales, quistes multifocales o si el recién nacido desarrolló un neumotórax. Generalmente esta prueba se difiere hasta los 6-8meses de vida en pacientes asintomáticos sin las características anteriores2,6,12.
El objetivo de este trabajo es evaluar el grado de concordancia entre las técnicas de imagen empleadas para el diagnóstico de las MPC en periodo prenatal (ecografía) y posnatal (TC torácica), y el estudio anatomopatológico (AP). De esta forma, pretendemos determinar su precisión para la caracterización de las lesiones definitorias de MCP tomando como referencia la histología, considerada el gold standard para el diagnóstico definitivo de las mismas. La hipótesis de trabajo es que los hallazgos obtenidos mediante ecografía prenatal en las MPC se corresponden de forma muy fiable con aquellos mostrados en la TC torácica posnatal, siendo eventualmente innecesaria la realización de este examen en el neonato o en el lactante asintomático.
Material y métodosDiseño del estudioSe realizó un estudio retrospectivo, a partir de una base de datos recogida de forma prospectiva, de pacientes diagnosticados de algún tipo de MPC en periodo prenatal, entre junio de 2005 y julio de 2020, en un hospital de referencia de tercer nivel. Los datos del estudio se recopilaron y gestionaron mediante las herramientas de captura de datos electrónicos Research Electronic Data Capture (REDCap) de nuestro centro. REDCap es una aplicación segura basada en la web y diseñada para respaldar la recopilación de información para estudios de investigación. Esta herramienta es muy útil, ya que proporciona: 1)una interfaz intuitiva para la entrada de datos validados; 2)pistas de auditoría para rastrear la manipulación de datos y los procedimientos de exportación; 3)procedimientos de exportación automatizados para descargas de datos sin interrupciones a paquetes estadísticos comunes, y 4)procedimientos para importar datos de fuentes externas20. Se analizaron los pacientes con un diagnóstico prenatal de MPC en los que se había efectuado un seguimiento clínico posnatal, incluyendo la realización de una TC. Aquellos pacientes con diagnóstico prenatal de MPC sin seguimiento posnatal, o sin TC, fueron excluidos del estudio. Este trabajo fue aprobado por el Comité de Ética e Investigación de nuestra institución (código 21/393) y todos los pacientes estudiados contaron con un consentimiento informado de los padres para la cirugía y para la toma de material video-fotográfico.
Protocolo diagnóstico y recogida de datosEl diagnóstico prenatal se realizó mediante ecografía con equipos de alta resolución: Siemens Antares; General Electric Voluson E8 y E10 Expert ultrasound machine. Para el diagnóstico posnatal se realizó una TC helicoidal con contraste intravenoso bajo anestesia general. Hasta 2010 se empleó un equipo Toshiba Xpress/ex Aspire con 1detector, y una técnica de 120mA y 80Kv con medidas de protección externa. Posteriormente, se utilizó un equipo Brilliance CT 64 slice (Philips Medical Systems) con 64 detectores y una corriente del tubo fijada en 100mA, y técnica de modulación de dosis sin medidas de protección externa.
Todos los pacientes pertenecientes a la muestra fueron diagnosticados prenatalmente con ecografía de algún tipo de MPC por especialistas en medicina fetal del Servicio de Ginecología y Obstetricia de nuestro hospital. Los datos fueron recogidos a partir de los informes de las exploraciones. Las variables prenatales estudiadas incluyeron: datos demográficos, edad gestacional al diagnóstico, hallazgos ecográficos y la existencia de gestación múltiple. Los pacientes con un diagnóstico prenatal de MPC fueron controlados en el periodo posnatal por especialistas del Servicio de Cirugía Pediátrica. A todos ellos se les realizó una TC torácica, habitualmente entre el tercer y el octavo mes de vida. En los pacientes con lesiones sugerentes de malignidad en la ecografía prenatal (MCVAP tipoIV o blastoma pleuropulmonar según la clasificación de Stocker)9, sintomatología respiratoria relevante o neumotórax en el periodo neonatal, la TC se realizó de manera precoz durante el primer mes de vida. Los estudios de imagen fueron revisados durante el reclutamiento de datos por una radióloga experta en este tipo de malformaciones. Los hallazgos comunes obtenidos en ambas pruebas de imagen (ecografía prenatal y TC posnatal) fueron: existencia de quistes, tamaño y localización de los mismos, presencia de vascularización sistémica de la lesión, y la impresión diagnóstica obtenida con cada técnica.
En los pacientes intervenidos quirúrgicamente, el estudio anatomopatológico (AP) inicial de las lesiones pulmonares fue realizado por diferentes patólogos del hospital. Sin embargo, para la elaboración de este trabajo se revisaron de nuevo todos los cristales por un patólogo especialista en la materia. Hemos considerado el análisis histológico como patrón de referencia (gold standard) a la hora de establecer un diagnóstico definitivo del tipo de MPC. Los pacientes no intervenidos, y consecuentemente sin AP, fueron excluidos del estudio final.
Para la tipificación de las malformaciones pulmonares se usó la clasificación más reciente de Stocker9.
Análisis estadísticoEl objetivo de este análisis fue determinar la capacidad de obtener un mismo resultado con pruebas diagnósticas diferentes. Para ello se recurrió al coeficiente estadístico Kappa, que permitió realizar un análisis de la concordancia entre las técnicas prenatales (ecografía) y posnatales (TC y AP). Se evaluaron la presencia de quistes, la localización de las lesiones, la existencia de vascularización sistémica y el diagnóstico de presunción. Este análisis se realizó de manera pareada: ecografía vs TC; ecografía vs AP; TC vs AP. En el análisis de concordancia se emplearon variables cualitativas nominales, utilizando el coeficiente estadístico Kappa simple en caso de variable cualitativa dicotómica y Kappa ponderado en los casos de variables cualitativas no dicotómicas. Para su interpretación hemos utilizado los siguientes intervalos:
- •
Kappa 0,00-0,20: concordancia pobre.
- •
Kappa 0,20-0,40: concordancia discreta.
- •
Kappa 0,40-0,60: concordancia moderada.
- •
Kappa 0,60-0,80: concordancia sustancial.
- •
Kappa 0,80-1,00: concordancia muy buena.
Se consideraron resultados significativos aquellos con una p<0,05 y un IC del 95%. Todos los análisis estadísticos fueron realizados utilizando el software SAS©, versión 9.4 del sistema SAS para Windows.
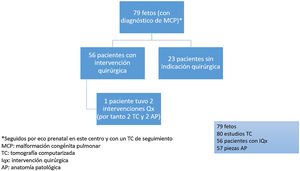
ResultadosSe diagnosticaron un total de 79 fetos con MPC, de los que 56 (70,8%) se sometieron a intervención quirúrgica posnatal; el resto de los pacientes no tenían indicación de cirugía (fig. 1). Se obtuvieron 57 lesiones para estudio histológico, ya que un paciente presentaba una MPC bilateral que requirió dos intervenciones de forma asíncrona. La edad gestacional media al diagnóstico prenatal fue de 22,42±3,94 semanas, y el 57% (45/79) fueron varones. Las lesiones macroquísticas, con un tamaño mayor de 5mm, han sido las más frecuentes en nuestra serie (45,5%). En cuanto a su localización, determinada por ecografía prenatal, el pulmón izquierdo (54,4%; 43/79) y los lóbulos inferiores (74,6%; 59/79) fueron los más afectados. El conjunto de datos demográficos y hallazgos prenatales se describen en la tabla 1.
Datos demográficos y prenatales
| Varones | 45 |
| Detección 2.° trimestre | 65a |
| Detección 3.ertrimestre | 13a |
| Edad gestacional al nacimiento (mediana) | 39 |
| Peso al nacimiento (mediana) en kg | 3,2 |
| Gestación múltiple | 4 |
| Anomalías prenatales | 13 |
| Desplazamiento mediastínico | 35 |
| Derrame pleural | 5 |
| Shunt toracoamniótico | 3 |
| Hidrops | 1 |
| Polihidramnios | 3 |
| Amniodrenaje | 1 |
| Macroquísticas | 36 |
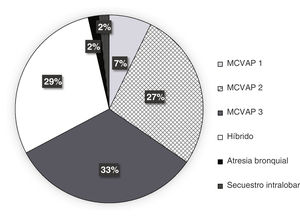
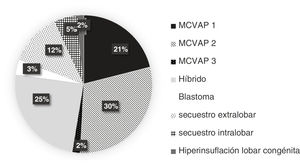
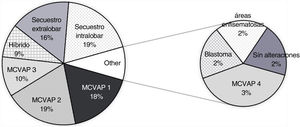
La distribución y la frecuencia de cada tipo de lesión, dependiendo de la prueba diagnóstica realizada, se exponen en las figuras 2-4. Globalmente, la mayoría de malformaciones detectadas fueron del tipo MCVAP tanto en la ecografía como en la TC. Con menor frecuencia, se identificaron lesiones híbridas MCVAP/secuestro (25%), secuestro pulmonar extralobar o intralobar (12% y 5%, respectivamente) e hiperinsuflación lobar congénita (2%) (figs. 2 y 3).
La concordancia entre las tres pruebas diagnósticas se hizo en base a las siguientes variables:
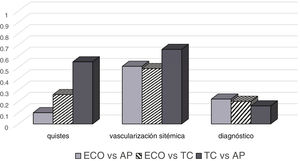
QuistesEl estudio de concordancia en la detección de lesiones quísticas ofreció unos resultados de concordancia pobre (índice Kappa 0,10) entre la ecografía prenatal y el estudio AP. Por otra parte, se identificó una concordancia moderada (Kappa 0,55) entre TC y AP. La concordancia entre las dos pruebas de imagen, ecografía y TC, fue discreta (Kappa 0,26) (fig. 5). La sensibilidad y la especificidad para la detección de quistes mediante ecografía fueron del 100% y del 9%, respectivamente. En cuanto a la TC, la sensibilidad fue del 100% y la especificidad del 50%.
LocalizaciónLa concordancia entre ecografía y TC respecto a la lateralidad de las lesiones fue muy buena. El índice Kappa simple para localización en pulmón derecho fue de 0,92 (IC95%: 0,8314-1,0), y de 0,96 (IC95%: 0,8947-1,0) para el izquierdo (p<0,0001). En las malformaciones bilaterales (n=2) la concordancia entre ambas pruebas fue perfecta (índice Kappa1). En un análisis más pormenorizado por lóbulos pulmonares, la concordancia para el lóbulo superior derecho fue de 0,34, para el lóbulo medio de 0,03, y el lóbulo inferior derecho mostró la mayor concordancia (Kappa 0,80). En el pulmón izquierdo, el lóbulo superior presentó un índice Kappa de 0,50 y en el lóbulo inferior fue más sustancial (0,74).
Vascularización sistémicaLa concordancia entre ecografía/AP y ecografía/TC en la detección de irrigación arterial sistémica fue moderada (Kappa 0,51 y 0,49, respectivamente). Esta fue mayor en la comparación entre TC y AP (Kappa 0,66) (fig. 5). La sensibilidad fue del 60% y la especificidad del 89% para la detección vascularización sistémica mediante ecografía prenatal. En el caso de la TC, la sensibilidad fue del 85% y la especificidad del 84%.
Diagnóstico de presunción por imagenTeniendo en cuenta la existencia de cierta disparidad en el número de posibles diagnósticos dependiendo de cada prueba (6 en ecografía, 8 en TC y 10 en AP; tabla 2), hemos encontrado una concordancia pobre entre el diagnóstico por TC y el definitivo por AP (Kappa 0,16). En la comparación entre ecografía/AP y ecografía/TC la concordancia fue discreta: Kappa 0,22 y 0,20, respectivamente (fig. 5).
Distribución de los diagnósticos según los diferentes estudios
| AP | Ecografía | TC |
|---|---|---|
| 10 MCVAP 1 | 1 Hib, 2 MCVAP1, 5 MCVAP2, 2 MCVAP3 | 5 MCVAP2, 5 MCVAP1 |
| 1 blastoma | MCVAP3 | MCVAP / blastoma |
| 11 MCVAP2 | 1 Hib, 1 MCVAP1, 2 MCVAP2, 6 MCVAP3, 1 ND | 1 Hib, 3 MCVAP1, 7 MCVAP2 |
| 6 MCVAP3 | 1 Hib, 3 MCVAP2, 2 MCVAP3 | 2 Hib, 1 MCVAP1, 1 MCVAP2, 1 MCVAP3, 1 MCVAP / blastoma |
| 2 MCVAP4 | 1 MCVAP1, 1 MCVAP2 | 2 MCVAP1 |
| 5 Hib | 1 Hib, 1 MCVAP2, 2 MCVAP3, 1 ND | 4 Hib, 1 MCVAP2 |
| 9 SEL | 7 Hib, 1 SIL, 1 MCVAP3 | 7 SEL, 2 SIL |
| 11 SIL | 4 Hib, 3 MCVAP2, 4 MCVAP3 | 7 Hib, 1 SIL, 1 MCVAP1, 2 MCVAP2 |
| 1 Sin alt. | 1 Hib | 1 MCVAP2 |
| 1 área enfisema | 1 atresia bronquial | 1 HLC |
Hib: lesión híbrida; HLC: hiperinsuflación lobar congénita; MCVAP: malformación congénita de la vía aérea pulmonar; ND: sin datos; SEL: secuestro extralobar; SIL: secuestro intralobar; sin alt.: sin alteraciones.
Hemos obtenido unos resultados globales discretos en la concordancia entre el diagnóstico por imagen (ecografía prenatal/TC posnatal) y la AP. La concordancia ha sido mejor cuando se ha analizado la vascularización arterial sistémica, especialmente entre TC y AP, y cuando se agrupaban los posibles diagnósticos. La aplicación del índice Kappa para determinar la concordancia entre las pruebas de imagen y el diagnóstico histológico es una aportación novedosa de nuestro trabajo. A diferencia de otros recursos estadísticos, el coeficiente Kappa permite la comparación de forma pareada y nos ofrece una información más precisa de la fiabilidad de cada prueba en las variables analizadas. El uso de esta nueva herramienta puede ser en parte responsable de las diferencias encontradas con otros autores8,21.
Resulta evidente la dificultad en proporcionar diagnósticos de presunción con técnicas de imagen, pero basados en criterios histológicos. Por ese motivo, Farrugia et al.21 propusieron una clasificación de las MPC fundamentada en criterios puramente anatómicos (naturaleza de la lesión, vascularización arterial y drenaje venoso) con la finalidad de reducir las discrepancias entre los hallazgos radiológicos, intraoperatorios y anatomopatológicos. En nuestro estudio hemos seguido un criterio similar, ya que si se disgregaban en exceso las variables y los posibles diagnósticos histológicos, la correlación entre las pruebas de imagen y el resultado AP corría el riesgo de ser muy poco relevante. Además del tipo de lesión (quística o sólida) y su eventual vascularización arterial sistémica, hemos añadido otras variables, como la localización y el diagnóstico de presunción. De esta manera, hemos obtenido una concordancia moderada TC/AP en la detección de lesiones quísticas (Kappa 0,55) y mucho menor entre ECO y AP (Kappa 0,10). La concordancia entre las dos pruebas de imagen fue discreta en este apartado (0,26). La concordancia correspondiente a TC/AP fue sustancial (Kappa 0,66) en la detección de vascularización sistémica de la lesión y, de nuevo, superior a la observada entre ecografía y AP. Ambas pruebas de imagen demostraron una precisión muy buena en la identificación de la localización de las lesiones. Disgregando por lóbulos pulmonares, la mejor concordancia se encontró en los inferiores, especialmente en el lóbulo inferior derecho. Sin embargo, la concordancia ecografía/AP no pasó de discreta cuando se analizó el diagnóstico de presunción. La concordancia fue incluso más baja entre TC y AP (Kappa 0,16), lo que puede resultar contradictorio con los resultados obtenidos relativos al tipo de lesión y su vascularización. Creemos que la dispersión de los diagnósticos, hasta 10 en AP y 8 en TC, puede explicar que este valor fuese tan irrelevante e incluso inferior al de ecografía/AP, donde solo se evaluaron 6 posibles diagnósticos.
Es obvio que las pruebas de imagen son fundamentales en la detección y la descripción de las lesiones pulmonares y en el establecimiento de un diagnóstico de presunción. El diagnóstico por imagen de las MPC ha mejorado sustancialmente en los últimos años, permitiendo una detección más temprana, habitualmente entre las semanas 18 y 22 de gestación6,21. La mayoría de estos pacientes diagnosticados prenatalmente tienen una buena evolución en el período perinatal15. No obstante, la aparición de complicaciones como polihidramnios, hidrops o desplazamiento mediastínico en el 10% de los casos y, por otra parte, la existencia de hasta un 45% de lesiones sintomáticas tras el nacimiento, hacen que el control ecográfico durante la gestación sea indispensable, ya que permite una adecuada planificación del parto y de la atención perinatal21. En nuestra experiencia, 7 pacientes (12,5%) se operaron por presentar sintomatología (3 patología infecciosa y 4 respiratoria).
La mayoría de las lesiones pulmonares detectadas tanto por ecografía prenatal como por TC posnatal se clasificaron como MCVAP (figs. 2 y 3), como ocurre en la mayoría de las series publicadas6,8,12. En cuanto al diagnóstico histológico, nuestro trabajo ofrece también una distribución muy similar a la encontrada en la literatura, siendo la malformación más frecuente el tipo MCVAP, seguido de secuestro pulmonar y de las malformaciones híbridas22 (fig. 4). Las MCVAP incluyen un espectro de anomalías que van desde lesiones quísticas de diferente tamaño hasta masas sólidas de tipo adenomatoideo9. Se ha demostrado que las lesiones con quistes grandes (>2cm) pueden malignizar con el paso del tiempo, siendo especialmente relevante la posible transformación en blastoma pleuropulmonar (BPP) de la lesión tipo4 de Stocker con grandes quistes multiloculares9. En nuestra serie, dos pacientes presentaron lesiones sospechosas de BPP, y uno fue confirmado histológicamente. Se han identificado ciertos factores de riesgo de BPP, como la presentación con neumotórax junto con quistes de gran tamaño multifocales y bilaterales1. En este sentido, tiene especial relevancia la muy buena concordancia demostrada en nuestro estudio entre ecografía prenatal y TC posnatal en la identificación de la localización y la bilateralidad de las lesiones. Además, hemos observado un predominio de las MPC en el pulmón izquierdo y en los lóbulos inferiores, similar a lo publicado recientemente6,15. Este hecho podría explicarse por la afectación mayoritaria de los lóbulos inferiores en algunas de las entidades más frecuentes, como son las MCVAP y los secuestros broncopulmonares (fig. 6).
Este estudio tiene algunas limitaciones, como su naturaleza retrospectiva y el tratarse de una cohorte con un número de casos relativamente reducido. Por otra parte, aunque la revisión ulterior de las ecografías prenatales no fue posible, sí lo fue en el caso de los diagnósticos realizados con TC posnatal (revisión posterior por radióloga experta sin conocimiento de la AP) y en el diagnóstico histológico (revisión por patóloga experta de las muestras para estudio microscópico).
En conclusión, el grado de concordancia entre la ecografía prenatal y la AP dista mucho de convertir esta prueba de imagen como la única para la toma de decisiones terapéuticas en el periodo perinatal y posnatal en los pacientes diagnosticados de MPC. Por otra parte, la TC posnatal ofrece una concordancia sustancial con el estudio histológico, especialmente en la detección de vascularización sistémica, y nos aporta datos predecibles sobre la anatomía y la localización de la lesión. Los datos aportados por la TC pueden ser muy útiles en la planificación de la cirugía, tanto urgente como electiva, que se deberá realizar en aquellos pacientes sintomáticos o con lesiones sospechosas de malignidad12,23.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Agradecemos la colaboración en el apartado estadístico de Carmen Romero Ferreiro, y a la Dra. María Enery Gómez Montes por facilitarnos material fotográfico.