Introducción
El síndrome nefrótico congénito tipo finlandés (SNCF) es una enfermedad de base genética, con una herencia autosómica recesiva, causada por la mutación del gen de la nefrina (NPHS1)1, localizado en el cromosoma 19q12-13.1. La nefrina es una proteína transmembrana del podocito que desempeña un papel fundamental en la barrera de filtración glomerular. En la población finlandesa se han descrito 2 mutaciones de este gen, conocidas como Fin-major y Fin-minor, aunque un 6 % de los pacientes pueden presentar otras. En el resto de la población son raras estas mutaciones 2.
Se manifiesta con proteinuria masiva, que conduce a la formación de edema generalizado y posteriormente ascitis en las primeras semanas de vida. Puede sospecharse en el período prenatal por la presencia de niveles elevados de a -fetoproteína en el líquido amniótico a partir de la semana 15, junto con niveles normales de colinesterasa, y en el nacimiento ante la asociación de prematuridad y de una placenta grande, con un peso superior al 25 % del peso del recién nacido.
Los datos de laboratorio son la proteinuria masiva (1-6 g/24 h), inicialmente selectiva (> 90 % albúmina), hipoalbuminemia (< 1 g/dl) e hiperlipidemia. Otros hallazgos consisten en hipogammaglobulinemia, hipotiroidismo, hiponatremia, hipocalcemia y el aumento de fibrinógeno, tromboplastina y factores de coagulación. El diagnóstico se puede confirmar por biopsia renal, que muestra las características dilataciones quísticas de los túbulos contorneados proximales.
La principal complicación en el SNCF es la infección repetida, especialmente por bacterias encapsuladas, debido a la pérdida de factores del complemento e inmunoglobulinas. La inmunidad celular está conservada 3. Otras complicaciones son el retraso del crecimiento y el retraso psicomotor. Ocasionalmente se asocia a malformaciones cardíacas 4.
El tratamiento del SNCF es complejo, debido a la falta de respuesta a esteroides e inmunosupresores. La función renal se deteriora en los primeros años de vida. Si no se aplica tratamiento alguno, la mayoría de los pacientes fallecen antes de los 2 años. En la última década esta situación ha mejorado al establecerse un tratamiento intensivo dividido en 3 fases: en primer lugar, se procede al soporte nutricional agresivo, con un adecuado suplemento proteicocalórico, y se utilizan fármacos que disminuyen la proteinuria 5, como la indometacina y los inhibidores de la enzima conversora de la angiotensina (IECA). Durante esta fase se emplean además antiagregantes plaquetarios, hormonas tiroideas y medidas hipolipemiantes. La administración parenteral de albúmina se reserva para las situaciones de descompensación clínica con edemas graves.
Cuando el control del paciente no se consigue con estas medidas, se realiza una nefrectomía, unilateral o bilateral, seguida del inicio de la diálisis. Por último se realiza el trasplante renal, que se considera curativo del SNCF.
Los objetivos del presente estudio son: a) determinar la repercusión de las distintas medidas terapéuticas empleadas en los pacientes afectados de SNCF en nuestro hospital, utilizando parámetros clínicos y analíticos; b) conocer las complicaciones más comunes en los períodos de prediálisis, diálisis y trasplante; c) cuantificar el crecimiento de estos niños en las distintas fases de la enfermedad, y d) evaluar la hospitalización en función del tratamiento recibido.
Pacientes y método
Estudio epidemiológico descriptivo retrospectivo en el que se analizan las historias clínicas de 12 pacientes diagnosticados de SNCF en Andalucía y tratados en el Servicio de Nefrología Pediátrica del Hospital Universitario Virgen del Rocío entre enero de 1985 y agosto de 2005. Los pacientes incluidos en el estudio fueron niños menores de 14 años que en el período neonatal presentaron proteinuria grave con hipoalbuminemia (< 1 g/l), edema generalizado, peso de la placenta superior a 25 % del peso al nacer, filtrado glomerular normal en los primeros 6 meses, y en los que se descartaron otras causas de síndrome nefrótico congénito 6. Los datos recogidos fueron edad al diagnóstico, sexo, patologías asociadas, datos clínicos, medidas antropométricas, pruebas complementarias, tratamientos, medidas de soporte nutricional, complicaciones, función renal, hospitalización y evolución.
Los datos fueron analizados mediante el programa estadístico SPSS. 12.0. Las variables se han presentado como mediana y rango intercuartílico (IQ), ya que el reducido número de pacientes estudiados no asegura que las variables sigan una distribución normal. Los procedimientos utilizados han sido aprobados, mediante consentimiento informado, por los padres de los pacientes.
Resultados
Datos clínicos iniciales
El diagnóstico se realizó en una mediana de 17 días (rango IQ: 6-30). En los 12 pacientes que componían la muestra no hubo predominio de género, con una relación varón/mujer de 1:1. Los datos que orientaron el diagnóstico fueron la proteinuria masiva (en el 100 % de los pacientes) y los edemas generalizados (100 %), que llegaron a producir ascitis en un 75 %. El 41 % presentó hipertensión arterial al inicio. La proteinuria inicial, medida mediante el índice proteína/creatinina en orina, fue de 22 (rango IQ: 13-35,8).
El 75 % de los pacientes fueron prematuros, con una edad gestacional mediana de 36,5 semanas (36-37). El peso de la placenta fue de 1.350 g (925-1.850), lo que supuso un 56 % del peso del recién nacido (2.410 g; rango IQ: 1.930-2.950).
Dos pacientes presentaban una cardiopatía congénita asociada: una comunicación interauricular y una estenosis de la válvula mitral. En ambos casos se comprobó la normalización mediante controles ecocardiográficos posteriores.
Pruebas complementarias
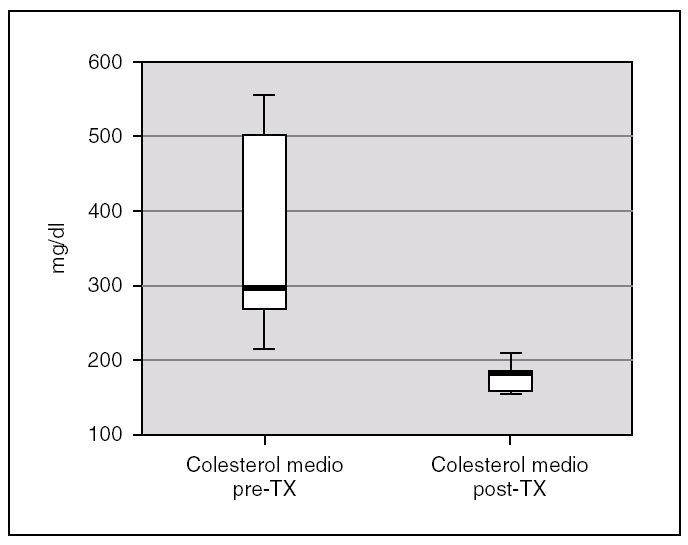
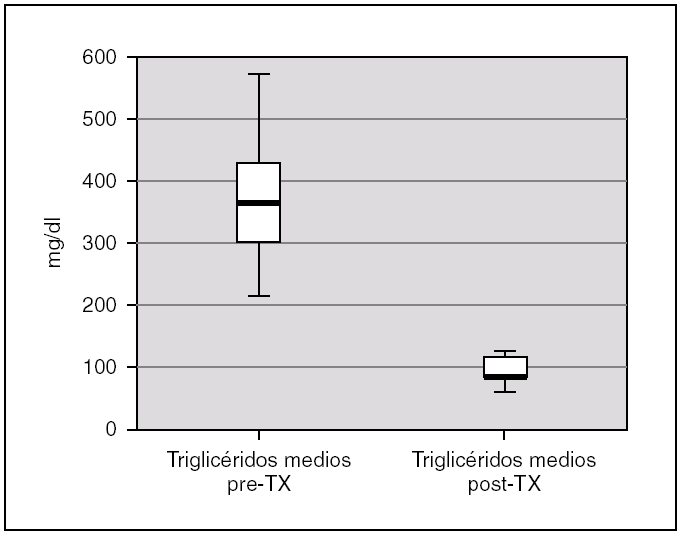
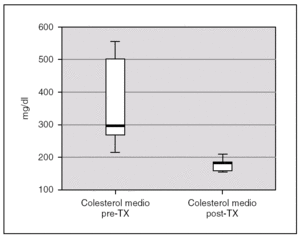
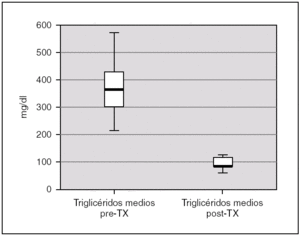
La albuminemia durante el período pretrasplante fue de 0,17 g/dl (0,12-0,28). Encontramos un colesterol plasmático total antes del trasplante de 277,7 mg/dl (238,9-397), y unos niveles de triglicéridos de 359,2 mg/dl (294-583,93). Ambas cifras descendieron tras el trasplante renal, alcanzándose significación estadística, con una disminución de los niveles de colesterol hasta 173,8 mg/dl (rango IQ: 153,8-188,8; p = 0,043) y de triglicéridos hasta 85 mg/dl (rango IQ: 70,8-123,9; p = 0,043) (figs. 1 y 2).
Figura 1. Cifras de colesterol antes y después del trasplante renal.
Figura 2. Cifras de triglicéridos antes y después del trasplante renal.
El diagnóstico se realizó por los datos clínicos y analíticos, y tras descartar otras causas de síndrome nefrótico congénito. En el 66,6 % de los casos se realizó biopsia renal, que resultó compatible con SNCF en un 87,5 %. Los hallazgos fueron glomérulos inmaduros, hiperplasia mesangial, dilataciones tubulares multifocales, y, en un solo caso, el 10 % de los glomérulos presentaba esclerosis global.
Tratamiento
Soporte nutricional, tratamiento farmacológico y otras medidas terapéuticas
En el 58,3 % de los pacientes se utilizaron técnicas de alimentación enteral, mediante sonda nasogástrica en un 85,7 % y gastrostomía en el 14,3 %. Recibieron un aporte calórico de 135 kcal/kg de peso (125-160), y un aporte proteico de 2,6 g/kg de peso (2-4).
Los fármacos más utilizados fueron las infusiones de albúmina (en el 91,7 %), los IECA (66,7 % de los pacientes, captopril en dosis entre 0,2 y 5 mg/kg/día), y la indometacina (58,3 %, dosis entre 0,3 y 3 mg/kg/día). Los pacientes presentaron una respuesta parcial al tratamiento antiproteinúrico, alcanzándose una mediana en el índice proteína/creatinina en orina de 6 (4-11) y unos valores mínimos de 1,9.
Otros fármacos empleados fueron la eritropoyetina, en el 75 % de los pacientes, análogos de la vitamina D, en el 66 %, hormona tiroidea, en el 83 %, y antiagregantes plaquetarios en el 50 % de los casos. Cuando las medidas dietéticas no conseguían controlar la hiperlipemia se emplearon estatinas (lovastatina), en un 33 % de los pacientes.
La nefrectomía se realizó en el 25 % de los casos, entre los 2,6 y los 3,6 años de edad.
Diálisis
El 58,3 % de los pacientes ha recibido tratamiento con diálisis, durante un período de 13,8 meses (9,6-15,7). El 41,7 % restante lo forman 3 pacientes que fallecieron antes de llegar a esta fase, y dos que se encontraban en prediálisis al finalizar el estudio. La edad al inicio de la diálisis fue de 3,8 años (2,8-7,6). La técnica elegida fue la diálisis peritoneal en el 100 % de los casos. El 71,4 % de éstos precisaron puntualmente el uso de hemodiálisis.
Trasplante renal
Un total de 7 pacientes (85,3 %) recibieron un trasplante renal, todos ellos procedentes de donante cadáver, a la edad de 5,3 años (4,3-8,9).
Evolución y complicaciones generales
Complicaciones generales
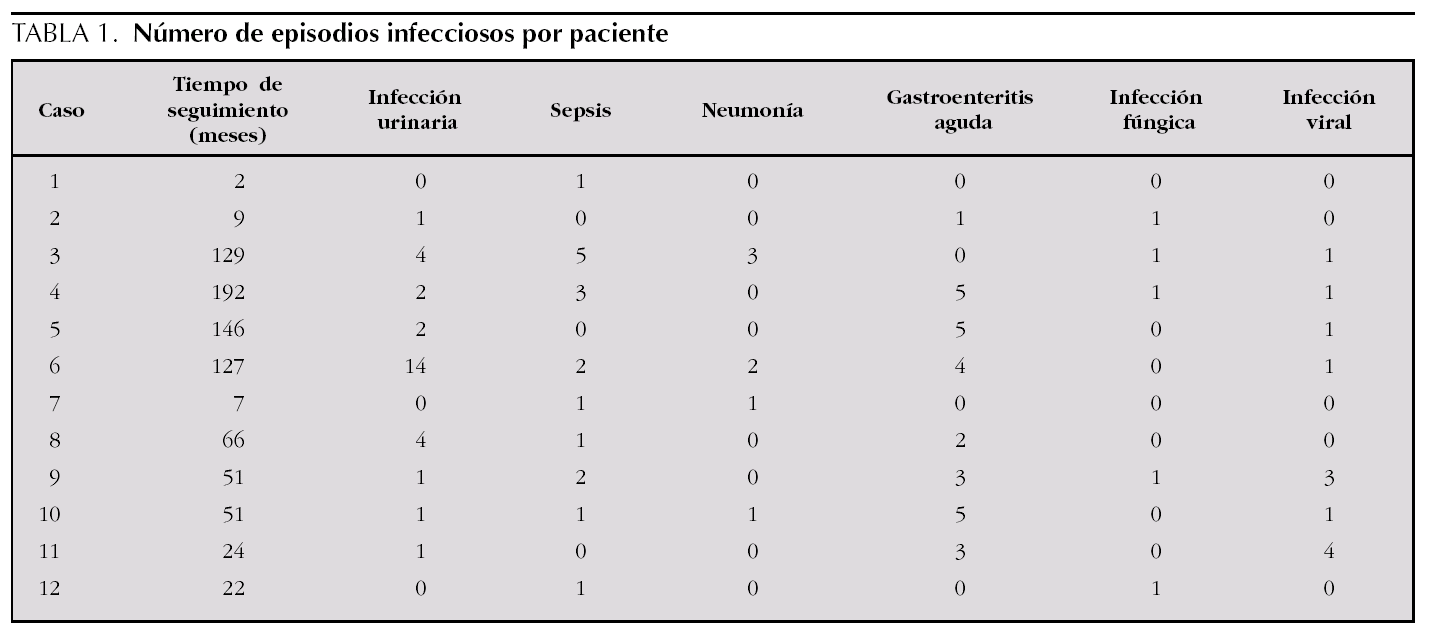
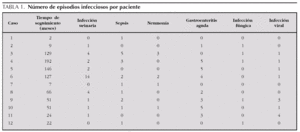
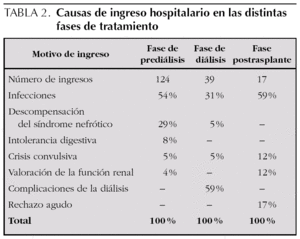
Las complicaciones más frecuentes fueron las infecciosas. El 100 % de los pacientes presentó alguna infección bacteriana. Las más frecuente fueron infección urinaria, que presentó el 75 % de los pacientes, sepsis (75 %), gastroenteritis aguda (66,7 %) y neumonía (33,5 %). Hubo un total de 75 infecciones bacterianas invasivas, con una mediana de 7,5 infecciones por paciente (rango IQ: de 1,25-10,25) (tabla 1).
En 5 de los pacientes se detectó infección fúngica (41,7 %); un caso de peritonitis por Candida albicans, en relación directa con el empleo de diálisis peritoneal, y el resto fueron candidiasis orales que respondieron al tratamiento local. Las infecciones virales aparecieron en el 58,3 % de los pacientes; exceptuando un caso de infección por citomegalovirus en un paciente trasplantado, el resto consistió en catarros de repetición.
Las complicaciones no infecciosas fueron: hipocalcemia (66,7 %), hiponatremia (41,7 %), hipopotasemia (41,7 %), convulsiones generalizadas secundarias a hipocalcemia o a crisis hipertensivas (58,3 %), trombosis venosas (16,7 %) y miocardiopatía dilatada (16,7 %). Los 2 pacientes con trombosis venosas no recibían tratamiento antiagregante profiláctico.
Complicaciones de la diálisis
Las principales fueron la peritonitis aguda (85,7 %), con una incidencia de un episodio por 8,2 paciente-mes, y la infección del orificio de salida del catéter peritoneal (85,7 %). Únicamente un paciente no presentó alguna de éstas. Otras fueron granuloma del orificio de salida del catéter peritoneal (28,6 %), hernia inguinal (14,3 %), hemorragia masiva por el orificio de salida (14,3 %), fuga peritoneo-pleural de la solución de diálisis (14,3 %) e infección del catéter de hemodiálisis (28,6 %).
Evolución del trasplante
El 71,4 % de los pacientes trasplantados tiene una función renal normal tras un período de seguimiento de 3,7 años (0,8-6,3). Dos pacientes presentaron nefropatía crónica del injerto: un paciente perdió el riñón por este motivo y precisó un segundo trasplante, y en el otro paciente el grado de nefropatía fue menor y mantiene una aceptable función renal. No hubo casos de recidiva del síndrome nefrótico.
Crecimiento y desarrollo psicomotor
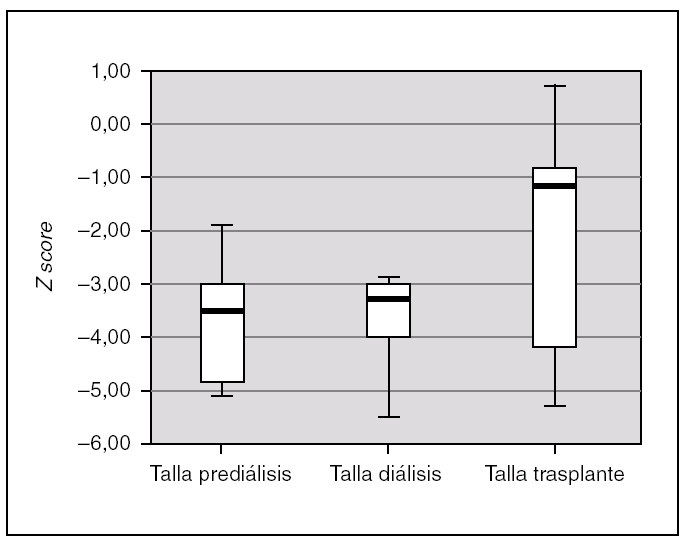
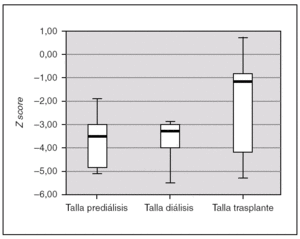
Todos los pacientes presentaron retraso de crecimiento en algún momento de su evolución. Si analizamos el crecimiento de los 7 pacientes que completaron las 3 fases de tratamiento, comprobamos que tras el trasplante se produce un incremento de talla estadísticamente significativo (p = 0,028). La talla durante la prediálisis, expresado en Z score, fue de 3,54 (4,86-2,79), durante la diálisis de 3,28 (4,01-2,91), y tras el trasplante se alcanza una talla de 1,34 (4,45-0,72) (fig. 3). En ningún paciente se empleó hormona de crecimiento.
Figura 3.Talla de los pacientes en las 3 fases de tratamiento, expresado en Z score para la edad y el género.
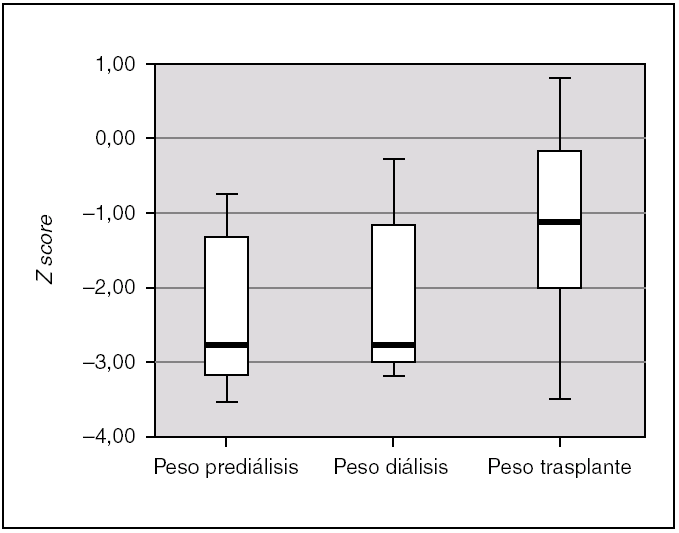
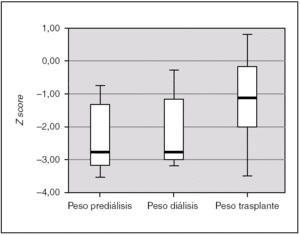
La ganancia de peso tras el trasplante resultó así mismo estadísticamente significativa (p = 0,004); en la fase de prediálisis el peso fue de 2,72 (3,38-0,93), durante la diálisis se mantiene en 2,72 (3,16-0,83), y tras el trasplante aumenta hasta un Z score de 1,23 (2,26-0,13) (fig. 4). En el 50 % de los pacientes, el peso y talla al final del estudio estuvieron dentro de rangos normales. En el 85,7 % de los pacientes el desarrollo psicomotor fue normal.
Figura 4.Peso de los pacientes en las 3 fases de tratamiento, expresado en Z score para la edad y el género.
Hospitalización
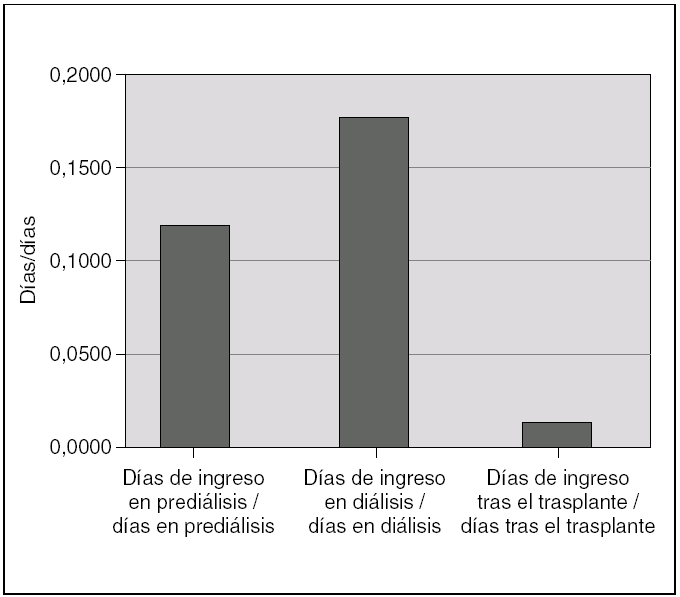
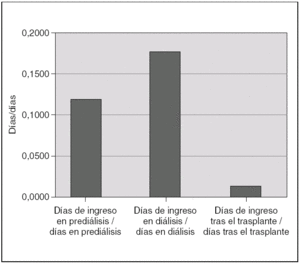
Durante el período de prediálisis, los niños estuvieron ingresados una mediana de un día de cada 8,5. Esta proporción aumenta durante la diálisis hasta un día de cada 5,5, debido a las complicaciones que supone esta técnica. En el período de trasplante la necesidad de ingreso se reduce hasta un día de cada 87 (fig. 5). Las causas de ingreso en cada período quedan expuestas en la tabla 2.
Figura 5. Proporción de días de ingreso/días libres de ingreso en las fases de prediálisis, diálisis y trasplante renal.
Mortalidad
El tiempo de seguimiento ha sido de 51 meses (12,3-128,5). La mortalidad fue del 33,3 %. Existe un descenso en la mortalidad en los últimos 10 años, sin significación estadística (p = 0,222), de manera que en los pacientes nacidos antes de 1995 (n = 5) la mortalidad fue del 60 %, y en los nacidos después de 1995 (n = 7) fue del 14,3 %. Las causas de fallecimiento fueron la descompensación del síndrome nefrótico en 2 pacientes, un tromboembolismo pulmonar y una sepsis en una preadolescente con injerto funcionante.
Discusión
El SNCF clásicamente se ha considerado una enfermedad de pronóstico infausto, de modo que todos los pacientes fallecían en los primeros 6 meses de vida 7. Actualmente, gracias al tratamiento enérgico se puede lograr una mayor supervivencia. En la última década se ha instaurado el uso de indometacina e IECA, pero los mejores resultados se han obtenido con la implantación de terapias sustitutivas renales, fundamentalmente la diálisis peritoneal y el trasplante renal, que ha permitido una mayor supervivencia junto a mejores resultados en cuanto a nutrición, crecimiento y desarrollo 8,9.
En la población finlandesa, el 94 % de los pacientes afectados de SNCF presentan la mutación Fin-major o Fin-minor, lo que implica la ausencia total de la expresión de la nefrina, y por tanto, formas clínicas más graves y que no responden al tratamiento antiproteinúrico 10. Los pacientes que presentan alguna de las otras mutaciones, como ocurre principalmente en la población no finlandesa, suelen presentar formas más benignas.
El tratamiento inicial de estos pacientes consiste en el tratamiento conservador, cuyo objetivo es disminuir las pérdidas proteicas para maximizar el crecimiento y reducir el riesgo de complicaciones 11. Consigue mejorar el control de los edemas, de la volemia, disminuye la incidencia de infecciones oportunistas y permite demorar el tratamiento sustitutivo. Se han comunicado casos de remisión de síndromes nefróticos congénitos con el empleo de IECA solo o asociado a indometacina 12-14. En nuestra serie, estos tratamientos no se emplearon de forma generalizada; los IECA se utilizaron en el 66,7 % y la indometacina en el 58,3 %. Esto es debido a que cuando los primeros pacientes de la muestra fueron tratados, las ventajas de su uso no eran conocidas. Actualmente se utilizan de forma sistemática en nuestros pacientes afectados de SNCF.
La realización de nefrectomía para el control de la proteinuria es controvertida. Holmberg et al 8 recomiendan la nefrectomía bilateral entre los 6 y 12 meses de vida, seguido de diálisis y trasplante renal. Con este planteamiento observa una mejoría rápida en el estado nutricional, lo que permite llevar al paciente a unas condiciones adecuadas para la realización del trasplante. Por otro lado, en la serie de Kovacevic et al 11 se apuesta por el tratamiento combinado con IECA e indometacina junto con un nefrectomía unilateral; con esto mejora significativamente la albuminemia y se reduce la necesidad de infusiones de albúmina y la hospitalización, a la vez que se consigue un crecimiento adecuado.
En nuestros protocolos actuales la nefrectomía no se realiza sistemáticamente. Siempre que el soporte nutricional intensivo y el tratamiento farmacológico consigan un control de las infecciones, del edema y un crecimiento adecuado, no se indica la nefrectomía. En nuestra serie sólo se realizaron 3 nefrectomías, dos de ellas unilaterales; en un caso la proteinuria masiva persistió tras la intervención, aunque cuando ésta se realizó no estaba establecido el uso de fármacos antiproteinúricos como coadyuvantes; en el otro caso la función renal sufrió un descenso brusco, precisando el empleo inmediato de diálisis.
Las infecciones bacterianas suponen una importante complicación en los pacientes con SNCF aunque su incidencia se ha reducido en los últimos años gracias al mejor tratamiento de estos pacientes 15. En nuestra serie encontramos un total de 75 infecciones bacterianas, lo que supone una incidencia alta, pero similar a la de otras series 4. En estos pacientes la inmunidad celular está conservada, por lo que no presentan una incidencia aumentada de infecciones fúngicas ni virales. En nuestra serie, el 58,3 % se diagnosticó de infecciones virales, pero exceptuando un caso de infección por citomegalovirus en una paciente trasplantada, el resto únicamente refería catarros frecuentes. Esta incidencia se considera normal en menores de 10 años 16, por lo que consideramos que la frecuencia de infecciones virales de la serie no está elevada respecto a la población general.
La peritonitis es la principal complicación de la diálisis peritoneal 17. Su incidencia es mayor en pacientes afectados de SNCF, presumiblemente por la alteración de la inmunidad humoral. En nuestra serie, la tasa de peritonitis fue de 1 episodio/8,2 paciente-mes, que es superior a la tasa global de los niños en diálisis peritoneal de nuestro centro (1 episodio/12 paciente-mes). Consideramos que nuestra tasa de peritonitis es alta, pero no más que en las series finlandesas; Hölttä et al 17 refieren una tasa de 1 episodio/7,3 paciente-mes en su serie de 34 pacientes menores de 5 años tratados con diálisis peritoneal, de los que el 80 % presentaban un SNCF. En otros estudios encontramos resultados variables. En la serie de Alexander et al 18, la incidencia global de peritonitis fue de 1 episodio/7,1 paciente-mes. Verrina et al 19 muestra una serie de 70 niños, de edad media de 8,5 ± 5,8 años, en los que la incidencia de peritonitis desciende hasta 1 episodio/19,8 paciente-mes.
La enfermedad puede recidivar en el injerto, por la acción de anticuerpos antinefrina circulantes formados en pacientes con ausencia completa de nefrina en los riñones nativos (genotipo Fin-major/Fin-major) 20,21. En la población finlandesa, donde estas mutaciones son más frecuentes, la recidiva ocurre en un 25 % de los SNCF trasplantados. En nuestra serie no se ha producido recidiva de la enfermedad, probablemente debido a que estas mutaciones del gen NPHS1 son raras en nuestro medio.
El retraso en el crecimiento de los pacientes con SNCF es multifactorial: pérdida proteica, dificultades para la alimentación oral, y en fases posteriores se suma el efecto deletéreo que produce el fallo renal. Un adecuado tratamiento nutricional puede mantener una aceptable velocidad de crecimiento en pacientes con fallo renal crónico 22. En nuestra serie tras la realización del trasplante se produce un crecimiento recuperador, como se describe en la literatura especializada 23, de modo que el 57 % de los pacientes trasplantados presenta un peso y talla normales para su edad. Este porcentaje debe aumentar, teniendo en cuenta que 2 pacientes se trasplantaron hace menos de un año.
La mortalidad de los pacientes con SNCF es variable. En la serie de Savage et al 7, de 20 pacientes tratados entre los años 1980 y 1999, la mortalidad global fue del 50 %, aunque ellos observan una mejoría del pronóstico en los últimos años de su estudio. En países en vías de desarrollo la mortalidad sigue siendo alta; en la serie de 30 pacientes publicada por Hamed y Shomaf 24, tratados en Jordania entre 1989 y 1999, la mortalidad fue del 100 %. En nuestra serie la mortalidad global fue del 33,3 %, y si consideramos los pacientes nacidos en los últimos 10 años, desciende hasta un 14,3 %. La mortalidad es del 5,9 % en la serie de Hölttä, de 34 pacientes en diálisis peritoneal 16; en los 7 pacientes de nuestra serie tratados con diálisis peritoneal la mortalidad fue del 14 %. Estos valores se deben comparar teniendo en cuenta la diferencia en el número de pacientes entre ambas series.
Los resultados deben ser interpretados teniendo en cuenta las limitaciones de nuestro estudio. El reducido número de pacientes limita la posibilidad de realizar inferencias estadísticas significativas y reduce el valor de las frecuencias obtenidas.
Conclusiones
1. El SNCF es una enfermedad de difícil manejo terapéutico. Gracias a los cambios experimentados en los últimos años se ha conseguido mejorar su pronóstico: el empleo de fármacos antiproteinúricos, junto con un tratamiento nutricional intensivo, permiten un mejor control clínico durante la primera fase de la enfermedad, y por tanto, iniciar la diálisis y el trasplante renal de forma más tardía y con mayores probabilidades de éxito.
2. Las infecciones bacterianas suponen la complicación más frecuente en el período prediálisis. La peritonitis aguda de los que realizan diálisis peritoneal, y la lucha contra la nefropatía crónica del injerto en los pacientes trasplantados, dificultan el tratamiento de estos niños.
3. El retraso en el crecimiento es un problema generalizado en el SNCF, pero con un soporte nutricional adecuado, y sobre todo con la realización del trasplante renal, frecuentemente se consigue normalizar el peso y la talla.
4. La hospitalización continúa siendo frecuente, principalmente en las fases de prediálisis y diálisis. Con el trasplante, el número y duración de los ingresos disminuye notablemente, lo que supone una mejoría en la calidad de vida y permite un adecuado desarrollo intelectual e integración social.
Agradecimientos
Al Dr. Aurelio Cayuela Domínguez (Unidad de Apoyo a la Investigación y Centro de Documentación Clínica Avanzada, Hospitales Universitarios Virgen del Rocío, Sevilla), Eloy Rojas Arias (Biblioteca General de la Universidad de Sevilla) y Manuel Portero Martínez (Relief Manager de Lloyds Pharmacy, Bristol).
Correspondencia: Dr. D. Canalejo González.
Pl. de los Tarantos, 2. 4.º dcha. 41007 Sevilla. España.
Correo electrónico: davidcanalejo@gmail.com
Recibido en noviembre de 2005. Aceptado para su publicación en julio de 2006.