Determinar la prevalencia de anomalías de la función de las vías aéreas pequeñas y de trastornos respiratorios del sueño en preescolares nacidos con gran prematuridad y peso neonatal muy bajo, y su relación con la displasia broncopulmonar y otros factores de riesgo neonatales.
MétodosEstudio transversal de niños de 3-6 años nacidos con peso <1.500g y <32 semanas de edad gestacional. Se realizó oscilometría respiratoria, determinándose la resistencia y la reactancia a 5Hz (R5 y X5), la diferencia de resistencias a 5 y 19Hz (R5-19), el área de reactancia (AX) y la frecuencia de resonancia (Fres). Se realizó también oximetría nocturna, determinándose los índices de desaturación del 3 y 4% (ODI3, ODI4). Se estudió la asociación de los resultados con la displasia broncopulmonar y otros factores de riesgo neonatales mediante pruebas de Chi-cuadrado o Mann-Whitney.
ResultadosSe estudió a 22 niños de (mediana, rango intercuartil) 4,9 (3,7-5,4) años, el 54,5% con displasia broncopulmonar. La prevalencia de resultados anormales era alta en todos los parámetros de la oscilometría (R5-19: 10,0%, X5: 21,1%, R5: 25,0%, Fres: 40,0%, AX: 45,0%) y de la oximetría (ODI3: 38,1%, ODI4: 33,3%). Ningunos de esos resultados se relacionaban con la displasia broncopulmonar ni otros factores de riesgo neonatales.
ConclusiónLos preescolares nacidos con gran prematuridad y muy bajo peso neonatal tienen una prevalencia elevada de alteraciones de la función de las pequeñas vías aéreas y, probablemente, de trastornos respiratorios del sueño, no relacionados con la displasia broncopulmonar.
.
To determine the prevalence of abnormalities in small airway function and sleep-disordered breathing in preschoolers born very preterm and with very low birth weight, and their association with bronchopulmonary dysplasia and other neonatal risk factors.
MethodsCross-sectional study of children aged 3 to 6 years born before 32 weeks of gestation with a birth weight of less than 1500 grams. Respiratory oscillometry was performed, determining the resistance and reactance at 5Hz (R5 and X5), the difference in resistance at 5 and 19Hz (R5-19), area under the reactance curve (AX), and the resonant frequency (Fres). Nocturnal oximetry was also performed, determining the oxygen desaturation indices at thresholds of 3% (ODI3) and 4% (ODI4). We analyzed the association of the results with bronchopulmonary dysplasia and other neonatal risk factors with the χ2 test or the Mann-Whitney U test.
ResultsThe sample included 22 children with a median (IQR) age of 4.9 (3.7-5.4) years, of who 54.5% had bronchopulmonary dysplasia. There was a high prevalence of abnormal results for all oscillometry parameters (R5-19, 10.0%; X5, 21.1%; R5, 25.0%; Fres, 40.0%; AX, 45.0%) and oximetry parameters (ODI3, 38.1%; ODI4, 33.3%). None of these results were associated with bronchopulmonary dysplasia or other neonatal risk factors.
ConclusionPreschoolers born very preterm and with very low birth weight have a high prevalence of abnormal small airway function and, probably, sleep-disordered breathing, unrelated to bronchopulmonary dysplasia.
El desarrollo de la neonatología moderna ha conseguido reducir la mortalidad de los niños nacidos con muy bajo peso neonatal (MBP<1.500g) y gran prematuridad (GP<32 semanas de edad gestacional)1. Esta mayor supervivencia supone un desafío en cuánto a posibles riesgos para la salud futura de los niños nacidos con MBP/GP, incluidos los efectos adversos a largo plazo de algunos tratamientos neonatales intensivos. Entre los sistemas orgánicos que pueden mostrar secuelas de la prematuridad a largo plazo está el respiratorio2.
En los niños con antecedentes de MBP/GP, se ha demostrado la persistencia de un patrón obstructivo de la vía aérea, con disminución de flujos espiratorios máximos, aumento en la resistencia en las vías aéreas pequeñas, atrapamiento aéreo, hiperreactividad de la vía aérea, alteraciones morfológicas en estudios de imagen (engrosamiento de la pared de vías aéreas) y, con menos frecuencia, defectos en la difusión alveolar de gases, sin evidencia de un proceso inflamatorio subyacente3–8. Esas alteraciones persisten hasta la edad adulta, y parecen mayores cuando hay enfermedad pulmonar crónica del prematuro/displasia broncopulmonar (DBP)9,10. Las alteraciones funcionales respiratorias tienen expresión clínica en forma de enfermedad pulmonar obstructiva crónica, con síntomas respiratorios recurrentes, muchas veces desencadenados por infecciones víricas, hospitalizaciones por causa respiratoria, limitación de la capacidad física, y necesidad de tratamiento broncodilatador y antiinflamatorio de las vías aéreas11,12. La mayoría de los episodios graves que requieren hospitalización ocurren en los niños13, pero los síntomas respiratorios persisten en la edad adulta14.
En general, las alteraciones clínicas y funcionales son mayores a mayor prematuridad, y la DBP podría incrementar el riesgo12,15,16. Sin embargo, es controvertido hasta qué punto la DBP supone realmente un mayor riesgo de enfermedad pulmonar persistente, más allá del atribuible a la misma prematuridad, otros factores perinatales y exposiciones ambientales4–6,17–21.
La mayoría de los estudios han recogido datos a partir de la edad escolar, cuando es más sencillo realizar estudios de función pulmonar convencionales, como la espirometría. La oscilometría respiratoria (OS) es una técnica que requiere menos cooperación, es más sencilla de realizar y obtiene resultados en menos tiempo, por lo que se considera una técnica adecuada para el estudio de la función pulmonar en preescolares. La OS estudia la resistencia y la reactancia del sistema respiratorio, y es especialmente útil para identificar alteraciones en las vías aéreas distales, que pueden ser importantes en la enfermedad pulmonar crónica del prematuro/DBP7. Varios estudios han encontrado correlación de sus resultados con los de la espirometría en escolares con antecedentes de prematuridad22. En preescolares, algunos estudios que han utilizado OS encuentran una prevalencia muy elevada de alteraciones consistentes en mayores resistencias globales y de vías aéreas distales, y sin claras diferencias relacionadas con la DBP3,23–25.
En contraste con la función pulmonar, la prevalencia de trastornos respiratorios del sueño (TRS) en niños nacidos prematuros ha sido poco estudiada. En la edad escolar y adolescencia, algunos estudios encuentran una alta prevalencia de TRS relacionada con la prematuridad26. El riesgo parece disminuir con la edad hasta la adolescencia para volver a aumentar a partir de entonces27. Estos hallazgos, sin embargo, no han sido constantes28. Los estudios en preescolares son escasos, y han encontrado una elevada prevalencia de TRS, posiblemente asociada a la DBP, y con tendencia a disminuir con la edad29.
Los objetivos de este estudio fueron determinar la prevalencia de alteraciones en la mecánica respiratoria y de TRS en preescolares nacidos con MBP/GP, y también determinar su asociación con características neonatales como la edad gestacional, el peso neonatal, el tratamiento recibido durante el ingreso neonatal o el diagnóstico de DBP.
MétodosSe realizó un estudio transversal que incluyó a niños nacidos entre 2018-2021, con peso neonatal <1.500g y edad gestacional <32 semanas, con hospitalización en la unidad de cuidados intensivos neonatales de un hospital de tercer nivel. Se excluyeron niños sin datos de seguimiento en la historia clínica electrónica, residentes fuera del ámbito de referencia del hospital, con enfermedades o malformaciones no relacionadas con la prematuridad que aumenten el riesgo de enfermedad respiratoria prolongada (malformaciones broncopulmonares, cardiopatías congénitas, fibrosis quística, inmunodeficiencias, síndromes polimalformativos), y niños con parálisis cerebral u otras lesiones neurológicas que impidan realizar correctamente las pruebas de función pulmonar. La DBP y su gravedad se definieron de acuerdo con los criterios establecidos por la Sociedad Española de Neonatología y el Grupo Español de Investigación en Displasia Broncopulmonar (GEIDIS)30, que consideran la presencia de DBP cuando se necesita tratamiento con oxígeno, presión positiva o alto flujo durante >28 días, y clasifica su gravedad de acuerdo al nivel de soporte respiratorio necesario a las 36 semanas de edad posmenstrual (o al alta, si ocurre antes).
Se realizó oximetría nocturna con un pulsioxímetro digital (Radical-7® con sonda RD-SET, Masimo Corporation, Irvine, California, EE. UU.), y los registros se analizaron mediante software Visi-Download (Stowood Scientific Instruments Ltd, Oxford, Reino Unido). Los pulsioxímetros se programaron sin alarmas, con un tiempo de promedio (averaging time) de 2s, y se hicieron registros de duración mínima de 6h (recomendaciones Australasian Sleep Association31). Se recogieron para el análisis: el índice de desaturación 3% (ODI3: media de descensos de SpO2≥3% respecto a la línea de base por hora de registro), índice de saturación del 4% (ODI4: media de descensos de SpO2≥4% respecto a la línea de base por hora de registro), SpO2 media durante el registro, y el porcentaje de tiempo registrado con SpO2<90% y <88% (CT90, CT88).
Además, los padres respondieron a la versión reducida (escala de TRS) del cuestionario Pediatric Sleep Questionnaire (SRBD-PSQ)32 en su versión validada en español33. Se trata de un cuestionario específico para el estudio de problemas respiratorios del sueño, adecuado para usar en niños >2 años, que consta de 22 ítems con respuesta si/no/no sabe.
De acuerdo con las últimas recomendaciones de la British Thoracic Society34, se consideraron probablemente patológicos: ODI3>7, ODI4>4 y SRBD-PSQ con respuestas positivas en ≥33% de los ítems.
La mecánica respiratoria se estudió mediante OS, con un sistema Tremoflo® C-100 (Thorasys Thoracic Medical Systems, Montreal, Canadá), siguiendo las especificaciones de la European Respiratory Society35. Se recogieron los siguientes parámetros: resistencia a 5Hz (R5), diferencia entre la resistencia a 5 y 19Hz (R5-19), reactancia a 5Hz (X5), área bajo la curva de reactancia (AX) y frecuencia de resonancia (Fres). Los parámetros se expresaron como z-scores o desviaciones estándar (DE) del valor de referencia según las ecuaciones de Ducharme et al. específicas para el Tremoflo® C-10036. Un aumento (z-score>1,645 DE) de R5, R5-19, AX o Fres, y una disminución (z-score<−1,645 DE) de X5 se consideraron anormales37.
Se realizó una pequeña encuesta a los padres sobre antecedentes familiares de asma, exposición a tabaco y sobre si los niños estaban recibiendo tratamiento antiasmático con corticoides inhalados.
Todas las variables continuas se han presentado como mediana y rango intercuartil. Se analizó la asociación de variables neonatales, del sueño, mecánica respiratoria y evolución clínica posneonatal mediante pruebas de Chi-cuadrado o pruebas de Mann-Whitney, según el caso.
El proyecto fue aprobado por el Comité de Ética del hospital (23-PI102). Los padres de los pacientes firmaron un consentimiento informado para la inclusión en el estudio.
ResultadosDurante el periodo de estudio, 50 niños MBP y nacidos con <32 semanas GA fueron atendidos en el hospital y sobrevivieron para ser dados de alta. No se pudo contactar con 18 (36,0%) por residir fuera del ámbito de referencia del hospital. Otros 10 (20,0%) rechazaron la invitación a participar. Finalmente 22 (44,0%) fueron incluidos en el estudio. Las características demográficas y clínicas de los pacientes incluidos se muestran en la tabla 1. Entre incluidos y no incluidos no había diferencias estadísticamente significativas en sexo, características de la gestación y parto, curso clínico neonatal, necesidades de ventilación o de oxígeno suplementario, días de ingreso en cuidados intensivos ni diagnóstico de DBP. Las madres de los pacientes que participaron tenían mayor edad al parto: 39 (34-41) años vs. 34 (25-36) años; p<0,001. Ninguno de los pacientes del estudio estaba recibiendo oxígeno ni soporte respiratorio actualmente.
Características demográficas y clínicas de la muestra (n=22)
| Sexo varón | 54,5% |
| Gestación múltiple | 40,9% |
| Gestación por fertilización in vitro | 22,7% |
| Madre no caucásica | 13,6% |
| Corticoides prenatales | 86,4% |
| Sulfato de magnesio | 68,2% |
| Hipertensión materna | 27,3% |
| Diabetes gestacional | 4,5% |
| Corioamnionitis | 9,1% |
| Prolapso de cordón | 4,5% |
| Antibioterapia intraparto | 45,5% |
| Cesárea | 63,6% |
| Reanimación neonatal con PPI o intubación | 77,2% |
| Surfactante | 54,5% |
| Displasia broncopulmonar | 54,5% |
| DBP leve (grado 1) | 31,8% |
| DBP moderada (grado 2) | 9,1% |
| DBP grave (grado 3) | 13,6% |
| Ductus arterioso persistente | 31,8% |
| Hemorragia intraventricular | 13,6% |
| Sepsis precoz | 4,5% |
| Sepsis tardía | 13,6% |
| Retinopatía de la prematuridad | 27,3% |
| Fumadores en casa | 14,3% |
| Asma familiar | 52,4% |
| Usan corticoides inhalados | 23,8% |
| Edad gestacional, semanas (mediana, IQR) | 28,4 (27,4-30,3) |
| Peso neonatal, g (mediana, IQR) | 1.120 (950-1.333) |
| Edad materna, años (mediana, IQR) | 39 (34-41) |
| Apgar 1, (mediana, IQR) | 6 (3-8) |
| Apgar 5, (mediana, IQR) | 8 (6-9) |
| Días con ventilación mecánica, (mediana, IQR) | 0,0 (0,0-5,0) |
| Días con ventilación no invasiva, (mediana, IQR) | 12,0 (3,0-29,0) |
| Días con oxigenoterapia, (mediana, IQR) | 3,0 (0,0-23,0) |
| Días en la UCIN, (mediana, IQR) | 24,5 (13,3-33,3) |
| Edad al estudio, años (mediana, IQR) | 4,9 (3,7-5,4) |
IQR: rango intercuartil; PPI: presión positiva intermitente; SEG: semanas de edad gestacional; UCIN: unidad de cuidados intensivos neonatales.
En 20 niños se pudo registrar adecuadamente una OS, y 21 proporcionaron un registro de oximetría nocturna válido.
Resultados de la oximetría nocturnaLa oximetría nocturna se registró durante (mediana, IQR) 9:23h (9:00-9:50h). Tenían ODI3 elevado (>7) el 38,1%, ODI4 elevado (>4) 33,3%, y SRBD-PSQ alterado el 33,3%. Las medianas (IQR) de ODI3, ODI4 y SRBD-PSQ eran respectivamente 6,1 (4,4-9,3), 2,8 (1,7-4,4) y 15,0% (9,5-38,9%). La oxigenación se mantenía adecuadamente durante el registro, siendo las medianas (IQR) de CT90 y CT88 de 0,02% (0,00-0,20%) y 0,00% (0,00-0,04%). La SpO2 media fue de 95,1% (93,6-95,9%).
Tres niños (14,3%) tenían resultado alterado tanto en SRBD-PSQ como en ODI3, y 2 niños (9,5%) tenían resultado alterado en SRBD-PSQ y ODI4.
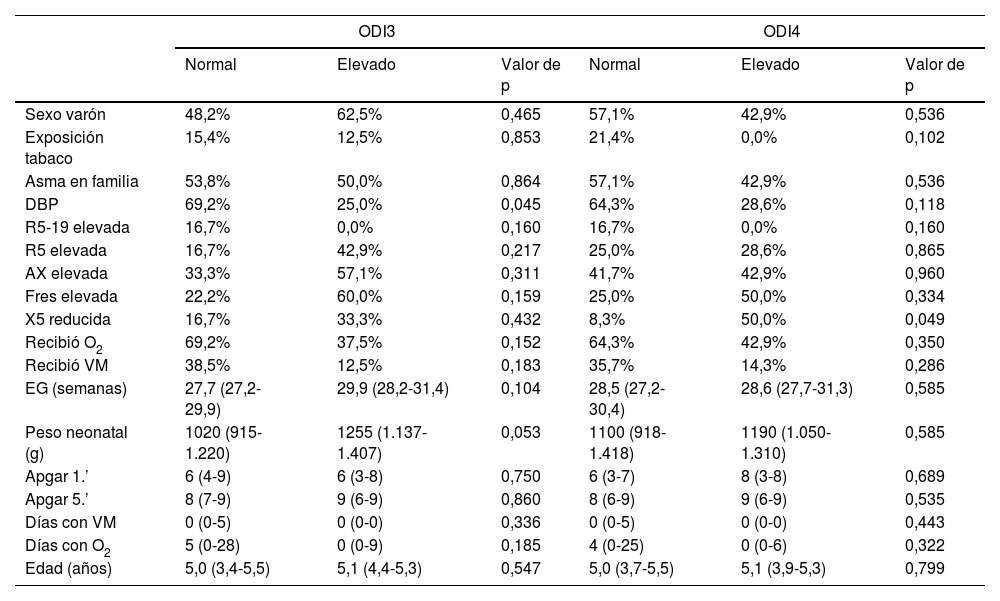
La prevalencia de alteraciones en ODI3, ODI4 o SRBD-PSQ no era mayor en niños con DBP, ni en los que recibieron oxigenoterapia o VM en el periodo neonatal, ni se asociaba a diferente edad gestacional o peso neonatal, ni tenían relación con la edad de estudio o con alteraciones de la función pulmonar, a excepción de un resultado marginalmente significativo entre alteraciones en X5 y ODI4 (tabla 2).
Resultados de la oximetría nocturna
| ODI3 | ODI4 | |||||
|---|---|---|---|---|---|---|
| Normal | Elevado | Valor de p | Normal | Elevado | Valor de p | |
| Sexo varón | 48,2% | 62,5% | 0,465 | 57,1% | 42,9% | 0,536 |
| Exposición tabaco | 15,4% | 12,5% | 0,853 | 21,4% | 0,0% | 0,102 |
| Asma en familia | 53,8% | 50,0% | 0,864 | 57,1% | 42,9% | 0,536 |
| DBP | 69,2% | 25,0% | 0,045 | 64,3% | 28,6% | 0,118 |
| R5-19 elevada | 16,7% | 0,0% | 0,160 | 16,7% | 0,0% | 0,160 |
| R5 elevada | 16,7% | 42,9% | 0,217 | 25,0% | 28,6% | 0,865 |
| AX elevada | 33,3% | 57,1% | 0,311 | 41,7% | 42,9% | 0,960 |
| Fres elevada | 22,2% | 60,0% | 0,159 | 25,0% | 50,0% | 0,334 |
| X5 reducida | 16,7% | 33,3% | 0,432 | 8,3% | 50,0% | 0,049 |
| Recibió O2 | 69,2% | 37,5% | 0,152 | 64,3% | 42,9% | 0,350 |
| Recibió VM | 38,5% | 12,5% | 0,183 | 35,7% | 14,3% | 0,286 |
| EG (semanas) | 27,7 (27,2-29,9) | 29,9 (28,2-31,4) | 0,104 | 28,5 (27,2-30,4) | 28,6 (27,7-31,3) | 0,585 |
| Peso neonatal (g) | 1020 (915-1.220) | 1255 (1.137-1.407) | 0,053 | 1100 (918-1.418) | 1190 (1.050-1.310) | 0,585 |
| Apgar 1.’ | 6 (4-9) | 6 (3-8) | 0,750 | 6 (3-7) | 8 (3-8) | 0,689 |
| Apgar 5.’ | 8 (7-9) | 9 (6-9) | 0,860 | 8 (6-9) | 9 (6-9) | 0,535 |
| Días con VM | 0 (0-5) | 0 (0-0) | 0,336 | 0 (0-5) | 0 (0-0) | 0,443 |
| Días con O2 | 5 (0-28) | 0 (0-9) | 0,185 | 4 (0-25) | 0 (0-6) | 0,322 |
| Edad (años) | 5,0 (3,4-5,5) | 5,1 (4,4-5,3) | 0,547 | 5,0 (3,7-5,5) | 5,1 (3,9-5,3) | 0,799 |
Los % son de ocurrencia de cada variable en cada categoría (normal/anormal) de ODI3 y de ODI4. Las cifras con paréntesis son medianas (rango intercuartil).
AX: área bajo la curva de reactancia; DBP: displasia broncopulmonar; EG: edad gestacional; Fres: frecuencia de resonancia; ODI3: índice de desaturación del 3%; ODI4: índice de desaturación del 4%; O2: oxigenoterapia; R5: resistencia del sistema respiratorio a 5Hz; R5-19: diferencia en la resistencia del sistema respiratorio a 5 y 19Hz; VM: ventilación mecánica; X5: reactancia del sistema respiratorio a 5Hz.
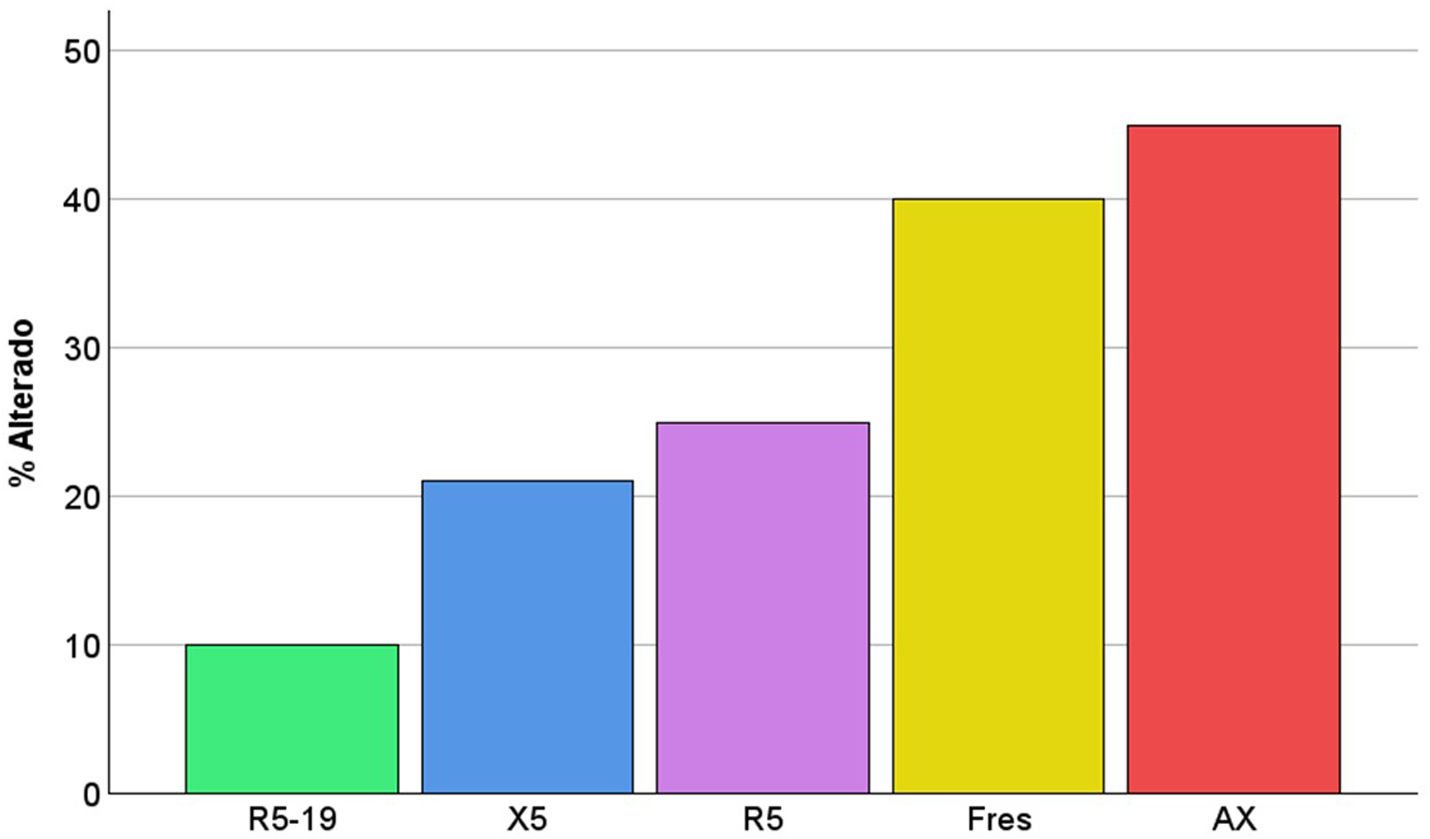
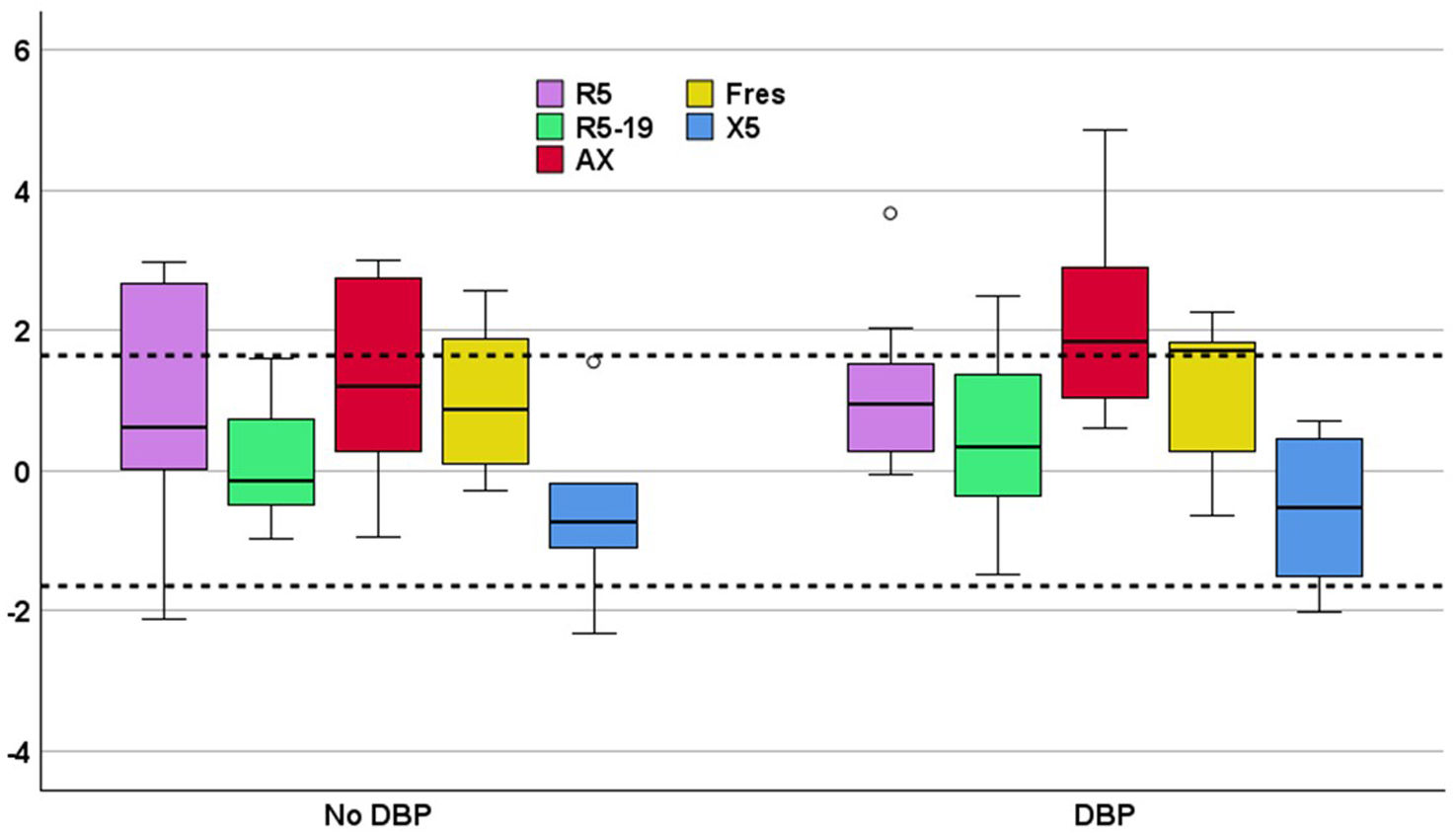
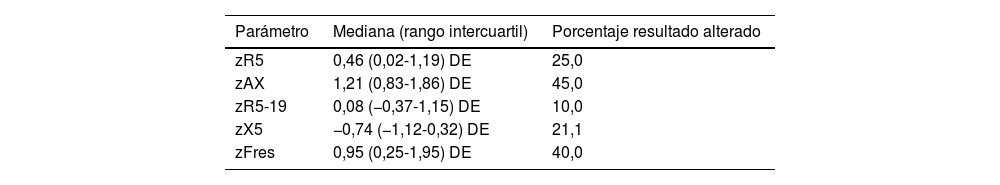
Se muestran en la tabla 3. Todos los parámetros de la OS estaban frecuentemente alterados, sobre todo el AX (fig. 1). La prevalencia de alteraciones en la OS no era mayor en niños con DBP (fig. 2), ni en los que recibieron oxigenoterapia o VM en el periodo neonatal, ni se asociaba a diferente edad gestacional o peso neonatal, ni tenían relación con alteraciones de la oximetría nocturna. Los resultados tampoco eran distintos en relación a tener antecedentes familiares de asma, estar expuesto a humo de tabaco o recibir en tratamiento con corticoides inhalados.
Resultados de la oscilometría respiratoria
| Parámetro | Mediana (rango intercuartil) | Porcentaje resultado alterado |
|---|---|---|
| zR5 | 0,46 (0,02-1,19) DE | 25,0 |
| zAX | 1,21 (0,83-1,86) DE | 45,0 |
| zR5-19 | 0,08 (−0,37-1,15) DE | 10,0 |
| zX5 | −0,74 (−1,12-0,32) DE | 21,1 |
| zFres | 0,95 (0,25-1,95) DE | 40,0 |
AX: área bajo la curva de reactancia; DE: desviaciones estandar; Fres: frecuencia de resonancia; R5: resistencia del sistema respiratorio a 5Hz; R5-19: diferencia en la resistencia del sistema respiratorio a 5 y 19Hz; X5: reactancia del sistema respiratorio a 5Hz.
Porcentaje de pacientes con resultados alterados en cada uno de los parámetros de la oscilometría respiratoria. AX: área bajo la curva de reactancia; Fres: frecuencia de resonancia; R5: resistencia del sistema respiratorio a 5Hz; R5-19: diferencia en la resistencia del sistema respiratorio a 5 y 19Hz; X5: reactancia del sistema respiratorio a 5Hz.
Z-score de los parámetros de oscilometría respiratoria en niños con y sin displasia broncopulmonar. Las líneas de guiones horizontales representan los límites de la normalidad (+1,645 y −1,645 desviaciones estándar). AX: área bajo la curva de reactancia; DBP: displasia broncopulmonar; Fres: frecuencia de resonancia; R5: resistencia del sistema respiratorio a 5Hz; R5-19: diferencia en la resistencia del sistema respiratorio a 5 y 19Hz; X5: reactancia del sistema respiratorio a 5Hz.
En esta muestra reducida de preescolares nacidos con MBP y edad gestacional <32 semanas, la prevalencia de alteraciones de la mecánica respiratoria era muy alta, indicando la presencia de una afectación predominante de vías aéreas distales. Igualmente, la prevalencia de TRS era muy elevada. No había una asociación entre los TRS y la función respiratoria, ni entre ellas con la DBP u otros posibles factores de riesgo perinatales.
La principal limitación del estudio es su reducido tamaño muestral, debido a su carácter unicéntrico. Por otra parte, las alteraciones del sueño se han estudiado mediante oximetría nocturna, no mediante polisomnografía. Aunque el ODI3 tiene alta sensibilidad y especificidad para identificar trastornos moderados o graves38, solo podemos considerar como probables, y no confirmados, los TRS en nuestros pacientes. Además, la concordancia de resultados entre la OS y pruebas convencionales de función pulmonar es imperfecta, su estandarización aún es mejorable, y sus resultados son en parte dependientes del sistema utilizado y de los valores de referencia aplicados. Por otra parte, hemos utilizado una definición de DBP acorde a la práctica neonatológica más actual, pero todas las definiciones de la DBP son poco consistentes39, porque no tienen un suficiente soporte fisiopatológico y atienden solo a un componente (alveolar) de la enfermedad pulmonar crónica.
Nuestros resultados coinciden con los de otros estudios que han investigado la función pulmonar mediante oscilometría en preescolares que fueron grandes prematuros. Delestrain et al.23 encontraron una resistencia respiratoria elevada (R5), no reversible con broncodilatadores, en el 76% de los niños de 4 años nacidos con ≤28 semanas de edad gestacional, y no encontraron diferencias relacionadas con la DBP. Manti et al.24, estudiando a niños de 3-6 años nacidos con edad gestacional <32 semanas, tampoco encontraron diferencias en los resultados de la OS ni en la respuesta a broncodilatadores entre niños con/sin DBP. Lombardi et al.25 estudiaron a los 5 años a niños nacidos con edad gestacional <32 semanas, encontrando que el 16,5% tenían R8 y AX elevados, sin diferencias entre niños con y sin DBP. Simpson et al.3, estudiando a los 4-8 años a niños nacidos ≤32 semanas de edad gestacional, encontraron un deterioro similar en oscilometría y espirometría entre niños con y sin DBP. Aunque la prevalencia de la afectación puede variar según el sistema de oscilometría y los valores de referencia empleados, nuestro estudio confirma que los preescolares con antecedentes de MBP y GP tienen con mucha frecuencia una función pulmonar alterada, relacionada con una obstrucción de las vías aéreas distales, y que no es atribuible a haber sido o no diagnosticados de DBP.
En cuanto a los TRS en la edad preescolar, varios estudios retrospectivos han encontrado un aumento de riesgo de TRS en los niños con antecedente de prematuridad. Sadras et al.40 identificaron, en niños <2 años (edad media 14,1 meses) y nacidos entre 24-34 semanas de edad gestacional, una prevalencia de TRS mayor que la de niños nacidos a término. A diferencia de nuestros resultados, hallaron una reducción progresiva de esa prevalencia con el aumento de la edad gestacional. En ese estudio, el ODI3 de los prematuros era algo mayor que en el nuestro (medianas de 8,9 vs. 6,1). Ortiz et al.29 estudiaron a niños <3 años (edad media 1,3 años) con DBP, casi el 60% con necesidad de oxígeno suplementario en el momento del estudio. La mediana del ODI3 en ese estudio era de 5,5, y la prevalencia de TRS era superior al 80%, sobre todo a expensas de eventos obstructivos. Los TRS eran más frecuentes a mayor gravedad de la DBP y disminuían rápidamente con el crecimiento. Como en nuestro estudio, la prevalencia de TRS no estaba influida por la edad gestacional. Nosotros hemos estudiado a niños de más edad que en esos 2 estudios, utilizando solo oximetría nocturna, y no encontramos ninguna asociación de las alteraciones de la oximetría nocturna con la DBP o la edad gestacional, ni tampoco con los resultados de la oscilometría.
En conclusión, en esta muestra de preescolares nacidos con MBP y <32 semanas de edad gestacional, es muy alta la prevalencia tanto de alteraciones de la función pulmonar, con un patrón de obstrucción de vías aéreas pequeñas, y probablemente de TRS, pero parecen corresponder a fenómenos independientes entre sí y no relacionados con la DBP.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Resultados parciales de este trabajo se han presentado en la XLVI Reunión Anual Sociedad Española de Neumología Pediátrica (abril 2025).