La infección por Helicobacter pylori (H. pylori) afecta a más del 50% de la población mundial. El aumento en las resistencias antibióticas es la principal causa del fracaso del tratamiento. El objetivo principal fue analizar el éxito erradicador tras la aplicación de las nuevas recomendaciones de tratamiento ESPGHAN e introducción de la PCR como técnica de diagnóstico directo, describir la evolución del patrón local de resistencias antibióticas y valorar el coste-efectividad de la aplicación de la PCR aislada o en conjunto con el cultivo como estrategia diagnóstica.
Pacientes y métodosEstudio descriptivo retrospectivo del total de aislamientos microbiológicos de H. pylori entre 2013-2019 en nuestro centro, mediante comparación del porcentaje de resistencias y éxito erradicador entre los periodos 2013-2016 y 2017-2019. Estudio de coste-efectividad de las pruebas de diagnóstico directo, comparando 3 opciones distintas: cultivo y PCR, solo cultivo, y solo PCR.
ResultadosSe incluyó a 192 pacientes, 98 fueron detectados por cultivo (2013-2016) y 94 por cultivo o PCR (2017-2019). Se instauró tratamiento antibiótico en 153 pacientes, 90 en el primer periodo (pautas ESPGHAN 2011: porcentaje erradicación 62,2%), 63 en el segundo (pautas ESPGHAN 2017: porcentaje erradicación: 73%). Se observó un aumento en las resistencias a claritromicina, pasando de un 16,3% (n=16) en el primer periodo a un 53,2% (n=48) entre 2017-2019 (98% detectadas por PCR, 60% por cultivo). No hubo diferencias en el resto de resistencias antibióticas. La solicitud aislada de la PCR presentó una ratio de análisis de coste-efectividad (CEAR) de 71,91, en comparación con un 92,16 del cultivo y un 96,35 del cultivo y la PCR de forma conjunta.
ConclusionesLa aplicación de las pautas ESPGHAN 2017 consiguió un mayor éxito de erradicación, aunque menor que lo observado en publicaciones previas, sin llegar al objetivo marcado de al menos un 90%. Se observó un incremento en las resistencias a macrólidos, sin poder discriminar si se trata de un aumento real o de una mayor sensibilidad diagnóstica de las técnicas moleculares, siendo la solicitud aislada de la PCR la estrategia más coste efectiva.
Helicobacter pylori (H. pylori) infection affects more than 50% of the world population. Increased antibiotic resistance is the main cause of treatment failure. The main objective was to analyze the eradication success after the application of the new ESPGHAN treatment recommendations and the introduction of PCR as a direct diagnosis technique, describe the evolution of the local pattern of antibiotic resistance, and assess the cost-effectiveness of PCR application, isolated or in conjunction with culture as a diagnostic strategy.
Patients and methodsretrospective descriptive study of all microbiological isolates of H. pylori in 2013-2019 in our center, by comparing the percentage of resistance and eradication success between the periods 2013-2016 and 2017-2019. Cost-effectiveness study of direct diagnostic tests, comparing 3 different options: culture and PCR; only culture; PCR only.
Results192 patients were included, 98 were detected by culture (2013-2016) and 94 by culture and / or PCR (2017-2019). Antibiotic treatment was established in 153 patients, 90 in the first period (2011 ESPGHAN guidelines: eradication percentage 62.2%), 63 in the second (2017 ESPGHAN guidelines: eradication percentage: 73%). An increase in resistance to clarithromycin was observed, going from 16.3% (n=16) in the first period, to 53.2% (n=48) in 2017-2019 (98% detected by PCR, 60% by culture). There were no differences in the rest of antibiotic resistances. The isolated PCR application presented a cost-effectiveness analysis ratio (CEAR) of 71.91, compared to 92.16 for the culture and 96.35 for the culture and PCR combined.
Conclusionsthe application of the ESPGHAN 2017 guidelines achieved greater eradication success, although less than that observed in previous publications, without reaching the target of at least 90%. An increase in resistance to macrolides was observed, without being able to discriminate whether it is a real increase or a greater diagnostic sensitivity of molecular techniques, with the isolated request for PCR being the most cost-effective strategy.
Más de la mitad de la población mundial se encuentra colonizada por Helicobacter pylori (H. pylori), con 4,4 billones de infectados de forma global1,2. En población pediátrica sana, los datos de seroprevalencia están cercanos al 33%, alcanzando el 40% en países en vías de desarrollo3. La infección suele cursar de forma asintomática, aunque hasta un 13% puede presentar complicaciones, en forma de enfermedad ulceropéptica4,5, siendo excepcional el desarrollo de cáncer gástrico o linfoma MALT6. En el año 2017, la ESPGHAN publicó las últimas recomendaciones para su tratamiento7.
La prevalencia de resistencias antibióticas de H. pylori ha aumentado en las últimas décadas. Según diferentes publicaciones, las resistencias a claritromicina oscilan entre un 17,5 y un 49% en Europa4, encontrando las cifras más altas en países del sur, como España o Portugal (32%-49%)8,9. Por su parte, las resistencias a metronidazol se encuentran entre un 20-40% en EE. UU. y Europa, mientras que las de ampicilina no superan el 2,5%10,11. Entre las posibles causas de este incremento, se encuentra la utilización masiva de antibioterapia en la población general12,13, junto con el uso de pautas de tratamiento empíricas no dirigidas por antibiograma (estrategia «test and treat»)14.
El cultivo de mucosa gástrica es el patrón oro tradicional para el diagnóstico de la infección, con una sensibilidad del 50-90% y una especificidad cercana al 100%, detectando resistencias de hasta 5 grupos distintos de antibióticos15,16. Las técnicas de diagnóstico molecular (PCR) detectan un número mayor de casos, al ser pruebas más sensibles y específicas (> 95%), aunque solo son aplicables para macrólidos y fluoroquinolonas17-19.
ObjetivosEl objetivo principal de este estudio fue analizar el éxito erradicador tras la aplicación de las nuevas recomendaciones de tratamiento ESPGHAN y la introducción de la PCR como técnica de diagnóstico directo a partir del año 20177 en comparación con los resultados obtenidos con las pautas previas del año 201120 y el uso exclusivo del cultivo convencional como herramienta diagnóstica.
Los objetivos secundarios fueron describir la evolución del patrón local de resistencias antibióticas entre los años 2013 y 2019, y valorar el coste-efectividad de la aplicación de la PCR aislada o en conjunto con el cultivo como estrategia diagnóstica.
Pacientes y métodosSe realizó un estudio descriptivo retrospectivo del total de aislamientos microbiológicos de H. pylori en muestras de mucosa gástrica mediante cultivo y PCR, en pacientes menores de 16 años, todos naïve al tratamiento, entre los años 2013 y 2019. Se analizaron 2 intervalos (2013-2016 y 2017-2019), tomando como referencia la incorporación de la PCR como técnica diagnóstica17,18, así como el cambio a las nuevas pautas de tratamiento de la ESPHGAN en 20177.
Se compararon los porcentajes de erradicación (mediante análisis por protocolo e intención de tratar) y los porcentajes de resistencias antibióticas a claritromicina, metronidazol y ampicilina entre ambos periodos según la aplicación respectiva de las guías 201120 y 20177. El análisis estadístico se realizó mediante la prueba de la chi al cuadrado para muestras independientes (SPSS v15). No hubo intervención fuera de los protocolos tradicionales de tratamiento y no se incluyeron otros datos personales asistenciales.
Se realizó un análisis de coste-efectividad en el segundo grupo (2017-2019), para evaluar el éxito de erradicación según 3 opciones diagnósticas diferentes. Se realizaron modelos matemáticos que simulaban la situación real en nuestro centro (solicitud de cultivo y PCR en todos los pacientes), con 2 situaciones teóricas (solicitud exclusiva de cultivo o PCR de forma exclusiva). Los porcentajes de erradicación de cada una de las opciones se consideraron como unidades objetivo. Se construyeron 3 árboles de decisión y se cuantificaron los gastos de las pruebas de diagnóstico directo (coste de cultivo: 1 euro por placa, 24,63 euros por antibiograma; coste PCR: 25 euros), con el objetivo de conocer la ratio de análisis de coste-efectividad (CEAR) (coste total por cada caso erradicado).
ResultadosSe incluyó a 192 pacientes en total, de los cuales 98 fueron detectados por cultivo (2013-2016) y 94 por cultivo o PCR (2017-2019).
Se instauró tratamiento antibiótico en 153 pacientes, 90 en el primer periodo (pautas ESPGHAN 2011) y 63 en el segundo (pautas ESPGHAN 2017). Las pérdidas en el seguimiento fueron del 7,8% (n=7) y del 14,3% (n=10), respectivamente. El porcentaje de erradicación fue del 62,2% (n=56) entre 2013 y 2016, y del 73% (n=45) entre 2017 y 2019, siendo esta diferencia estadísticamente significativa (p<0,05) en el análisis por protocolo, pero no en el análisis por intención de tratar.
El resultado del estudio de resistencias antibióticas se presenta en la tabla 1. Se encontraron diferencias estadísticamente significativas entre el porcentaje de resistencias a claritromicina entre ambos periodos, siendo un 16,3% (n=16) en 2013-2016 y un 53,2% (n=48) en 2017-2019 (p<0,05). Del total de resistencias frente a claritromicina en el segundo periodo, el 98% (n=47) fueron detectadas mediante PCR y el 60% (n = 29) por cultivo. No se observaron diferencias en el resto de las resistencias antibióticas.
Resistencias antibióticas de Helicobacter pylori
| 2013-2016 (n=98) | 2017-2019 (n=94) | ||||
|---|---|---|---|---|---|
| Cultivo | Cultivo | PCR | Total | p | |
| Claritromicina | 16,3% (n=16) | 30,8% (n=29) | 50,5% (n=47) | 53,2% (n=48) | < 0,05 |
| Metronidazol | 7,2% (n=7) | 6,3% (n=6) | 0 | 6,3% (n=6) | > 0,05 |
| Ampicilina | 1% (n=1) | 1% (n=1) | 0 | 1% (n=1) | > 0,05 |
| Claritromicina+metronidazol | 3% (n=3) | 2.1% (n=2) | 0 | 2.1% (n=2) | > 0,05 |
En el primer periodo (2013-2016) se observan las resistencias detectadas por cultivo. En el segundo periodo (2017-2019), se muestran las resistencias detectadas de forma independiente por cultivo y PCR, así como las resistencias totales detectadas por ambas pruebas.
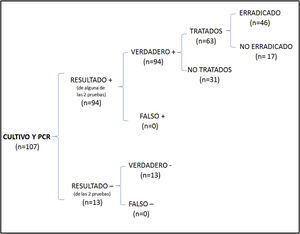
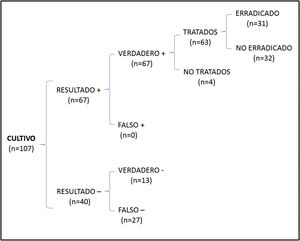
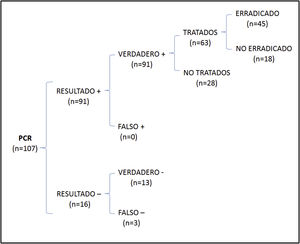
En el análisis de coste-efectividad, del total de 107 muestras recogidas, 13 fueron negativas en ambos casos, 64 presentaron cultivo y PCR positivos, 27 cultivo negativo y PCR positiva, y 3 cultivo positivo y PCR negativa. El análisis del número de casos erradicados en la muestra total se muestra en la figura 1, mientras que los resultados de las 2 otras situaciones teóricas se muestran en la figura 2 (solo cultivo) y en la figura 3 (solo PCR). Los costes totales de cada opción se recogen en la tabla 2. La estrategia más coste-efectiva fue la solicitud aislada de la PCR, con un CEAR de 71,91, en comparación con las otras 2 opciones (CEAR cultivo: 92,16; CEAR cultivo+PCR: 96,35).
Diferentes estrategias diagnósticas en el estudio de coste-efectividad
| Casos erradicados/casos tratados | Costes | Coste-efectividad | Pacientes a tratar para prevenir un caso | |
|---|---|---|---|---|
| Cultivo+PCR | 46/63 (73%) | 4.432,21 euros | 96,35 | 1,37 |
| Cultivo | 31/63 (49,2%) | 2.857,21 euros | 92,16 | 2,03 |
| PCR | 45/63 (71,4%) | 3.236,23 euros | 71,91 | 1,40 |
La decisión de tratamiento en la infección por H. pylori en Pediatría debe ser individualizada y plantearse en pacientes sintomáticos o con complicaciones asociadas7,20. Desde el año 2011, la ESPGHAN y la NASPGHAN consideran como válidas pautas dirigidas por antibiograma de 7 a 14 días de duración o estrategias no dirigidas, como la terapia secuencial20. En el año 2017 se publicaron las nuevas guías, en las que solo se admiten pautas de 14 días y dirigidas en todos los casos por antibiograma7.
En los casos en los que se considere o esté indicada la erradicación, es necesaria la confirmación de la infección mediante al menos 2pruebas de diagnóstico directo en muestra de mucosa gástrica (visualización directa por anatomía patológica, cultivo o PCR)15-17, evitando así la estrategia «test and treat»14.
En el estudio EuroPedHP Registry4, el porcentaje de erradicación para pautas cortas de 7 a 10 días fue del 75,6%, mientras que para las pautas largas de 14 días, del 85%. En nuestro estudio, aunque la eficacia de las pautas de tratamiento ESPGHAN 20177 fue superior con respecto a lo observado previamente con las pautas de 201120, no se alcanzaron dichos valores. Estas diferencias podrían explicarse por nuestro menor tamaño muestral, junto con un porcentaje considerable de pérdidas durante el seguimiento. En ningún caso se alcanzó el objetivo de al menos un 90% de erradicación7.
Las resistencias antibióticas son la primera causa de fallo en el tratamiento de la infección por H. pylori11. En las últimas décadas, se ha observado un aumento en las resistencias de los principales antibióticos implicados en su tratamiento7. Entre las posibles causas, se ha postulado un mayor consumo de macrólidos en España, países del sur de Europa y zona del Pacífico oeste, siendo estas regiones geográficas las que presentan mayores resistencias12,13. Este hecho, junto a la aplicación de pautas «test and treat»14 sin confirmación directa ni estudio microbiológico previo, podrían explicar este incremento.
En nuestro estudio, encontramos una menor prevalencia de resistencias a claritromicina en el primer periodo (2013-2016), con respecto a lo descrito en publicaciones previas9,10. Sin embargo, entre 2017 y 2019, el porcentaje ascendió hasta un 30,8% considerando los aislamientos mediante cultivo, y hasta un 53,2% tras la introducción de la PCR. Mientras que el cultivo detectó un 60% de las resistencias en el segundo periodo, la incorporación de la PCR permitió detectar el 98% de las mismas. La mayor sensibilidad de las técnicas moleculares17,19 podría explicar este aumento, aunque desconocemos si pudo ser debido a una infradetección en el periodo anterior. Ninguno de los pacientes incluidos había recibido tratamiento previo erradicador, por lo que todas estas resistencias se consideraron primarias, sin poder concluir datos sobre la aparición de resistencias secundarias. Con respecto al resto de los antibióticos, las resistencias fueron similares en ambos periodos, pero menores a las descritas en los estudios europeos en el caso del metronidazol, en los que se habla de un porcentaje entre el 20 y el 40%10,11. Las resistencias a ampicilina detectadas en nuestra muestra fueron prácticamente inexistentes.
En el estudio de coste-efectividad de las diferentes estrategias diagnósticas, la solicitud aislada del cultivo fue la opción que generó menor gasto, pero con un porcentaje de erradicación más bajo, del 49,2%. La solicitud de la PCR de forma aislada resultó ser la estrategia más coste-efectiva, con un porcentaje de erradicación del 71,4%, prácticamente similar a la solicitud conjunta de cultivo y PCR, pero con un coste menor. No obstante, el cultivo aporta un valor adicional al detectar resistencias frente a otros antibióticos15,16.
Las limitaciones de nuestro estudio incluyen su carácter retrospectivo y las pérdidas durante el seguimiento, así como la falta de valoración de la adhesión terapéutica al tratamiento y el grado de cumplimiento en los casos no erradicados. La ausencia de aplicación de la PCR en el primer periodo no nos permite saber si este aumento registrado es por una menor detección diagnóstica previa o por un aumento real de la tasa de resistencias. Son necesarios más estudios prospectivos para confirmar estas hipótesis.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.