La dieta baja en FODMAP (acrónimo en inglés de polioles, monosacáridos, disacáridos y oligosacáridos fermentables) ha demostrado eficacia como tratamiento del síndrome de intestino irritable en adultos, siendo escasos los estudios en niños. Nuestro objetivo es analizar la implantación de esta dieta como tratamiento del dolor abdominal crónico funcional en población pediátrica de un área mediterránea, y su respuesta a esta.
Material y métodosSe elaboró una tabla clasificando los alimentos según su contenido en FODMAP, y se diseñó un «Diario de síntomas y deposiciones» para recoger los datos. Posteriormente se realizó un estudio prospectivo con niños con dolor abdominal crónico funcional de nuestra Unidad de Gastroenterología Pediátrica.
ResultadosSe reclutaron 22 pacientes, 20 de los cuales completaron el estudio. Se recogieron durante 3 días datos sobre el dolor abdominal; posteriormente recibieron dieta baja en FODMAP 2 semanas, y al finalizarla recogieron de nuevo dichos datos. Tras la dieta se objetivó disminución en frecuencia diaria de episodios de dolor abdominal (1,16 [RIQ: 0,41-3,33] frente a 2 [RIQ: 1,33-6,33] inicialmente, p=0,024), menor intensidad del dolor (1,41cm [RIQ: 0,32-5,23] frente a 4,63cm [RIQ: 2,51-6,39] inicial, p=0,035, medido mediante Escala Visual Analógica de 10cm), menor interferencia con la actividad diaria y menos síntomas acompañantes. Solo un 15% de los pacientes consideraron la dieta difícil.
ConclusionesLa implantación de una dieta baja en FODMAP durante 2 semanas en una población pediátrica mediterránea con dolor abdominal crónico funcional es posible utilizando dietas adaptadas, es bien valorada por los pacientes, y su evaluación mediante herramientas objetivas muestra mejoría en los síntomas de dolor abdominal.
The low FODMAP diet (fermentable oligosaccharides, monosaccharides, disaccharides, and polyols) has shown to be effective in adult patients with irritable bowel syndrome, but there are few studies on paediatric patients. The aim of this study is to assess the implementation and the outcomes of a low FODMAP diet in the treatment of functional abdominal pain in children from a Mediterranean area.
Material and methodsA table was designed in which foods were classified according to their FODMAP content, as well as a ‘Symptoms and Stools Diary’. A prospective study was conducted on children with functional abdominal pain in our Paediatric Gastroenterology Unit.
ResultsA total of 22 patients were enrolled in the trial, and 20 completed it. Data were collected of the abdominal pain features over a period of 3 days, and then patients followed a two-week low FODMAP diet. Afterwards, information about abdominal pain features was collected again. After the diet, they showed fewer daily abdominal pain episodes compared to baseline (1.16 [IQR: 0.41-3.33] versus 2 [IQR: 1.33-6.33] daily episodes, P=.024), less pain severity compared to baseline (1.41cm [IQR: 0.32-5.23] versus 4.63cm [IQR: 2.51-6.39] measured by 10-cm Visual Analogue Scale, P=.035), less interference with daily activities, and less gastrointestinal symptoms. Only 15% of patients found it difficult to follow the diet.
ConclusionsThe implementation of a low FODMAP diet for 2 weeks in a Mediterranean paediatric population diagnosed with functional abdominal pain is possible with adapted diets. It was highly valued by patients, and they showed an improvement in abdominal pain symptoms assessed by objective methods.
El dolor abdominal crónico (DAC) funcional es la causa más frecuente de dolor abdominal de larga evolución en las consultas de pediatría1, y se incluye dentro de los trastornos funcionales gastrointestinales (TFGI), cuya fisiopatología se atribuye a la interacción de factores psicosociales, ambientales y genéticos, que favorecen la existencia de hiperalgesia visceral, así como alteraciones de la motilidad intestinal y de la distensibilidad de la pared abdominal, que junto con la presencia de una microbiota intestinal anómala favorecen la hiperalgesia visceral2,3.
Se han propuesto múltiples tratamientos para el DAC funcional, sin que ninguno de ellos haya demostrado una clara eficacia. En los últimos años se ha planteado la posible relación entre la clínica de DAC funcional y la malabsorción de ciertos componentes de algunos alimentos, que provocarían síntomas mediante el mecanismo de malabsorción de azúcares, y cuya restricción en la dieta mejoraría los síntomas de dolor abdominal4. Dentro de estas modificaciones dietéticas, en población adulta con síndrome de intestino irritable (SII) se han llevado a cabo estudios basados en la reducción de la ingesta de los hidratos de carbono de cadena corta fermentables, conocidos también como FODMAP (acrónimo en inglés de polioles, monosacáridos, disacáridos y oligosacáridos fermentables)5-10.
La reducción de la ingesta de FODMAP se basa en que estos son escasamente absorbidos en el intestino delgado, por lo que permanecen en la luz intestinal ejerciendo un efecto osmótico que provoca paso de agua hacia la luz, y por otro lado, al no ser absorbidos pasan intactos al colon, donde son fermentados por las bacterias colónicas dando lugar a la formación de gases y ácidos orgánicos, que provocan distensión luminal. En las personas con hiperalgesia visceral, la distensión luminal provocada bien por gases, o por líquido, puede inducir o aumentar los síntomas de dolor abdominal10,11.
Los FODMAP incluyen oligosacáridos fermentables (fructooligosacáridos y galactooligosacáridos), disacáridos (lactosa), monosacáridos (fructosa) y polialcoholes (sorbitol, manitol, maltitol, xilitol)12. La fructosa se absorbe por difusión facilitada mediante el transportador GLUT-5, su malabsorción es dosis-dependiente y aproximadamente el 30% de la población tiene una capacidad de absorberla muy limitada cuando se encuentra libre12,13. La lactosa precisa de la hidrólisis por parte de la enzima lactasa, cuya actividad disminuye a lo largo de la primera infancia en la mayoría de humanos12. Respecto a los polioles, un 70% de ellos no se absorben en los individuos sanos14. Finalmente, el grupo de los oligosacáridos incluye los fructooligosacáridos (FOS), que se absorben escasamente, y los galactooligosacáridos (GOS), que no se absorben15.
En población adulta con SII, se ha demostrado un buen control de los síntomas tras seguir una dieta baja en FODMAP en aproximadamente un 70% de los pacientes16,17. En la población pediátrica, hasta el momento se ha publicado únicamente un estudio en Estados Unidos con niños con SII, con resultados favorables18. Sin embargo, no se ha publicado ninguno en población pediátrica del área mediterránea, cuya dieta es muy diferente a la norteamericana, pues esta incluye habitualmente una cantidad de FODMAP considerablemente superior a los consumidos en nuestra área14.
Por otro lado, dado que el SII se incluye dentro de los TFGI relacionados con el dolor abdominal2, parece razonable plantear que estas modificaciones dietéticas puedan ser útiles como tratamiento del DAC funcional, puesto que los mecanismos fisiopatológicos son similares.
Por todo ello se presenta este estudio, cuyo objetivo principal es evaluar la implantación de la dieta baja en FODMAP en la práctica clínica como tratamiento del DAC funcional en una población pediátrica del área mediterránea, teniendo en cuenta las adaptaciones necesarias a los hábitos dietéticos de dicha zona. Se expone el método de recogida de datos para analizar sus efectos en la reducción de la frecuencia y la intensidad de los episodios de dolor abdominal, la disminución de su interferencia con las actividades diarias, los cambios en las características de las deposiciones y en los síntomas acompañantes, así como la percepción de las familias, mostrando por último los resultados obtenidos en nuestra muestra.
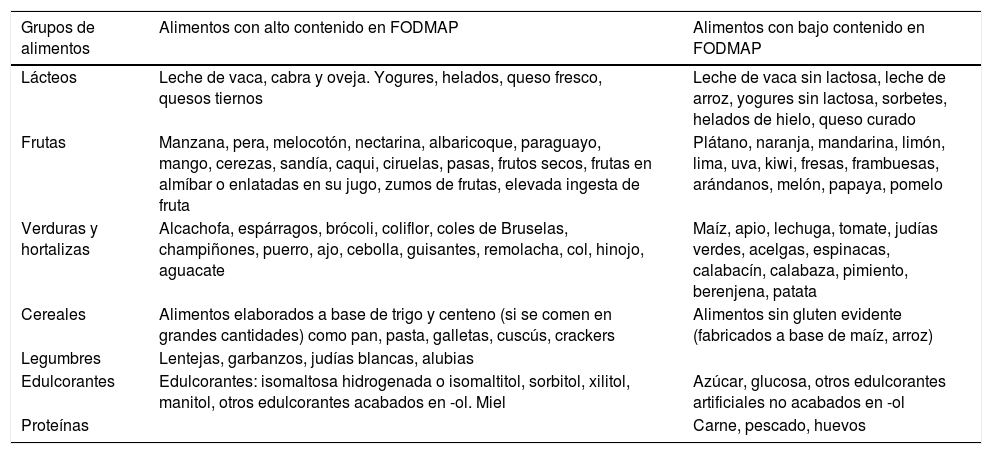
Material y métodosDiseño para la implantación y valoración de la dieta baja en FODMAPPara implantar la dieta baja en FODMAP en población pediátrica del área mediterránea, se realizó una revisión de los alimentos propuestos en estudios previos, como el de Barret y Gibson4 y Magge y Lembo19, y se elaboró una tabla (tabla 1) clasificando los alimentos según su contenido en FODMAP en «permitidos» o «no permitidos», adaptando la selección de alimentos a nuestro medio.
Clasificación de los alimentos según su contenido en FODMAP
| Grupos de alimentos | Alimentos con alto contenido en FODMAP | Alimentos con bajo contenido en FODMAP |
|---|---|---|
| Lácteos | Leche de vaca, cabra y oveja. Yogures, helados, queso fresco, quesos tiernos | Leche de vaca sin lactosa, leche de arroz, yogures sin lactosa, sorbetes, helados de hielo, queso curado |
| Frutas | Manzana, pera, melocotón, nectarina, albaricoque, paraguayo, mango, cerezas, sandía, caqui, ciruelas, pasas, frutos secos, frutas en almíbar o enlatadas en su jugo, zumos de frutas, elevada ingesta de fruta | Plátano, naranja, mandarina, limón, lima, uva, kiwi, fresas, frambuesas, arándanos, melón, papaya, pomelo |
| Verduras y hortalizas | Alcachofa, espárragos, brócoli, coliflor, coles de Bruselas, champiñones, puerro, ajo, cebolla, guisantes, remolacha, col, hinojo, aguacate | Maíz, apio, lechuga, tomate, judías verdes, acelgas, espinacas, calabacín, calabaza, pimiento, berenjena, patata |
| Cereales | Alimentos elaborados a base de trigo y centeno (si se comen en grandes cantidades) como pan, pasta, galletas, cuscús, crackers | Alimentos sin gluten evidente (fabricados a base de maíz, arroz) |
| Legumbres | Lentejas, garbanzos, judías blancas, alubias | |
| Edulcorantes | Edulcorantes: isomaltosa hidrogenada o isomaltitol, sorbitol, xilitol, manitol, otros edulcorantes acabados en -ol. Miel | Azúcar, glucosa, otros edulcorantes artificiales no acabados en -ol |
| Proteínas | Carne, pescado, huevos |
Posteriormente, para recoger los datos sobre las características del dolor abdominal de los participantes en el estudio y poder compararlos con los obtenidos tras realizar la dieta, se diseñó un «Diario de síntomas y deposiciones» (fig. 1) que recoge los siguientes datos:
a) Intensidad del dolor abdominal, valorada mediante la Escala Visual Analógica (EVA), que consta de una línea de 10cm en cuyos extremos aparecen las palabras «sin dolor» y «máximo dolor», y sobre la cual el niño debe dibujar una línea según la intensidad de su dolor20.
b) Número de episodios de dolor abdominal diarios.
c) Interferencia con la actividad diaria, para lo cual se utilizó una escala de tipo Likert con 4 categorías (1 «no interfiere», 2 «interfiere poco», 3 «interfiere mucho», 4 «imposibilita la actividad»)20.
d) Características de las deposiciones según la Escala de Bristol modificada para niños21.
e) Síntomas acompañantes, como distensión abdominal, gases, vómitos, náuseas y otros.
Por último, para evaluar la percepción de la dieta por parte de las familias, se diseñó un cuestionario en el que se recogía la opinión de los niños y sus familias en cuanto a facilidad para seguir la dieta, grado de cumplimiento de la misma, y satisfacción global tras la dieta, utilizando para ello una escala tipo Likert22 con 5 categorías.
Desarrollo del estudioSe realizó un estudio prospectivo durante 10 meses, en el que se incluyeron todos los pacientes de 5 a 15 años con diagnóstico de DAC funcional, según los criterios de RomaIII23, que acudieron de forma consecutiva a la consulta de Gastroenterología y Nutrición Pediátrica de un hospital terciario. Se consideraron criterios de exclusión la edad inferior a 4 o superior a 15 años, la existencia de signos de alarma o sospecha de organicidad, diagnóstico previo de patología orgánica o la no aceptación por parte de los padres de participar en el estudio.
Todos los pacientes seleccionados y sus padres o tutores fueron informados sobre el mismo, haciéndose entrega de un documento de información, y una vez aceptaron, firmaron un consentimiento informado antes de ser incluidos en el estudio. El estudio fue aprobado por el Comité Ético de Investigación Clínica de nuestra comunidad autónoma.
Análisis de las variablesPara la realización de la base de datos y el estudio descriptivo y analítico se utilizaron los programas Microsoft Excel 2007 y SPSS versión 23.0. Los resultados descriptivos se expresaron en forma de mediana y rango intercuartílico. Para el estudio analítico, dado el tamaño de la muestra (n=20) se aplicaron pruebas no paramétricas. Los test estadísticos empleados fueron el test de Wilcoxon y la prueba de McNemar. El límite mínimo de significación estadística aceptado en todo el cálculo estadístico ha sido del 95% (p<0,05).
ResultadosSe reclutaron 22 pacientes, de los cuales 20 concluyeron el estudio (10 mujeres y 10 varones). De las 2 pérdidas que tuvieron lugar, una fue antes de iniciar la dieta por mejoría del dolor abdominal, y otra durante la dieta por su situación familiar. La edad mediana de la muestra era de 10 años (RIQ: 8,25-11,75), y la mediana de tiempo de evolución del dolor abdominal era de 36 meses (RIQ: 12-99). En todos los pacientes se había realizado previamente una ecografía abdominal y una analítica de sangre, que incluía hemograma, bioquímica, marcadores de enfermedad celiaca, inmunoglobulinas, función hepática, y reactantes de fase aguda. Según los criterios de RomaIII23, de los 20 pacientes 13 presentaban criterios de dolor abdominal funcional, 6 dispepsia funcional y uno SII.
Una vez incluidos en el estudio, se entregó a los pacientes el «Diario de síntomas y deposiciones» que debían rellenar durante 3 días consecutivos, tras lo cual comenzaron una dieta baja en FODMAP durante 2 semanas. Para ello se les explicó en qué consistía la dieta, entregándoles la tabla de alimentos según su contenido en FODMAP (tabla 1). Se les indicó que durante 2 semanas debían prescindir de todos los alimentos con alto contenido en FODMAP, señalando que en dicha tabla se ofrecían alternativas permitidas, por su bajo contenido en FODMAP, de todos los grupos de alimentos (salvo legumbres). Durante los 3 últimos días de la dieta se les solicitó que completasen de nuevo un «Diario de síntomas y deposiciones» idéntico al inicial, y tras la dieta, los pacientes fueron reevaluados y las familias interrogadas sobre facilidad, grado de satisfacción y cumplimiento de la dieta22. Por último, tras esta fase restrictiva inicial de 2 semanas, se recomendó la reintroducción progresiva de FODMAP. El orden de reintroducción de los diferentes grupos de alimentos con alto contenido en FODMAP se dejó a elección del paciente, siempre y cuando lo hiciera en distintos días y a dosis crecientes para poder identificar los alimentos relacionados con el dolor abdominal, así como la cantidad de los mismos que desencadenan dolor en cada paciente.
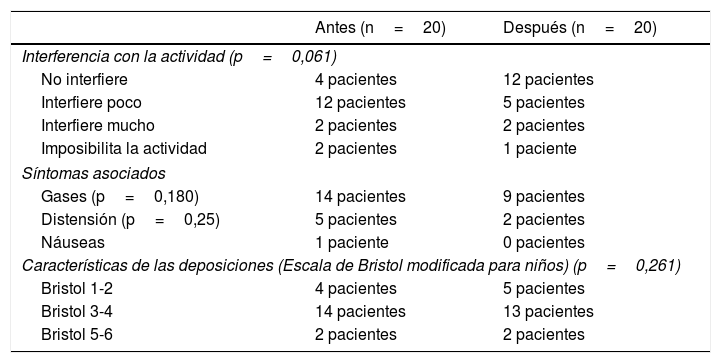
Comparando el diario inicial con el final, se observó que tras seguir una dieta baja en FODMAP durante 2 semanas, los pacientes presentaron una reducción en la frecuencia diaria de episodios de dolor abdominal, siendo la mediana inicial de 2 (RIQ: 1,33-6,33), y tras la dieta 1,16 (RIQ: 0,41-3,33) (p=0,024), así como un descenso en la intensidad del dolor abdominal, de 4,63 (RIQ: 2,51-6,39) (medido mediante la escala EVA de 10cm) a 1,41 (RIQ: 0,32-5,23) (p=0,035). También mostraron tras la dieta una menor interferencia del dolor abdominal con la actividad diaria, y menor aparición de síntomas acompañantes como distensión abdominal o gases, manteniéndose similares las características de las deposiciones, sin observarse diferencias estadísticamente significativas (tabla 2).
Síntomas antes y después de la dieta
| Antes (n=20) | Después (n=20) | |
|---|---|---|
| Interferencia con la actividad (p=0,061) | ||
| No interfiere | 4 pacientes | 12 pacientes |
| Interfiere poco | 12 pacientes | 5 pacientes |
| Interfiere mucho | 2 pacientes | 2 pacientes |
| Imposibilita la actividad | 2 pacientes | 1 paciente |
| Síntomas asociados | ||
| Gases (p=0,180) | 14 pacientes | 9 pacientes |
| Distensión (p=0,25) | 5 pacientes | 2 pacientes |
| Náuseas | 1 paciente | 0 pacientes |
| Características de las deposiciones (Escala de Bristol modificada para niños) (p=0,261) | ||
| Bristol 1-2 | 4 pacientes | 5 pacientes |
| Bristol 3-4 | 14 pacientes | 13 pacientes |
| Bristol 5-6 | 2 pacientes | 2 pacientes |
Al finalizar el estudio, se interrogó a los pacientes y a sus familias sobre su percepción de la dieta. De los 20 pacientes, 6 respondieron que les resultó muy fácil de seguir, a 7 les pareció fácil, 4 refirieron dificultad media y 3 indicaron que era difícil. En cuanto al cumplimiento, 13 referían mucho cumplimiento, 6 bastante y uno regular, y globalmente, 8 de los 20 pacientes respondieron que estaban muy satisfechos con los resultados obtenidos, 4 bastante satisfechos, 4 indiferentes, uno poco y 3 nada satisfechos.
DiscusiónEl DAC funcional puede afectar negativamente a la calidad de vida de los pacientes, pues a menudo presentan sintomatología de larga evolución para la que ninguno de los tratamientos disponibles ha sido eficaz24.
En los últimos años, en paralelo al aumento de la prevalencia de DAC funcional, se ha observado un cambio en el patrón de alimentación occidental, con un incremento en el consumo de fructosa, fructanos, debido a la mayor ingesta de alimentos procedentes del trigo y alimentos procesados, así como polioles, debido a la mayor demanda de productos sin azúcar25. Este aumento de la ingesta de FODMAP favorecería la aparición de dolor abdominal en los niños con DAC funcional debido a que estos son absorbidos escasamente en el intestino delgado, ejerciendo un efecto osmótico, y son fermentados por las bacterias colónicas, produciendo gases y distensión luminal13. Por lo tanto, cuando se consume una dieta reducida en FODMAP, descienden la actividad osmótica luminal, la fermentación de los hidratos de carbono y la formación de gas, logrando así reducir la distensión y el dolor abdominal en estos niños.
El único trabajo en la literatura que estudia la dieta baja en FODMAP en pediatría está realizado en niños estadounidenses con SII18. Consideramos relevante evaluar la posibilidad de la implantación de esta dieta en la práctica clínica en niños del área mediterránea con DAC funcional en una consulta de Gastroenterología y Nutrición Pediátrica.
Para ello, se elaboró, con base en estudios previos4,19, una tabla de alimentos según su contenido en FODMAP adaptada a la dieta mediterránea, que informa sobre nuestros alimentos básicos y ofrece gran cantidad de alternativas a los alimentos excluidos.
Por otro lado, para realizar una recogida de datos válida, hemos elaborado un «Diario de síntomas y deposiciones» que de una forma rápida y sencilla permite obtener información sobre las características del dolor abdominal basal y tras la dieta, compararlas fácilmente y evaluar los cambios de forma objetiva, evitando el posible sesgo de medición. Para valorar la intensidad del dolor abdominal, se optó por emplear la Escala Visual Analógica, pues ha demostrado ser fácil de utilizar, válida y fiable para la valoración del dolor en niños20.
En cuanto a la respuesta clínica, la dieta baja en FODMAP puede suponer una opción de tratamiento para los niños con DAC funcional, ya que en nuestra muestra se observa tras la dieta una reducción considerable tanto en la frecuencia de episodios diarios de dolor abdominal como en su intensidad, así como una disminución de los síntomas acompañantes. Estos datos son equiparables a los obtenidos por Chumpitazi et al.18, que muestran una mejoría de estos parámetros tras la dieta baja en FODMAP comparándolos tanto con los observados durante la dieta basal como con la dieta típica americana.
Asimismo, en los estudios realizados en población adulta con SII se muestra que tras la dieta baja en FODMAP los pacientes presentaron una reducción significativa del dolor y la distensión abdominales, tanto en los estudios de cohortes7,8 como comparados con aquellos que siguieron la dieta tradicionalmente recomendada para el SII16,26,27 y los que realizaron una dieta alta en FODMAP9,10.
En nuestro estudio, los pacientes presentan también un descenso en la interferencia del dolor abdominal con la vida diaria tras seguir una dieta baja en FODMAP, lo cual supone una mejora importante en su calidad de vida, como se ha mostrado en adultos28. Por otro lado, no se observan diferencias en las características de las deposiciones tras la dieta, tal y como sucede en estudios previos9,16,26.
El diseño del estudio tiene como fin valorar la implantación de esta dieta en la práctica clínica habitual. Por ello, aunque nuestros resultados muestran un buen control de los síntomas tras seguir una dieta baja en FODMAP, no permiten establecer conclusiones sobre su eficacia como tratamiento del DAC funcional en pediatría en nuestro medio, debido al tamaño muestral y, principalmente, a la ausencia de grupo control. Debe tenerse en cuenta que, al seguir una dieta de exclusión, sin disponerse de grupo control, los resultados favorables obtenidos pueden deberse en parte al posible efecto nocebo tras la retirada de ciertos alimentos. Sin embargo, estas limitaciones son comunes a muchos de los estudios publicados sobre tratamientos dietéticos, pues resulta difícil desarrollar estudios controlados a doble ciego con dietas29,30.
Por otro lado, existe controversia sobre el papel que pudiera tener la sensibilidad al gluten no celiaca (SGNC) sobre la mejoría de estos pacientes, pues en la dieta baja en FODMAP se excluye el trigo y, por consiguiente, en gran medida el gluten. Sin embargo, también se ha observado que al menos parte de los pacientes con SGNC mejoran gracias a la retirada de los oligosacáridos (FODMAP) presentes en el trigo, sin influir la ingesta de gluten30-32, por lo que parece necesario ampliar los estudios en este tema.
Puesto que se trata de una dieta restrictiva, existe preocupación sobre su equilibrio nutricional a largo plazo. En adultos se ha observado una reducción de la ingesta de fibra durante la dieta5, y un discreto descenso en la ingesta calórica y de calcio, que se normalizarían tras la adecuada reintroducción progresiva de FODMAP33. Si los pacientes reciben un buen asesoramiento nutricional, esta dieta puede considerarse nutricionalmente adecuada34, no así si se realiza sin supervisión médico-dietética35,36.
No obstante, no existen estudios que evalúen las consecuencias nutricionales de una dieta baja en FODMAP en población pediátrica. Este es uno de los motivos por los que en nuestro estudio se limitó la duración de la fase restrictiva de la dieta a 2 semanas, en lugar de 3-6 semanas como se propone para población adulta5, dado que podría ser igual de eficaz18,19, minimizando los posibles riesgos nutricionales y facilitando el cumplimiento. Así, la mayoría de los pacientes estudiados consideró esta dieta fácil o muy fácil de seguir, y casi todas las familias refieren un elevado cumplimiento de la dieta, lo cual se relaciona con un mejor control de los síntomas7,11.
Por último, se han planteado dudas acerca del posible efecto negativo de la restricción de FODMAP, con efecto prebiótico, sobre la microbiota intestinal. Tras la dieta, se han observado cambios en su composición, y reducción en la concentración de bifidobacterias10,11,26,37, sin observarse aumento de bacterias perjudiciales38, siendo desconocidos los efectos a largo plazo sobre la microbiota39.
Por todo ello, no se recomienda seguir la dieta baja en FODMAP durante periodos de tiempo prolongados, sino llevar a cabo inicialmente una fase restrictiva limitada, seguido de la reintroducción progresiva de los distintos alimentos para determinar cuáles provocan síntomas y liberalizar la dieta al máximo, siendo necesaria en ocasiones únicamente una discreta reducción de ciertos FODMAP40.
Como conclusión, la puesta en marcha de una dieta baja en FODMAP a corto plazo en los niños de nuestro medio como tratamiento del DAC funcional es posible mediante el empleo de dietas adaptadas, siendo recomendable el uso de herramientas objetivas para valorar la evolución de los síntomas. Cabe destacar que, en nuestra muestra, los niños y sus familias consideran esta dieta fácil de seguir, lo cual, junto con los resultados favorables obtenidos, conlleva una elevada satisfacción por parte de los pacientes. Dado que no se dispone de datos sobre su seguridad nutricional a largo plazo en pediatría y sus efectos sobre la microbiota intestinal, es recomendable limitar la fase restrictiva de la dieta a un corto periodo de tiempo, con la posterior reintroducción progresiva de alimentos, además de realizarlo bajo supervisión médico-dietética.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Presentación previa en congresos. Este estudio ha sido presentado en la 50.a Reunión anual de la ESPGHAN (European Society for Paediatric Gastroenterology, Hepatology and Nutrition), celebrada en Praga del 11 al 13 de mayo de 2017.