Además de las consecuencias en términos de morbimortalidad (especialmente en pacientes adultos), la pandemia de SARS-CoV-2/COVID-19 ha amenazado con bloquear los circuitos asistenciales habituales. En este sentido, la detección de SARS-CoV-2 en pacientes con necesidad de contacto reiterado con el sistema sanitario ha obligado a establecer estrategias seguras de control clínico y de negativización.
Se analizaron los datos de los pacientes diagnosticados de infección por SARS-CoV-2 mediante PCR en muestra respiratoria entre el 11 de marzo y el 30 de abril de 2020 en un hospital terciario pediátrico de referencia de Barcelona (España), a los que se hubiera practicado posteriormente un nuevo estudio para comprobar la negativización de la PCR en aspirado nasofaríngeo. Dicho estudio se realizó a pacientes con necesidad de asistencia seriada en hospitales de día, procedimientos, hospitalizaciones programadas, etc. Para estos controles clínicos y de negativización, y posterior reintegración a la asistencia habitual, se habilitó un circuito seguro con controles de PCR idealmente semanales pero adaptados a circunstancias logísticas (mediana de días entre controles: 8; rango intercuartílico [RIC]: 6-13días).
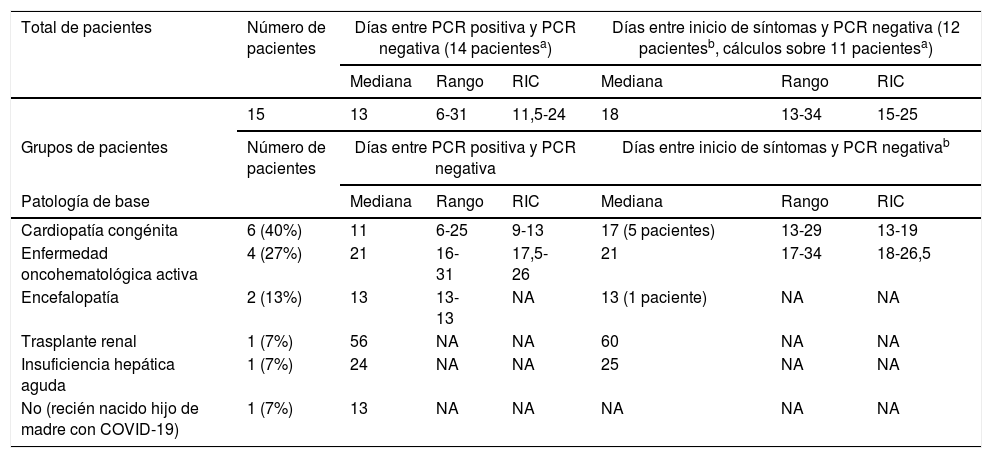
Del total de 25 pacientes con infección por SARS-CoV-2 atendidos en nuestro hospital durante este periodo, se recogieron 15 pacientes que cumplían con los criterios de inclusión, con una mediana de edad de 22meses (rango: 1día-15años; RIC: 1-148meses), 60% varones. Doce casos se estudiaron por cuadro clínico compatible con COVID-19 (5 presentaron clínica respiratoria y fiebre; 4, cuadro respiratorio afebril; 2, fiebre sin foco, y uno, cuadro gastrointestinal con fiebre), 2 casos por cribado al ingreso según protocolo y un caso como estudio de hijo de madre con COVID-19. Siete niños (46%) precisaron ser hospitalizados por COVID-19, necesitando ingreso 3 de ellos en la Unidad de Cuidados Intensivos Pediátricos. Todos los pacientes evolucionaron favorablemente. Otros 6 (40%) ingresaron por motivos no relacionados con la COVID-19, y los 2 pacientes restantes no precisaron hospitalización (13%). En cuanto a la patología de base, 6 pacientes (40%) tenían cardiopatías congénitas; 4 (27%), enfermedades oncohematológicas activas; 2 (13%), encefalopatía, además de una paciente trasplantada renal y otro niño con insuficiencia hepática aguda (7% respectivamente). El paciente restante fue un neonato hijo de madre con COVID-19, sin comorbilidades.
Globalmente, la mediana de tiempo hasta la negativización de la PCR fue de 13días (RIC: 6-31). Ocho pacientes (53%) necesitaron más de una PCR de control hasta dicha negativización, hasta un máximo de 4 en un caso. Se constató una mediana de tiempo significativamente mayor desde la PCR positiva inicial hasta el primer resultado negativo en pacientes inmunodeprimidos respecto a no inmunodeprimidos (21días vs. 13días, p=0,015). La mediana de tiempo desde el inicio de la clínica en casos sintomáticos hasta el resultado negativo fue de 18días (rango: 13-34; RIC: 15-25), concordante con estudios realizados en adultos1,2, y algo mayor que en trabajos pediátricos recientes en pacientes con COVID-19 no grave y sin especificarse patología de base3. En la tabla 1 se detallan los tiempos de negativización por grupo de pacientes.
Datos de negativización de la PCR a SARS-CoV-2 en función de distintas variables
| Total de pacientes | Número de pacientes | Días entre PCR positiva y PCR negativa (14 pacientesa) | Días entre inicio de síntomas y PCR negativa (12 pacientesb, cálculos sobre 11 pacientesa) | ||||
|---|---|---|---|---|---|---|---|
| Mediana | Rango | RIC | Mediana | Rango | RIC | ||
| 15 | 13 | 6-31 | 11,5-24 | 18 | 13-34 | 15-25 | |
| Grupos de pacientes | Número de pacientes | Días entre PCR positiva y PCR negativa | Días entre inicio de síntomas y PCR negativab | ||||
| Patología de base | Mediana | Rango | RIC | Mediana | Rango | RIC | |
| Cardiopatía congénita | 6 (40%) | 11 | 6-25 | 9-13 | 17 (5 pacientes) | 13-29 | 13-19 |
| Enfermedad oncohematológica activa | 4 (27%) | 21 | 16-31 | 17,5-26 | 21 | 17-34 | 18-26,5 |
| Encefalopatía | 2 (13%) | 13 | 13-13 | NA | 13 (1 paciente) | NA | NA |
| Trasplante renal | 1 (7%) | 56 | NA | NA | 60 | NA | NA |
| Insuficiencia hepática aguda | 1 (7%) | 24 | NA | NA | 25 | NA | NA |
| No (recién nacido hijo de madre con COVID-19) | 1 (7%) | 13 | NA | NA | NA | NA | NA |
| Inmunosupresión farmacológica | Mediana | Rango | RIC | Mediana | Rango | RIC | |
|---|---|---|---|---|---|---|---|
| Sí | 5 (33,3%) | 21 (4 pacientesa) | 16-31 | 17,5-26 | 21 (4 pacientesa) | 18-34 | 18-26,5 |
| No | 10 (66,6%) | 13 | 6-25 | 10,5-13 | 17 (7 pacientes) | 13-29 | 13-22 |
| Tratamiento | Mediana | Rango | RIC | Mediana | Rango | RIC | |
|---|---|---|---|---|---|---|---|
| Pacientes que recibieron lopinavir-ritonavirc | 3 (20%) | 12 | 10-25 | 11-18,5 | 19 | 17-29 | 18-24 |
| Pacientes que recibieron HCQ+azitromicinad | 5 (33,3%) | 13 | 9-25 | 10-16 | 17 | 13-29 | 13-17 |
| Sin tratamiento específico | 9 (60%) | 15,5 (8 pacientesa) | 6-31 | 13-24 | 24 (5 pacientesa) | 13-34 | 18-25 |
| Rango etarioe | Mediana | Rango | RIC | Mediana | Rango | RIC | |
|---|---|---|---|---|---|---|---|
| Menores de 2años | 8 (53%) | 13 | 9-25 | 12-14 | 17 (5 pacientes) | 13-29 | 13-17 |
| Mayores de 2años | 7 (47%) | 21 (6 pacientesa) | 12-31 | 14-24 | 21,5 (6 pacientesa) | 13-34 | 18-25 |
| Presencia de síntomas compatibles | Mediana | Rango | RIC | Mediana | Rango | RIC | |
|---|---|---|---|---|---|---|---|
| Sintomáticos | 12 (80%) | 16 (11 pacientesa) | 9-31 | 12,5-24 | 18 (11 pacientesa) | 13-34 | 15-24,5 |
| Asintomáticos | 3 (20%) | 13 | 6-13 | 9,5-13 | NA |
HCQ: hidroxicloroquina; NA: no aplicable; RIC: rango intercuartílico.
Para estos cálculos se excluyó a la paciente trasplantada renal dado que se aplazó su control de negativización para hacerlo coincidir con una visita programada alejada en el tiempo.
Incluye un paciente que recibió únicamente lopinavir-ritonavir (tiempo de negativización 12 días), otro que recibió lopinavir-ritonavir junto con HCQ y azitromicina (tiempo de negativización 25 días) y un tercero al que se administró lopinavir-ritonavir, remdesivir, HCQ y azitromicina (tiempo de negativización 16 días).
En varios casos se pospuso la realización de la PCR de control para que coincidiera con visitas programadas del paciente, pudiéndose haber sobreestimado el tiempo de negativización. En este sentido, para los cálculos se excluyó a una paciente trasplantada renal cuyo control se aplazó 56 días por dicho motivo. Por otro lado, debido a una muestra limitada, no se pudieron analizar diferencias en función de edad, gravedad ni tratamiento, a pesar de que podrían resultar significativamente relevantes2. Tampoco se valoraron los datos de umbral de ciclo (Ct) de PCR, aunque valores elevados podrían sugerir restos virales, no necesariamente asociados con contagiosidad4.
Dado que la infectividad efectiva de cada paciente parece ser menos prolongada que el periodo de excreción de material genético viral, se debe considerar que los controles de negativización de PCR podrían ser sustituidos en población general por periodos de cuarentena como los recomendados por la OMS y el CDC, siendo necesaria mayor evidencia científica en el paciente pediátrico5. Sin embargo, los pacientes inmunodeprimidos o atendidos en unidades con pacientes complejos o frágiles podrían seguir necesitando estrategias de desaislamiento basadas en controles de negativización, uso del Ct o estudio serológico. Son necesarios más estudios sobre la aplicación del Ct de PCR en pacientes pediátricos y en inmunodeprimidos4, y es preciso seguir buscando el equilibrio entre evitar el retraso de procedimientos o tratamientos necesarios para niños con COVID-19 y la seguridad de los circuitos.
Los datos expuestos en el presente trabajo pueden suponer una base valiosa en la adaptación a la realidad pandémica para centros con pacientes similares.