La microflora intestinal de los lactantes amamantados tiene un papel primordial en la función intestinal y en el desarrollo del sistema inmune. Los oligosacáridos presentes en la leche materna estimulan selectivamente el crecimiento de Bifidobacterias y Lactobacilos en el intestino.
En los últimos años se han realizado varios intentos para obtener una flora similar en lactantes alimentados con fórmulas infantiles. Una de las posibilidades para obtener este efecto es proporcionar nutrientes selectivos para esta microflora beneficiosa (prebióticos).
ObjetivoRealizar una revisión de la evidencia científica disponible sobre la incorporación de prebióticos a los alimentos para lactantes y su posible influencia en la respuesta inmune.
Material y métodosSe realizó un amplia búsqueda bibliográfica con los siguientes términos de búsqueda: “prebióticos OR oligosacáridos OR microflora intestinal AND fórmula infantil AND resultados”. Se hizo especial análisis de los estudios clínicos con fórmulas infantiles que incorporaran prebióticos.
ResultadosUn prebiótico es una sustancia no absorbible en el intestino delgado y susceptible de fermentación por la flora colónica. El empleo de una mezcla determinada de galactooligosacáridos y fructooligosacáridos en una fórmula infantile aumenta el número de bifidobacterias de una forma dependiente de la dosis (el efecto máximo obtenido a una concentración de 0,8 g/dl) y reduce el número de gérmenes patógenos tanto en lactantes pretérminos como a término cuando se comparaban con lactantes que recibían una fórmula no suplementada. El efecto de los oligosacáridos sobre el metabolismo bacteriano se estudió midiendo la producción de ácidos grasos de cadena corta y el pH fecal. Estudios más recientes han mostrado beneficios clínicos de la incorporación de una mezcla de prebióticos a una fórmula infantil. En primer lugar, se ha visto una disminución en el riesgo de aparición de dermatitis atópica en lactantes de riesgo; en segundo lugar, una reducción en el número de episodios infecciosos, fundamentalmente intestinales e infecciones de vías respiratorias superiors en el primer año de vida.
Puede especularse que los prebióticos pueden tener un papel importante en la prevención de la alergia y de las infecciones leves en el lactante.
The intestinal microflora of breast-fed infants is an important physiological factor in gut function and the development of the immune system. Human milk oligosaccharides have been shown to selectively stimulate the growth of Bifidobacteria and Lactobacilli in the intestine.
In the last few years several attempts have been made to establish the presence of similar microbiota in formulafed infants. One of the approaches to modify the balance of intestinal microflora is to supply the potentially helpful microbiota with selective nutrients (prebiotics).
GoalTo review the current scientific evidence related to the addition of prebiotics to infant feeds and their possible role in the immune function.
Material and methodsA bibliographic search with Mesh terms: Prebiotics OR oligosaccharides OR intestinal microflora AND infant formula AND results was performed. Special analysis was done on clinical studies.
ResultsPrebiotics are substances that are not absorbed through the small intestine and are fermented by colonic bacteria. A prebiotic mixture from galacto-oligosaccharides and fructo-oligosaccharides has been used to mimic the effect of human milk oligosaccharides. It has been demonstrated that such a mixture significantly increases the number of bifidobacteria in a dose-related way (maximum effect at 0.8 g/dl) and reduces the number of pathogens in term as well as in preterm infants when compared with a group of infants fed a non-supplemented formula. The effect of oligosaccharides on bacterial metabolism was studied by measuring short chain fatty acid production and fecal pH.
More recent studies have been able to show clinical benefits with the use of a prebiotic mixture in infant formulas. Firstly, it has been shown to decrease the risk of developing atopic dermatitis in high risk infants; secondly a reduced incidence of intestinal as well as upper airway infections in the first year of life.
It can be hypothesized that prebiotics might play an important role as a new concept in allergy and infection prevention in infants.
El conocimiento de la composición de la microflora intestinal se remonta a algo más de un siglo. En las últimas décadas se ha visto acompañado por un interés creciente por determinar la relación que existe entre la microbiota y el desarrollo de la inmunidad y la propia función del intestino. La aplicación de estos hallazgos en el desarrollo de alimentos infantiles tiene indudable interés. Revisamos en este trabajo la evidencia científica disponible sobre el papel de los prebióticos en la composición de la microflora intestinal y los efectos de su incorporación a las fórmulas lácteas.
El sistema inmune existe para proteger al individuo frente a los organismos patógenos. Para ello ha desarrollado un sistema complejo que incluye mecanismos de reconocimiento, respuesta, eliminación y memoria. Además, el sistema inmune actúa asegurando una tolerancia a lo “propio”, a los alimentos, a otros componentes ambientales así como a las bacterias comensales. El ser humano vive rodeado de un medio con un elevado contenido bacteriano. Una relación cordial, simbiótica, con estos microorganismos que constituyen la flora intestinal o microbiota parece, pues, clave para la supervivencia. El número de bacterias alcanza valores 10 veces superiores al de las células del organismo, lo que constituye colectivamente un “órgano” activo, cuyo metabolismo influye de forma decisiva en el mantenimiento de la homeostasis del individuo1.
La presencia de bacterias vivas en la luz del colon tiene un impacto importante en la fisiología del individuo: intervienen en el mantenimiento del epitelio colónico, en la integridad de la mucosa y en la absorción de vitaminas y minerales entre otras funciones2. El hombre no podría vivir sin su flora. Pero además, cambios cuantitativos en la flora intestinal pueden tener efectos importantes en las citocinas de la pared intestinal, que, a su vez, influirán en el tipo de respuesta de células T que se generan ante los antígenos orales. Llama poderosamente la atención la explosión en los últimos 50 años de enfermedades alérgicas y atópicas en los países desarrollados con un alto nivel de higiene doméstica3,4.
La exposición a las bacterias durante el parto y a partir de la piel de la madre así como la provisión de factores inmunológicos en la leche materna son elementos clave en la maduración del intestino del lactante y, por extensión, de su sistema inmune intestinal.
La alimentación puede ser fuente de antígenos frente a los que el sistema inmune debe hacerse tolerante; proporciona factores que, a su vez, pueden modular la respuesta inmune y elementos que influyen sobre la flora intestinal. Por lo tanto, la alimentación en las primeras etapas de la vida puede afectar a la competencia inmune posterior, a la capacidad para organizar una respuesta inmune adecuada frente a la infección, a la capacidad de desarrollar una tolerancia a lo propio así como a antígenos ambientales no perjudiciales y al desarrollo de alteraciones inmunológicas5. Aunque son muchos los elementos en la alimentación del lactante que pueden desarrollar este papel, nos ceñiremos en esta revisión a la acción de los prebióticos incorporados a los alimentos para el lactante, sobre todo a las fórmulas infantiles.
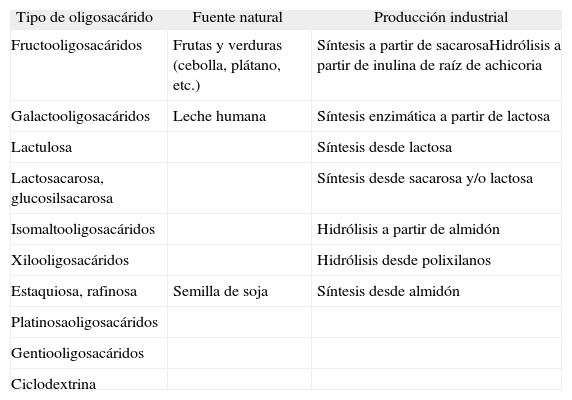
PREBIÓTICOSEl término “prebiótico” se refiere a un ingrediente alimentario no digerible que afecta beneficiosamente al huésped mediante la estimulación selectiva del crecimiento y/o actividad de una o un número limitado de bacterias en el colon, es decir, se trata de influir positivamente en la microflora intestinal mediante la dieta, mejorando la salud del huésped6,7. La eficacia de los prebióticos está ligada a su capacidad de resistir la digestión en el intestino delgado y alcanzar el colon. Es decir, un grupo restringido de microorganismos, fundamentalmente bifidobacterias y lactobacilos, los utilizaría de un modo selectivo. Para que un ingrediente alimentario se considere prebiótico debe cumplir los siguientes criterios: 1) no debe ser hidrolizado ni absorbido en el tracto digestivo superior; 2) tiene que ser un sustrato selectivo de uno o un número limitado de bacterias colónicas beneficiosas, y estimular su número o actividad metabólica; 3) debe modificar el equilibrio de la microflora a favor de una composición mejor, y 4) debe producir efectos beneficiosos sistémicos o luminales en el organismo que los ingiere. Algunos hidratos de carbono no digeribles, algunos péptidos y proteínas y ciertos lípidos serían candidatos a prebióticos. De entre estos “alimentos colónicos”, los hidratos de carbono no digeribles aparecen naturalmente en algunos alimentos y cumplen los criterios de prebiótico citados anteriormente8. Después de múltiples estudios, se ha observado que sólo un grupo de oligosacáridos puede considerarse prebiótico. La inulina y sus derivados, los fructooligosacáridos (FOS) han demostrado actividad prebiótica9. Entre los oligosacáridos de origen lácteo destacan los galactooligosacáridos, la lactulosa, el lactitol y la lactosacarosa10,11 (tabla 1).
Oligosacáridos presentes en alimentos y tipo de fuente disponible
| Tipo de oligosacárido | Fuente natural | Producción industrial |
| Fructooligosacáridos | Frutas y verduras (cebolla, plátano, etc.) | Síntesis a partir de sacarosaHidrólisis a partir de inulina de raíz de achicoria |
| Galactooligosacáridos | Leche humana | Síntesis enzimática a partir de lactosa |
| Lactulosa | Síntesis desde lactosa | |
| Lactosacarosa, glucosilsacarosa | Síntesis desde sacarosa y/o lactosa | |
| Isomaltooligosacáridos | Hidrólisis a partir de almidón | |
| Xilooligosacáridos | Hidrólisis desde polixilanos | |
| Estaquiosa, rafinosa | Semilla de soja | Síntesis desde almidón |
| Platinosaoligosacáridos | ||
| Gentiooligosacáridos | ||
| Ciclodextrina |
Los FOS son oligosacáridos lineales, de cadena media o corta, formados por moléculas de fructosa unidas por enlaces glucosídicos β-1,2 unidos, o no a una molécula de glucosa y con diferentes grados de polimerización. Los FOS son fermentados en la parte inferior del colon por la mayor parte de las especies de bifidobacterias existentes allí12. Los estudios de digestibilidad indican que los enlaces glucosídicos β-1,2 son resistentes a todas las enzimas digestivas humanas13. Se encuentran en forma natural en frutas y verduras como el puerro, la cebolla, el ajo y la alcachofa, entre otros. Los galactooligosacáridos (GOS) son oligosacáridos presentes en la leche materna, que están formados por moléculas de galactosa unidas a una molécula de glucosa mediante enlaces glucosídicos β-1,4. Son fermentados en la parte superior del colon y los estudios de digestibilidad realizados in vitro demuestran que son estables en pH ácido y que la lactasa y otras enzimas digestivas no los hidrolizan.
FUNDAMENTOS DE LA ACCIÓN PREBIÓTICAEl efecto primario del prebiótico es una interacción con la capacidad fermentativa del ecosistema gastrointestinal. Esta acción puede deberse a interacciones microbio-microbio, interacciones microorganismo-huésped, y/o interacciones entre el huésped y metabolitos originados por los microorganismos. Entre estos metabolitos destacan los ácidos grasos de cadena corta (AGCC) acetato, propionato y butirato, todos ellos biológicamente activos.
Las propiedades nutricionales de los prebióticos están relacionadas directamente con los cambios fisiológicos que ocasionan en el huésped. Las principales acciones de los prebióticos son: a) mejoría del tránsito intestinal, al aumentar el volumen fecal por una parte y estimular la motilidad por acción directa de los AGCC14; b) aumentan la absorción de minerales, fundamentalmente calcio y magnesio, aunque existen datos también para el hierro y el cinc15; c) se ha observado un efecto anticarcinogénico persistente en varios modelos experimentales de ratón, especialmente en la prevención o enlentecimiento en el desarrollo de cáncer de colon16–19; d) efectos en el metabolismo lipídico: estudios en animales muestran que la dietas ricas en prebióticos disminuyen los triglicéridos en suero y en el hígado20, y e) efecto potenciador del sistema inmune, campo de muy reciente interés en el que además de los datos procedentes de modelos experimentales disponemos ya de estudios que valoran resultados clínicos21. Este aspecto será objeto de una revisión más profunda en este artículo.
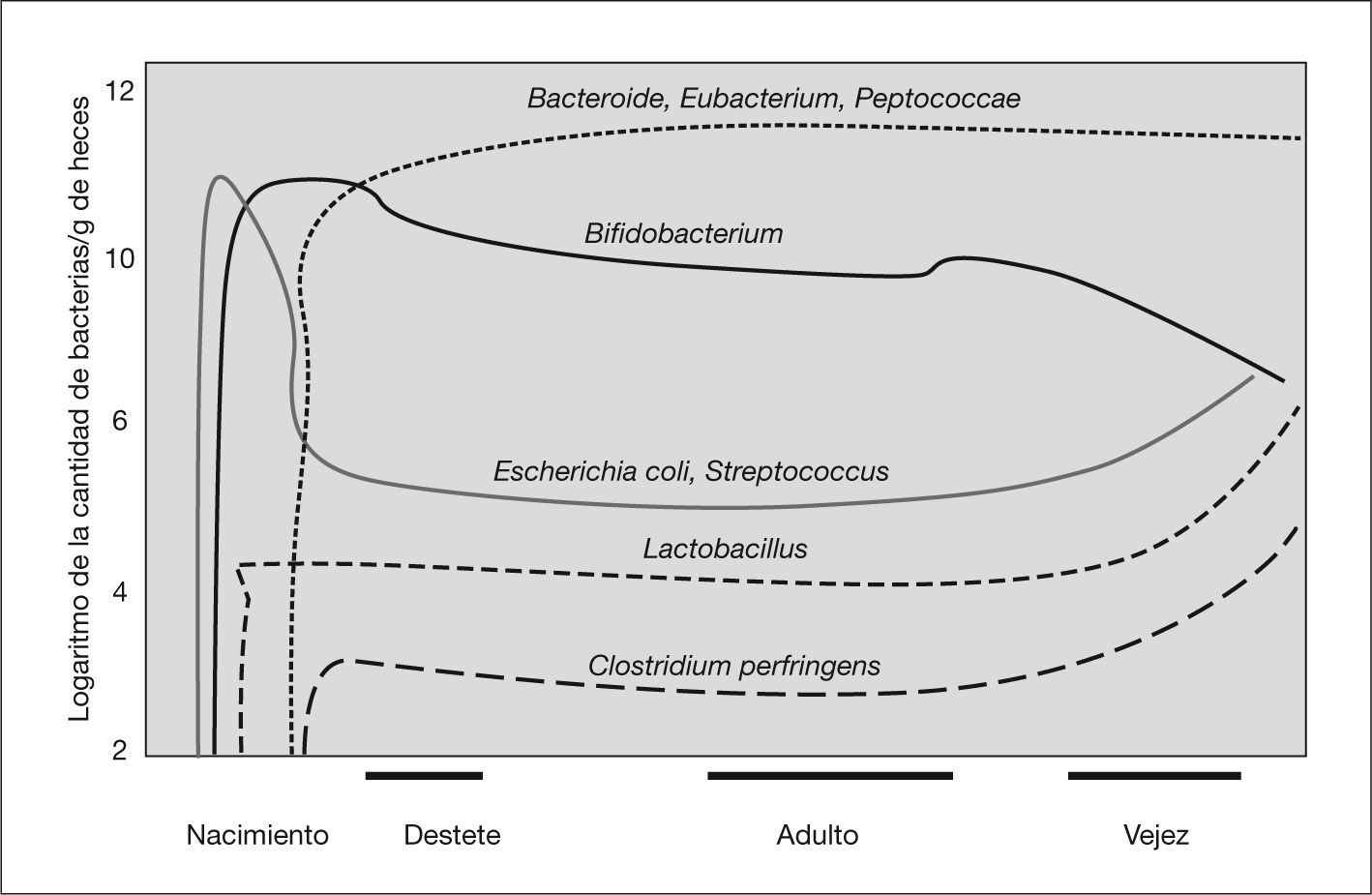
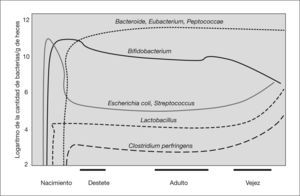
PREBIÓTICOS Y LECHE MATERNATodo individuo tiene una flora intestinal única que adquiere de la madre en el momento del parto. En los recién nacidos por vía vaginal, inicialmente en sus heces aparecen Escherichia coli y Enteroccus spp., y son sustituidos en los primeros 5 días por bifidobacterias. Los niños nacidos mediante cesárea se colonizan inicialmente por bacterias procedentes del medio ambiente hospitalario. La composición de la microflora está, en estas edades tempranas, influida fuertemente por la dieta, de tal forma que a alrededor de los 10 días de vida podemos encontrar una flora bacteriana heterogénea, con predominio de bifidobacterias en el lactante alimentado al pecho y una flora más diversificada, parecida a la que encontramos en el individuo adulto, en los lactantes que reciben fórmula22 (fig. 1). Se conoce bastante menos sobre la comunidad microbiana intestinal en el prematuro. Parece haber un número de especies inferior a la que presentan los términos, con predominio de enterobacterias y enterococos que no desparece con el tiempo y una colonización por anaerobios, especialmente bifidobacterias, más tardía23,24.
Los lactantes alimentados al pecho tienen una flora en la que predominan bifidobacterias y bacterias productoras de ácido láctico, con pocos bacteroides, coliformes y clostridios. Una explicación acerca del diferente patrón de colonización de bacterias intestinales entre los lactantes amamantados y los que reciben una fórmula infantil se basa en el contenido en hidratos de carbono de la leche materna. La lactosa es el principal azúcar de la leche, entre 6 y 7g/100ml, aunque esta cantidad varía con la lactancia. Además, la leche materna tiene más de 130 oligosacáridos complejos distintos en una cantidad apreciable (12 o 13g/l), lo que significa que constituyen el tercer mayor soluto después de la lactosa y los lípidos, por encima del contenido proteico. Contiene también glucosa (1,5mmol/l) y galactosa (15mmol/l) libres25. Con la duración de la lactancia, aumenta el contenido en lactosa mientras que disminuye en oligosacáridos. La lactosa favorece el crecimiento de una flora lactobacilar y facilita la absorción intestinal de calcio. Una parte de la lactosa escapa a la digestión y a la absorción en intestino delgado y alcanza el colon, donde es fermentada.
Los oligosacáridos de la leche materna (LM) son combinaciones de 5 monosacáridos distintos: glucosa, galactosa, ácido siálico, fucosa y N-acetil-glucosamina. Se sintetizan en la glándula mamaria por enzimas específicas, las glucosiltransferasas, añadiendo secuencialmente monosacáridos a la molécula base de lactosa. Así se forman compuestos con estructuras lineales y ramificadas26. Estos oligosacáridos complejos tienen una longitud entre 3 y 10 monosacáridos. El espectro de oligosacáridos en la LM está determinado genéticamente y relacionado con su estado secretor y los determinantes de grupo sanguíneo ABO y Lewis. También influye en el contenido de oligosacáridos el momento del día, la duración de la lactancia o si se trata de leche de madre de un niño a término o pretérmino (mayor contenido). El contenido en oligosacáridos disminuye a lo largo de la lactancia (20g/l en la primera semana, 13g/l en el tercer mes), así como su distribución. Mientras la N-acetil-glusamina continúa siendo el monosacárido dominante, el ácido siálico deja su segundo lugar a la fucosa27.
La mayoría de esos oligosacáridos no se absorbe, llega al colon y es fermentada por la flora intestinal. Así, su función no es exclusivamente ser una fuente de energía o proporcionar monosacáridos para formar parte de las glucoproteínas o glucolípidos de las membranas celulares, como es el caso del ácido siálico para los gangliósidos de las membranas de células neuronales. Por una parte, compiten con los receptores de membrana para las bacterias y virus patógenos en el epitelio intestinal, y, por otra, ejercen su acción bifidogénica al convertirse en la principal fuente de energía para las bacterias del género Bifidobacterium bifidus28. Ambos factores contribuyen al efecto protector frente a las infecciones de la lactancia materna29,30.
Más recientemente se ha demostrado que la leche materna no sólo contiene oligosacáridos que le confieren un efecto prebiótico, sino que además contiene bacterias ácido lácticas de origen endógeno y, por tanto, sería propiamente un alimento simbiótico31,32.
PREBIÓTICOS EN ALIMENTOS INFANTILESA la vista de las propiedades funcionales de los prebióticos en la LM se entiende el interés desde el punto de vista científico y desde una perspectiva comercial por incorporar prebióticos a las fórmulas infantiles y también a otros alimentos destinados a niños y adolescentes33–35. La estructura hidrocarbonada de los oligosacáridos hace poco probables las reacciones alérgicas, su similitud con los presentes en la LM disminuye el riesgo de toxicidad, pero además no generan resistencias microbianas, son solubles en agua y pueden esterilizarse fácilmente. Se emplean distintos tipos de oligosacáridos, en Europa y Estados Unidos se utilizan fructanos tipo inulina, FOS y GOS, mientras que en Japón se emplean isomaltooligosacáridos y xilooligosacáridos extraídos de plantas y sintetizados a partir de lactosa o sacarosa. Es probable que la inclusión de cantidades moderadas de estos prebióticos pudiera ayudar a los lactantes alimentados con una fórmula infantil a adquirir una flora intestinal con más bifidobacterias y menor número de clostridios, coliformes y bacteroides. La composición de los oligosacáridos de la LM es bastante compleja, por lo que no se dispone todavía de oligosacáridos similares para su uso en fórmulas infantiles. Por lo tanto, se han buscado mezclas de oligosacáridos de origen distinto que producen un efecto bifidogénico similar36. Los FOS utilizados en la mayoría de fórmulas infantiles son de alto peso molecular, derivados de la inulina, en combinación con GOS. La combinación más habitual es 9:1, tratando de conseguir un peso molecular semejante a los oligosacáridos de la LM37.
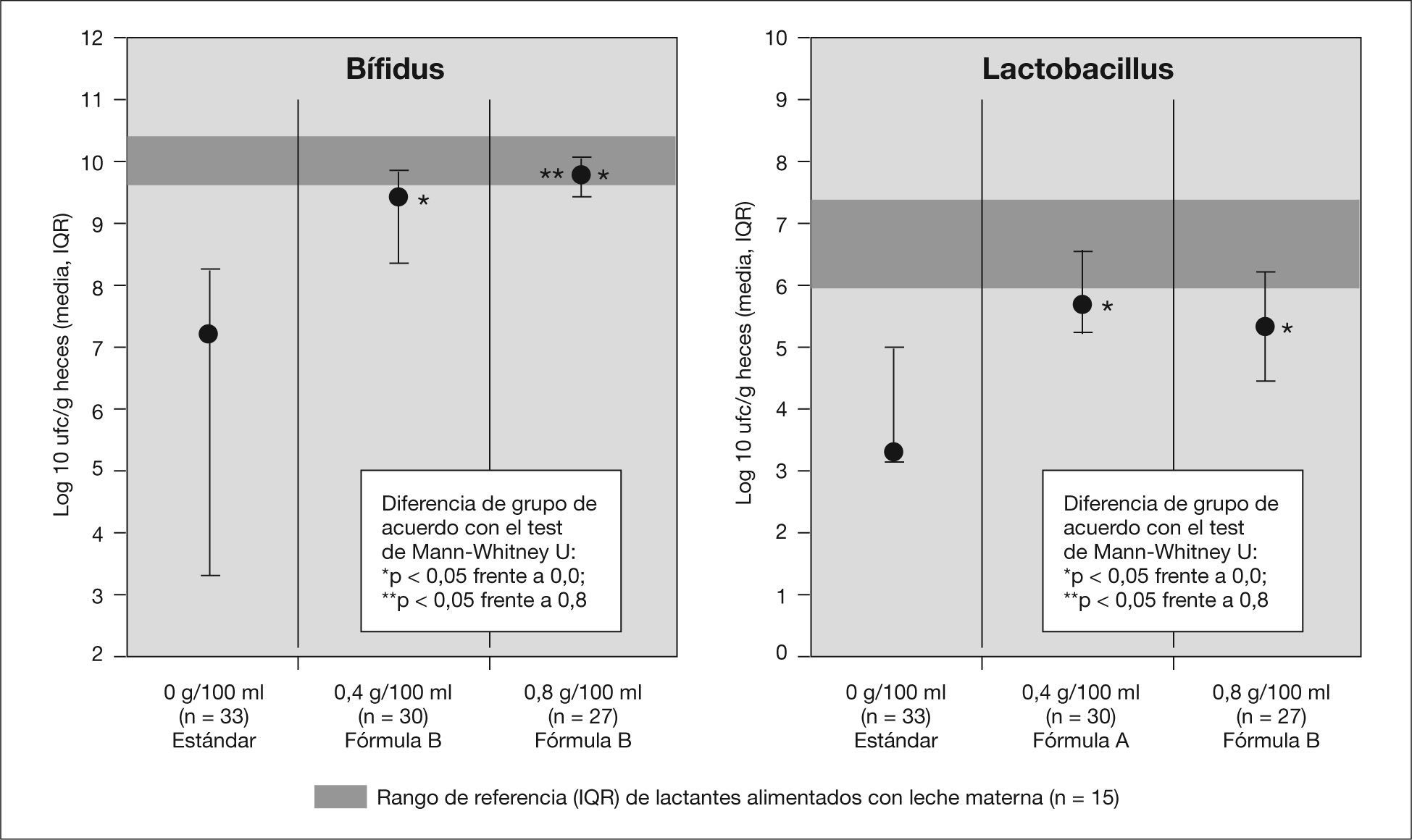
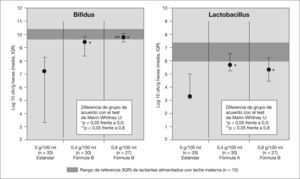
A la hora de considerar la incorporación de un oligosacárido o de una mezcla de oligosacáridos el primer efecto medido debe ser la confirmación de su efecto bifidogénico. Los primeros estudios en humanos datan de mediados de la década de 1990, en sujetos adultos en los que se demostró que la adición de 15g diarios de oligofructosa o inulina causaba un aumento significativo de bifidobacterias en las heces38. Con posterioridad numerosos estudios han confirmado ese efecto tanto en recién nacido pretérminos39 como en lactantes nacidos a término40. La duración media de la suplementación para demostrar diferencias significativas en el recuento de bacterias fue de 4 semanas. Este aumento en el recuento de bifidobacterias se correlacionó con un aumento en la actividad metabólica de dicha flora (cambios en la producción de ácidos grasos de cadena corta, lactato y pH), similares a las que ocurrieron en el grupo de lactantes alimentados al pecho41. Cuando se usan técnicas de biología molecular (por ejemplo, reacción en cadena de la polimerasa [PCR] cuantitativa en tiempo real) se ha observado que el patrón de subespecies de bifidobacterias es similar en los lactantes que recibieron fórmula suplementada con un mezcla de GOS + FOS que en los alimentados con LM y significativamente diferente del que se encontró en lactantes que recibían fórmulas no suplementadas42. Estos efectos no se han podido demostrar si se incorporaba exclusivamente un solo tipo de oligosacáridos. Euler et al43 no encontraron diferencias significativas en la flora fecal tras la suplementación con 1,5 a 3g/l de FOS. El efecto bifidogénico de la suplementación depende de la dosis; los mejores resultados se encuentran cuando la concentración de GOS + FOS estaba alrededor de 0,8-1g/dl44 (fig. 2). Ese efecto beneficioso se acompañaba de una mejoría en las características de las deposiciones (más blandas y suaves). La incorporación de oligosacáridos ácidos procedentes de hidrolizado de pectina (0,2g/dl durante 6 semanas en 16 lactantes nacidos a término en un estudio prospectivo, aleatorizado y doble ciego), no modificó la microecología intestinal45. El efecto de la mezcla de prebióticos sobre la flora intestinal - se acompaña de una reducción en el recuento de microorganismos patógenos (especies de Staphylococcus, gramnegativos, Clostridium difficile, Bacillus subtilis y Acinetobacter) durante el período que reciben suplementación46.
El efecto bifidogénico de los prebióticos en las fórmulas infantiles depende de la dosis.
Modificado de Moro et al54, con autorización.
Los prebióticos se toleran bien, aunque si se administran en cantidades excesivas también pueden tener efectos indeseados: flatulencia, borborigmos, dolor abdominal y diarrea47. La administración de dosis elevadas (6,6g, tres veces al día) en pacientes con reflujo gastroesofágico produjo un aumento significativo en los síntomas48. Dosis diarias inferiores a 20g/día se toleran bien49. El Scientific Committee on Food de la Unión Europea no apreció ninguna duda sobre la seguridad de una mezcla de prebióticos (GOS al 90% + FOS al 10%) en una concentración de 0,8g/dl, añadida a una fórmula infantil50. La directiva de la Comisión Europea relativa a los preparados para lactantes y preparados de continuación, de diciembre de 2006, señala que pueden añadirse FOS y GOS a los preparados para lactantes, en una cantidad no superior a 0,8g/100ml según una combinación de 90% de oligogalactosil lactosa y 10 % de oligosil sacarosa de elevado peso molecular51.
A la luz de la evidencia publicada hasta la fecha el Comité de Nutrición de la Sociedad Europea de Gastroenterología, Hepatología y Nutrición Pediátricas (ESPGHAN) publicó en 2004 un comentario sobre el uso de oligosacáridos prebióticos en productos para alimentación de lactantes. Señalaba que con los escasos estudios publicados hasta entonces no podía hacerse ninguna recomendación sobre su uso con fines terapéuticos o preventivos. Sin embargo comentaban que durante su administración se encontró un aumento en el número de bifidobacterias en heces y que tenían un efecto positivo sobre la consistencia de las heces; que no se habían demostrado efectos adversos con su uso y recomendaban, por una parte la realización de estudios prospectivos, aleatorizados, bien diseñados encaminados a demostrar beneficios clínicos; y, por otra, una evaluación más exhaustiva para el caso de los prematuros y para lactantes con condiciones clínicas especiales, por ejemplo, situaciones de inmunodeficiencia52.
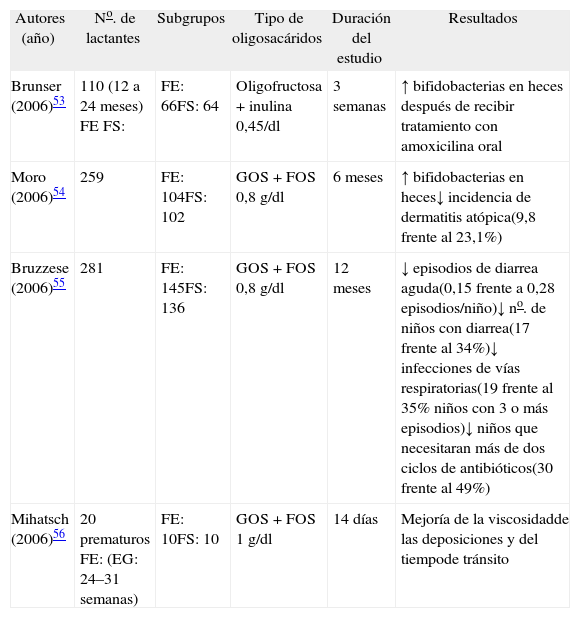
Con posterioridad a este documento se han publicado varios ensayos clínicos aleatorizados cuyos resultados clínicos se resumen en la tabla 253–56. Sólo se han publicado dos ensayos clínicos controlados, valorando la eficacia clínica de la adición de oligosacáridos a una fórmula infantil, uno de ellos publicado como comunicación. Reúnen un total de 550 lactantes, en un período de seguimiento entre 6 y 12 meses. En el primero de ellos se observó disminución superior al 50 % en la incidencia de dermatitis atópica; en el segundo se observó una disminución de los episodios infecciosos diarreicos y respiratorios, superior al 50 %. A priori la actuación sobre la inmunidad intestinal tendría interés en dos grupos de enfermedades: infecciones y problemas alérgicos. La estimulación inmune con un prebiótico se ha correlacionado positivamente con la producción de IgA en respuesta a la vacuna oral de polio en lactantes sanos57. La competición con las cepas patógenas y la proliferación de bidifobacterias explicarían el efecto protector frente a las infecciones. En cuanto a la acción sobre enfermedades alérgicas el mecanismo es menos claro. La hipótesis inicial sería que los prebióticos de la dieta podrían modular el desarrollo posnatal del sistema inmune modificando la flora intestinal. Arman et al42 han demostrado que el uso de una fórmula suplementada con GOS + FOS origina una disminución en el recuento de Bifidobacterium adolescentis en las heces de lactantes a término. Se había demostrado previamente que los niveles de B. adolescentis son más bajos en lactantes sanos que en lactantes alérgicos55. En un estudio realizado en lactantes de riesgo atópico, la suplementación con una mezcla de GOS + FOS obtuvo una disminución significativa en las concentraciones plasmáticas de IgE, IgG1, IgG2 e IgG3, sin modificaciones en las concentraciones de IgG4. Las concentraciones de IgG1 frente a proteína de leche de vaca fueron significativamente inferiores56. Pero también existen cada vez mayor número de datos que apuntan a una acción directa de los oligosacáridos sobre las células inmunes. Se ha demostrado in vitro que los oligosacáridos de la LM afectan a la producción de citocinas y a la activación de células T derivadas de células de cordón humano57.
Ensayos clínicos sobre fórmulas suplementadas con oligosacáridos
| Autores (año) | No. de lactantes | Subgrupos | Tipo de oligosacáridos | Duración del estudio | Resultados |
| Brunser (2006)53 | 110 (12 a 24 meses) FE FS: | FE: 66FS: 64 | Oligofructosa + inulina 0,45/dl | 3 semanas | ↑ bifidobacterias en heces después de recibir tratamiento con amoxicilina oral |
| Moro (2006)54 | 259 | FE: 104FS: 102 | GOS + FOS 0,8g/dl | 6 meses | ↑ bifidobacterias en heces↓ incidencia de dermatitis atópica(9,8 frente al 23,1%) |
| Bruzzese (2006)55 | 281 | FE: 145FS: 136 | GOS + FOS 0,8g/dl | 12 meses | ↓ episodios de diarrea aguda(0,15 frente a 0,28 episodios/niño)↓ no. de niños con diarrea(17 frente al 34%)↓ infecciones de vías respiratorias(19 frente al 35% niños con 3 o más episodios)↓ niños que necesitaran más de dos ciclos de antibióticos(30 frente al 49%) |
| Mihatsch (2006)56 | 20 prematuros FE: (EG: 24–31 semanas) | FE: 10FS: 10 | GOS + FOS 1g/dl | 14 días | Mejoría de la viscosidadde las deposiciones y del tiempode tránsito |
EG: edad gestacional; FE: fórmula convencional; FOS: frutooligosacáridos; FS: fórmula suplementada; GOS: galácticooligosacáridos.
La incorporación de oligosacáridos prebióticos a fórmulas infantiles especiales es también objeto de interés, aunque el número de trabajos al respecto es muy escaso58,59.
Se han realizado dos estudios en los que se añadían oligosacáridos en el cereal en lactantes sanos, se encontró un aumento en el porcentaje de bifidobacterias en heces en uno de ellos (1,5g/d de la mezcla GOS + FOS 9:1 durante 6 semanas)60 y una mejora de la consistencia de las heces en el otro61 (ingesta media de FOS, 0,74g/día, durante 28 días). Otros trabajos muestran una acción preventiva frente a la diarrea por rotavirus o contra la alergia62. La adición de oligosacáridos a cereales63, o a soluciones de rehidratación oral64 no ha demostrado ni cambios en la prevalencia de la diarrea, ni mejora en el número de deposiciones ni en el porcentaje de deshidrataciones o la necesidad de ingreso hospitalario en países en desarrollo.
En conclusión, se puede afirmar que los datos experimentales iniciales permitieron poner de manifiesto que los oligosacáridos prebióticos pueden modular el sistema de defensa natural frente a la infección en el lactante. La interacción entre estos oligosacáridos y el sistema inmune es muy complejo. Muchos de los efectos están mediados por su influencia sobre la microflora intestinal, pero puede haber una acción directa sobre las células inmunes. Más recientemente se comienza a disponer de datos procedentes de ensayos clínicos bien diseñados que muestran que la adición de una mezcla determinada de oligosacáridos puede contribuir a disminuir la incidencia de infecciones intestinales y respiratorias en el primer año de vida, así como una menor incidencia de dermatitis atópica en lactantes de riesgo. Aunque el conocimiento de los mecanismos moleculares que explican estas acciones no se conoce por completo, se abren perspectivas interesantes para su aplicación en la alimentación del lactante, al considerar que su administración durante los primeros meses de vida podría imitar la función inmunomoduladora de los oligosacáridos de la LM. Se necesitan más ensayos clínicos bien diseñados y con la potencia suficiente que confirmen estos resultados iniciales.