La displasia broncopulmonar (DBP) es la secuela más prevalente del recién nacido pretérmino, y sigue suponiendo un motivo frecuente de consulta en las unidades de Neumología Pediátrica. La decisión del alta de la unidad neonatal debe apoyarse en una valoración exhaustiva de la situación clínica del paciente y en el cumplimiento de unos requisitos, que incluyen la estabilidad respiratoria y nutricional, y la instrucción a los cuidadores en el manejo domiciliario. Para un control adecuado de la enfermedad, es necesario que quede establecido, previamente al alta, un calendario de visitas y de exploraciones complementarias, y deben aplicarse las pautas de prevención de exacerbaciones y el tratamiento apropiados. El concepto de DBP como enfermedad multisistémica es fundamental en el seguimiento de los pacientes y debe ser tenido en cuenta para un buen control de la enfermedad.
En este documento, el Grupo de Trabajo de Patología Respiratoria Perinatal de la Sociedad Española de Neumología Pediátrica propone un protocolo que sirva como referencia para unificar el seguimiento de los pacientes con DBP entre los diferentes centros y ámbitos asistenciales.
Se revisan los aspectos a tener en cuenta en la evaluación previa al alta de la Unidad Neonatal y las principales complicaciones durante el seguimiento. Seguidamente, se detallan las recomendaciones en materia de tratamiento de la enfermedad y prevención de complicaciones, los controles tras el alta y su cronología.
Bronchopulmonary dysplasia (BPD) is the most common complication of preterm birth, and remains a major problem in pediatric pulmonology units. The decision of discharging from the Neonatal Unit should be based on a thorough assessment of the condition of the patient and compliance with certain requirements, including respiratory and nutritional stability, and caregiver education on disease management. For proper control of the disease, a schedule of visits and complementary tests should be established prior to discharge, and guidelines for prevention of exacerbations and appropriate treatment should be applied.
In this paper, the Working Group in Perinatal Respiratory Diseases of the Spanish Society of Pediatric Pulmonology proposes a protocol to serve as a reference for the follow up of patients with BPD among different centers and health care settings.
Key factors to consider when planning discharge from the Neonatal Unit and during follow up are reviewed. Recommendations on treatment and prevention of complications are then discussed. The final section of this guide aims to provide a specific schedule for follow-up and diagnostic interventions to be performed in patients with BPD.
La displasia broncopulmonar (DBP) es una enfermedad pulmonar crónica, originada por la interrupción del desarrollo vascular y pulmonar, en la que intervienen múltiples factores perinatales1,2. Afecta a recién nacidos prematuros (RNPT) con muy bajo peso al nacimiento, especialmente los menores de 1.000g, y supone la causa más frecuente de morbilidad respiratoria en esta población.
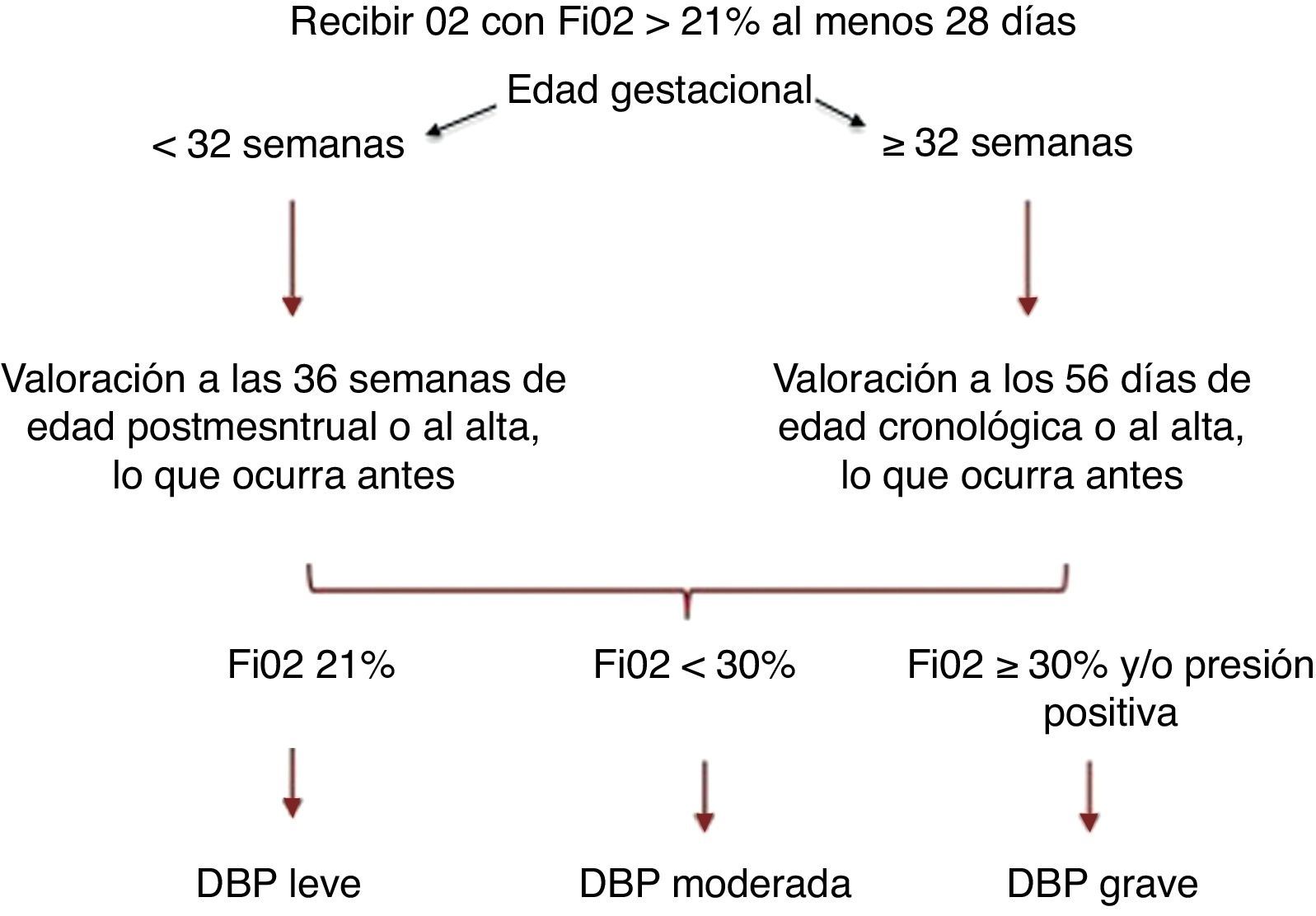
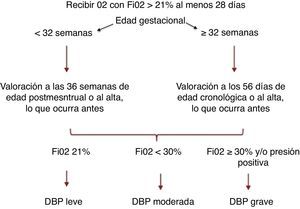
El consenso del National Institute of Child Health and Human Development (NICHD) define la DBP como la necesidad de O2 suplementario en el RNPT al menos 28 días, y la clasifica en leve, moderada o grave según las necesidades de O2 o de soporte ventilatorio en una evaluación posterior3 (fig. 1). Recientemente, la Sociedad Española de Neonatología ha revisado los criterios diagnósticos4, y recomienda incorporar a la clasificación anterior la prueba fisiológica de reducción de O25 (tabla 1).
Clasificación DBP, consenso NICHD1.
Prueba de retirada de oxígeno para la definición fisiológica de la DBP
| Indicada en RN con DBP que: |
| • Necesitan una FiO2 ≤ 30% para mantener una SaO2 > 90% |
| • Reciben una FiO2 > 30% y su SaO2 es > 96% |
| • No habría que realizar esta prueba a los RN con una FiO2 > 30% o ventilación con presión positiva para mantener saturaciones entre 90 y 96%, ya que estos presentan por definición DBP grave |
| Se coloca al niño en posición supina durante 30min tras la toma y con sus necesidades de O2 habituales, midiendo FC, FR y SaO2, apneas y bradicardias durante 15min |
| Se comienza a disminuir cada 5min la FiO2 un 2% si respira en cámara abierta, o a disminuir el flujo 0,1-0,5 lpm si respira con cánulas nasales, hasta su retirada (fase de reducción) |
| En ese momento se observa la respuesta durante 60min, para volver posteriormente a la situación basal. No se tienen en cuenta las necesidades de O2 durante la alimentación |
| Se considera fracaso de la reducción si: |
| • SaO2 80-89% durante > 5min o |
| • SaO2 < 80% durante > 15 s |
| Efectos adversos del procedimiento: |
| • Episodios de apnea y bradicardia |
| • Posible incremento >5% de las necesidades de O2 después de una hora tras el regreso a la situación basal |
Fuente: Sánchez-Luna et al.4
La DBP se asocia a una estancia hospitalaria más prolongada, mayor incidencia de problemas respiratorios y cardiovasculares en los 2 primeros años, y retraso del neurodesarrollo y del crecimiento6. Los niños con antecedentes de DBP pueden mantener alteraciones en la función pulmonar durante la adolescencia y al alcanzar la edad adulta7.
Estos pacientes requieren un seguimiento muy exhaustivo, que incluye una adecuada valoración previa al alta de Neonatología, la programación de visitas y exploraciones complementarias pertinentes, y recomendaciones en materia de prevención y tratamiento. A este respecto, el Grupo de Trabajo de Patología Respiratoria Perinatal de la Sociedad Española de Neumología Pediátrica (GTPRP-SENP) ha elaborado un protocolo que pretende servir como referencia para los especialistas encargados del control de los niños con DBP.
Valoración previa al alta hospitalariaIncluye los siguientes aspectos:
OxigenoterapiaUna vez sobrepasada la etapa de riesgo de retinopatía, la indicación de oxigenoterapia se establece cuando la SaO2 ambiente es ≤92%. Deberá considerarse en pacientes con SaO2 entre 93 y 96%, ante signos de compromiso pulmonar crónico y retraso del crecimiento pese a un aporte nutricional adecuado, y en pacientes con hipertensión pulmonar (HP).
Pruebas de imagenLa TAC torácica es la prueba más sensible para mostrar lesiones secundarias a DBP. Es característico encontrar áreas hiperlucentes multifocales, opacidades lineales y subpleurales, engrosamiento peribronquial, ampollas y enfisema, aunque ningún patrón radiológico puede utilizarse como factor pronóstico8. Se recomienda realizar 4-6 cortes mediante TAC de alta resolución para minimizar la exposición a la radiación. Debido a dicha exposición y a que muchos centros utilizan sedación, se aconseja reservarla para los casos en que pueda aportar una información relevante para el manejo del paciente.
Despistaje de hipertensión pulmonarLa prevalencia de HP en niños con DBP oscila entre el 18 y el 43%9. La prueba recomendada para su despistaje es la ecocardiografía. Debe realizarse en pacientes con dependencia de O2 a las 36 semanas de edad posmenstrual o a los 2 meses de vida (o si aparece empeoramiento clínico, con mayores necesidades de O2 o soporte respiratorio)10, y en pacientes con antecedente de retraso de crecimiento intrauterino y ganancia ponderal insuficiente.
En algunos centros, los pacientes que requieren vasodilatadores pulmonares son tratados mediante cateterismo cardiaco para confirmar HP. Consideramos que es mejor reservar esta prueba invasiva para casos graves sin respuesta a vasodilatadores, o ante sospecha de anomalías cardiovasculares10,11.
GasometríaEn los casos graves, puede ser necesaria una gasometría arterial previa al alta para evaluar la ventilación, aunque por su invasividad la práctica habitual es realizar gasometrías capilares. Es frecuente cierto grado de hipercapnia.
Vía aéreaEn los pacientes tratados mediante ventilación mecánica (VM) prolongada o traqueostomizados, se recomienda descartar mediante fibrobroncoscopia granulomas o estenosis traqueal o subglótica, secundarios a intubación prolongada o a la cánula de traqueostomía. También se recomienda fibrobroncoscopia cuando se sospeche laringomalacia o traqueobroncomalacia.
Función pulmonarSu evaluación se restringe a centros especializados y aún no forma parte de los estudios de rutina, por su complejidad, ausencia de valores de referencia y necesidad de sedación. La técnica que aporta más información es la compresión torácica forzada a volumen corriente (flujo espiratorio máximo a capacidad residual funcional) y con preinsuflación (capacidad vital forzada y flujos espiratorios forzados). La pletismografía analiza la capacidad funcional residual, la capacidad pulmonar total y el volumen residual. El estudio de la respiración a volumen corriente y de la mecánica pulmonar también puede mostrar alteraciones, aunque son menos sensibles.
Los resultados muestran un patrón obstructivo con atrapamiento aéreo, que tiende a persistir en el tiempo12.
Valoración nutricionalEl gasto energético de los pacientes con DBP es al menos una tercera parte mayor que el del resto de prematuros, por ello es necesario incrementar su aporte calórico. Se debe evitar la sobrecarga hídrica, con aportes necesarios para una diuresis suficiente13. Si existe elevado trabajo respiratorio con las tomas, o estancamiento ponderal, debe valorarse la alimentación mediante sonda nasogástrica (SNG). Si se prevé alimentación por SNG prolongada o existen alteraciones de la deglución que favorezcan la broncoaspiración, se considerará realizar una gastrostomía.
Valoración neurológicaPreviamente al alta es necesario que los pacientes sean evaluados por el equipo de Neurología y determinar la necesidad de seguimiento por un equipo de Rehabilitación.
Fármacos actuales y previsión para el altaVer tratamiento de la DBP, más adelante.
InmunoprofilaxisPasivaSe recomienda el uso de palivizumab en niños menores de un año de edad con DBP. Durante el segundo año de vida se podría considerar la profilaxis solo para los niños que han necesitado tratamiento (oxigenoterapia, broncodilatadores, corticoides o diuréticos) en los 6 meses anteriores al inicio de la temporada del VRS14. Se administra vía intramuscular a 15mg/kg de peso, mensualmente durante la temporada del VRS.
ActivaLa vacunación del RNPT debe ir suplementada con la vacunación frente a la gripe y tosferina de las personas de su entorno cercano (incluyendo hermanos no completamente vacunados frente a DTPa), al menos 2 semanas antes del contacto directo. Se recomienda la vacunación antigripal de la familia durante los 2 primeros años de vida del RNPT15.
A partir de los 6 meses de edad se recomienda la vacunación antigripal a todos los niños con DBP. La vacunación se realizará con la vacuna inactivada trivalente autorizada para el año en curso: 2 dosis de 0,25ml separadas con un intervalo de un mes la primera vez que se vacunen, y una sola dosis los años sucesivos.
Las infecciones invasivas por neumococo son especialmente frecuentes en los RNPT menores de 32 semanas de gestación. Por ello es importante la administración de la vacuna neumocócica conjugada 13-valente. Aunque los niveles de anticuerpos son menores que en los niños nacidos a término, la mayoría alcanzan tasas superiores a las consideradas protectoras para la enfermedad neumocócica invasiva.
Criterios para el altaEl momento del alta debe individualizarse y coordinarse entre todo el equipo multidisciplinar. Deben cumplirse una serie de criterios16 (tabla 2). Es indispensable que el personal sanitario instruya a los cuidadores y que estos participen progresivamente en los cuidados (tabla 3).
Criterios para el alta hospitalaria
| Ganancia ponderal satisfactoria |
| Las gráficas de crecimiento deben mostrar una tendencia ascendente en las últimas semanas. Con frecuencia hay que recurrir a fórmulas de alto contenido energético (100 kcal/100 ml). Mientras sea posible la lactancia materna, es aconsejable alternarla fortificada con estas fórmulas para evitar perder los beneficios de la lactancia materna |
| Estabilidad cardiorrespiratoria |
| En ausencia de cambios recientes de medicación o en los aportes de O2, debe comprobarse una estabilidad en la oxigenación, ausencia de exacerbaciones respiratorias, apneas o episodios de bradicardia |
| Capacidad de coordinar succión-deglución-respiración |
| Es un requisito que la alimentación por succión no se acompañe de desaturaciones significativas o crisis de atragantamiento. En caso contrario se valorará el empleo de SNG |
| Comprobar administración de inmunoprofilaxis |
| Información a los familiares |
| Deben aprender las maniobras de RCP básica, y se les tiene que proporcionar bolsa autoinflable, mascarilla facial y alargadera conectada a fuente de O2. Han de recibir información verbal y escrita de la enfermedad y sus implicaciones, evolución, signos de descompensación y medidas para prevención de infecciones, sobre todo por el VRS |
| Aspectos sociales |
| Los servicios sociales deben valorar la situación familiar, tramitar las ayudas económicas que precisen en la medida de lo posible y programar visitas domiciliarias. Deben proporcionarse los medios suficientes para garantizar los cuidados del paciente en el domicilio, así como sus desplazamientos a las consultas hospitalarias |
| Informe de alta |
| Exploración física. Constantes vitales. SaO2 ambiente y con FiO2 |
| Informe del último control radiológico y gasometría capilar |
| Medicación pautada, dosis, posología y vías de administración. Oxigenoterapia: dispositivo pautado y flujo. Teléfono de la empresa suministradora |
| Alimentación: fórmula, preparación, volumen e intervalo de tomas |
| Constatar la fecha de administración de palivizumab y de las vacunas |
| Reflejar con claridad el plan de citas a todas las especialidades implicadas intentando hacerlas coincidir. Idealmente unidad multidisciplinar |
| Se debe tratar de remitir el informe al pediatra de Atención Primaria, con el que se concertará una cita en 48-72 h |
Instrucciones que deben recibir los cuidadores por parte del personal sanitario, de forma previa al alta hospitalaria
| Aspiración de secreciones, colocación de gafas nasales y manejo de traqueostomía en caso de ser portador de esta, incluyendo desobstrucción y recambio de las cánulas |
| Administración de alimentación (succión, sonda o gastrostomía). Posibilidad de aumentar el aporte de oxígeno durante las tomas en caso de fatiga. Nociones de medidas posturales antirreflujo o durante el sueño, en caso indicado |
| Administración de la medicación (diluciones vía oral, inhaladores), dosis y posología. Se simplificará al máximo, intentando suspender aquella que no sea estrictamente necesaria |
| Manejo de oxigenoterapia, nebulizadores y pulsioxímetro con sus parámetros de alarma. Sería deseable que reciban con antelación el aparataje que van a utilizar en el domicilio para que se familiaricen con él. En caso de precisar soporte ventilatorio, deben estar perfectamente adiestrados en su manejo antes del alta, y es necesario el seguimiento posterior por un equipo de atención domiciliaria |
Se debe principalmente a la enfermedad respiratoria, pero también existen alteraciones a nivel nutricional, neurológico y cardiovascular17. El seguimiento debe involucrar a múltiples especialistas, para un adecuado desarrollo orgánico y funcional.
Patología respiratoriaLa morbilidad respiratoria es común en los primeros 2 años de vida. El espectro puede ser muy heterogéneo: desde casos graves con tratamiento médico intenso y oxigenoterapia, hasta casos totalmente asintomáticos. Los pacientes pueden requerir oxigenoterapia durante meses y precisar asistencia hospitalaria frecuente17. Pueden sufrir un deterioro lento y progresivo de su estado respiratorio, o presentar exacerbaciones agudas, casi siempre relacionadas con infecciones virales o hiperreactividad bronquial. Es muy importante prevenir e identificar precozmente dicho deterioro. El rechazo del alimento, el cansancio con las tomas y el aumento de la frecuencia respiratoria y del tiraje son signos de alarma. Pueden contribuir al deterioro la sobrecarga de líquidos y la descompensación cardiaca (cor pulmonale), propia de los casos graves de DBP. Se deben tomar medidas para controlar la transmisión del VRS en la comunidad18 y evitar ambientes contagiosos como guarderías, o ingresos reglados para cirugía en épocas de epidemia.
Si la clínica respiratoria no mejora a pesar de las medidas habituales, conviene descartar reflujo gastroesofágico (RGE), más frecuente que en otros prematuros, probablemente agravado por el atrapamiento aéreo. El riesgo aumenta por el empleo de teofilinas, SNG y realización de gastrostomía sin corrección quirúrgica previa del RGE.
Trastornos del crecimientoEl cuidado nutricional es un factor clave en la prevención y manejo posterior de la DBP19. Estos niños suelen tener un crecimiento inadecuado, cuyas posibles causas son un aporte nutricional deficiente, una oxigenación subóptima y un gasto energético aumentado.
Durante al menos el primer año, es primordial una estricta monitorización de los parámetros de crecimiento mediante programas de seguimiento específicos.
Los niños con DBP suelen ser malos comedores, por anorexia o cansancio con las tomas debido al trabajo respiratorio. Si el niño no experimenta una adecuada ganancia ponderal, deberán revisarse los aportes, alteraciones de la ingesta, colaboración de los padres o descartar RGE. Por el contrario, el crecimiento rápido aumenta el riesgo de obesidad e insulinorresistencia; por ello no se trata de ganar peso rápidamente, sino que este incremento sea de masa magra.
El enlentecimiento de la curva ponderal va íntimamente ligado al deterioro respiratorio. Una hipoxemia marginal es causa demostrada de retraso en el crecimiento, por lo que debe asegurarse una adecuada oxigenación.
Trastornos del neurodesarrolloLas alteraciones del neurodesarrollo son más frecuentes en los niños con antecedentes de DBP que en el resto de los RNPT. El riesgo aumenta con la VM prolongada, la presencia de hemorragia intraventricular grado III-IV y el alta después de las 43 semanas de edad posmenstrual20. Estos trastornos pueden afectar a la percepción visual y auditiva, al lenguaje, memoria, capacidad de aprendizaje y función motora. La prevalencia del trastorno por déficit de atención es mayor en los niños con DBP21. Además, existe una relación entre la administración precoz de corticoides sistémicos para el tratamiento de la DBP y las alteraciones en el neurodesarrollo a largo plazo20.
Trastornos cardiovascularesLa hipoplasia y el daño de la microvascularización pulmonar asociados a la DBP pueden dar como resultado HP. El diagnóstico suele establecerse después de los 2 meses de vida y tras el alta hospitalaria. Por ello, los programas de detección de la HP deben incluir 2 o 3 ecocardiografías durante el primer año, y siempre antes y después de la retirada de los suplementos de O211.
Los niños con DBP pueden presentar hipertensión arterial, de causa no aclarada22. Suele iniciarse entre el 2.° y el 4.° mes tras el alta; generalmente es leve y responde bien al tratamiento. Deberá tomarse la tensión arterial periódicamente durante el seguimiento.
En algunos niños se ha descrito hipertrofia ventricular izquierda, en ocasiones relacionada con el uso de dexametasona.
Tratamiento de la displasia broncopulmonarFármacos tras el altaSuelen emplearse para el control de los síntomas respiratorios, aunque no existe consenso generalizado sobre los fármacos a utilizar una vez pasada la fase crítica de la enfermedad23. El tratamiento deberá individualizarse según la sintomatología respiratoria, el requerimiento de oxigenoterapia y la evolución del crecimiento. Es muy importante el seguimiento para valorar el tiempo que debe mantenerse, y vigilar sus posibles efectos secundarios.
Broncodilatadores inhaladosSe usarán solo cuando se sospeche un episodio agudo de obstrucción bronquial, siempre que la respuesta sea favorable24.
Los más empleados son los beta-2-agonistas de acción corta, a la misma dosis y forma de administración que en el paciente con síntomas de broncoespasmo. Estos fármacos pueden causar una respuesta paradójica en niños que asocian traqueobroncomalacia.
Los anticolinérgicos (bromuro de ipratropio) tienen menor efecto broncodilatador y, aunque no están recomendados en niños con DBP, pueden utilizarse siguiendo los mismos criterios que en las crisis asmáticas24.
Glucocorticoides inhaladosNo hay suficiente evidencia de su efecto sobre el crecimiento pulmonar o en el control de la obstrucción bronquial, por lo que su indicación debe ser cuidadosa23,25. Pueden ser útiles para prevenir los episodios recurrentes de sibilancias, con los mismos criterios que en el asma.
DiuréticosEstán indicados en pacientes hipoxémicos con edema pulmonar, o ante compromiso pulmonar grave con mala regulación del agua corporal.
El más utilizado es la furosemida, pero no hay evidencias suficientes para recomendar su uso prolongado26. Por sus riesgos potenciales (alcalosis, hiponatremia e hipopotasemia; ototoxicidad; nefrocalcinosis; colelitiasis; osteopenia), se recomienda emplearla a días alternos durante períodos cortos25,26. Si se precisa tratamiento prolongado con diuréticos, la asociación tiacida-espironolactona es una alternativa razonable para minimizar los efectos secundarios, con controles y monitorización electrolítica estrictos. Su retirada se valorará ante mejoría clínica, ausencia de HP y bajas necesidades de O2.
Tratamiento de la hipertensión pulmonarMedidas generalesIncluyen la optimización de la situación respiratoria y nutricional. La hipoxemia crónica o intermitente puede exacerbar la HP. Por tanto, se debe mantener una SaO2 > 94-95%. Se deben descartar otras enfermedades asociadas (RGE, aspiración pulmonar y anomalías estructurales de la vía aérea)27.
Vasodilatadores pulmonaresNo existen ensayos clínicos controlados y los datos sobre eficacia y seguridad a largo plazo son escasos. Se recomiendan ante HP moderada-grave, cuando las medidas anteriores han sido ineficaces.
Se deben descartar enfermedades en las que su utilización puede ser perjudicial (colaterales vasculares, disfunción ventricular izquierda, enfermedad venooclusiva, o cortocircuitos intracardiacos)11. Para ello, algunos autores recomiendan un cateterismo antes de iniciar el tratamiento. Otros proponen realizar ecocardiografía o angio-TAC y reservar el cateterismo para casos con mala evolución o intervenciones terapéuticas11,27.
El óxido nítrico inhalado se utiliza en los pacientes que precisan soporte ventilatorio invasivo. No obstante, las dificultades para su uso prolongado y su elevado coste hacen recomendable sustituirlo por otros vasodilatadores cuando la situación lo permita27.
El sildenafilo oral es el fármaco más utilizado en la HP asociada a la DBP28. La dosis inicial es de 0,5mg/kg cada 8 h. Si no aparece hipotensión sistémica, puede aumentarse hasta un máximo de 2mg/kg cada 6 h.
En los casos sin respuesta a sildenafilo, la utilización de iloprost nebulizado puede ayudar a mejorar la HP y la oxigenación29.
El epoprostenol por vía intravenosa continua es el fármaco con acción más potente sobre la HP, pero puede producir hipotensión y empeorar la hipoxemia, al aumentar la vasodilatación pulmonar en zonas no ventiladas. En casos graves se puede asociar al tratamiento bosentán oral o treprostinil subcutáneo27.
OxigenoterapiaEl objetivo fundamental de la oxigenoterapia domiciliaria (OD) en el niño con DBP es tratar la hipoxemia crónica o intermitente derivada de la enfermedad. Aportes suplementarios de O2 mejoran la ganancia de peso30,31, reducen la resistencia de la vía aérea, aumentan la distensibilidad pulmonar32 y reducen la HP33. La incidencia del síndrome de muerte súbita del lactante y de episodios de apnea obstructiva del sueño disminuyen en los niños que mantienen SaO2 > 93%23.
Indicaciones de la oxigenoterapia domiciliariaEl empleo de O2 suplementario exige evitar tanto la hipoxia como la exposición excesiva al O2. No disponemos de ensayos clínicos para determinar los criterios de SaO2 con los que iniciar o mantener la oxigenoterapia. Las recomendaciones actuales se basan en valores de referencia en niños sanos y en estudios observacionales sobre los efectos de la hipoxia34. Siguiendo las recomendaciones de las Unidades de Neonatología, parece razonable emplear el rango de SaO2 de 88-92%, establecido en la definición fisiológica, para suspender la administración de O2 suplementario en los RNPT con riesgo de desarrollar retinopatía. Una vez el niño alcanza una edad gestacional a término y adquiere una vascularización retiniana madura, los suplementos serán los necesarios para obtener SaO2 ≥ 93%, y especialmente ≥95% en aquellos casos con HP documentada o retraso del crecimiento35.
La fuente más recomendada son los tanques de O2 líquido junto con una mochila para los desplazamientos. Los concentradores de O2 son una opción en pacientes con necesidades mínimas de O2, cuando se prolongan en el tiempo. Estos dispositivos pueden aportar flujos de entre 0,1 y 4 lpm. El flujo de O2 habitualmente necesario suele ser bajo (0,5-1 lpm), por lo que se suele administrar con gafas nasales. Con estos flujos, la humidificación de los aportes de O2 no es necesaria, excepto en portadores de traqueostomía.
ControlesHabitualmente suele proporcionarse un pulsioxímetro para controlar y titular las necesidades de OD. Este dispositivo ofrece a la familia un sistema de alarma precoz, aunque los artefactos producidos por el movimiento constituyen un problema36. Sin embargo, permite al padre/cuidador disponer de información permanente y disminuye las llamadas o visitas médicas. Además, ayuda a decidir si deben aumentarse los aportes de O2, o si es necesario acudir a un centro sanitario37. Si la evolución es favorable, se pueden ir reduciendo los aportes bajo control estricto, permitiendo disminuir el tiempo de OD.
RetiradaDeben tenerse en cuenta los factores expuestos en la tabla 4. Tras comprobar que la SaO2 con aire ambiente se mantiene estable (93-95%), es recomendable mantener en domicilio los dispositivos de oxigenoterapia durante un tiempo, especialmente en época epidémica de infecciones respiratorias.
Factores a tener en cuenta ante la retirada de oxígeno domiciliario
| • Situación respiratoria estable |
| • Curva de peso y talla ascendente |
| • Sat. de O2 mantenidas con aire ambiente entre 93 y 95% (día y noche) |
| • Resolución de la hipertensión pulmonar (documentada con ecocardiografía) |
| • La retirada debe ser gradual |
| • Realizar pequeños descensos en el flujo de oxígeno a lo largo de varios meses |
| • No disminuir ni retirar durante procesos infecciosos intercurrentes |
| • Observar al paciente durante 2-4 semanas antes del próximo descenso |
| • Considerar continuar con los aportes de oxígeno e incluso aumentarlos si la ganancia de peso no es adecuada o hay signos evidentes de hipoxia |
Junto con los cambios posturales, facilita la movilización de secreciones y el drenaje bronquial en niños con atelectasias persistentes o secreciones espesas, o cuando se prolonga la VM. Se emplean diferentes técnicas, como vibraciones, presiones toracoabdominales, ejercicios de reexpansión pulmonar, drenaje postural, percusión suave, tos provocada y estimulación del punto pectoral de Vojta38.
En domicilio, se recomienda continuar con estas técnicas en los pacientes especialmente graves, pues los efectos de la fisioterapia respiratoria parecen ser beneficiosos39.
Soporte nutricionalEl objetivo principal del soporte nutricional es optimizar el crecimiento y el desarrollo. Las técnicas de alimentación y la composición de las fórmulas enterales son motivo de discusión. Para administrar las calorías adecuadas, se debe recurrir a fórmulas especiales para prematuros, sobre todo durante los primeros meses, y en ocasiones será necesario suplementar con hidratos de carbono o grasas. Habrá que prestar atención a los suplementos minerales y vitamínicos, necesarios en todos los prematuros23.
Calendario de visitas. Protocolo de actuaciónEn este apartado queda resumido el plan de seguimiento del niño con DBP tras el alta hospitalaria, propuesto por el GTPRP-SENP. Es aplicable a todos los niños con diagnóstico de DBP, incluidos los grados leves. La tabla 5 muestra el cronograma de visitas recomendado. Es orientativo y se modificará a criterio del médico responsable, según las necesidades de cada paciente. La tabla 6 refleja los controles clínicos, y la tabla 7 resume las exploraciones complementarias a considerar durante el seguimiento.
Cronograma de visitas recomendado en el paciente con DBP
| 1.ª visita: • 2 semanas tras el alta, o a las 40 semanas de edad gestacional corregida, según fecha de alta de Neonatología |
| 2.ª visita y sucesivas durante el primer año de vida: • Cada 1-3 meses según las necesidades del paciente (oxigenoterapia, traqueostomía, diuréticos…) |
| Visitas entre el primer y el segundo año de vida: • Cada 3-6 meses |
| Visitas a partir de los 2-3 años: • Si la evolución es favorable: visita anual hasta los 14-18 años (o bienal a partir de los 10 años) Si la evolución no es favorable: visitas según necesidades |
| A partir de los 14 años (según cada centro): • Transición a Neumología de adultos, especialmente en casos de DBP moderada-grave |
Controles clínicos en las diferentes visitas
| En la primera visita: |
| • Informar a los padres de forma breve y sencilla sobre la DBP y su pronóstico a largo plazo, plan de visitas y posibles pruebas complementarias. Actualizar y aclarar dudas en siguientes visitas |
| • Antecedentes familiares: número de hermanos, antecedentes familiares de alergia, asma, o enfermedades pulmonares en familiares de primer grado |
| • Factores ambientales: tabaquismo materno durante el embarazo, familiares fumadores en el domicilio, animales en el domicilio |
| Somatometría con percentiles (curva de crecimiento) |
| Alimentación: volumen, diversidad, forma de administración (succión-cuchara, SNG, gastrostomía) |
| Constatar profilaxis con palivizumaba |
| Calendario de vacunaciones: vacunas recibidas comprobando especialmente la de la gripe y el neumococoa |
| Registro de: |
| • Visitas a urgencias e ingresos hospitalarios por problemas respiratorios (detección de virus respiratorios si se han solicitado) |
| • Episodios de broncoespasmo u otra enfermedad respiratoria relevante controlados ambulatoriamente por el pediatra |
| Supervisión del tratamiento de base (broncodilatadores, corticoides, diuréticos, fármacos para la hipertensión pulmonar); valorar modificaciones |
| Controles especiales en los tratados con oxígeno o portadores de traqueostomía: flujo de oxígeno, dispositivos, SaO2 alcanzada |
| Anamnesis por aparatos: |
| • Respiratorio: tos, sensación de disnea (en reposo, con las tomas o con la actividad) |
| • ORL: ronquido, estridor, pausas de apnea |
| • Aparato digestivo: regurgitación/vómitos, ganancia ponderal, episodios de atragantamiento o aspiración |
| Exploración física: aspecto general, situación respiratoria en reposo, auscultación cardiopulmonar |
| Recomendaciones sobre prevención de infecciones respiratorias y medidas frente al tabaquismo pasivo |
Pruebas complementarias durante el seguimiento de los pacientes con DBP
| Individualizar en cada paciente la indicación de: |
| Pruebas de imagen: Rx de tórax, TAC pulmonar, gammagrafía |
| Gasometría (DBP moderada-grave con O2 domiciliario) |
| Control de electrolitos (en los tratados con diuréticos) |
| Polisomnografía/poligrafía respiratoria nocturna |
| Fibrobroncoscopia (sospecha de anomalías estructurales de la vía aérea) |
| pHmetría/impedanciometría |
| Pulsioximetría nocturna: recomendable en los pacientes con oxigenoterapia domiciliaria, previamente a su retirada definitiva. |
| Ecocardiografía: |
| Indicada en los primeros meses de seguimiento como despistaje de HP en los casos de DBP moderada-grave (a los 2-3 meses, 4-6 y 10-12 meses de edad) |
| Controles periódicos en pacientes con diagnóstico de hipertensión pulmonar, a criterio de Cardiología |
| Función pulmonara: |
| En menores de 2 años: según disponibilidad del laboratorio de función pulmonar, con fines de investigación y con un protocolo establecido |
| A partir de los 3 años: espirometría forzada con prueba broncodilatadora. Controles espirométricos anuales. Volúmenes pulmonares. Broncoprovocación tras el ejercicio |
| Otro tipo de estudios, como pletismografía, difusión, etc., con fines de investigación |
| Estudio alergológico: |
| A considerar en los niños mayores de 3 años en los que persistan episodios de broncospasmo |
Los autores declaran no tener ningún conflicto de intereses.