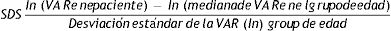La subunidad ácido-lábil (ALS) tiene un papel importante en los efectos endocrinos de los factores de crecimiento similares a la insulina (IGF) en tejidos diana. Históricamente ha recibido una atención limitada. El objetivo de nuestro estudio fue describir el rango normal de ALS en niños sanos y su relación con otros factores de crecimiento.
Pacientes y métodosSe diseñó un estudio descriptivo transversal. Se recopilaron datos sobre edad, altura, índice de masa corporal, edad gestacional, antropometría al nacer y niveles séricos de ALS, IGF1 e IGFBP3 de niños sanos de 2 a 15años con estatura estándar. Los niveles de ALS, IGF1 e IGFBP3 se midieron mediante ELISA. Se utilizaron modelos de normalización GAMLSS para la estandarización de variables.
ResultadosSe recogieron muestras de 446 niños. En niños prepúberes, los niveles de ALS, IGF1 e IGFBP3 se correlacionaron de manera positiva en ambos sexos y con la edad (p<0,01). Los niveles de ALS, IGF1 e IGFBP3 y la relación molar IGF1/IGFBP3 fueron significativamente diferentes entre ambos sexos y más altos en los niños puberales (p<0,01). Se realizaron gráficas de normalidad por género para cada uno de los componentes del complejo ternario y para las relaciones molares IGF1/IGFBP3 e IGFBP3/ALS. Además, se construyeron fórmulas modelo para calcular el Z Score según la edad y el sexo.
ConclusionesEste estudio podría determinar valores de referencia específicos por edad y sexo para IGF1, IGFBP3, ALS, IGF1/IGFBP3 e IGFBP3/ALS en niños españoles y parece establecer la relación entre edad, sexo y estadio puberal.
The acid-labile subunit (ALS) plays an important role in the endocrine effects of insulin-like growth factors (IGFs) on target tissues. Historically, it has attracted limited attention. The aim of our study was to describe the normal range of ALS in healthy children and its association with other growth factors.
Patients and methodsWe designed a cross-sectional descriptive study. We collected data on age, height, body mass index, gestational age, anthropometry at birth and serum levels of ALS, IGF1 and IGFBP3 in healthy children aged 2-15years with a normal height. The levels of ALS, IGF1 and IGFBP3 were measured by ELISA. We fitted GAMLSS normalization models to standardize the variables.
ResultsSamples were collected from 446 children. In prepubertal children, the levels of ALS, IGF1 and IGFBP3 were positively correlated in both sexes and with age (P<.01). We found significant differences in the levels of ALS, IGF1 and IGFBP3 and the IGF1/IGFBP3 molar ratio between the sexes and higher levels in pubertal boys (P<.01). We generated normal probability plots for each sex for each of the components of the ternary complex and for the IGF1/IGFBP3 and IGFBP3/ALS molar ratios. In addition, we extracted equations from the models for the calculation of z-scores for age and sex.
ConclusionsThis study may contribute to age- and sex-specific reference values for IGF1, IGFBP3 and ALS levels and IGF1/IGFBP3 and IGFBP3/ALS ratios in Spanish children and suggests an association between age, sex and pubertal stage.
El crecimiento es un proceso genético muy complejo regulado por múltiples factores extragénicos. La estatura adulta estándar se alcanzará solo cuando todos los factores actúen adecuadamente. Los factores endógenos más importantes que intervienen en el crecimiento son las hormonas, en particular el eje de la hormona del crecimiento (GH)1.
El factor de crecimiento similar a la insulina-1 (IGF1), estimulado por la GH, juega un papel fundamental en el crecimiento durante la infancia y la pubertad. IGF1 se encuentra principalmente en un complejo ternario con proteína de unión al factor de crecimiento similar a la insulina-3 (IGFBP3) y subunidad ácido-lábil (ALS)2.
La ALS es una glucoproteína de 84-86kDa sintetizada exclusivamente por el hígado a partir del gen IGFALS (MIM615961) y estimulada por la GH. Fue descrita y purificada a partir de suero humano por Baxter3 en 1990.
La ALS se encuentra casi exclusivamente en el suero y circula en exceso sobre los otros componentes del complejo ternario, con un 50-60% de la ALS encontrada en forma libre3. El primer caso de baja estatura causado por una deficiencia de ALS fue descrito en 2004 por Domené et al.4. Desde entonces se han descrito 42 variantes del gen IGFALS5-6.
Estudios recientes que utilizan secuenciación masiva informan que la deficiencia total de ALS representa entre el 3 y el 6% de los niños diagnosticados con insensibilidad a la GH7,8.
Entre los niños con baja estatura idiopática, la deficiencia completa de ALS representaría el 1%, mientras que el 5% presentarían un perfil bioquímico que sugiere una deficiencia parcial de ALS9.
A pesar del importante papel de la ALS en los efectos endocrinos de los factores de crecimiento similares a la insulina (IGF) en los tejidos diana, históricamente ha recibido una atención limitada en comparación con otros componentes circulantes del sistema IGF10.
La importancia de medir la ALS en niños con baja estatura aún no se ha descrito.
La caracterización de niños con baja estatura y deficiencia parcial de ALS podría ser clínicamente relevante, ya que estos pacientes muestran un aumento en la tasa de crecimiento después de iniciar el tratamiento con GH9,11.
El objetivo de nuestro estudio fue determinar el rango normal de ALS en niños sanos para identificar los factores que influyen en la concentración de ALS y la relación con otros factores de crecimiento.
Pacientes y métodosSe diseñó un estudio descriptivo transversal. El estudio se realizó en una unidad de endocrinología pediátrica de referencia en colaboración con la facultad de medicina de la universidad de la misma ciudad.
Los criterios de inclusión fueron: niños sanos con edades comprendidas entre 2 y 15años, talla por encima de −2 desviaciones estándar (SD), índice de masa corporal (IMC) −2 a 2SD, edad gestacional (EG) igual o superior a 36 semanas, peso y longitud del recién nacido −2 a 2SD. Todos los valores antropométricos fueron ajustados según sexo, edad y EG en relación con el estudio de crecimiento español de 201012.
Los datos sobre la edad, la altura, el peso y el IMC se recogieron al mismo tiempo de la recolección de muestras, así como los niveles séricos de ALS, IGF1 e IGFBP3, edad gestacional (EG), longitud del recién nacido (LRN) y peso del recién nacido (PRN).
Se obtuvieron muestras de suero de niños sanos en diferentes situaciones: pacientes derivados a una consulta de endocrinología pediátrica que no padecían una enfermedad, niños sanos en consultas de atención primaria y niños que esperaban someterse a una intervención por patología leve no crónica o inflamatoria (hernia inguinal, fimosis, uña encarnada, criptorquidia unilateral, orejas prominentes…). No se incluyeron los pacientes que sufrían una enfermedad que pudiera influir en los resultados ni los pacientes con historia clínica incompleta.
Todos los niños mayores de 12años con la madurez adecuada y los tutores legales firmaron los consentimientos informados.
Este estudio se realizó en cumplimiento de los principios éticos de la Declaración de Helsinki y fue aprobado por el comité de ética del Hospital Universitario de Salamanca.
Los niveles totales de ALS fueron determinados por ELISA (ALS E35 Assay, Mediagnost Laboratory, Alemania) utilizando anticuerpos específicos de conejos13,14. El límite de detección fue de 0,23mU/ml; la variabilidad entre ensayos fue del <8% y la variabilidad intraensayo fue de <6,8%.
El IGF1 total se midió utilizando un ensayo inmunométrico quimioluminiscente marcado con enzimas en fase sólida (IMMULITE 1000 IGF-I, Siemens). El IGF1 se separó de las proteínas de unión utilizando un ambiente ácido, dejando el IGF1 sin unir y expuesto a los anticuerpos específicos altos. El límite de detección fue de 14,4ng/ml. El coeficiente de variación intraensayo e interensayo fue de <4,8 y 5,7%, respectivamente. No se describieron reactividades cruzadas significativas.
Durante el estudio se produjo un cambio en la determinación de IGF1 por parte del laboratorio, adoptando un nuevo estándar (WHO NBSC IS 02/254). Este evento modificó los niveles totales de IGF1 obtenidos con el estándar anterior (WHO NBSC IS 87/518), que fueron más bajos utilizando el nuevo método. Los valores del nuevo método muestran una correlación y una concordancia muy buenas respecto al antiguo, como se demostró en un estudio realizado en nuestro laboratorio, donde el 95,6% de los puntos se encontraban dentro de los límites óptimos15. Los valores de IGF1 obtenidos con el método anterior se convirtieron según la fórmula descrita:
IGF1 nuevo método=6,053+0,754 (IGF1 antiguo método)para poder comparar todos los valores de IGF1 en igualdad de condiciones.
Los niveles totales de IGFBP3 se determinaron mediante tecnología de quimioluminiscencia (IDS-iSYS Insulin-like Growth Factor Binding Protein3, IS-4400). Se agregaron reactivos de activación; la luz resultante emitida por la etiqueta de acridinio fue directamente proporcional a la concentración de IGFBP3 en la muestra original. El límite de detección fue de 50ng/ml. El coeficiente de variación intraensayo e interensayo fue de <2,6 y 7,2%, respectivamente. Esta determinación no tuvo reactividad cruzada con otras IGFBP16.
Debido a que el peso molecular de IGF1 (7,6kDa), IGFBP3 (29kDa) y ALS (85kDa) son muy diferentes, esta relación debe expresarse como una relación molar. La relación entre IGF1 e IGFBP3 debe determinarse después de que ambas concentraciones se expresen en nanomol/l. Considerando la gran diferencia de peso molecular entre IGF1 e IGFBP3, la relación molar expresada como porcentaje indica la abundancia relativa de IGF1 en comparación con IGFBP316-18. El cálculo de la relación molar IGF1/IGFBP3 se basó en la publicación de Friedrich et al.16.
EstadísticaLa normalidad de los datos se determinó mediante la prueba de Saphiro-Wilk y la prueba de Kolmogorov-Smirnov; la normalidad se estableció como p>0,05. La media y la desviación estándar se calcularon para los casos de variables normales, y la mediana y el rango intercuartílico se calcularon para las variables no normales. Los grupos se compararon utilizando la prueba t de Student y ANOVA para datos normales, y Mann Whitney y Kruskall-Wallis para datos no normales.
Se utilizaron modelos de normalización GAMLSS19-20 para la estandarización de las relaciones molares ALS, IGF1 e IGFBP3, e IGF1/IGFB3 e IGFBP3/ALS en población pediátrica sana. Los modelos se ajustaron en función de la edad y el sexo. Para el análisis estadístico se utilizaron el software SPSS2121 y el software R22.
El sistema de puntuación de desviación estándar (SDS) expresa el número de puntuaciones SD o Z por las que un dato está por encima o por debajo de la media o mediana de la población de referencia. En el sistema SDS, los valores de la población de referencia siguen una distribución normal (distribución de Laplace-Gauss).
La fórmula para calcular la SDS es: SDS=(valor medio de la población de referencia del valor observado) / [valor de desviación estándar de la población de referencia].
Los valores de referencia de las variables en nuestro estudio (ALS, IGF1, IGFBP3, IGF1/IGFBP3 e IGFBP3/ALS) no siguen una distribución normal, por lo que se debe realizar una transformación matemática logarítmica previa para lograr la normalización de estos datos con el fin de calcular posteriormente el SDS23.
ResultadosSe recogieron muestras de 446 niños (267 niños y 179 niñas) con una mediana de edad de 7,6años.
Descripción generalSe recogieron datos de 343 niños prepúberes (222 niños y 121 niñas) y 103 niños puberales (45 niños y 58 niñas).
La mediana de edad fue de 7,1 (4,73-10,66) años en los niños y de 8,2 (5,98-10,98) años en las niñas. La estatura media fue de 0,06±0,99SD en niños y 0,03±1,06SD en niñas. No hubo diferencias significativas entre la talla, el peso, el IMC o los valores de antropometría al nacer entre hombres y mujeres. Los datos descriptivos de la muestra se muestran en la tabla suplementaria 1.
Correlaciones entre ALS, IGF1 e IGFBP3 (tablas suplementarias 2 y 3)En niños prepúberes, los niveles de ALS, IGF1 e IGFBP3 se correlacionaron de manera significativa y positiva en ambos sexos y con la edad (p<0,01). La correlación con la edad desapareció de la etapa puberal, aunque esto puede ser debido al bajo tamaño de la muestra, ya que en nuestro estudio solo se incluyen 45 varones y 58 mujeres puberales.
Los niveles de ALS, IGF1 e IGFBP3 se correlacionaron positivamente con la altura y el IMC SD (p<0,01), pero no con LRN SD. Los niveles de la relación molar IGF1/IGFBP3 también se correlacionaron positivamente con la edad, la altura y el IMC (p<0,05).
Comparación entre IGF1, IGFBP3 y ALS según sexo y pubertad (tabla suplementaria 4)Los niveles de ALS, IGF1 e IGFBP3 e IGF1/IGFBP3 fueron significativamente diferentes en niños y niñas y más altos en niños puberales en comparación con niños prepúberes (p<0,01).
No se observaron diferencias significativas en los niveles de IGFBP3/ALS entre niños y niñas o en niños puberales y prepúberes.
No se observaron diferencias significativas entre las diferentes etapas de TannerII, III, IV yV en niños puberales para los niveles de ALS.
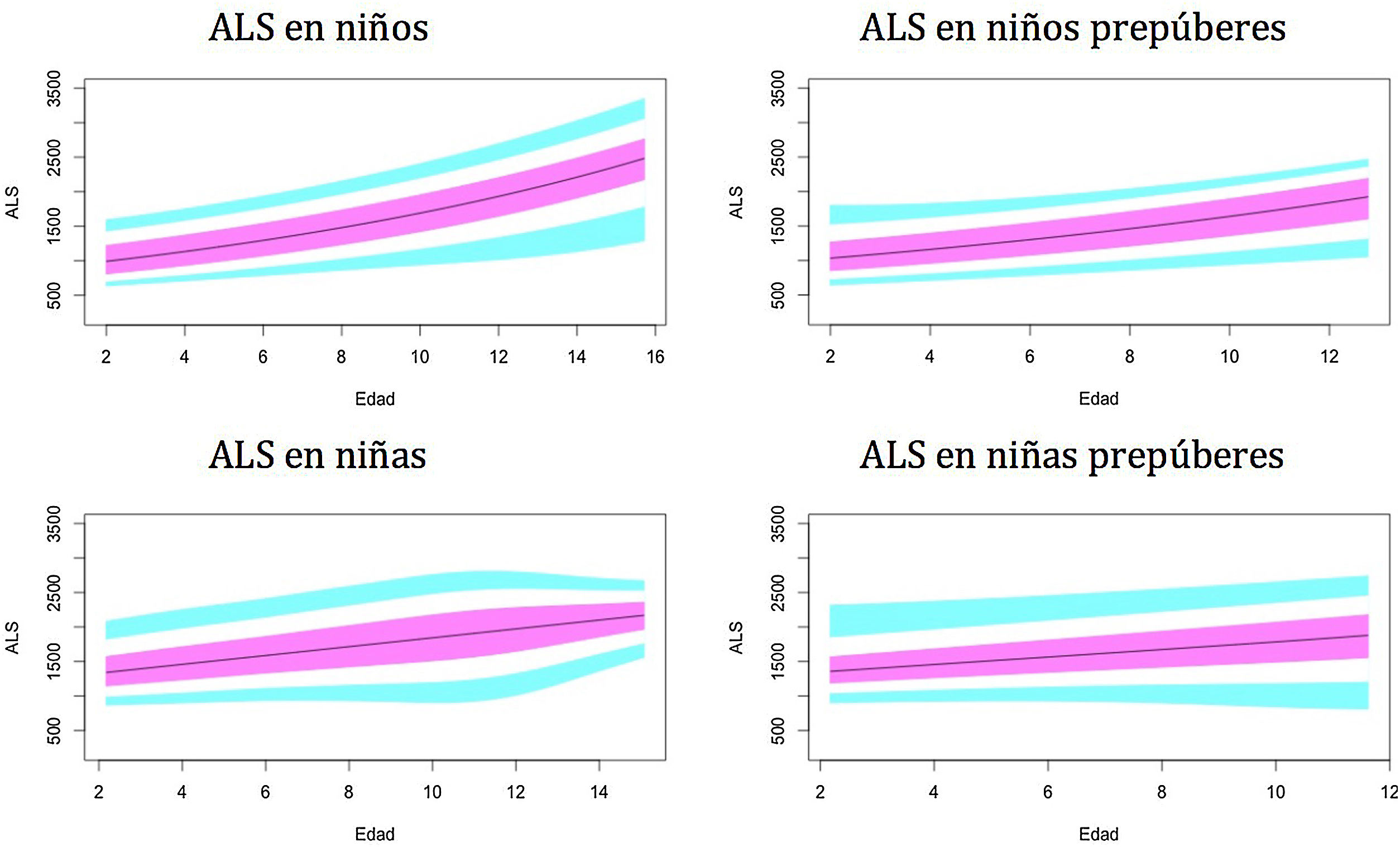
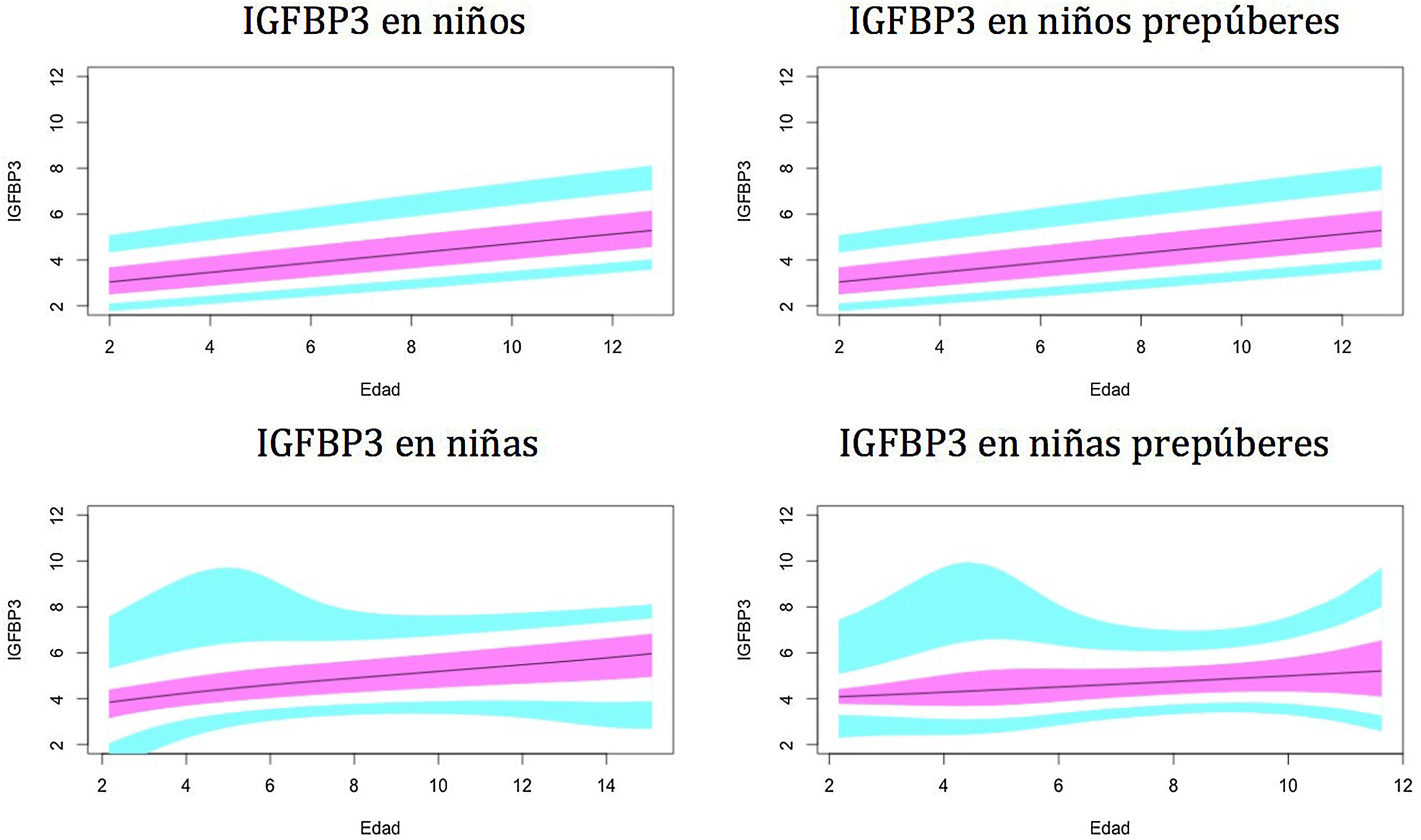
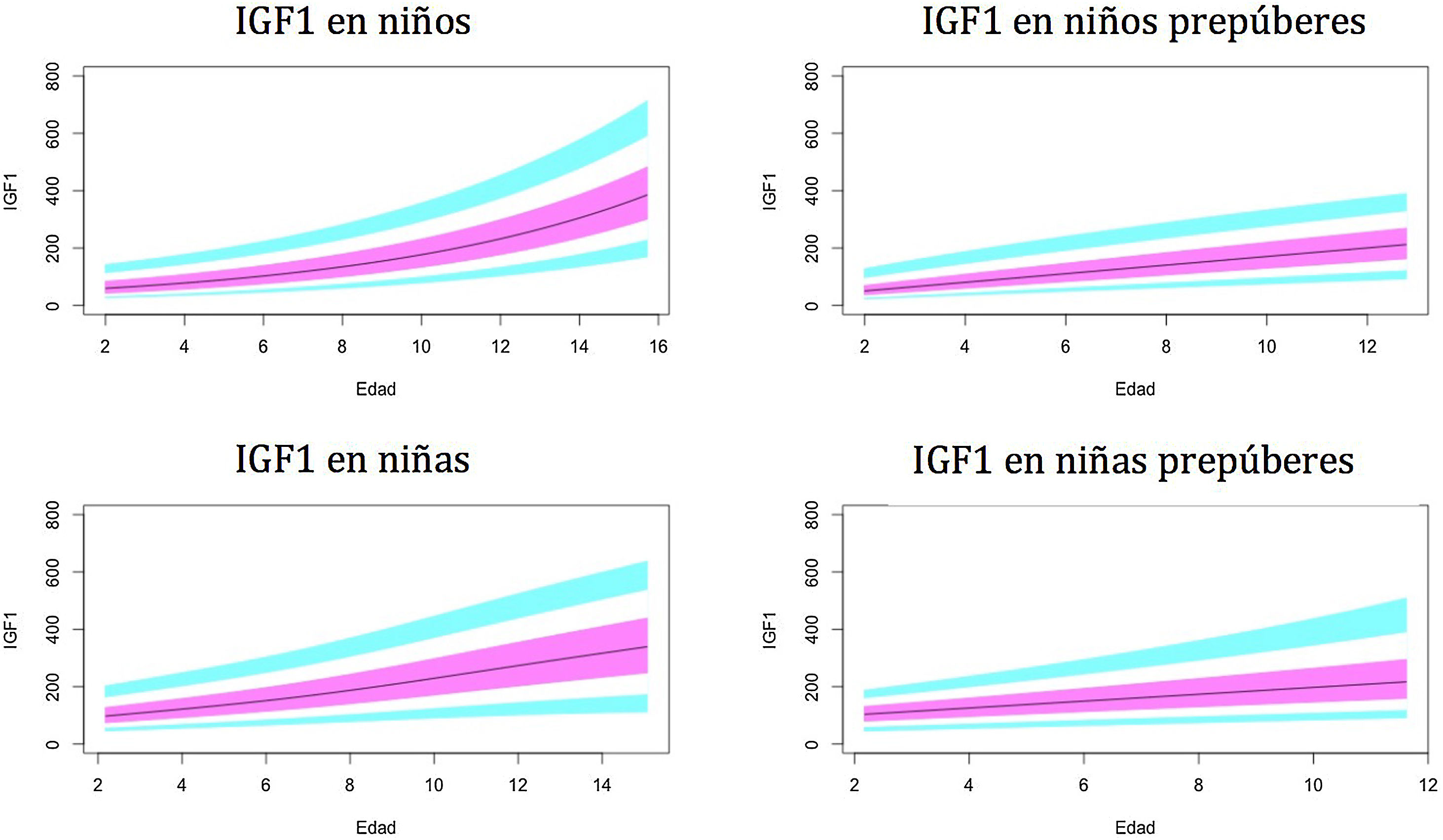
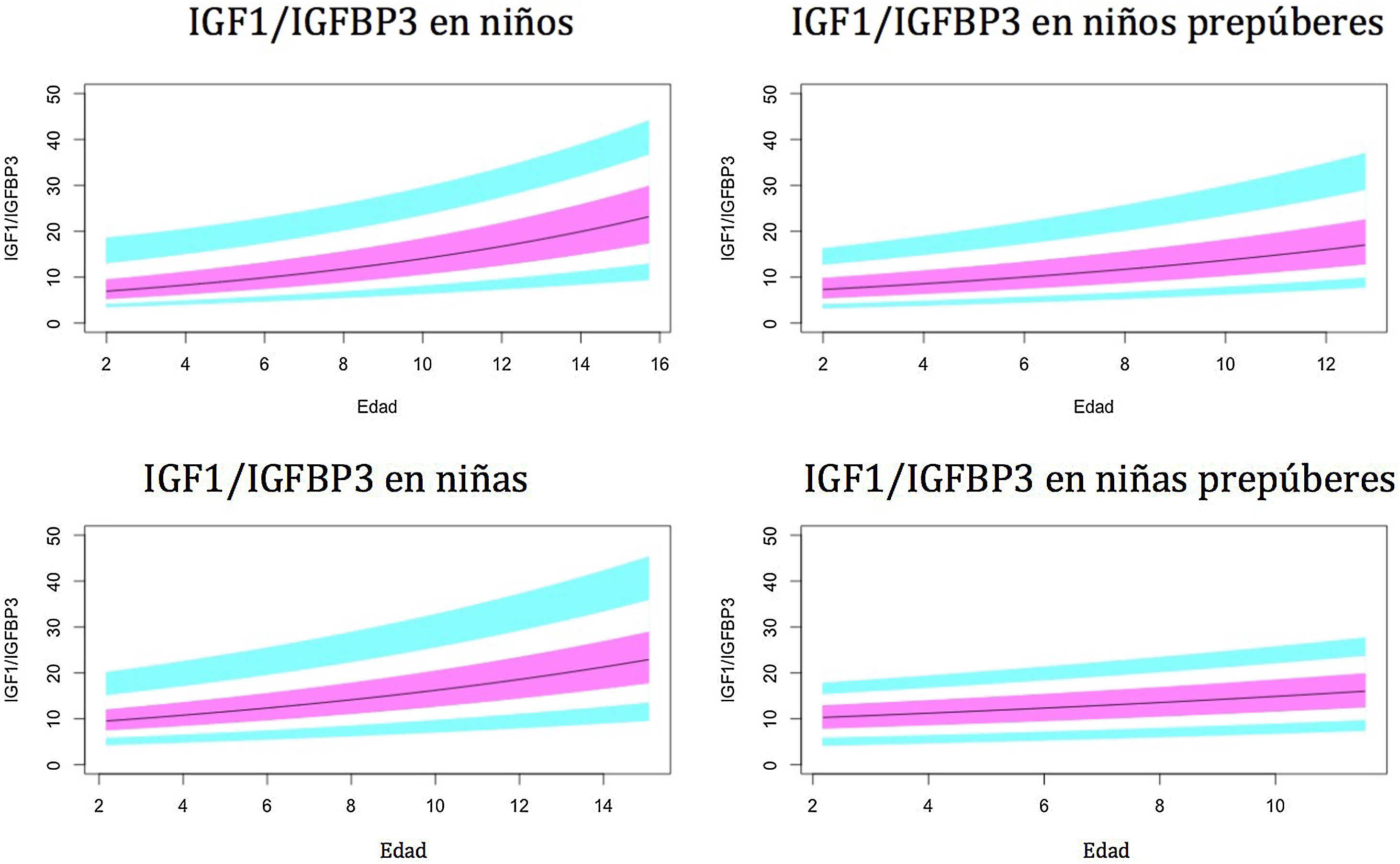
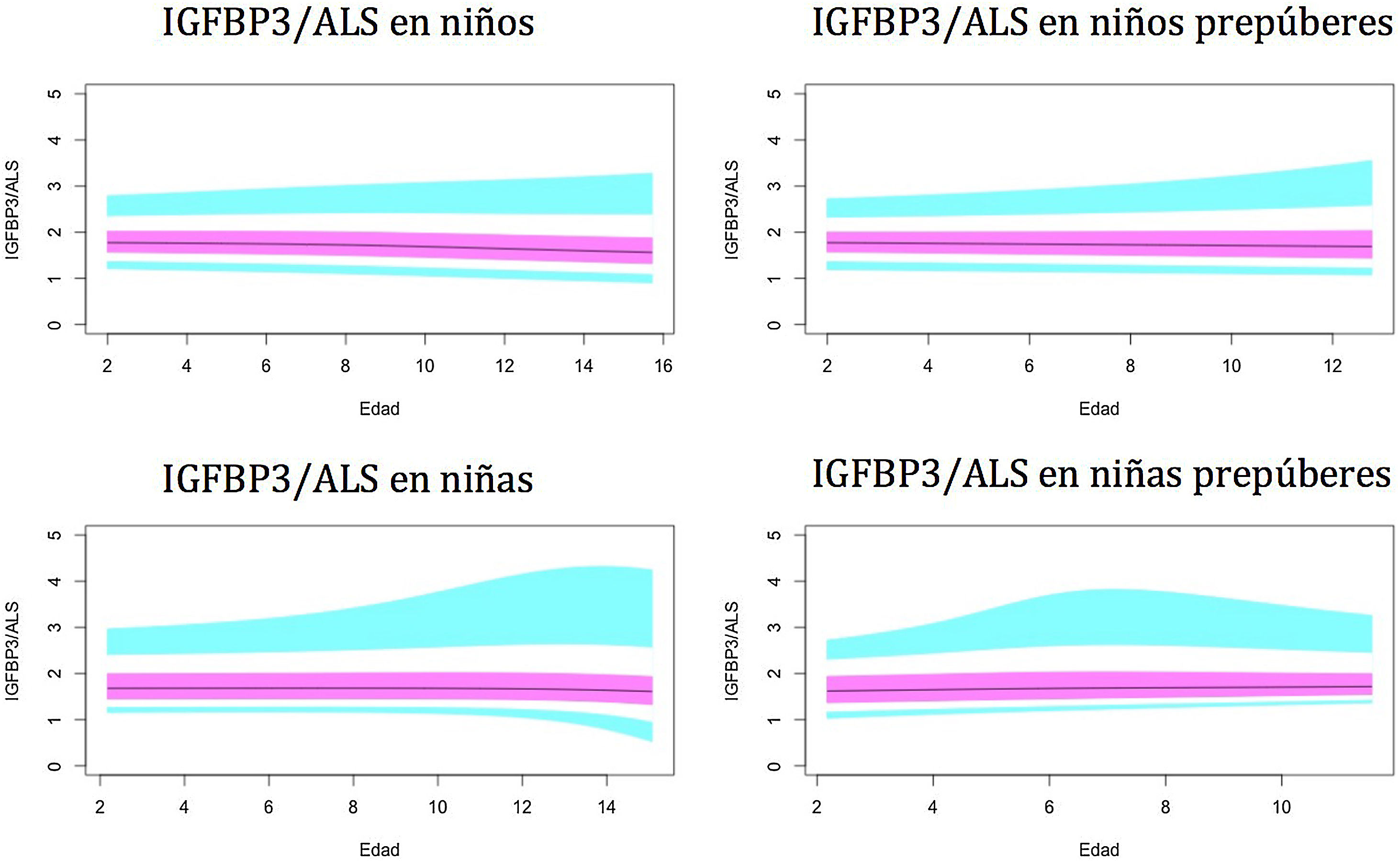
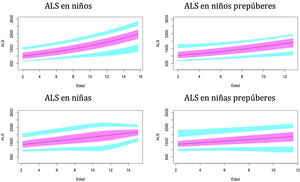
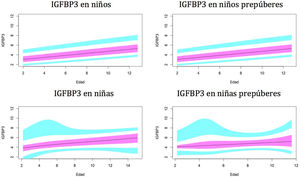
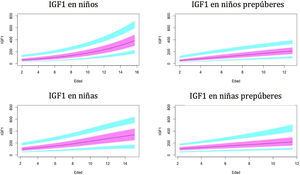
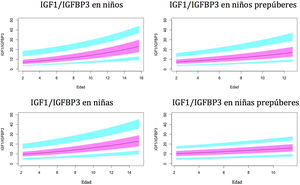
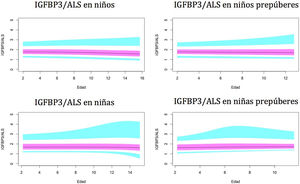
Gráficos de normalidadSe realizaron gráficos de normalidad por sexo para todos los sujetos. También se establecieron para cada uno de los tres componentes del complejo ternario y para las relaciones molares IGF1/IGFBP3 e IGFBP3/ALS para el total de los sujetos y los sujetos prepúberes (figs. 1-5).***
Valores normales para la proteína de unión al factor de crecimiento de insulina número3 (IGFBP3) en μg/ml.
La línea azul corresponde a los valores del percentil 3-10 y 90-97; la línea púrpura corresponde a los valores del percentil 25-75; la línea negra corresponde al valor de la puntuación 0Z, percentil 50.
Valores normales para la relación molar IGF1/IGFBP3.
La línea azul corresponde a los valores del percentil 3-10 y 90-97; la línea púrpura corresponde a los valores del percentil 25-75; la línea negra corresponde al valor de la puntuación 0Z, percentil 50.
IGFBP3: proteína de unión al factor de crecimiento de insulina número3; IGF1: factor de crecimiento de insulina tipo1.
Valores normales para la relación molar IGFBP3/ALS.
La línea azul corresponde a los valores del percentil 3-10 y 90-97; la línea púrpura corresponde a los valores del percentil 25-75; la línea negra corresponde al valor de la puntuación 0Z, percentil 50.
IGFBP3: proteína de unión al factor de crecimiento de insulina número 3; ALS: subunidad ácido-lábil.
Después de llevar a cabo la transformación matemática de nuestros datos para lograr una distribución normal, podemos calcular la desviación estándar (SD) de un dato observado mediante la siguiente fórmula matemática: SDS=[ln (valor observado) − ln (valor medio de la población de referencia)] / [valor de desviación estándar de la población de referencia (ln)]
Los valores medios de la población de referencia y los valores de desviación estándar de la población de referencia se muestran en las tablas suplementarias 5-9.
DiscusiónEste estudio determina el rango normal de ALS en población pediátrica sana mediante la creación de tablas, fórmulas y gráficos de probabilidad normal. Además, el rango normal para las relaciones molares IGF1/IGFBP3 e IGFBP3/ALS se determina mediante tablas, fórmulas y gráficos de probabilidad.
Se observa que los niveles de ALS aumentan progresivamente con la edad a lo largo del desarrollo infantil.
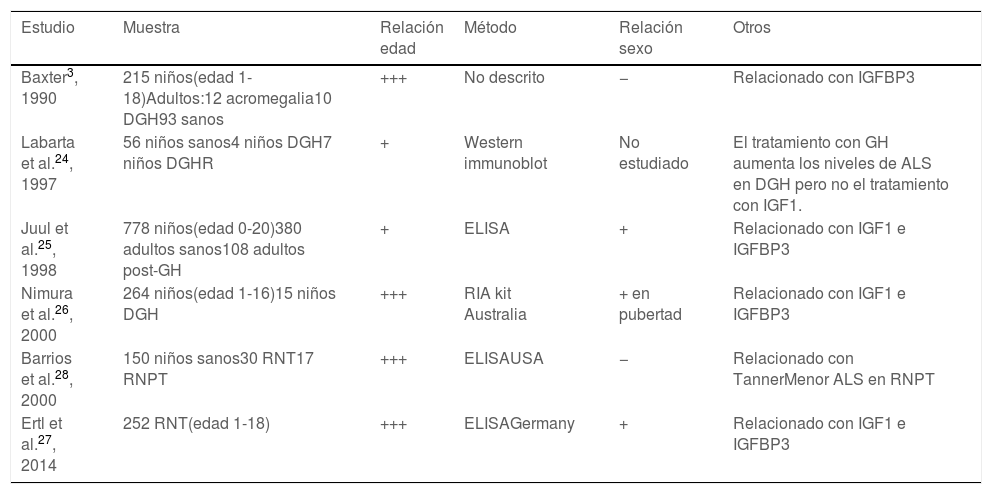
Los niveles de ALS están relacionados con IGF1 e IGFBP3 y con la edad, como se observó en estudios previos3,24-28) (tabla 1). Las diferencias entre sexos han sido inconstantes en estudios previos (tabla 1).
Resultados de estudios previos sobre el rango normal para la subunidad ácido-lábil (ALS)
| Estudio | Muestra | Relación edad | Método | Relación sexo | Otros |
|---|---|---|---|---|---|
| Baxter3, 1990 | 215 niños(edad 1-18)Adultos:12 acromegalia10 DGH93 sanos | +++ | No descrito | − | Relacionado con IGFBP3 |
| Labarta et al.24, 1997 | 56 niños sanos4 niños DGH7 niños DGHR | + | Western immunoblot | No estudiado | El tratamiento con GH aumenta los niveles de ALS en DGH pero no el tratamiento con IGF1. |
| Juul et al.25, 1998 | 778 niños(edad 0-20)380 adultos sanos108 adultos post-GH | + | ELISA | + | Relacionado con IGF1 e IGFBP3 |
| Nimura et al.26, 2000 | 264 niños(edad 1-16)15 niños DGH | +++ | RIA kit Australia | + en pubertad | Relacionado con IGF1 e IGFBP3 |
| Barrios et al.28, 2000 | 150 niños sanos30 RNT17 RNPT | +++ | ELISAUSA | − | Relacionado con TannerMenor ALS en RNPT |
| Ertl et al.27, 2014 | 252 RNT(edad 1-18) | +++ | ELISAGermany | + | Relacionado con IGF1 e IGFBP3 |
ALS: subunidad ácido-lábil; DGH: deficiencia de hormona de crecimiento; DGHR: deficiencia del receptor de la hormona del crecimiento; GH: hormona del crecimiento; IGFBP3: proteína de unión al factor de crecimiento de insulina número3; IGF1: factor de crecimiento de insulina tipo1; RNPT: recién nacido pretérmino; RNT: recién nacido a término.
Este estudio muestra diferencias en los niveles de ALS entre ambos sexos en los niños. Las niñas tienen niveles más altos de ALS, especialmente durante el período prepuberal, como en los estudios de Ertl et al.27 y Juul et al.25, y en contraste con otros estudios que no han encontrado diferencias entre sexos28 o solo han encontrado diferencias en el período puberal26.
Los resultados de nuestro estudio muestran un rápido aumento de los niveles de ALS en la etapa puberal, a partir de los 10años, y un aumento moderado en los sujetos prepúberes antes de los 10años. Estos resultados difieren del estudio de Ertl et al.27, donde los niveles de ALS aumentan rápidamente a partir de los 12-13años. Esto podría explicarse por la presencia de sujetos prepúberes y puberales en el estudio.
El método y la unidad de medida utilizados en el estudio de Barrios et al.28 difieren del nuestro, pero observamos un aumento de los niveles de ALS con la edad y la etapa puberal en ambos estudios.
En nuestro estudio observamos variaciones en IGF1 e IGFBP3 a lo largo del desarrollo. Hay un aumento de estos niveles con la edad y un mayor aumento en el período puberal. Los resultados muestran diferencias entre ambos sexos, como se describió previamente en otros estudios29-35.
El pico puberal de IGF1 aparece antes en las niñas, de acuerdo con la literatura38,39. Esto puede estar relacionado con que la pubertad en niños comienza a una mayor edad cronológica. Se observa una estabilización de los niveles de IGF1 en mujeres puberales, alrededor de los 14años de edad. Esto no ocurre en los varones, ya que nuestros sujetos tienen hasta 15años y la pubertad en los hombres termina más tarde. En el estudio de Ertl et al.27 esta estabilización también aparece en niñas mayores de 14años; la estabilización y posterior disminución ocurre a partir de los 17años en niños. El estudio de Alberti et al.31 también muestra una disminución de los niveles a la edad de 14años en las niñas y más tarde en los niños.
Como se mostró en estudios previos30,31, observamos diferencias en los niveles de IGFBP3 entre ambos sexos.
En el período prepuberal, hasta los 10años, los niveles de IGFBP3 son más altos en las niñas, como se observó en estudios previos35-38.
En nuestro estudio se observa un aumento de la IGFBP3 relacionado con la edad a lo largo del período prepuberal, tanto en niños como en niñas, y una estabilización de los niveles, e incluso una disminución, a partir de los 14-15años y la etapa puberalIII, que también ha sido descrita en el estudio de Juul et al.30.
Estudios previos, como el de Ertl et al.27, también muestran una estabilización de los niveles de IGFBP3 a partir de los 14 años en niños y de los 12 en niñas, pero estos datos no distinguen etapas puberales.
El índice IGF1/IGFBP3 aumenta con la edad. El aumento es más rápido en el período puberal. Los niveles son significativamente más altos en niños puberales en comparación con los niños prepúberes, lo que parece indicar que el aumento de IGF1 en el período puberal es mayor que el aumento de IGFBP3. Esto es coincidente con la mayor tasa de crecimiento observada en estudios previos30,31,35,39.
Los niveles del índice IGFBP3/ALS se mantienen prácticamente constantes durante toda la infancia, sin variaciones significativas entre los sujetos puberales y prepúberes. ALS solo se une a IGFBP3 cuando este está presente como complejo binario con IGF1, y con mucha menos afinidad del ALS por los complejos binarios en comparación con la alta afinidad de IGFBP3 por IGF1. El cálculo de la relación molar IGFBP3/ALS podría ser un parámetro importante para evaluar a aquellos niños con deficiencia parcial de ALS, revelando una cantidad limitada de ALS.
Estudios previos sobre la relación entre los factores de crecimiento y las medidas antropométricas han mostrado resultados diferentes30,32-35. Este estudio muestra una correlación positiva entre los niveles de IGF1, IGFBP3, ALS e IGF1/IGFBP3 con la altura y el IMC medidos en desviaciones estándar, pero no con la longitud al nacer. Este último destaca que en el crecimiento prenatal los factores de crecimiento similares a la insulina se expresan y ejercen sus efectos sin requerir el estímulo de la GH. Ha sido bien establecido que la GH no desempeña un rol importante durante el crecimiento prenatal. Así, los pacientes con deficiencias severas de GH (aun aquellos con deficiencia genética de tipoIA con ausencia completa de GH) y los pacientes con síndrome de Laron por mutaciones inactivantes del receptor de GH presentan un peso y una longitud al nacer dentro de límites normales. Por otro lado, pacientes con deficiencias completas de IGF1 o de IGF2 presentan un cuadro característico de retraso de crecimiento intrauterino, demostrativo del importante rol que desempeñan ambos factores de crecimiento en el crecimiento intrauterino. Debe destacarse que durante esta etapa de la vida los factores de crecimiento IGF1 e IGF2 no requieren la acción de la GH para su normal expresión.
LimitacionesEste estudio incluyó a un número significativo de niños sanos, pero tiene limitaciones.
En primer lugar, el número de sujetos puberales en nuestro estudio no es suficiente para permitir gráficos de probabilidad normales confiables y el rango de edades de los sujetos incorporados se limita a aquellos entre los 2 y los 15años, por lo cual no es posible establecer con claridad los cambios que ocurren en la pubertad, para lo que se requeriría la incorporación de sujetos hasta los 18años.
En segundo lugar, la retirada del ensayo utilizado inicialmente para la determinación de las concentraciones séricas de IGF1 en este estudio (WHO NBSC IS 87/518) hizo necesario convertir cada valor sérico de IGF1 obtenido con el estándar anterior en un valor equivalente para el ensayo actualmente en uso (WHO NBSC IS 02/254)15.
ConclusionesLa combinación de medición de IGF1, IGFBP3 y ALS podría ser útil para el diagnóstico y el seguimiento de niños con trastornos del crecimiento.
Este estudio determinó valores de referencia específicos por edad y sexo para IGF1, IGFBP3, ALS, IGF1/IGFBP3 e IGFBP3/ALS en niños españoles. Estableció la relación entre edad, sexo y etapa puberal, y construyó una fórmula modelo para calcular el Z Score según edad y sexo.
Estos datos normativos deberían facilitar el cuidado de los niños y el monitoreo del crecimiento de los niños sanos.
La creación de gráficas de normalidad basadas en el sexo, la edad y la etapa puberal de las proporciones molares que relacionan los componentes del complejo ternario podría ayudarnos en la evaluación y el seguimiento de pacientes con trastornos del crecimiento.
Se necesitan estudios más amplios para ajustar el rango normal, especialmente en niños puberales.
FinanciaciónEsta investigación no recibió ninguna subvención específica de agencias de financiación en los sectores público, comercial o sin fines de lucro.
Conflicto de interesesLos autores declaran que no tienen ningún conflicto de intereses que pueda percibirse como un perjuicio para la imparcialidad de la investigación reportada