Basándonos en los documentos de consenso europeo y americano de fibrosis quística (FQ) se propone un incremento de la suplementación de vitamina D (VD) en pacientes con FQ y niveles insuficientes. El objetivo de nuestro estudio fue conocer la seguridad y la eficacia de este nuevo protocolo.
Material y métodosEstudio multicéntrico, experimental no aleatorizado ni controlado. A los pacientes con niveles insuficientes (<30ng/ml) se les administró dosis crecientes de VD (entre 800 y 10.000UI/día). Se realizó seguimiento durante 12 meses analizando estatus vitamínico, nutricional, función pulmonar y metabolismo fosfocálcico. Análisis estadístico: pruebas t para datos apareados y regresión logística con análisis multivariable.
ResultadosUn total de 30 pacientes entre 1 y 39 años (mediana 9,1) completaron el estudio. Se retiraron 2 por niveles de 25 OH VD>100ng/ml a los 3 meses sin encontrarse signos clínicos ni analíticos de hipercalcemia. Tras 12 meses se observó un incremento de 7,6ng/ml (IC 95% 4,6-10ng/ml) de los niveles medios de 25 OH VD. El 37% alcanzaron niveles ≥30ng/ml, un 13% <20ng/ml y un 50% entre 20 y 30ng/ml. No se observó asociación de la mejoría de los niveles de VD con la función pulmonar.
ConclusionesCon el protocolo propuesto se consigue un incremento de los niveles séricos de VD y una disminución del porcentaje de pacientes con insuficiencia de la misma, aunque todavía muy lejos de alcanzar los porcentajes de suficiencia recomendados para esta entidad.
Based on the European and American cystic fibrosis (CF) consensus recommendations, an increase in vitamin D (VD) supplementation in patients with CF and insufficient or deficient levels was proposed. The objective of our study was to determine the safety and efficacy of this new protocol.
Material and methodsMulticentre nonrandomized uncontrolled experimental study. Patients with insufficient levels (<30ng/mL) received increasing doses of VD (between 800 and 10,000IU/day). Patients were followed up for 12 months, during which their vitamin and nutritional status, pulmonary function and calcium and phosphate metabolism were assessed. Statistical analysis: t test for paired data and multivariate logistic regression analysis.
ResultsThirty patients aged 1–39 years (median, 9.1) completed the follow-up. Two patients were dropped from the study on account of 25-OH VD levels greater than 100ng/mL at 3 months without clinical or laboratory signs of hypercalcaemia. At 12 months, we observed an increase of 7.6ng/mL (95% CI, 4.6–10ng/mL) in the mean 25-OH VD level and an improvement in vitamin status: 37% achieved levels of 30ng/mL or greater, 50% levels between 20 and 30ng/mL and 13% remained with levels of less than 20ng/mL. We found no association between improved VD levels and pulmonary function.
ConclusionsThe proposed protocol achieved an increase in serum VD levels and a decrease in the percentage of patients with VD insufficiency, although it was still far from reaching the percentages of sufficiency recommended for this entity.
La deficiencia de vitamina D (VD) en pacientes con fibrosis quística (FQ) es muy frecuente. Entre un 40 y 90% tienen niveles séricos de 25 OH VD inferiores a 30ng/ml, mientras que aproximadamente un 15-20% presentan cifras por debajo de 15ng/ml1.
Son múltiples los factores que explican esta circunstancia: ingesta insuficiente de VD, menor absorción debido a la insuficiencia pancreática exocrina, alteraciones en la hidroxilación hepática, disminución de la proteína transportadora de la VD, así como disminución de la síntesis por menor exposición solar2,3.
Para el tratamiento de la deficiencia de VD se han descrito distintas pautas. Por ejemplo, aquellas basadas en la administración semanal: 12.000UI/semana o 50.000UI/semana para los menores o mayores de 5 años, respectivamente4; por otro lado, las pautas «stoss» o de choque, que consisten en administrar una dosis única de hasta 600.000UI seguida de la dosis diaria habitual5. Sin embargo, no existen estudios que comparen la eficacia de las mismas. En los últimos años, tanto la Fundación Americana de FQ6 como la Sociedad Europea de FQ7 han publicado sendos documentos de consenso de manejo nutricional de los pacientes con FQ, en los que se revisan al alza las recomendaciones de suplementación de VD. Ambas guías recomiendan aumentar la dosis de VD en pacientes con FQ. En el caso de la Fundación Americana de FQ, se recomienda tratar la deficiencia de VD con incrementos trimestrales de la dosis diaria de la misma hasta un máximo de 10.000UI/día.
Existen pocos estudios que hayan establecido la efectividad de estas nuevas guías. El objetivo del presente estudio fue analizar la seguridad y eficacia de esta nueva pauta de tratamiento en pacientes con FQ y niveles insuficientes y deficientes de VD.
Material y métodosEstudio multicéntrico, en el que participaron 6 hospitales de España, prospectivo, que analiza la respuesta de los participantes a la intervención propuesta sin disponer de grupo control de comparación. El estudio fue aprobado por el Comité de Ética de la Investigación (CEIC) del hospital investigador principal (referencia n° 45/15) y del resto de centros participantes.
Se incluyó en el estudio a aquellos pacientes con diagnóstico de FQ sin límite de edad que aceptasen participar y firmar el consentimiento informado, encontrándose estos en situación clínicamente estable (ausencia de tos, fiebre, expectoración, hemoptisis o tratamiento antibiótico en las 2 semanas previas) y presentando insuficiencia pancreática exocrina (elastasa fecal <200μg/g) y niveles de 25 OH VD <30ng/ml.
Se consideraron criterios de exclusión presentar datos de alteración hepática, como aumento de las aminotransferasas> 3 veces el límite superior de la normalidad; elevación del Índice Internacional Normalizado (INR)>1,5; presentar una tasa de protrombina <50% o signos de colestasis grave (aumento de la bilirrubina directa por encima del doble para el límite normal de su edad). Por otro lado, también se excluyó a los pacientes con insuficiencia renal (filtrado glomerular <60ml/min/1,73m2 o <1 desviación estándar [DE] del filtrado glomerular para la edad).
En cuanto a las variables analizadas, se registró la edad, el sexo, las mutaciones en el gen CFTR y la dosis de VD recibida (UI/día).
Determinamos peso (kg), talla (cm) e índice de masa corporal (IMC) y las puntuaciones Z (Z-score=valor – media / desviación estándar), utilizando los correspondientes valores de referencia de la Organización Mundial de la Salud.
Se analizó la función pulmonar mediante espirometría: volumen espiratorio en el primer segundo de la espiración (VEMS), capacidad vital (CV) y flujo espiratorio medio (FEF 25-75). Se consideró obstrucción cuando el VEMS era inferior al 80% del valor teórico para la edad, talla y peso del enfermo8.
Como variables analíticas se analizó colesterol, triglicéridos, calcio, fosfatasa alcalina (FA), parathormona (PTH) y vitaminas liposolubles (25 OH VD, alfatocoferol y retinol). Se consideró deficiencia de VD si los niveles estaban por debajo de 20ng/ml e insuficiencia si se encontraban entre 20 y 30ng/ml9.
Finalmente se analizó la función pancreática exocrina mediante elastasa fecal y cuantificación de grasa en heces de 24h.
Todas las variables analíticas fueron determinadas mediante métodos estandarizados de cada hospital. Los niveles de 25 OH VD se determinaron a través de inmunoanálisis tipo competitivo de quimioluminiscencia que emplea una proteína fijadora de VD marcada con rutenio, acridinio o biotina.
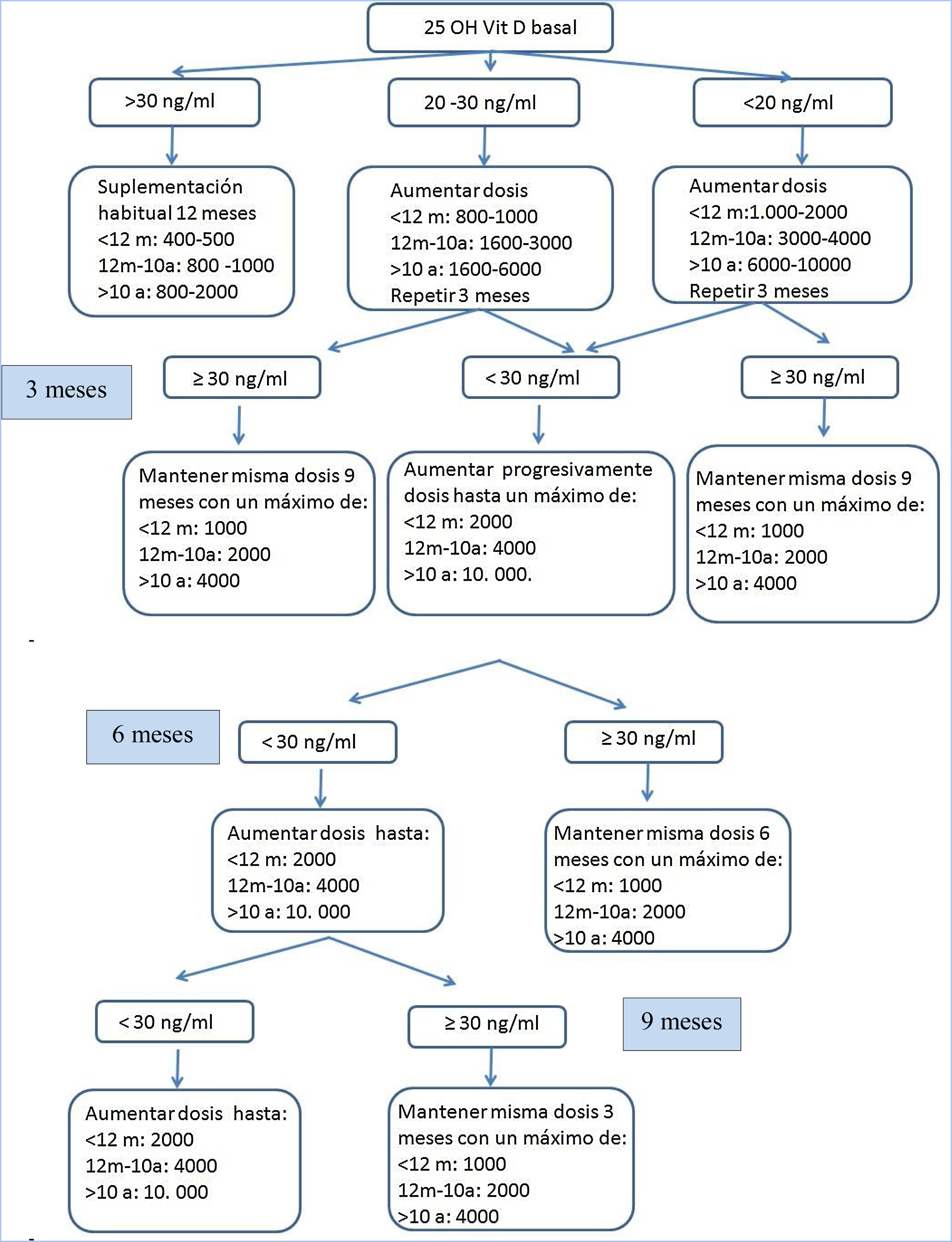
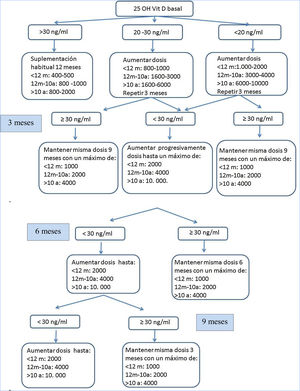
Desarrollo del estudioDurante los años 2014-2016 se reclutó a los pacientes y se realizó una visita de selección (V0). Los pacientes que cumplían los criterios de inclusión y ninguno de exclusión recibieron suplementación con vitamina D3 según el documento de consenso de la fundación norteamericana de FQ y se realizaron controles clínicos y analíticos a los 3, 6, 9 meses (V1,V2,V3), donde se ajustó la dosis de VD según sus niveles séricos, con el objetivo de mantener niveles de calcidiol entre 30 y 100 (ng/ml) (fig. 1). Al año del seguimiento (V4) en todos los pacientes se realizaron de nuevo todas las determinaciones de la visita de selección. Se retiró a los pacientes con niveles de 25 OH VD>100ng/ml o clínica compatible con hipercalcemia (pérdida de peso, dolor abdominal, vómitos, estreñimiento, poliuria, polidipsia, deshidratación...).
Análisis estadísticoLos datos fueron depurados mediante pruebas lógicas y de rango para variables como el peso o la talla en relación con la edad y de consistencia para las fechas. Asimismo, se obtuvieron las distribuciones de las variables más importantes (VD).
Se comprobó la normalidad de las variables mediante la prueba de Shapiro-Wilk. Aquellas variables que cumplían los requisitos de normalidad se describieron mediante media y DE, mientras que aquellas que no los cumplían se describieron mediante mediana y rango intercuartílico.
Para comparaciones de medias entre las visitas se aplicaron pruebas t para datos pareados.
Se utilizaron pruebas de correlación de Pearson (CP) y de Spearman para analizar el comportamiento conjunto de las variables cuantitativas.
Las diferencias se consideraron estadísticamente significativas cuando sus niveles de significación presentaban valores de p<0,05.
La base de datos fue diseñada en Microsoft Access (Microsoft Corporation, Redmond, Washington, EE.UU.) y el análisis estadístico se realizó mediante el programa Stata versión 13.0 (StataCorp LLC, College Station, Texas, EE.UU.).
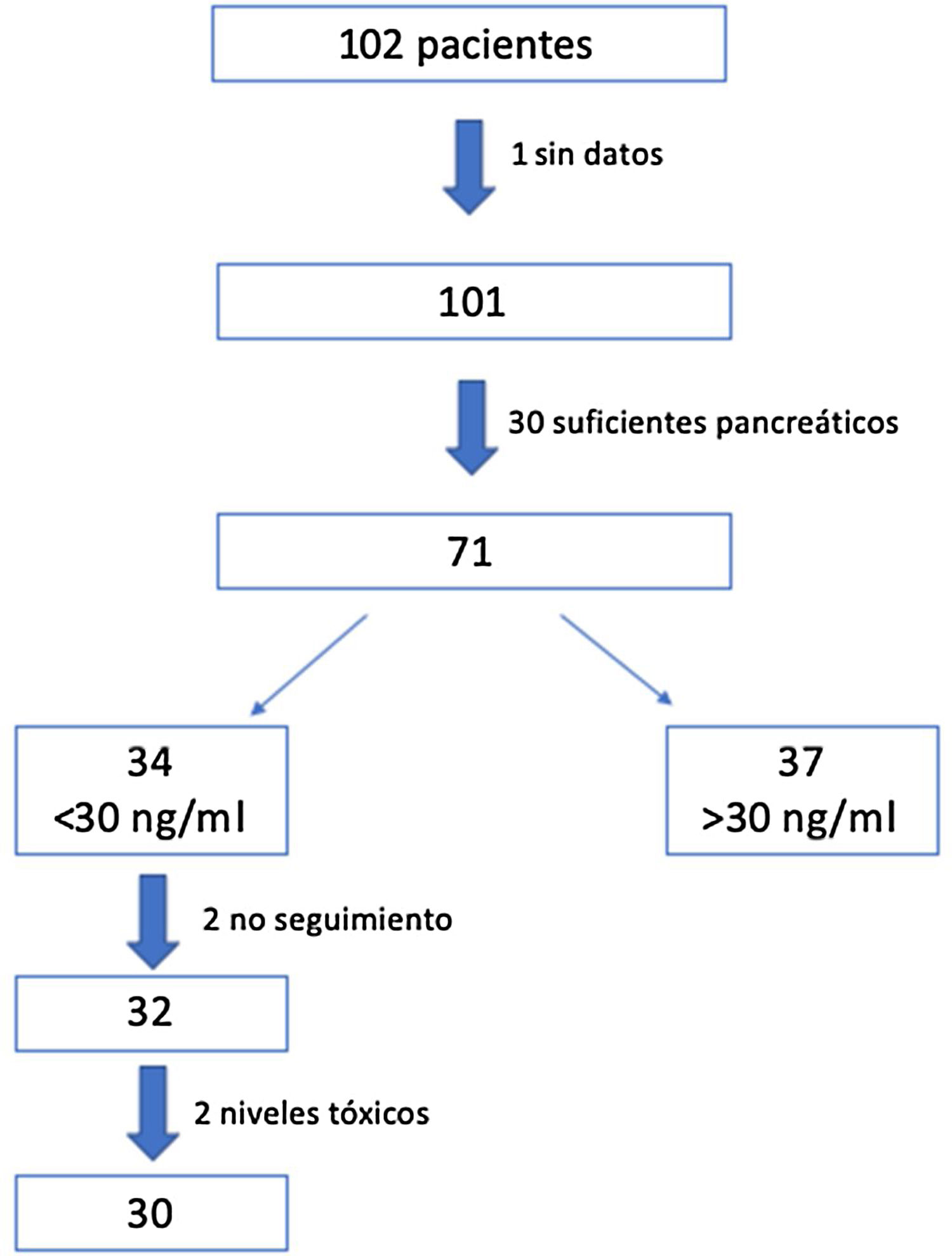
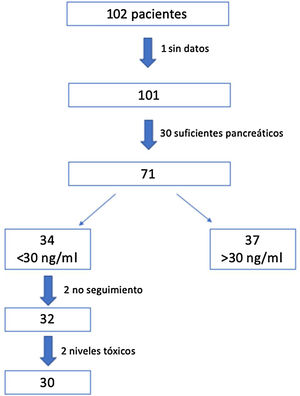
ResultadosSe reclutaron 102 pacientes, de los que 71 fueron seleccionados para el estudio: uno de ellos no fue incluido por datos insuficientes y 30 por ser suficientes pancreáticos. De estos se aplicó el protocolo a los 34 (48%) que presentaban en la visita inicial niveles insuficientes de VD (<30ng/ml). Se produjeron 2 pérdidas durante el seguimiento y otros 2 presentaron niveles de 25 OH VD por encima de 100ng/ml a los 3 meses, por lo que fueron retirados. Finalmente se realizó el estudio con los 30 pacientes restantes (fig. 2).
El 50% de los pacientes eran varones, con una mediana de edad de 9,05 años rango intercuartílico [RI]: 3,76-15,62). El resto de características basales de la muestra se detallan en la tabla 1.
Situación basal de la muestra
| Variables | Valor |
|---|---|
| Edad (mediana 9,05 años (RI: 3,76-15,62) | |
| <2 años | 13% |
| 2-10 años | 37% |
| >10 años | 50% |
| Diagnóstico Screening | 45% |
| Genética | |
| Homocigoto DF508 | 50% |
| Heterocigoto DF508 | 43,3% |
| Otra mutación | 6,7% |
| Desnutrición (IMC<18,5kg/m2/<p10) | 8% |
| IMC (DE) Media± DE (mín-máx) | 0,03±0,9 (-1,9 - 1,5) |
| Obstrucción pulmonar (VEMS<80%) | 62% |
| Colonización Pseudomonas aeruginosa | 19% |
| Colonización MARSA | 12% |
| VEMS (%), media±DE (mín-máx) | 75,6±19,0 (40,0-107,0) |
| FEF25-75(%), media±DE (mín-máx) | 57,6±28,5 (20,0-116,0) |
| CV (%), media±DE (mín-máx) | 80,1±21,2 (33,0-111,0) |
CV: capacidad vital; DE: desviación estándar; FEF: velocidad máxima de flujo mesoespiratorio; IMC: índice de masa corporal; MARSA: Staphylococcus aureus resistente a la meticilina; VEMS: volumen espirado máximo en el primer segundo.
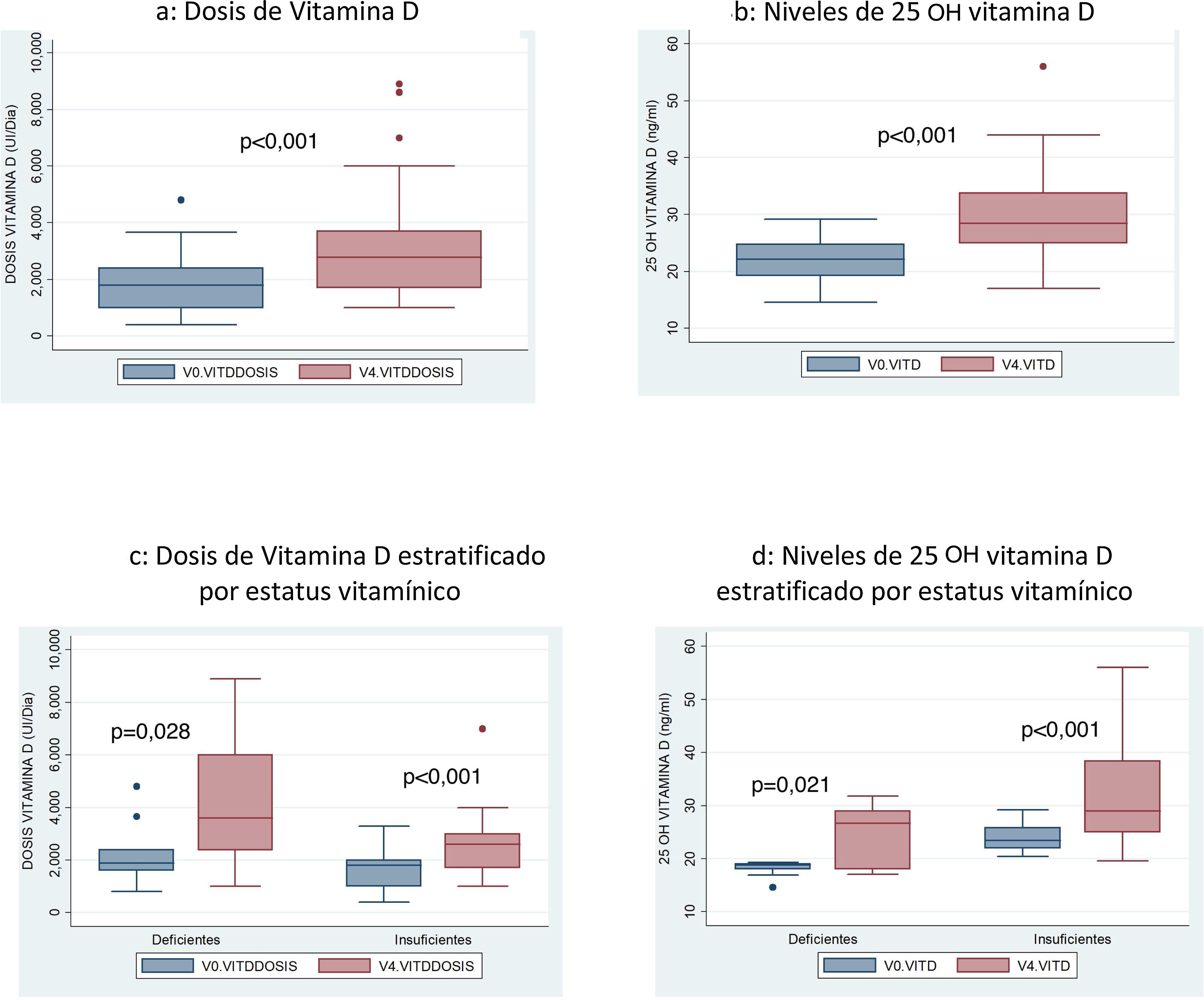
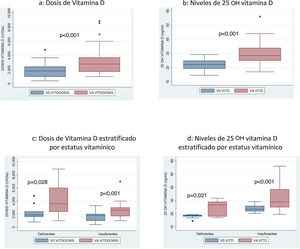
Si comparamos la dosis media de vitamina D recibida en la visita inicial (V0) con la de la visita final, tras 12 meses (V4) se objetiva un incremento significativo de la misma: 1837UI/día en V0 frente a 3165UI en V4 (p<0,001) (fig. 3a).
También se objetivó un incremento de 7,6ng/ml (IC 95% 4,6-10ng/ml) de los niveles medios de 25 OH VD al comparar la media en la visita inicial (22,12ng/mL) con los que presentaban tras un año de seguimiento (29,75ng/ml) (fig. 3b).
Se observó una correlación positiva entre el incremento de la dosis recibida de VD (entre V0 y V4) con los incrementos de los niveles de calcidiol entre ambas visitas (CP: 0,37, p=0,045).
Tras la aplicación del protocolo, se logró reducir el porcentaje de pacientes con niveles deficientes del 30% al 13% y el porcentaje de pacientes insuficientes de un 70% a un 50% (p=0,044). Tras 12 meses de seguimiento, un 37% de pacientes lograron alcanzar niveles suficientes (>30ng/ml). El 53% de los pacientes mejoraron el estatus nutricional de la VD: 5 pasaron de niveles deficientes a insuficientes, uno de niveles deficientes a suficientes y 10 de insuficientes a suficientes.
En cuanto al estatus nutricional analizado a través del IMC, no se encontraron diferencias significativas tras la aplicación del protocolo en estudio (tabla 2).
Estatus nutricional, función pancreática, pulmonar y metabolismo fosfocálcico. Comparación V0 vs. V4
| Variable | V0 | V4 | p |
|---|---|---|---|
| Niveles de vitamina A (μg/dl), media (IC 95%) | 40,1(33,8-46,4) | 41,9(36,9-46,4) | 0,459 |
| Niveles de vitamina E (μg/ml), media (IC 95%) | 977,0(817,4-1136,5) | 1019,5(866,4-1172,7) | 0,623 |
| Ratio vitamina E/colesterol (mg/g), media (IC 95%) | 7,8(6,6-9,0) | 8,5(7,0-10) | 0,323 |
| IMC (DE), media (IC 95%) | 0,03(−0,4-0,5) | −0,09(−0,5-0,3) | 0,292 |
| Grasa en heces (g/24h)Media (IC 95%) | 7,1(5,2-9,0) | 6,7(5,2-8,1) | 0,665 |
| Enzimas pancreáticas(Unidades lipasa/día)Media (IC 95%) | 122.288,0(93.563,0-151.013,0) | 120.475,0(95.086,0-145.864,0) | 0,874 |
| Colesterol (mg/dl), media (IC 95%) | 129,6(117,2-142,0) | 125,9(116,2-136,0) | 0,288 |
| Triglicéridos (mg/dl), media (IC 95%) | 87,2(72,9-101,5) | 87,2(72,4-102,1) | 1 |
| Zinc (μg/ml)Media (IC 95%) | 97,5(84,9-110,0) | 97,9(86,9-108,6) | 0,909 |
| VEMS (%), media (IC 95%) | 74,2 (65,6-82,9) | 76,2 (66,6-85,8) | 0,303 |
| FEF25-75 (%), media (IC 95%) | 61,0 (40,2-81,8) | 60,4 (40,9-80,4) | 0,902 |
| CV (%), media (IC 95%) | 79,3 (69,0-89,6) | 83,8 (73,1-94,4) | 0,214 |
| Calcio (mg/dl), media (IC 95%) | 10,0 (9,7-10,2) | 9,6 (9,5-9,8) | 0,008 |
| Fósforo (mg/dl), media (IC 95%) | 4,6 (4,4-4,8) | 4,5 (4,3-4,7) | 0,490 |
| Fosfatasa alcalina (U/L), media (IC 95%) | 270,0 (230,0-309,0) | 225,0 (187,0-262,0) | 0,007 |
| Parathormona (pg/ml), media (IC 95%) | 46,0 (34,0-57,0) | 40,0 (32,0-48,0) | 0,199 |
CV: capacidad vital; DE: desviación estándar; FEF: velocidad máxima de flujo mesoespiratorio; IC: intervalo de confianza; IMC: índice de masa corporal; VEMS: volumen espirado máximo en el primer segundo.
A diferencia de la VD, no observamos diferencias en los niveles del resto de vitaminas liposolubles tras un año de seguimiento. Respecto a la función pancreática exocrina, no se objetivaron diferencias en la determinación de grasa en las heces, ni se modificó la terapia de sustitución de enzimas pancreáticas que recibían los pacientes (tabla 2).
Se analizó la función pulmonar de los pacientes a través del VEMS, FEF25-75 y CV sin encontrar diferencias significativas a lo largo del seguimiento (tabla 2).
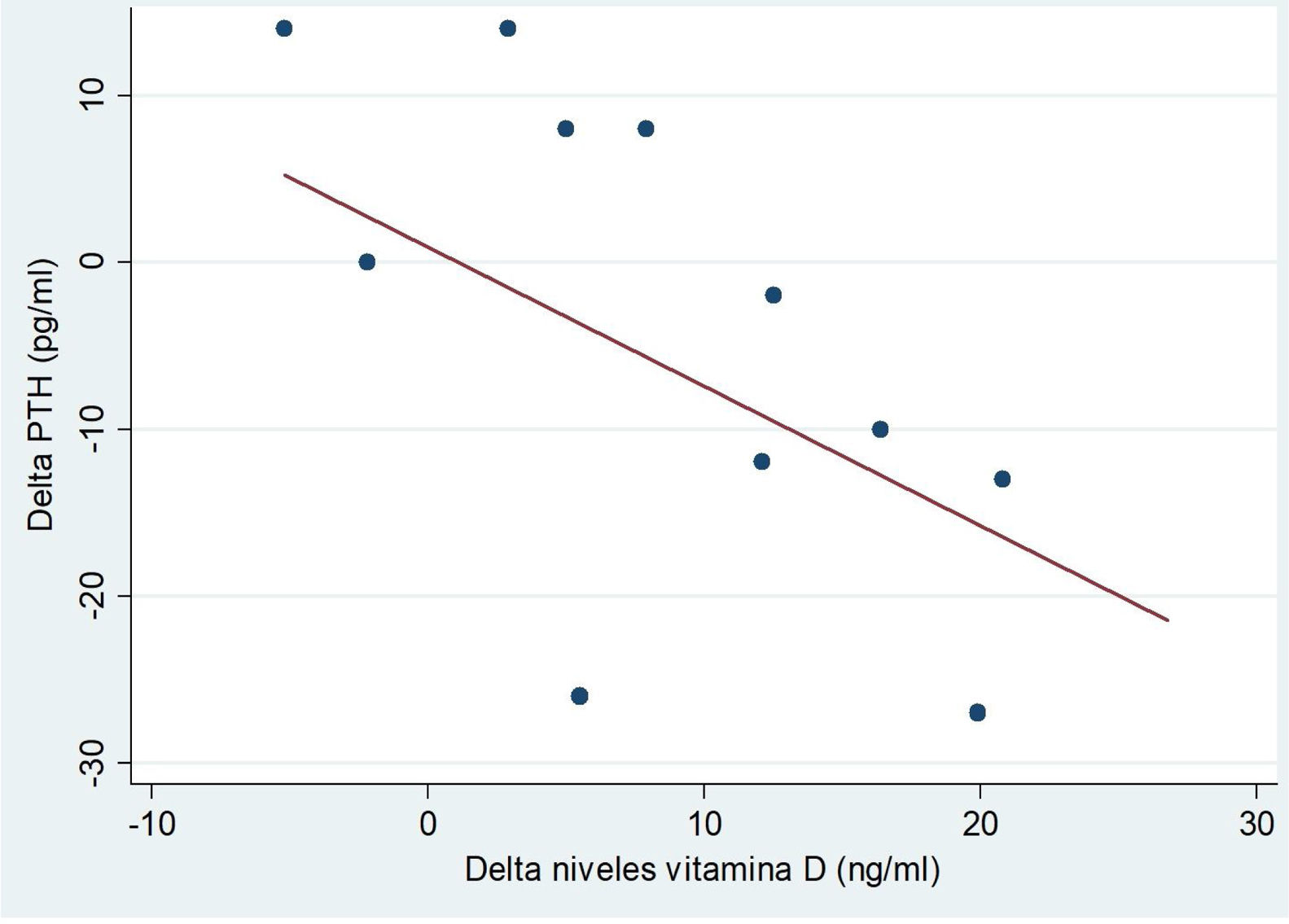
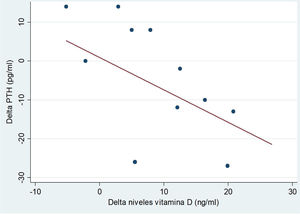
Tras la intervención, se observó un descenso estadísticamente significativo en los niveles de FA (tabla 2). Al estratificar el análisis por edades, se objetivó una correlación inversa entre el incremento de niveles de 25 OH VD y el incremento de los niveles de PTH en los pacientes mayores de 10 años (fig. 4). El resto de resultados de la estratificación por edades se muestran en la tabla 3.
Estatus nutricional, función pancreática, pulmonar y metabolismo fosfocálcico estratificado por grupos de edad. Comparación V0 vs. V4
| Variable | <2 años (n=4) | 2-10 años (n=11) | >10 años (n=15) | ||||||
|---|---|---|---|---|---|---|---|---|---|
| V0 | V4 | p | V0 | V4 | p | V0 | V4 | p | |
| Niveles de 25 OH vitamina D (ng/ml), mediana (RI) | 21,6 (20,1-23,2) | 28,9 (25,5-35,8) | 0,14 | 23,0 (21,0-26,0) | 26,0 (25,0-32,0) | 0,037 | 20,4 (18,8-23,7) | 29,0 (19,6-38,4) | 0,003 |
| Niveles de vitamina A (μg/dl), mediana (RI) | 44,7 (26,0-65,9) | 34,0 (34,0-43,0) | 0,59 | 36,4 (34,1-45,0) | 37,3 (36,4-48,0) | 1 | 38,0 (28,0-55,0) | 47,5 (34,0-54,0) | 0,06 |
| Niveles de vitamina E (μg/ml), mediana (RI) | 608,0 (330,0-865,5) | 884,0 (736,0-1145,0) | 0,11 | 1025,0 (779,0-1244,0) | 950,0 (800,0-993,0) | 0,37 | 1213,0 (644,0-1408,0) | 974,0 (736,0-1306,0) | 0,83 |
| Ratio vitamina E/colesterol (mg/g), mediana (RI) | 6,0 (3,9-6,7) | 7,4 (7,7-11,3) | 0,11 | 8,1 (6,3-8,7) | 6,8 (6,1-8,3) | 1 | 8,0 (7,3-10,5) | 8,4 (6,2-12,3) | 0,7 |
| IMC (DE), mediana (RI) | 1,1 (0,4-1,4) | 0,7 (−0,3-1,4) | 0,27 | −0,1 (−0,6-0,3) | 0,1 (−0,9-0,2) | 0,24 | −0,2 (−0,4-0,6) | −0,2 (−0,6-0,7) | 0,61 |
| Grasa en heces (g/24h), mediana (RI) | 8,1 (3,3-12,9) | 8,1 (4,5-8,4) | 0,32 | 6,3 (5,4-6,9) | 6,8 (4,7-8,3) | 0,35 | 7,8 (6,9-10,7) | 8,3 (7,2-10,2) | 0,69 |
| Colesterol (mg/dl), mediana (RI) | 130,5 (88,5-156,0) | 128,0 (92,5-150,0) | 0,71 | 132,0 (126,0-155,0) | 136,5 (129,0-14,04) | 0,5 | 117,0 (94,0-148,0) | 118,0 (104,0-141,0) | 0,51 |
| Triglicéridos (mg/dl), mediana (RI) | 116,5 (95,5-150,5) | 112,5 (85,5-132,0) | 0,72 | 62,0 (52,0-81,0) | 75,0 (53,0-85,0) | 0,22 | 73,0 (62,0-88,0) | 65,0 (59,0-110,0) | 0,51 |
| Zinc (μg/ml), mediana (RI) | 93,0 (66,0-119,0) | 93,0 (78,0-126,0) | 0,17 | 101,0 (81,0-123,0) | 116,5 (92,0-123,5) | 0,89 | 91,5 (72,0-115,0) | 93,0 (66,0-101,0) | 0,92 |
| VEMS (%), mediana (RI) | 80,0 (78,0-93,0) | 78,1 (78,0-109,0) | 0,29 | 76,0 (59,4-91,0) | 70,9 (59,0-90,0) | 0,8 | |||
| FEF25-75 (%), mediana (RI) | 77,5 (62,5-94,0) | 64,5 (64,0-97,0) | 0,1 | 43,5 (31,0-60,0) | 52,5 (27,0-73,7) | 0,62 | |||
| CV (%), mediana (RI) | 83,0 (81,0-100,0) | 81,0 (73,0-108,0) | 0,89 | 79,0 (60,0-97,0) | 83,0 (62,0-102,0) | 0,18 | |||
| Calcio (ng/ml), mediana (RI) | 10,8 (9,6-11,0) | 9,7 (9,3-9,9) | 0,29 | 10,3 (10,2-10,4) | 9,8 (9,3-9,9) | 0,05 | 9,7 (9,4-9,9) | 9,7 (9,3-9,8) | 0,75 |
| Fósforo (ng/ml), mediana (RI) | 4,9 (4,7-6) | 5,5 (4,9-5,6) | 1 | 4,7 (4,4-5) | 4,8 (4,4-4,8) | 0,8 | 4,5 (4,3-4,8) | 4,3 (3,8-4,7) | 0,6 |
| Fosfatasa alcalina (U/L), mediana (RI) | 309,5 (241,0-377,0) | 257 (198,5-299,0) | 0,07 | 263,0 (215,0-372,0) | 226,0 (194,0-351,0) | 0,29 | 254,0 (190,0-292,0) | 169,5 (111,0-231,5) | 0,04 |
| Parathormona (pg/ml), mediana (RI) | 34,5 (28,0-41,0) | 40,0 (16,0-43,0) | 0,59 | 42,0 (34,0-60,0) | 43,0 (34,0-55,0) | 0,21 | 41,0 (31,5-62,0) | 36,0 (30,0-49,5) | 0,49 |
CV: capacidad vital; DE: desviación estándar; FEF: velocidad máxima de flujo mesoespiratorio; IMC: índice de masa corporal; RI: rango intercuartílico; VEMS: volumen espirado máximo en el primer segundo.
En el presente estudio hemos demostrado que la implementación de las recomendaciones de suplementación de VD de la Fundación Americana de FQ consigue mejorar el estatus vitamínico de nuestros pacientes en un 53% de los casos. Se consiguió por un lado un incremento progresivo y significativo de la dosis recibida (3165UI/día de media al año de seguimiento) y, como consecuencia, un aumento de los niveles medios de 25 OH VD (de 22,12 a 29,75ng/ml). Sin embargo, tan solo el 37% de los pacientes alcanzaron niveles suficientes de VD.
El estudio de Abu-Fraiha et al.10 reporta resultados similares. Siguieron un protocolo también basado en las recomendaciones de la Fundación Americana de FQ en 90 pacientes pediátricos y adultos, y encontraron una mejoría de los niveles medios de 25 OH VD de 19,5 a 24,5ng/ml tras un año de seguimiento. Al finalizar el estudio, se pasó de un 50% de pacientes con niveles deficientes a un 26,7%, y de un 27,8% de pacientes con niveles insuficientes a un 43,3%. Un 27% de los pacientes alcanzaron niveles suficientes, por encima de 30ng/ml.
Por su parte, Shepherd et al.5 realizaron un estudio experimental en 142 pacientes pediátricos con FQ donde analizaron el impacto de la administración de una pauta «stoss» o de choque que consistía en administrar una dosis única de hasta 600.000UI seguida de la dosis diaria habitual. Lograron pasar, al año de seguimiento, de unos niveles medios de 19ng/ml a 25,84ng/ml, alcanzando niveles por encima de 30ng/ml en el 70% de los pacientes.
Coriati et al.11 realizaron un estudio retrospectivo en 200 pacientes adultos con FQ a los que se les incrementó la dosis de VD recibida llegando a una media de 3403UI/día. Analizaron el estatus vitamínico antes y después de la intervención objetivando que los niveles de 25 OH VD subieron de 25,9 hasta 37ng/ml y pasaron de un 69% de pacientes con niveles por debajo de 30ng/ml a un 25,5%.
La adherencia al tratamiento y la optimización de la terapia de reemplazo de enzimas pancreáticas son dos factores importantes para evaluar la eficacia de cualquier intervención con vitaminas liposolubles en pacientes con FQ insuficientes pancreáticos. En nuestro estudio no observamos diferencias en la esteatorrea, en la dosis recibida de enzimas pancreáticas ni en los niveles de vitamina A y E tras 12 meses de seguimiento. Sin embargo, sí observamos una correlación positiva entre el incremento de la dosis de VD con el incremento de los niveles plasmáticos de VD. Estos resultados sugieren que parte del efecto de la intervención se debe al incremento de la dosis de VD recibida. Si se hubiera producido una mejoría en la adherencia terapéutica podríamos haber observado una mejoría del estatus de la vitamina A y E, dado que nuestros pacientes reciben habitualmente suplementación mediante polivitamínicos que incluyen todas las vitaminas liposolubles. Tampoco podemos achacar la mejoría del estado nutricional de la VD a la función pancreática exocrina porque no se han producido modificaciones ni en la esteatorrea ni en el tratamiento con enzimas pancreáticas.
A nivel pulmonar, cabe destacar que en los últimos años se han atribuido nuevas funciones a la VD como la antiinflamatoria o la antimicrobiana12,13. Sin embargo, la asociación entre los niveles de VD en pacientes con FQ y la función pulmonar, exacerbaciones respiratorias o colonizaciones pulmonares crónicas es controvertida. En nuestro trabajo analizamos la función pulmonar a través del %VEMS, %FEF25-75 y %CV a lo largo de un año tras el aumento progresivo de la dosis de VD administrada. A pesar del aumento de los niveles séricos de calcidiol, no se observó ninguna mejoría en la función pulmonar, ni correlación entre los niveles de 25 OH VD con ningún parámetro de función pulmonar analizado.
En el estudio de Abu-Fraiha et al.10 encontraron una relación inversa entre los niveles de 25 OH VD y las exacerbaciones pulmonares, así como los días de hospitalización, pero no con la función pulmonar, que no se vio afectada a pesar de la mejoría del estatus vitamínico.
En el trabajo realizado por Lehoux Dubois et al.14 se analizó el impacto de un aumento en la suplementación de VD en pacientes adultos con FQ. Hallaron una relación directa entre el %FEV1 y los niveles séricos de 25 OH VD al inicio del estudio, pero esta no se mantuvo en el tiempo.
Del mismo modo, nuestros resultados van en la misma línea que los metaanálisis más recientes que concluyen que, a pesar del incremento de dosis de VD recibida por los pacientes con FQ en los últimos años, no hay cambios relevantes desde el punto de vista pulmonar15.
En el presente estudio se analizaron las distintas variables del metabolismo fosfocálcico antes y después de la intervención. Se objetivó una disminución en los niveles de FA tras el año de seguimiento y una correlación inversa entre los niveles séricos de 25 OH VD y la PTH, fundamentalmente en los pacientes mayores de 10 años. Estos datos sugieren indirectamente que la resorción ósea pudo ser menor tras la intervención. No encontramos diferencias significativas en los niveles de calcio o fósforo.
Nuestros resultados van en la misma línea que otros estudios previos donde el incremento de los niveles de 25 OH VD no parece relacionarse con cambios en el resto de parámetros del metabolismo fosfocálcico10,16–19.
Hay que tener en cuenta que es difícil observar cambios a nivel del calcio o fósforo sanguíneos, dado que se trata de parámetros fuertemente regulados por la homeostasis. Sin embargo, un déficit de VD mantenido sí puede tener repercusiones negativas a nivel de la salud ósea a pesar de la normalidad de estos parámetros.
En cuanto a la seguridad del protocolo propuesto, del total de 32 pacientes que participaron en el estudio, en 2 de ellos se alcanzaron niveles de 25 OH VD por encima de 100ng/ml. Se considera que niveles por encima de 100-150ng/ml pueden causar hiperfosfatemia e hipercalcemia y por tanto fueron excluidos del estudio por riesgo de toxicidad6,20.
El sujeto 1 tenía 10,4 años, era portador en homocigosis para la mutación DF508, recibía 600UI/día de VD y se incrementó la dosis a 1000UI/día. Se observó un ascenso de los niveles de 25 OH VD a los 3 meses de 27,2ng/ml a 122ng/ml. El sujeto 2 tenía 16,3 años, era portador en heterocigosis para DF508, recibía 1966UI/día de VD y se incrementó la dosis a 2785UI/día. A los 3 meses, los niveles de 25 OH VD ascendieron de 17,3ng/ml a 159,7ng/ml.
Tras la retirada del estudio los niveles de VD de ambos pacientes descendieron de nuevo. No hubo repercusión clínica en ningún momento y el resto de parámetros del metabolismo fosfocálcico no se vieron afectados ni de forma estadísticamente significativa ni clínicamente relevante.
Es llamativo que ni el incremento ni la dosis final alcanzada eran muy elevados. Estos datos podrían explicarse por una susceptibilidad genética individual. En los últimos años se ha demostrado que los polimorfismos de varios genes relacionados principalmente con el transporte de la VD pueden condicionar hasta un 20% la variabilidad de los niveles del calcidiol21. Se han identificado más de 120 variantes en el gen que codifica la VDBP (proteína de unión a la vitamina D) con diferentes afinidades por la VD y esto podría determinar una variabilidad en los niveles de calcidiol22.
Nuestro trabajo presenta diferentes limitaciones, marcadas por la ausencia de grupo control, de aleatorización y de enmascaramiento. Los pacientes reclutados pudieran estar especialmente motivados a participar, por lo que es plausible pensar que se trataría de un subgrupo de pacientes bien controlados y con buena adherencia, por lo que no pueden generalizarse los resultados a toda la población.
Como principales fortalezas nos gustaría destacar que nuestro estudio es una de las series de pacientes más amplias publicadas hasta la fecha que analizan las consecuencias de la implantación de estas nuevas recomendaciones de tratamiento de la deficiencia de VD en pacientes con FQ e insuficiencia pancreática.
A diferencia de otras publicaciones que incluyen pacientes con FQ suficientes pancreáticos, en nuestro estudio nos centramos exclusivamente en aquellos donde la deficiencia de VD es más problemática, como son aquellos con fenotipo más grave e insuficiencia pancreática exocrina.
Como conclusión podemos decir que la implantación de las recomendaciones propuestas por la Fundación Americana de FQ provoca un aumento en la dosis de VD que reciben nuestros pacientes y se corresponde con un incremento de los niveles séricos y la disminución del porcentaje de pacientes deficientes. A pesar de ello, aún estamos lejos de alcanzar los niveles recomendados para esta entidad. Hacen falta más estudios para valorar si este aumento de los niveles de VD puede tener repercusiones positivas a nivel clínico.
Cuando se realizan incrementos de VD, se debe monitorizar sus niveles séricos, así como investigar la presencia de signos clínicos y analíticos de hipercalcemia.
FinanciaciónEste trabajo ha recibido financiación por parte de la Fundación Ernesto Sánchez Villares 05/2015 y Fundación Nutrición y Crecimiento.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Este trabajo ha sido presentado previamente en el Congreso Nacional de la SEGHNP de 2020 celebrado de forma telemática.