Estudios recientes señalan un aumento de la prevalencia de Haemophilus influenzae y una disminución de Streptococcus pneumoniae entre las bacterias causantes de otitis media aguda (OMA). El objetivo del estudio es conocer la distribución de microorganismos patógenos identificados en Urgencias en los menores de 14 años con OMA y su patrón de resistencias.
Pacientes y métodosEstudio retrospectivo, analítico y unicéntrico incluyendo pacientes menores de 14 años diagnosticados de OMA en los que se recogió un cultivo de secreción ótica en el servicio de urgencias pediátricas de un hospital terciario entre 2013 y 2021.
ResultadosDurante el periodo de estudio se registraron 14.684 episodios con diagnóstico de OMA, recogiéndose en 768 cultivo de secreción ótica. La mediana de edad fue de 2 años, el 57% varones y el 70% habían presentado al menos una OMA previa. Los patógenos más frecuentemente aislados fueron: Haemophilus influenzae, 188 (24,5%; de ellos, 15,5% resistentes a ampicilina); Streptococcus pyogenes, 86 (11,2%); Staphylococcus aureus, 82 (10,7%); Streptococcus pneumoniae, 54 (6,9%; de ellos, 9,4% con resistencia intermedia a penicilina); Pseudomonas aeruginosa, 42 (5,5%) y Moraxella catarrhalis, 11 (1,4%). En el 34,9% no se aislaron patógenos.
ConclusionesHaemophilus influenzae es la primera causa de OMA en menores de 14 años. Este hecho, junto a la baja tasa de aislamientos y resistencia a penicilina de Streptococcus pneumoniae, cuestiona la idoneidad de la amoxicilina a dosis elevadas como tratamiento antibiótico empírico de la OMA.
Recent studies show an increase in the prevalence of Haemophilus influenzae and a decrease in Streptococcus pneumoniae among the bacteria that cause acute otitis media (AOM). The objective of our study was to analyse the distribution of pathogens identified in children aged less than 14 years presenting to the emergency department with AOM and their patterns of antimicrobial resistance.
Patients and methodsSingle centre retrospective, analytical study in patients aged less than 14 years with a diagnosis of AOM in whom an ear drainage sample was collected for culture in the paediatric emergency department of a tertiary care hospital between 2013 and 2021.
ResultsDuring the study period, there were 14,684 documented care episodes corresponding to children with a diagnosis of AOM. An ear drainage culture was performed in 768 of those episodes. The median age of the patients was 2 years, 57% were male and 70% had a previous history of AOM. The most frequently isolated pathogens were: Haemophilus influenzae (n=188 [24.5%]; 15.5% of them resistant to ampicillin), Streptococcus pyogenes (n=86 [11.2%]), Staphylococcus aureus (n=82 [10.7%]), Streptococcus pneumoniae (n=54 [6.9%]; 9.4% with intermediate resistance to penicillin), Pseudomonas aeruginosa (n=42 [5.5%]) and Moraxella catarrhalis (n=11 [1.4%]). No pathogen was isolated in 34.9% of cases.
ConclusionsHaemophilus influenzae is the leading cause of AOM in children aged less than 14 years. This, combined with the low frequency of isolation and penicillin resistance of Streptococcus pneumoniae, calls into question the appropriateness of high-dose amoxicillin for empiric treatment of AOM
La otitis media aguda (OMA) es uno de los motivos de consulta más frecuente en la infancia y la infección que requiere tratamiento antibiótico con mayor frecuencia1,2, siendo más habitual entre los 6 y 24 meses de edad3. Hoy en día es conocido que en torno al 70-92% de las OMA se resuelven de forma espontánea sin necesidad de antibioterapia, de tal forma que se recomienda iniciar antibioterapia empírica en pacientes seleccionados en función de la edad, uni o bilateralidad de la OMA, intensidad del dolor, grado de elevación de la temperatura, presencia de factores de riesgo o imposibilidad de un adecuado seguimiento4.
Las bacterias patógenas más frecuentes causantes de OMA son el Streptococcus pneumoniae (S. pneumoniae), Haemophilus influenzae (H. influenzae) y Moraxella catarrhalis (M. catarrhalis)1,5,6. Típicamente, S. pneumoniae era el patógeno predominante, siendo el tratamiento empírico recomendado la amoxicilina a dosis altas por la elevada tasa de resistencia intermedia a penicilina.
En los últimos años ha habido una serie de cambios relevantes. Por una parte, la indicación de tratamiento a pacientes seleccionados se ha acompañado de una disminución de las tasas de resistencia a amoxicilina de S. pneumoniae7. Por otro lado, tras la introducción de las vacunas conjugadas antineumocócicas heptavalente (VCN7) y 13-valente (VCN13), la distribución de los patógenos está variando. Previo a la introducción de las citadas vacunas, los serotipos de S. pneumoniae incluidos en la VCN7 representaban el 60-70% de los casos8,9. Tras la introducción de la VCN13, en torno al 15-25% de los casos son causados por esta bacteria6,10,11, mientras ha aumentado la proporción de OMA debido a M. catarrhalis y H. influenzae, identificándose esta última en torno al 50-60% de los pacientes6. En diferentes estudios desarrollados fuera de nuestro medio, el H. influenzae aparece como el principal agente etiológico en niños12. Aun así, las recomendaciones más recientes no consideran cambiar la sugerencia del tratamiento antibiótico empírico de los niños con OMA11. Este tratamiento debe estar dirigido a los patógenos más frecuentes. Si se confirmara en nuestro medio la redistribución de patógenos y la preponderancia del H. influenzae, debería considerarse adaptar el tratamiento empírico inicial.
La hipótesis de nuestro estudio es que H. influenzae es el principal agente causante de OMA en nuestro medio y que la tasa de resistencia intermedia a penicilinas de S. pneumoniae es baja.
El objetivo principal de este estudio es conocer la prevalencia de los diferentes patógenos bacterianos y su patrón de resistencias en niños menores de 14 años diagnosticados con OMA en nuestra comunidad. El objetivo secundario es analizar la idoneidad del tratamiento antibiótico empírico recomendado para los niños con OMA.
MetodologíaSe realizó un estudio retrospectivo, descriptivo, unicéntrico de pacientes diagnosticados de OMA en los que se recogió un cultivo de secreción ótica en el Servicio de Urgencias Pediátricas (SUP) de un hospital terciario desde el año 2013 hasta el 2021. En este servicio se registran anualmente alrededor de 55.000 episodios correspondientes a niños entre 0-14 años.
Los diagnósticos de OMA, otorrea y mastoiditis en Urgencias se realizan siguiendo los criterios para su diagnóstico establecidos por la Sociedad Española de Urgencias de Pediatría y el sistema de codificación CIE-10, incluido en el sistema de codificación diagnóstica de la citada sociedad13.
Se consideraron antecedentes personales relevantes los siguientes:
- •
Seguimiento por Otorrinolaringología por presentar al menos uno de los siguientes: OMA de repetición, otitis media serosa, hipertrofia adenoidea y/o amigdalar, pacientes portadores de drenajes transtimpánicos, hipoacusia, colesteatoma u otra patología que afecte a oído medio o interno.
- •
Pacientes recibiendo tratamiento que favorezca la aparición de infecciones bacterianas como corticoides o inmunosupresores.
Se incluyeron todos los pacientes menores de 14 años que recibieron el diagnóstico de OMA en los que se recogió un cultivo de secreción ótica (caso índice). En nuestro SUP, la decisión de recoger el cultivo de secreción ótica es tomada por los médicos que atienden al paciente, en la gran mayoría de los casos médicos internos residentes de pediatría con supervisión presencial de un pediatra de Urgencias. Se consideraron como re-consultas a los episodios relacionados correspondientes al mismo paciente en las siguientes 72 horas a la visita inicial.
Se excluyeron aquellos pacientes con diagnóstico de OMA sin cultivo de secreción ótica y aquellos que presentaban datos incompletos (patógenos aislados, patrones de resistencia).
El cultivo del exudado ótico se realizó mediante siembra en medios agar sangre, agar MacConkey y agar chocolate suplementado; incubados durante 48 horas en aerobiosis el agar MacConkey, anaerobiosis el agar chocolate y el agar sangre en atmósfera enriquecida con CO2.
Los antibiogramas se realizaron e interpretaron según los criterios del Clinical & Laboratory Standards Institute (CLSI), vigentes para cada patógeno y año.
La variable principal del estudio fue el cultivo de secreción ótica, mientras que las variables secundarias recogidas fueron los antecedentes personales, características demográficas, manifestaciones clínicas y hallazgos de la exploración física, tratamiento recibido en urgencias y evolución del paciente.
Análisis estadístico. Las variables cualitativas se describen en frecuencias absolutas y frecuencias relativas e intervalos de confianza del 95%. Las variables continuas se presentan con la media y la desviación estándar o por el intervalo entre la mediana y el cuartil, dependiendo de la distribución de la variable. Las variables cuantitativas se compararon mediante la prueba t de Student, mientras que las variables categóricas se analizaron mediante las pruebas Chi cuadrado y exacta de Fisher. Se consideraron estadísticamente significativos valores de p menores de 0,05.
El estudio recibió la aprobación del Comité de Ética en Investigación Clínica con el código CEI E22/35.
ResultadosDurante el periodo de estudio se registraron 441.728 episodios correspondientes a niños menores de 14 años, de los cuales 14.684 recibieron diagnóstico de OMA (3.3%). De ellos, se recogió cultivo de secreción ótica en 768 (5,2%). La recogida de cultivos fue más frecuente en los meses fríos, sin mostrar cambios a lo largo del estudio salvo una disminución en los años 2020 y 2021.
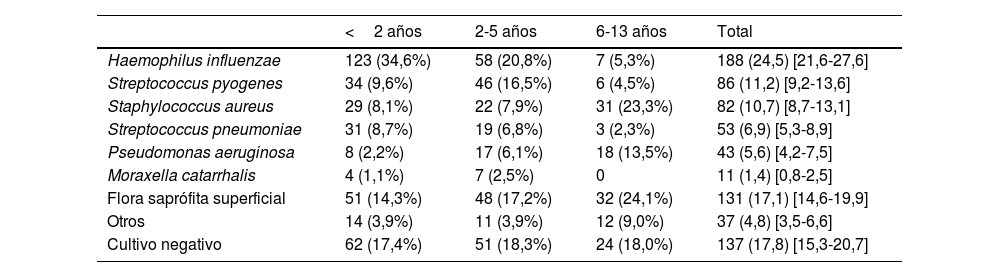
Características de los pacientesLa mediana de edad fue de 2 años, 438 (57%) eran varones, 335 (43,6% tenían antecedentes personales relevantes y 538 (70,1%) habían tenido al menos una OMA previamente. Las características de los 768 pacientes incluidos se muestran en la tabla 1. Globalmente, el H. influenzae fue la bacteria identificada con mayor frecuencia, pues estaba presente en 188 pacientes (24,5%) y se aisló un S. pneumoniae en 53 (6,9%), mostrando la distribución de patógenos diferencias significativas en relación con la edad de los pacientes (tabla 2).
Características de los 768 pacientes con diagnóstico de otitis media aguda supurada en los que se recogió un cultivo de la secreción ótica
| Edad (años) | 2 (1-4) |
| Sexo (varón) | 438 (57) |
| Antecedentes personales relevantes | 335 (43,6) |
| Otitis media aguda previa | 538 (70,1) |
| Fiebre | 241 (31,4) |
| Otalgia | 462 (60,2) |
| Síntomas catarrales | 441 (57,4) |
| Despegamiento del pabellón auricular | 15 (1,9) |
| Bilateralidad | 95 (12,4) |
| Vómitos | 24 (3,1) |
| Diarrea | 17 (2,2) |
| Horas de evolución | 24 (8-48) |
Los datos se expresan como n (porcentaje) excepto la edad y las horas de evolución del cuadro, que se expresan como mediana y (rango intercuartil).
Prevalencia de microorganismos en cultivos de secreción ótica recogidos en pacientes diagnosticados de OMA supurada en relación con la edad de los niños
| <2 años | 2-5 años | 6-13 años | Total | |
|---|---|---|---|---|
| Haemophilus influenzae | 123 (34,6%) | 58 (20,8%) | 7 (5,3%) | 188 (24,5) [21,6-27,6] |
| Streptococcus pyogenes | 34 (9,6%) | 46 (16,5%) | 6 (4,5%) | 86 (11,2) [9,2-13,6] |
| Staphylococcus aureus | 29 (8,1%) | 22 (7,9%) | 31 (23,3%) | 82 (10,7) [8,7-13,1] |
| Streptococcus pneumoniae | 31 (8,7%) | 19 (6,8%) | 3 (2,3%) | 53 (6,9) [5,3-8,9] |
| Pseudomonas aeruginosa | 8 (2,2%) | 17 (6,1%) | 18 (13,5%) | 43 (5,6) [4,2-7,5] |
| Moraxella catarrhalis | 4 (1,1%) | 7 (2,5%) | 0 | 11 (1,4) [0,8-2,5] |
| Flora saprófita superficial | 51 (14,3%) | 48 (17,2%) | 32 (24,1%) | 131 (17,1) [14,6-19,9] |
| Otros | 14 (3,9%) | 11 (3,9%) | 12 (9,0%) | 37 (4,8) [3,5-6,6] |
| Cultivo negativo | 62 (17,4%) | 51 (18,3%) | 24 (18,0%) | 137 (17,8) [15,3-20,7] |
Los datos se expresan como n (porcentaje) y se añade el [intervalo de confianza al 95%] en la columna de datos totales.
p<0,01
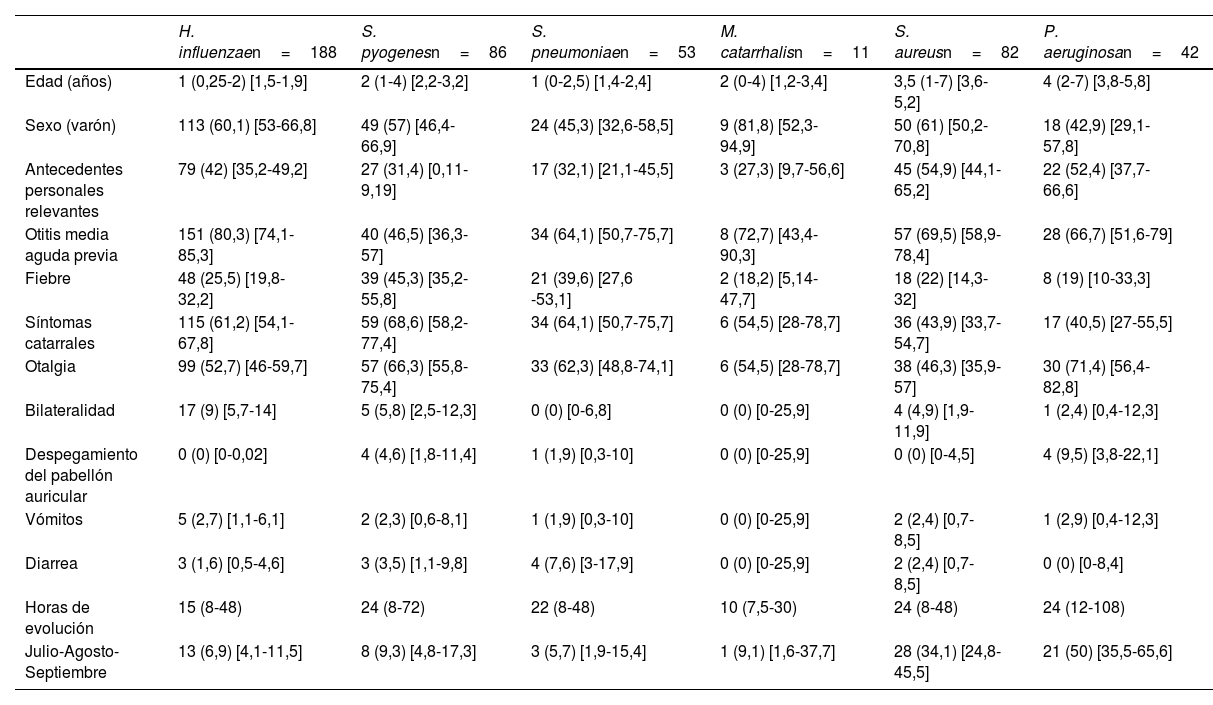
Por debajo de los 5 años, H. influenzae y S. pyogenes fueron las bacterias aisladas con mayor frecuencia. En los niños más mayores, los patógenos más habituales fueron S. aureus y Pseudomonas aeruginosa (P. aeruginosa), habitualmente propios de niños con otitis externa. La mediana de edad de los pacientes con aislamiento de S. aureus (3,5 años) o P. aeruginosa (4 años) fue significativamente superior a la del resto de patógenos (que varió entre 1 y 2 años; p<0,01) y se aislaron con mayor frecuencia en meses cálidos (34,1% S. aureus y 50% P. aeruginosa, vs 7,4% el resto de patógenos, p<0,01). Las características clínicas de los pacientes en relación con el patógeno causal de OMA se muestran en la tabla 3.
Características de los pacientes en relación con el patógeno causal de otitis media aguda
| H. influenzaen=188 | S. pyogenesn=86 | S. pneumoniaen=53 | M. catarrhalisn=11 | S. aureusn=82 | P. aeruginosan=42 | |
|---|---|---|---|---|---|---|
| Edad (años) | 1 (0,25-2) [1,5-1,9] | 2 (1-4) [2,2-3,2] | 1 (0-2,5) [1,4-2,4] | 2 (0-4) [1,2-3,4] | 3,5 (1-7) [3,6-5,2] | 4 (2-7) [3,8-5,8] |
| Sexo (varón) | 113 (60,1) [53-66,8] | 49 (57) [46,4-66,9] | 24 (45,3) [32,6-58,5] | 9 (81,8) [52,3-94,9] | 50 (61) [50,2-70,8] | 18 (42,9) [29,1-57,8] |
| Antecedentes personales relevantes | 79 (42) [35,2-49,2] | 27 (31,4) [0,11-9,19] | 17 (32,1) [21,1-45,5] | 3 (27,3) [9,7-56,6] | 45 (54,9) [44,1-65,2] | 22 (52,4) [37,7-66,6] |
| Otitis media aguda previa | 151 (80,3) [74,1-85,3] | 40 (46,5) [36,3-57] | 34 (64,1) [50,7-75,7] | 8 (72,7) [43,4-90,3] | 57 (69,5) [58,9-78,4] | 28 (66,7) [51,6-79] |
| Fiebre | 48 (25,5) [19,8-32,2] | 39 (45,3) [35,2-55,8] | 21 (39,6) [27,6 -53,1] | 2 (18,2) [5,14-47,7] | 18 (22) [14,3-32] | 8 (19) [10-33,3] |
| Síntomas catarrales | 115 (61,2) [54,1-67,8] | 59 (68,6) [58,2-77,4] | 34 (64,1) [50,7-75,7] | 6 (54,5) [28-78,7] | 36 (43,9) [33,7-54,7] | 17 (40,5) [27-55,5] |
| Otalgia | 99 (52,7) [46-59,7] | 57 (66,3) [55,8-75,4] | 33 (62,3) [48,8-74,1] | 6 (54,5) [28-78,7] | 38 (46,3) [35,9-57] | 30 (71,4) [56,4-82,8] |
| Bilateralidad | 17 (9) [5,7-14] | 5 (5,8) [2,5-12,3] | 0 (0) [0-6,8] | 0 (0) [0-25,9] | 4 (4,9) [1,9-11,9] | 1 (2,4) [0,4-12,3] |
| Despegamiento del pabellón auricular | 0 (0) [0-0,02] | 4 (4,6) [1,8-11,4] | 1 (1,9) [0,3-10] | 0 (0) [0-25,9] | 0 (0) [0-4,5] | 4 (9,5) [3,8-22,1] |
| Vómitos | 5 (2,7) [1,1-6,1] | 2 (2,3) [0,6-8,1] | 1 (1,9) [0,3-10] | 0 (0) [0-25,9] | 2 (2,4) [0,7-8,5] | 1 (2,9) [0,4-12,3] |
| Diarrea | 3 (1,6) [0,5-4,6] | 3 (3,5) [1,1-9,8] | 4 (7,6) [3-17,9] | 0 (0) [0-25,9] | 2 (2,4) [0,7-8,5] | 0 (0) [0-8,4] |
| Horas de evolución | 15 (8-48) | 24 (8-72) | 22 (8-48) | 10 (7,5-30) | 24 (8-48) | 24 (12-108) |
| Julio-Agosto-Septiembre | 13 (6,9) [4,1-11,5] | 8 (9,3) [4,8-17,3] | 3 (5,7) [1,9-15,4] | 1 (9,1) [1,6-37,7] | 28 (34,1) [24,8-45,5] | 21 (50) [35,5-65,6] |
Los datos se expresan como n (porcentaje) e [intervalo de confianza al 95%], excepto la edad y las horas de evolución del cuadro que se expresan como mediana y (rango intercuartil).
La distribución de bacterias no mostró cambios significativos en relación con la presencia de antecedentes personales relevantes ni tampoco a lo largo de los años del estudio, salvo una disminución de los aislamientos de S. pyogenes en 2020 y 2021.
En la tabla 4 se muestran los patrones de resistencia de H. influenzae y S. pneumoniae.
Patrón de resistencia de H. influenzae y S. pneumoniae
| H. influenzae | S. pneumoniae | ||
|---|---|---|---|
| Amoxicilina/ampicilina a dosis bajas | Sensibilidad | 153 (81,4) [75,2-86,3] | 48 (90,6) [79,7-95,9] |
| Resistencia intermedia | 0 (0) [0-2] | 5 (9,4) [4,1-20,2] | |
| Resistencia(CMI≥2μg/ml) | 28 (14,5) [10,5-20,7] | 0 (0) [0-6,8] | |
| Amoxicilina + ácido clavulánico | Sensibilidad | 181 (96,3) [92,5-98,2] | |
| Resistencia intermedia | 6 (3,2) [1,5-6,8] | ||
| Resistencia(CMI ≥2μg/ml) | 1 (0,5) [0,1-2,3] |
Los datos se expresan como n (porcentaje) e [intervalo de confianza al 95%]
CMI: concentración mínima inhibitoria.
En uno de cada 153 pacientes que recibió el diagnóstico de OMA y se cultivó la secreción ótica se identificó un S. pneumoniae con resistencia intermedia a amoxicilina.
DiscusiónLa bacteria aislada con mayor frecuencia en los cultivos de secreción ótica recogidos en los niños menores de 14 años diagnosticados de OMA en Urgencias en nuestro medio fue H. influenzae.
De acuerdo con nuestro conocimiento, se trata del primer estudio realizado recientemente en el entorno propio y en una muestra amplia en pacientes pediátricos y corrobora los hallazgos observados en otros entornos5,14. En una revisión sistemática que incluye estudios entre 1993 y 201715, las principales bacterias aisladas en niños con OMA fueron S. pneumoniae (26.1%), H. influenzae (18.8%), S. aureus (12.3%) y S. pyogenes (11.8%), sin cambios claros durante esos años, probablemente por la limitada información disponible sobre el estado vacunal neumocócico de los niños y los pocos datos de los últimos años15. Aun así, la mayoría de los estudios subraya el impacto de las VCN y el cambio de patógenos identificados en los niños con OMA5,11,16, incluso en pacientes con OMA grave12. En nuestra serie, independientemente de que los pacientes tuvieran o no antecedentes relevantes, la bacteria más prevalente fue H. influenzae, seguida por S. pyogenes, mientras que S. pneumoniae se aisló en algo menos del 7%, siendo casi anecdóticos los aislamientos de M. catarrhalis. El único cambio relevante durante el periodo del estudio fue la disminución de aislamientos de S. pyogenes en 2020 y 2021, aspecto que hay que recoger con cautela por el impacto que las medidas de protección para la COVID-19 han tenido sobre las infecciones respiratorias. Estas medidas también justifican una menor recogida de cultivos dada la caída de diagnósticos de infecciones respiratorias experimentada durante esos años.
Las resistencias a los antibióticos también deben ser tomadas en consideración al momento de establecer el tratamiento antibiótico empírico. Aproximadamente el 15% de los H. influenzae aislados mostraron resistencia a la amoxicilina, similar a los resultados objetivados en varios estudios12, e inferior al 50% referido en otros17. Por otro lado, en nuestra serie no se aisló ningún S. pneumoniae con resistencia completa a penicilina (concentración mínima lnhibitoria [CMI]>2) mientras que el 9,3% mostraba resistencia intermedia. Esta tasa de resistencia es menor a la referido en la literatura que lo sitúa en torno al 15-30%, debido a la emergencia de serotipos no incluidos en las VCN11. Hoy en día, el aumento de aislamientos de serotipos no vacunales15,18,19 con susceptibilidad reducida a la amoxicilina conduce a que no se considere cambiar la amoxicilina a dosis estándar11. La preponderancia de H. influenzae en nuestro estudio y el hecho de que el S. pneumoniae con susceptibilidad intermedia a amoxicilina sea la causa de aproximadamente 1 cada 150 OMA, conduce a cuestionar la idoneidad de la amoxicilina a dosis elevadas como tratamiento antibiótico empírico de los niños con OMA. Nuestros resultados apoyan la opción de la dosis estándar de amoxicilina-clavulánico como tratamiento inicial11,16,17,20. No obstante, la modificación del antibiótico debe plantearse con cautela, ya que en la práctica clínica, actualmente las tasas reales de resolución de la OMA tratada con antibióticos de espectro reducido frente a los de amplio espectro son del 96,9% y el 96,6%, respectivamente21. Es probable que esto se deba al aumento en la prevalencia de organismos que tienen más probabilidades de resolverse por sí mismos debido a un curso clínico típicamente benigno y un sobrediagnóstico en estos pacientes17. Además, un cambio de la prescripción de antibióticos de espectro reducido a la de amplio espectro podría conducir a un aumento significativo en la comorbilidad por efectos adversos de estos últimos, como el aumento de la prevalencia de infecciones por Clostridium difficile y el desarrollo de resistencias antibióticas17. La modificación del tratamiento antibiótico empírico de las OMA en la infancia debiera acompañarse del desarrollo de un robusto sistema de vigilancia multicéntrico, tanto clínico como microbiológico, que monitorice el impacto de un cambio como este.
Una alternativa podría ser individualizar el tratamiento antibiótico, ya que existen ciertas diferencias clínicas en las OMA en relación con la bacteria responsable. De hecho, es conocido que los niños con OMA previa tienen más probabilidad de tener H. influenzae1. En nuestro estudio, los pacientes con OMA por H. influenzae y S. pneumoniae fueron más jóvenes que el resto de las OMA, mientras que los pacientes con OMA por H. influenzae tenían con más frecuencia OMA previa o AP relevantes, pero las diferencias no fueron suficientemente importantes como para poder establecer un patrón de sospecha etiológica útil en relación con la posible etiología de la OMA.
Finalmente, en alrededor del 15% de los cultivos se identificaron S. aureus o P. aeruginosa, bacterias habitualmente relacionadas con otitis externas, al igual que se ha reflejado en otros estudios12. Según nuestros resultados, el diagnóstico de OMA en un niño con otalgia y supuración por encima de los seis años debe hacerse con cautela, sobre todo en los meses cálidos, ya que un gran número de ellos podrían corresponder a otitis externa.
Nuestro estudio tiene una serie de limitaciones. Por un lado, durante el periodo de estudio no se recogió cultivo a todos los niños diagnosticados de OMA con supuración. La petición del cultivo era decisión del pediatra que atendía al paciente. Es posible que se recogieran cultivos con más frecuencia en niños con OMA más grave, no previamente sanos o con fracaso terapéutico. Por otra parte, la identificación de las bacterias se basó en el cultivo convencional. Esto probablemente pueda subestimar la tasa de prevalencia de las mismas, porque las técnicas de reacción en cadena de polimerasa son más precisas que el cultivo en la detección de bacterias en el líquido del oído medio22, sobre todo Moraxella catarrhalis. Se trata de un estudio unicéntrico, por lo que los resultados obtenidos deben extrapolarse con cautela a otros entornos, si bien pensamos que en lugares con condiciones sociosanitarias similares, principalmente VCN universal y gratuita, los resultados debieran ser similares. Finalmente, no se dispone de información del serotipo de las cepas de S. pneumoniae aisladas. Eso, a pesar de que no era objetivo del estudio, habría podido corroborar si nuestros aislados corresponden a los identificados dentro del grupo de serotipos emergentes (23B, 24F, 14 y 11A)11.
Este estudio, finalmente, subraya la importancia de establecer sistemas de vigilancia permanentes del perfil microbiológico de diferentes enfermedades infecciosas, incluyendo las resistencias antibióticas18.
Podemos concluir que H. influenzae es la primera causa de OMA. Este hecho, junto con la baja tasa de aislamientos y resistencia a penicilina de S. pneumoniae, cuestiona la idoneidad de la amoxicilina a dosis elevadas como tratamiento antibiótico empírico de la OMA. Son necesarios estudios prospectivos multicéntricos que confirmen estos resultados.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Se puede consultar material adicional a este artículo en su versión electrónica disponible en https://doi.org/10.1016/j.anpedi.2023.12.008.
Presentación en reuniones científicas: 69 Congreso de la AEP. 1-3 junio 2023. XXVI Reunión Anual de la Sociedad Española de Urgencias de Pediatría. 16-18 de mayo de 2022.