La disfunción diafragmática bilateral es una entidad infrecuente. Dentro del ámbito pediátrico las causas más comunes son las asociadas a traumatismo obstétrico o cirugía cardiovascular. En el diagnóstico diferencial se incluye la enfermedad de Charcot-Marie-Tooth (CMT).
Si bien en esta enfermedad es infrecuente, la afectación de la musculatura respiratoria, por su carácter distal, está descrita su asociación con neumopatía restrictiva secundaria a una disfunción del nervio frénico con paresia diafragmática bilateral o anomalías de la pared torácica.
Presentamos 2 casos de CMT que ingresaron en la Unidad de Cuidados Intensivos con fallo respiratorio tipo II. En ambos casos el tratamiento con ventilación no invasiva produjo una mejoría clínica significativa.
A destacar el hecho de que en uno de los pacientes la evidencia de una afectación frénica sirvió como signo guía para el diagnóstico de su enfermedad de base.
Diaphragmatic bilateral palsy is uncommon in children. The most important etiologies are thoracic surgery and obstetric trauma. Respiratory muscle impairment is a rare phenomenon in patients with Charcot-Marie-Tooth disease (CMT). However, it can be associated with restrictive pulmonary impairment, phrenic nerve dysfunction or thoracic cage abnormalities. We report two paediatric cases of CMT disease with type 2 respiratory failure due to diaphragmatic dysfunction. In both cases treatment with non-invasive mechanical ventilation resulted in satisfactory clinical improvement. Evidence of phrenic damage was the main clue in one patient in order to obtain an accurate diagnostic of her disease.
La disfunción diafragmática bilateral es una entidad poco frecuente en pediatría. Entre las causas principales se encuentran el traumatismo obstétrico y la lesión del nervio frénico secundaria a cirugía cardiovascular o del área mediastínica. Mucho más infrecuentes son otras etiologías, entre ellas la enfermedad de Charcot-Marie-Tooth (CMT)1,2.
Dentro del término CMT se engloba un grupo de enfermedades «genéticamente heterogéneas», causadas por mutaciones específicas en uno de los múltiples genes que codifican la mielina y que producen defectos en su estructura, formación y mantenimiento. Los defectos en estas proteínas pueden producir degeneración axonal dependiente de la longitud, de ahí el predominio distal. Comparten el mismo fenotipo clínico, caracterizado por atrofia y «debilidad muscular distal», normalmente acompañada de deformidades esqueléticas secundarias, afectación sensitiva distal y abolición de los reflejos tendinosos profundos con un espectro de gravedad variable.
Los estudios de conducción nerviosa, patrón hereditario y las nuevas técnicas de ADN molecular son importantes para la clasificación y diagnóstico de los diferentes subtipos3.
Algunos de ellos, especialmente los de mayor gravedad, con pérdida temprana de la deambulación pueden tener afectación de la musculatura respiratoria, así como de los nervios laríngeo y frénico.
La parálisis de cuerdas vocales se asocia con algunos subtipos de CMT: CMT2C (12q23-24), CMT tipo VII, y CMT4A. En cuanto a la afectación del nervio frénico la mayoría de los casos presentan una desmielinización subclínica, que puede ponerse de manifiesto en forma de insuficiencia respiratoria en un contexto de agudización, ya sea infecciosa, embólica, postanestésica o por broncoaspiración.
Casos clínicosCaso 1Corresponde a una paciente de sexo femenino, de 14 años de edad, diagnosticada de enfermedad de CMT tipo II con confirmación genética (heterocigosis p.P251L del exón 8 del gen MFN2). Como «antecedentes patológicos» destacaba el diagnóstico a los 2 años de edad de la citada neuropatía sensitivomotora, con alteración de la marcha y ausencia de reflejos rotulianos y aquíleos. Pérdida de la deambulación a los 10 años.
Si bien no constaban antecedentes de patología respiratoria previa ni se disponía de pruebas funcionales (por infravaloración de la sintomatología y ausencia de seguimiento neumológico hospitalario), interrogando a la familia destacaba una clínica en el último año de dificultad respiratoria nocturna sutil, con cefalea matutina ocasional y ortopnea por la que no habían consultado, así como mucosidad persistente de vías altas en los períodos invernales sin signos de afectación bronquial. Nunca había requerido ingreso por este motivo. Es posible que previamente hubiera un fallo respiratorio crónico leve así como un síndrome de apneas-hipopneas del sueño no diagnosticados.
Ingresó en la Unidad de Cuidados Intensivos de nuestro centro por insuficiencia respiratoria aguda a los 14 años de edad. Clínica de febrícula y dificultad respiratoria progresiva con antecedente de traumatismo en extremidad inferior y dolor del área costal por caída de la silla de ruedas 48h antes.
En la exploración física al ingreso destacaba palidez cutánea y disnea. Edema en extremidad inferior derecha sin signos de trombosis venosa profunda ni de fracturas tanto a nivel costal como de la extremidad. La paciente se encontraba febril (T.a 38,2°C), con taquipnea de 40rpm y Sat. Hb basal de 88–89%, precisando FiO2 0,5 en mascarilla Venturi para Sat. Hb correcta. A la auscultación respiratoria, entrada de aire asimétrica con hipofonesis bibasal, de predominio izquierdo. En la analítica sanguínea destacaba leucocitosis con desviación izquierda, así como aumento leve de los dímeros D. Gasometría venosa pH 7,30; pCO2 58mmHg; pO2 60mmHg; bicarbonato 37mmol/l. Radiografía del miembro inferior sin signos de fractura. Desde el ingreso tratamiento con ventilación no invasiva con BiPAP Vision® modalidad S/T (interfase buconasal) con los siguientes parámetros máximos: IPAP 15cm H2O; EPAP 8cm H2O; FiO2 0,5, mejorando la hipoxemia de forma rápida. Por el cuadro febril con leucocitosis e hipoxemia se inicia tratamiento con amoxicilina-clavulánico y claritromicina. Inicialmente, ante la posibilidad de tromboembolismo pulmonar por antecedente traumático, hipoxemia y elevación de dímeros D, se inició tratamiento con heparina de bajo peso molecular hasta resultado de pruebas de imagen. En la radiografía de tórax destacaba infiltrado-atelectasia bibasal con pérdida de volumen pulmonar bilateral (6 espacios intercostales), ausencia de fracturas costales. El TC torácico con contraste no evidenció defectos intraluminales en los vasos pulmonares. Se atribuye la descompensación respiratoria a sobreinfección respiratoria y posible empeoramiento de la dinámica por dolor tras el traumatismo. Buena evolución clínica con retirada del BiPAP Vision® diurno al quinto día de ingreso, si bien persistía tendencia a la taquipnea, con respiración paradójica y franco empeoramiento durante el decúbito. Se realizó por este motivo electromiograma diafragmático, que mostró una ausencia bilateral de potencial evocado en los diafragmas al estimular los nervios frénicos. Este hallazgo se corroboró mediante estudio ultrasonográfico en el que se evidenció una contracción diafragmática bilateral ineficiente.
La paciente fue dada de alta a domicilio con ventilación no invasiva nocturna con buena adaptación, resolución de la clínica de hipoventilación nocturna y controles gasométricos correctos.
Caso 2Se trata de una paciente de 17 años con enfermedad neuromuscular que ingresa en el hospital, procedente de otro centro, para cirugía correctiva de genu valgo y escoliosis.
Como «antecedentes patológicos» figuraba el diagnóstico, realizado en el hospital de referencia, de una atrofia muscular espinal de tipo II-III en la primera década de la vida con pérdida de la capacidad de deambulación a los 8 años de edad. La paciente estaba en tratamiento con ventilación no invasiva domiciliaria nocturna (modalidad S/T) desde los 15 años de edad por un patrón respiratorio restrictivo sospechado por la espirometría y la enfermedad de base, con apneas-hipopneas del sueño (índice de apnea-hipopnea al diagnóstico de 4/h, de predominio obstructivo con desaturaciones de hasta el 89%) e hipercapnia diurna (PvCO2 52mmHg; bicarbonato estándar en muestra venosa 34mmol/l). Hasta ese momento no había requerido ingreso por problemas respiratorios agudos. Pruebas funcionales respiratorias realizadas antes de la cirugía fueron: espirometría funcional que mostraba los siguientes parámetros: FVC 72%; FEV1 80%; FEV1/FVC 95,46; PEF 85% (valores expresados respecto al teórico). Mesoflujos dentro de la normalidad. No se realizó espirometría en decúbito. En cuanto a la medición de la fuerza muscular; presión inspiratoria máxima (PI máx.) 58cm H2O; presión espiratoria máxima (PE máx.) 130cm H2O. Flujo espiratorio pico durante la tos (PCF) 6,7l/s. No disponemos de medición de volúmenes estáticos. La gasometría arterial diurna mostró pH 7,37; pCO2 45mmHg; pO2 95mmHg, bicarbonato estándar 28mEq/l; exceso de base +2mEq/l.
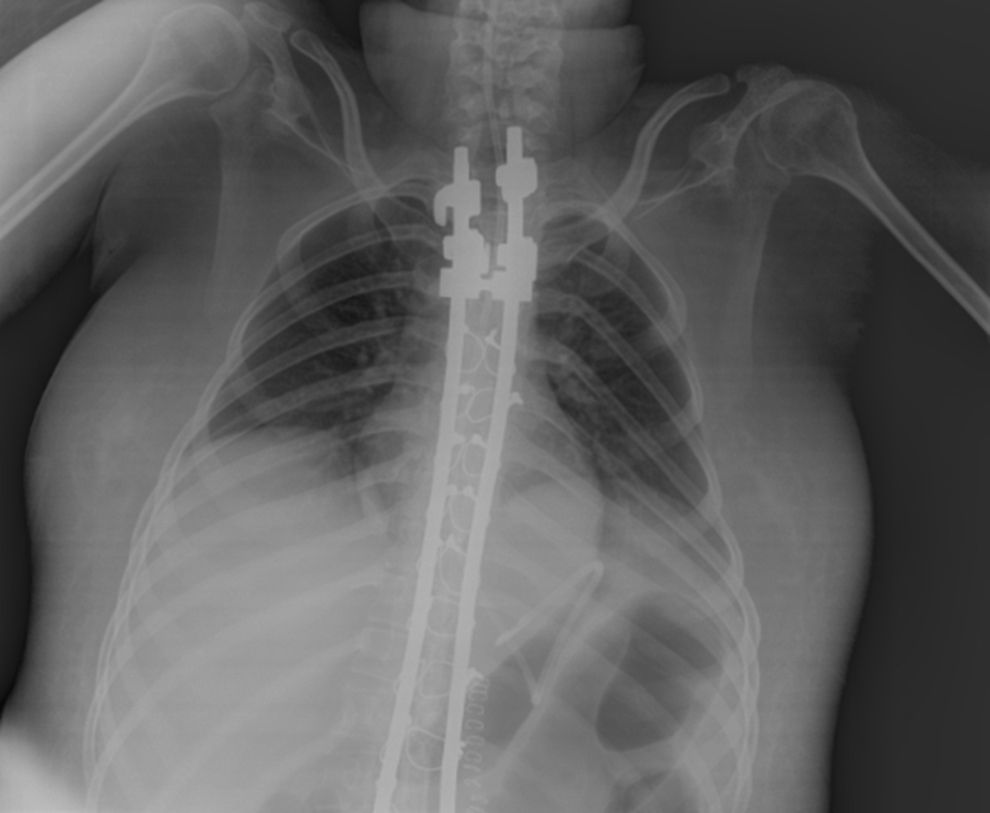
Ingresa tras cirugía de escoliosis (artrodesis fijadora con tornillos pediculares y fijación de la pelvis con tornillo ilíaco, abordaje posterior) en la Unidad de Cuidados Intensivos intubada por fallo en el destete posquirúrgico, asociado a mala dinámica respiratoria postanestésica. Se mantiene ventilada en volumen control precisando una FiO2 máxima 0,4, PIP de 20; PEEP 7cmH20. Extubación a las 48h de ingreso, sin incidencias. Tras el destete destaca disnea con movimiento toracoabdominal paradójico, más evidente en decúbito supino y utilización de la musculatura accesoria supraclavicular. Taquipnea de 30rpm con respiración superficial y mala excursión torácica. La auscultación mostraba taquicardia, tonos rítmicos, sin soplos e hipofonesis pulmonar bibasal. En la gasometría arterial realizada con oxígeno en gafas nasales, FiO2 aproximada 0,28, presenta pH 7,34; pCO2 68mmHg; pO2 75mmHg; bicarbonato 34mEq/l. La radiografía de tórax mostró una elevación diafragmática bilateral, más pronunciada en el lado derecho, con volúmenes pulmonares pequeños y algunas atelectasias basales (fig. 1).
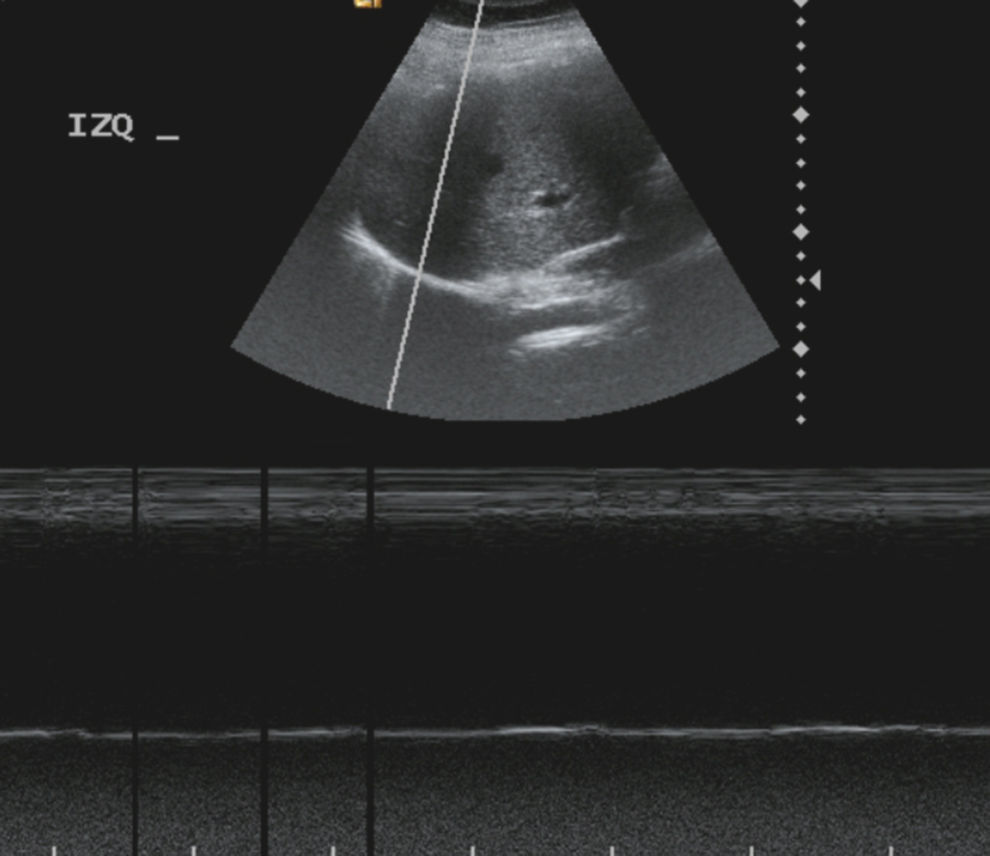
Se inició ventilación no invasiva con BiPAP Vision®, modalidad S/T, con los siguientes parámetros: IPAP 16cm H20; EPAP 6cm H20; FiO2 0,25, mejorando en las primeras 12h de uso la clínica y la gasometría; pH 7,38; pCO2 47mmHg; pO2 82mmHg; bicarbonato 32mEq/l. Ante estos hallazgos, junto con la incapacidad para reducir el número de horas de uso y de volver a los parámetros ventilatorios previos al ingreso, se llevó a cabo un estudio de la motilidad diafragmática e integridad del nervio frénico. El diagnóstico se confirmó, como en la paciente anterior, con el electromiograma y la visualización en la ecografía en modo-M de una ausencia de movimientos diafragmáticos (fig. 2). Una vez superada la fase aguda se demostró mediante espirometría una variación del FVC>20% en decúbito frente a la posición de sedestación y se iniciaron medidas fisioterapéuticas y estudios adicionales.
Se realizó una revisión diagnóstica puesto que la afectación del nervio frénico es excepcional en la atrofia muscular espinal. Los potenciales nerviosos periféricos presentaron una afectación neuroaxonal sensitivomotora difusa en ambas extremidades, con inclusión de los nervios frénicos, hallazgos compatibles con «enfermedad de CMT» quedando pendiente la confirmación por estudio genético.
DiscusiónLa paresia diafragmática bilateral es infrecuente en pediatría. Su hallazgo en un paciente con debilidad muscular debe hacernos pensar en la enfermedad de CMT, y a la inversa.
Si bien la enfermedad de CMT se manifiesta habitualmente con una clínica de afectación distal no hay que olvidar que en algunos subtipos genéticos y en los pacientes con un curso más grave, son susceptibles de tener debilidad de la musculatura respiratoria así como afectación laríngea y diafragmática4. En diferentes estudios entre un 0–30% de los pacientes con CMT presentan clínica respiratoria atribuible a neumopatía restrictiva, apneas obstructivas o parálisis de cuerdas vocales.
En concreto la afectación del nervio frénico se ha descrito tanto en pacientes con CMT1 como CMT2 (especialmente formas 2C y 4). En cuanto a los estudios genéticos, mutaciones específicas en algunos genes, como GDAP1, se han asociado con mayor probabilidad de disfunción diafragmática5,6.
En un estudio en el que se evaluaba la función respiratoria de 9 pacientes afectos de CMT con mutación del gen GDAP1 se encontró que 8 de ellos tenían afectación diafragmática (3 bilateral), todos presentaban un patrón respiratorio restrictivo con gasometrías normales. Seis referían además cambios en la voz desde la adolescencia, evidenciándose en la laringoscopia directa 4 pacientes una paresia de cuerda vocal izquierda y 4 con paresia bilateral por afectación del laríngeo recurrente. Dos de ellos con clínica aspirativa7.
Por otro lado en pacientes con CMT1 no seleccionados, estudios de conducción del nervio frénico mostraron que de un 96–100% de los pacientes tenían una prolongación del tiempo de conducción sin existir una buena correlación con la clínica, y pudiendo permanecer asintomáticos durante años. De hecho solo un 30% tenían una capacidad vital forzada menor del 80% y un porcentaje aún menor presentaba algún tipo de manifestación clinicoanalítica8. Por lo que el estudio electromiográfico rutinario, no tendría utilidad desde el punto de vista clínico en pacientes asintomáticos.
La presencia de un aumento del trabajo respiratorio, con taquipnea, ortopnea y respiración toracoabdominal paradójica así como tos inefectiva y dificultad para el aclaramiento de secreciones deben hacer pensar al clínico en la posibilidad de esta afectación, principalmente en aquellos pacientes con discapacidad más severa.
En cuanto al estudio diagnóstico, el tener una radiografía de tórax normal es un pobre predictor de la función diafragmática9. Generalmente es más demostrativa si se realiza en inspiración y espiración para comprobar el escaso cambio de volumen. La ecografía en modos B y M ha demostrado ser una de las herramientas más útiles, inocuas (no ionizante) y efectivas en cuanto al coste para el estudio de la motilidad diafragmática y permite realizar estudios comparativos en el seguimiento del paciente. La primera permite, además de la visualización directa del movimiento diafragmático y el descenso renal o de ramas izquierdas de la vena porta, medir el cambio de grosor del diafragma durante la inspiración, normalmente aumenta el grosor un 50–70% en caso de normofuncionamiento10–12. El estudio fluoroscópico, aunque sensible y específico para el estudio de la parálisis unilateral, es poco demostrativo en el caso de afectaciones bilaterales y supone una mayor radiación del paciente. Los movimientos de ascenso de las costillas impulsados por la contracción de la musculatura accesoria pueden dar la falsa imagen de un movimiento diafragmático.
Desde el punto de vista funcional la «espirometría» puede ser de gran utilidad. Por un lado, nos podría orientar acerca de un patrón restrictivo (diagnóstico definitivo mediante pletismografía) y, de forma más específica, una disminución de la capacidad vital forzada en decúbito supino versus bipedestación. En individuos sanos se produce una modificación de 3–5% de la capacidad vital en decúbito supino, la cifra asciende a un 10% en caso de parálisis diafragmática unilateral y más de un 30% en el caso de afectación bilateral. También son muy útiles la medición de la PI máx. y PE máx.; la afectación diafragmática cursa con una disminución de la PI máx. (−10cm H2O a −20cm H2O)13.
La medición de la presión transdiafragmática mediante el uso de sondas con balón situadas en esófago y estómago se consideran test estándar para el estudio de esta patología; sin embargo, son pocos los centros pediátricos en los que está disponible14.
Pacientes con debilidad diafragmática bilateral, de esta y otras etiologías pueden beneficiarse del tratamiento con ventilación no invasiva, especialmente como soporte nocturno15–17. Esta opción debería considerarse siempre antes de otros métodos más invasivos como la intubación, ventilación mecánica y traqueostomía.
Destacar que en pacientes con enfermedad neuromuscular y afectación diafragmática cabe pensar en la enfermedad de CMT. En nuestro caso esta asociación fue el signo guía que nos permitió reconsiderar el diagnóstico y cambiar la etiqueta de atrofia muscular espinal por la de CMT.
Es necesario establecer un protocolo de estudio y seguimiento de la función respiratoria de estos pacientes a partir de la primera década de la vida y especialmente en aquellos grupos de riesgo. Un diagnóstico temprano nos permite, por un lado, identificar factores predictores de fallo respiratorio y, por otro, establecer medidas fisioterápicas y de ventilación no invasiva que nos permitan mejorar su pronóstico y calidad de vida.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.