Introducción
La sepsis neonatal es una enfermedad de baja incidencia pero de elevada morbimortalidad asociada, lo que conduce a la realización de muchos test analíticos cuando se sospecha. No obstante, no existe en la actualidad ningún marcador analítico que confirme o descarte con seguridad la infección en el neonato, y el clínico no puede esperar a los resultados de los cultivos de sangre y/o líquido cefalorraquídeo (LCR) para iniciar el tratamiento antibiótico. Esto ha conducido al uso de distintas combinaciones de test diagnósticos, con resultados muy dispares1.
En un metaanálisis realizado sobre 194 estudios relacionados con los test diagnósticos más comúnmente usados en la sepsis neonatal (variables hematológicas, proteína C reactiva [PCR], cultivos de sangre), Fowlie y Schmidt2 publicaron en 1998 que la calidad de los métodos usados para establecer la validez de los test diagnósticos era generalmente pobre y que, incluso en los estudios más rigurosos, la precisión de los test variaba sustancialmente. Las razones de esta imprecisión eran diversas e incluían la no distinción entre sepsis neonatal de comienzo precoz o tardío, diferentes puntos de corte para el mismo marcador y la introducción de rangos de edad gestacional muy amplios (24-42 semanas) en las series estudiadas.
A menudo, a pesar de que el recién nacido presenta signos clínicos y datos analíticos indicativos de infección bacteriana, los cultivos de sangre resultan negativos3-5. Esto se atribuye a una inadecuada proporción entre la cantidad de sangre extraída y el medio de cultivo usado, a una bacteriemia intermitente o de baja densidad y al uso creciente de antibióticos antes y durante el parto5-8.
Erkeller-Yuksel et al9 establecieron que, al nacer, ± 91 % de las células T CD4 expresan CD45RA+ en su superficie, y que la exposición repetida al antígeno causa un cambio del fenotipo CD45RA+/CD45RO al CD45RA/CD45RO+. Consecuentemente, estos autores propusieron que las células CD45RA+ son quizá células no primadas por el antígeno. También observaron que los linfocitos T CD45RO+ aumentan lentamente desde el nacimiento hasta proporciones aproximadas al 45 % a la edad de 15-16 años.
Este proceso de adquisición del fenotipo memoria parece ser un proceso conducido por el patógeno, más que lo que ocurre con otros factores, tales como la PCR. Las células memoria T CD4+ expresan en su superficie isoformas alteradas de CD45 que regulan la interacción del receptor de la célula T con su correceptor. La molécula CD45 es una tiroxina-fosfatasa transmembrana cuyo gen tiene tres exones variables (A, B, C), que codifican parte de una enzima del dominio externo. La célula T naive tiene una isoforma de alto peso molecular (CD45RA, con los 3 exones) que no se asocia con receptor. Pero en la célula T memoria los exones variables se pierden y la isoforma (CD45RO) se asocia con ambos, el receptor de la célula T y con su correceptor. Este complejo receptor-correceptor parece traducir la señal más efectivamente que el receptor de la célula T naive. Se cree que los cambios en el fenotipo ocurren tras el contacto con el microorganismo patógeno y no tras un proceso inflamatorio inespecífico.
En sangre de cordón umbilical de neonatos nacidos a término, Rabian-Herzog et al10 observaron que el 31,0 ± 10,8 % de los linfocitos T eran CD4+, comparado con el 42,4 ± 7,2 % encontrado en sangre de adulto. Entre esos linfocitos T CD4+, el 63,8 ± 12,7 % expresaba CD45RA+ en su superficie. Esto sugiere que la población linfocítica dominante en el neonato es población naive.
En 119 muestras de sangre de cordón, Michie y Harvey11 encontraron que el antígeno CD45RO+ estaba presente en menos del 10 % de los linfocitos T de los neonatos control, y fue detectado en al menos el 17 % de los linfocitos T (p < 0,006) de los neonatos con infección congénita probada. El modo de parto, la incompatibilidad materno-fetal y la presencia de líquido teñido de meconio no alteraban dichos resultados.
Resultados similares publicaron Brüning et al12, quienes confirmaron que la proporción de linfocitos T CD45RO+ en el punto de corte 9 % mostraba una especificidad del 94,6 % y una sensibilidad del 64,1 % como marcador de infección congénita o infección neonatal de comienzo precoz debido a causa viral o toxoplasmosis.
Tezuka et al13 sugirieron que la expresión aumentada de CD45RO+ (en los linfocitos T, B y en las células natural killers [NK]) podría actuar como marcador diagnóstico de sepsis neonatal, especialmente su determinación en los linfocitos T CD4+. Dichos autores observaron que alrededor del 90 % de los linfocitos T en sangre de cordón de neonatos a término expresaban CD45RA+/CD45RO y, como las concentraciones basales de CD45RO+ son bajas, no sorprende que pequeños incrementos sean fácilmente detectables.
En paralelo a este trabajo, Hodge et al14 evaluaron el fenotipo CD45RO y CD45RA/CD45RO (doblemente marcado) en neonatos sanos e infectados, registrando rangos de referencia para la expresión de CD45RA/CD45RO y CD45RO en neonatos control de menos del 11 % y del 19 %, respectivamente, con un valor predictivo positivo (VPP) del 100 %. Estos autores concluyeron que CD45RO es un marcador de activación tardía y que CD45RA/ CD45RO (doblemente marcado) es una marcador de activación muy precoz (detectado en fases muy precoces de la infección). No se encontraron diferencias significativas en relación con la edad gestacional, modo de parto, presencia de distrés respiratorio, isoinmunización o tratamiento corticoideo o antibiótico en la madre o el neonato.
Nuestro estudio fue diseñado para evaluar la utilidad de los linfocitos T CD4+ como marcador diagnóstico de sepsis neonatal de comienzo tardío en neonatos pretérmino.
Pacientes y métodos
Se llevó a cabo un estudio de cohortes prospectivo con una muestra de 72 neonatos, menores de 259 días de edad gestacional, que se dividieron en dos grupos: sepsis tardía (n = 24) y controles no infectados (n = 48). Las muestras de sangre venosa periférica del grupo sepsis se obtuvieron en el momento en que la infección fue sospechada, después de las primeras 72 h de vida.
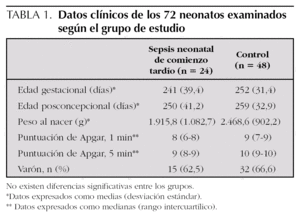
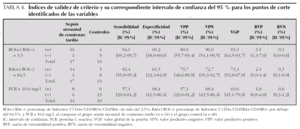
La tabla 1 expone los datos clínicos de los 72 neonatos examinados según el grupo de estudio.
El grupo sepsis incluye recién nacidos con:
1.Factores de riesgo de sepsis de transmisión horizontal: catéter central o venoso, ventilación mecánica, alimentación parenteral, intralípidos, sepsis previa y tratamiento antibiótico previo, exsanguinotransfusión.
2.Signos clínicos de infección que comienzan pasadas las primeras 72 h de vida15: malestar general, mala perfusión periférica/cianosis/palidez cutánea, hipotonía/letargia, disregulación térmica/fiebre, hipotensión, distensión abdominal, mala tolerancia digestiva/vómitos/diarrea, hepatoesplenomegalia, ictericia, hipoglucemia, coagulación intravascular diseminada, dificultad respiratoria/incremento de los requerimientos ventilatorios o de oxígeno, irritabilidad, convulsiones.
3.Datos analíticos indicativos de infección: leucocitosis > 20.000/ml o leucopenia < 5.000/ml; índice neutrófilos inmaduros/neutrófilos totales (NI/NT) > 0,2; recuento plaquetario < 150.000/ml; PCR > 10,0 mg/l.
4.Todos los neonatos del grupo sepsis recibieron tratamiento antibiótico durante 7-10 días.
La edad gestacional media de este grupo fue de 241 días y la edad posconcepcional media, de 250 días (tabla 1).
En el grupo sepsis, 14 de 24 neonatos tuvieron cultivo de sangre y/o LCR positivo. La tabla 2 muestra los microorganismos causantes.
Un total de 10 de los 24 neonatos incluidos en el grupo sepsis tuvieron cultivos negativos. Éstos son los diagnósticos en el momento del alta además de sepsis tardía: un neonato fallecido por fallo multiorgánico, un neonato con neumonía del lóbulo superior derecho, un neonato con enterocolitis necrosante, dos neonatos con meningitis (el LCR mostraba pleocitosis, hiperproteinorraquia, hipoglucorraquia, cultivo negativo).
El grupo control incluye neonatos ingresados en la unidad neonatal a causa de síndrome de distrés respiratorio tipo II, hijo de madre diabética, asfixia perinatal moderada, isoinmunización, bajo peso al nacer, hiperbilirrubinemia, hijo de madre usuaria de drogas por vía parenteral, malformación del tracto urinario sin evidencia de infección, hipoglucemia, poliglobulia, nacidos de embarazo no controlado, soplo sistólico. En resumen, el grupo control comprende neonatos con enfermedad no infecciosa. Todos ellos evolucionaron favorablemente sin precisar tratamiento antibiótico. Previamente se había comprobado que no existían diferencias significativas en términos de datos clínicos entre estos neonatos.
La edad gestacional media y posconcepcional media fue 252 días y 259 días, respectivamente, para el grupo control (p = 0,29 con respecto al grupo sepsis) (tabla 1). De todos los neonatos asignados al grupo control se obtuvo muestra de sangre después de las primeras 72 h de vida.
Para la tinción de los linfocitos se usó 0,5 ml de sangre venosa periférica que fueron recogidos en tubos con ácido etilendiaminotetraacético (EDTA) y conservados a 4 °C. Dos alícuotas de 20 μl de sangre completa se separaron en dos tubos diferentes (dos tubos por cada neonato, un tubo para añadir anticuerpos monoclonales marcados con fluorocromo, y otro tubo para el control isotipo, 40 μl en total). Los eritrocitos se lisaron (ImmunoPrep® Reagent System, Beckman Coulter®) y se lavaron dos veces.
Se añadieron los siguientes anticuerpos monoclonales a los tubos:
Tubo 1: 10 μl de CD45RA (mouse anti-human IgG1, CD45RAPECy5, conjugado con tercer color) + 5 μl de CD45RO (mouse monoclonal antibody to human CD45RO conjugado a FITC [isotiacianato de fluoresceína, verde]) + 2 μl de CD4 (mouse monoclonal antibody to human CD4-RPE [CD4 R-ficoeritrina, rojo]) (CD45RA: CD45RAPECy5, Cytognos, Avda. del Campo Charro, s/n. 37007 Salamanca; CD45RO y CD4: Caltag Laboratories, 1849 Old Bayshore Hwy., Suite 200, Burlingame. California, EE.UU.).
Tubo 2 (control isotipo): 10 μl mouse isotype control IgG1-PECY5, Cytognos + 5 μl de CD45RO mouse isotype control IgG2a-FITC (Caltag Laboratories) + 2 μl de CD4 mouse isotype control IgG2a-RPE (Caltag Laboratories).
Los tubos fueron incubados a 4 °C durante al menos 20 min, después se añadió PBS (suero salino tampón fosfato) + BSA (albúmina bovina al 0,3 %) + EDTA, hasta alcanzar 1 ml y se analizó por citometría de flujo. Este método identifica los inmunofenotipos de las poblaciones celulares de acuerdo con los antígenos de superficie.
Se calculó el índice NI/NT dividiendo el número de precursores neutrófilos entre el total de neutrófilos. Un índice hasta 0,2 se considera normal16-19.
La PCR se determinó mediante nefelometría (Behring Nephelometer Analyzer II), usando muestras de 0,5 ml de sangre completa. Se define una PCR patológica cuando excede 10,0 mg/l3,20-23.
Las variables cuantitativas se resumen en su media y desviación estándar (DE). En todos los casos se comprobó la distribución de la variable frente a los modelos teóricos. Se analizaron las diferencias en media entre los grupos de estudio con el test de la t de Student (en comparaciones de una variable con dos categorías) y/o el análisis de la variancia (ANOVA). En todos los casos se comprobó la distribución de la variable frente a los modelos teóricos y se contrastó la hipótesis de homogeneidad de varianzas.
Se estimaron las curvas de rendimiento diagnóstico para los marcadores con el fin de detectar los puntos discriminativos o de corte de detección de sepsis. Se han calculado las áreas bajo la curva y sus intervalos de confianza (IC) del 95 % para evaluar la capacidad diferenciadora global de los marcadores.
Se calcularon los siguientes índices de validez y su IC 95 %: sensibilidad, especificidad, VPP y valor predictivo negativo (VPN), valor global de la prueba (VGP) (grado en el que un test representa el valor verdadero) y razón de verosimilitud positiva (RVP) y negativa (RVN).
Se ajustó un modelo de regresión logística, con el objeto de evaluar qué marcador era más predictor de sepsis. En todos los casos se comprobó la distribución de la variable frente a los modelos teóricos y se contrastó la hipótesis de homogeneidad de varianzas. En todos los contrastes de hipótesis se rechazó la hipótesis nula con un error de tipo I o error a menor a 0,05. El paquete informático utilizado para el análisis fue SPSS para Windows versión 11.0.
Resultados
Marcadores linfocitarios
El porcentaje de linfocitos T CD4+/CD45RO+/CD45RA fue significativamente mayor en el grupo sepsis neonatal tardía frente al grupo control (7,0 ± 2,8 % frente a 3,5 ± 1,9 %; p = 0,001) (tabla 3).
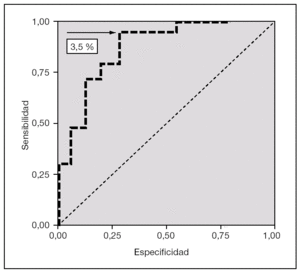
La figura 1 muestra que el área bajo la curva ROC (receiver operating characteristic) de la variable porcentaje de linfocitos T CD4+/CD45RO+/CD45RA es 0,85 y que el mejor punto de corte es superior al 3,5 %. La curva ROC también indica que para ese punto de corte superior al 3,5 %, como marcador de sepsis neonatal tardía, esta variable muestra una sensibilidad del 94,1 % (IC 95 %: 69,2-99,7), una especificidad del 69,2 % (IC 95 %: 38,9-89,6), VPP del 80,0 % (IC 95 %: 55,7-93,4), VPN del 90,0 % (IC 95 %: 54,1-99,5), un VGP del 83,3 % (IC 95 %: 64,5-93,7), RVP de 3,1 (1,3-7,0) y RVN de 0,1 (0,0-0,6) (tabla 4).
Figura 1.Curva ROC (receiver operating characteristics) del parámetro porcentaje de linfocitos T CD4+/ CD45RO+/CD45RA en el grupo sepsis neonatal de comienzo tardío (n = 24) comparado con el grupo control (n = 48). El área bajo la curva es de 0,85; el punto de corte óptimo, de 3,5 % (sensibilidad, 94,1 %; especificidad, 69,2 %).
El porcentaje de linfocitos TCD4+/CD45RO+/CD45RA superior al 3,5 % alcanza una odds ratio de 36,0 (IC 95 %: 3,5-373,2; p < 0,001), en la que la sensibilidad es del 94,1 % y la especificidad, del 69,2 %.
En el grupo sepsis neonatal tardía la media del porcentaje de linfocitos T CD4+/CD45RO+/CD45RA fue similar para los neonatos con cultivo de sangre negativos comparados con aquéllos con infección probada bacteriológicamente.
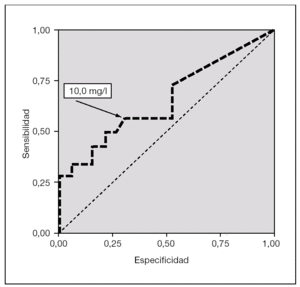
Proteína C reactiva
La figura 2 muestra que el área bajo la curva ROC de la variable de PCR es 0,66 y el mejor punto de corte, > 10,0 mg/l. La curva ROC también indica que en ese punto de corte superior al 10,0 mg/l, como marcador de sepsis neonatal tardía, esta variable muestra una sensibilidad de 57,1 % (IC 95 %: 29,6-81,2), especificidad del 68,4 % (IC 95 %: 43,5-86,4), VPP del 57,1 % (IC 95 %: 29,6-81,2), VPN del 68,4 % (IC 95 %: 43,5-86,4), VGP del 63,6 % (IC 95 %: 45,1-79,0), RVP de 1,8 (0,8-4,0) y RVN de 0,6 (0,3-1,2) (tabla 4).
Figura 2.Curva ROC (receiver operating characteristics) del parámetro proteína C reactiva (mg/l) en el grupo sepsis neonatal de comienzo tardío (n = 24) comparado con el grupo control (n = 48). El área bajo la curva es de 0,66; el punto de corte óptimo, de 10,0 mg/l (sensibilidad, 57,1 %; especificidad, 68,4 %).
Combinación de test diagnósticos
Para comprobar si el marcador linfocitario propuesto podría mejorar la validez de las variables generalmente usadas para el diagnóstico de la sepsis neonatal (PCR, NI/NT), se intentaron varias combinaciones de dichas variables con nuestro marcador. Los mejores resultados se obtuvieron con la combinación de las variables linfocitos T CD4+/CD45RO+/CD45RA y PCR.
La proporción de neonatos sanos mayores de 72 h de vida que tienen una PCR inferior a 10,0 mg/l y un porcentaje de linfocitos T CD4+/CD45RO+/CD45RA por debajo del 3,5 % (especificidad) es del 94,7 % (IC 95 %: 71,9-99,7). La probabilidad de que un neonato con ambos test positivos (PCR > 10,0 mg/l y porcentaje de linfocitos T CD4+/CD45RO+/CD45RA > 3,5 %) tenga una sepsis tardía (VPP) es del 85,7 % (IC 95 %: 42,0-99,2) (tabla 5). La proporción de neonatos infectados mayores de 72 h de vida con ambos test positivos (PCR > 10,0 mg/l y porcentaje de linfocitos T CD4+/CD45RO+/CD45RA > 3,5 %) (sensibilidad) es del 100,0 % (IC 95 %: 78,1-100,0), aunque, en este caso, la especificidad baja a 30,8 % (IC 95 %: 10,4-61,1).
Finalmente, la probabilidad de que un neonato con ambos test negativos (PCR < 10,0 mg/l y porcentaje de linfocitos T CD4+/CD45RO+/CD45RA < 3,5 %) no tenga una sepsis tardía (VPN) es del 100,0 % (IC 95 %: 39,6-100,0) (tabla 5).
La inclusión del NI/NT en el punto de corte 0,2 no mejoró la validez diagnóstica del marcador linfocitario.
Discusión
Nuestros hallazgos reflejan que, como marcador de sepsis neonatal de comienzo tardío en neonatos pretérmino, una proporción de linfocitos T CD4+/CD45RO+/CD45RA superior al 3,5 % en sangre periférica tiene una sensibilidad del 94,1 %, un VPP del 80 % y un VPN del 90 %, aunque con una especificidad del 69,2 %. Así, un neonato con este marcador presenta una odds ratio para esta enfermedad de 36,0 (p < 0,001).
La proporción de neonatos pretérmino sanos con una PCR < 10,0 mg/l y/o proporción de linfocitos T CD4+/ CD45RO+/CD45RA por debajo del 3,5 % (especificidad) es del 94,7 %, aunque con una sensibilidad del 46,2 %. La probabilidad de que un neonato con ambos test positivos (PCR > 10,0 mg/l y linfocitos T CD4+/CD45RO+/CD45RA > 3,5 %) esté realmente infectado es del 85,7 % (VPP).
De esta forma, el uso de la combinación de estos test mejora la especificidad, el VPP y el VPN, del uso aislado de la proporción de linfocitos T CD4+/CD45RO+/CD45RA, y también mejora la especificidad, el VPP, el VPN y el VGP del uso aislado de la PCR.
Dado que algunos neonatos sufren más de un episodio de infección nosocomial, también evaluamos el uso de este marcador en neonatos con infección nosocomial recurrente. Este análisis reveló que las células CD45RO+ volvían a las concentraciones observadas en los neonatos no infectados, independientemente de si el neonato había sufrido uno o varios episodios de infección. De todas formas, el tamaño poblacional era demasiado pequeño para establecer conclusiones definitivas a este respecto.
La proporción de neonatos pretérmino con sepsis tardía con ambos test positivos (sensibilidad) es del 100 %. Y la probabilidad de que un neonato con ambos test negativos no tenga una sepsis tardía es del 100 % (VPN).
Junto con el NI/NT, la PCR ha sido la variable más ampliamente usada para el diagnóstico de la sepsis neonatal. De todas formas, la PCR tiene un bajo VPP, puesto que a menudo se eleva en situaciones diferentes a la infección (p. ej., asfixia perinatal, síndrome de distrés respiratorio, hemorragia intracerebral, aspiración meconial)5.
Aunque se han usado varios puntos de corte para la PCR (> 6, 7, 9, 10 mg/l) y diferentes momentos para su determinación (horas, días), existe mucha variación en la literatura médica acerca del valor diagnóstico de la determinación de las concentraciones de la PCR, con rangos de sensibilidad de 29-90 %, especificidad de 41-100 %, VPP de 18-100 % y VPN de 38-98 %. Cuando varios marcadores se combinan para el diagnóstico de la sepsis neonatal existe también gran variación. La combinación más comúnmente usada es la PCR junto a valores hematológicos (recuento leucocitario, NI/NT, recuento de neutrófilos), lo cual arroja rangos de sensibilidad de 22-75 %, de especificidad de 45-98 %, de VPP de 9-71 % y de VPN de 63-95 %2.
Blommendahl et al24 usaron PCR y procalcitonina como marcadores para el diagnóstico de sepsis neonatal. Cuando una de estas variables es positiva, la sensibilidad de la combinación es del 75 %, la especificidad del 84 %, el VPP del 14 % y el VPN del 96 %. Cuando ambas variables son positivas, los respectivos valores son del 58, 86, 28 y 96 % (rangos no publicados). Ninguno de los marcadores estudiados por dichos autores fue válido por sí solo.
Muchos autores argumentan que los diferentes puntos de corte de las variables, los diferentes métodos de medición, el diseño de los estudios, la definición de sepsis y el amplio rango de edades posnatales son causantes de la ausencia de consenso general acerca de la validez de los marcadores de infección neonatal25,26.
Desde hace algún tiempo, algunos autores defienden el uso de diferentes puntos de corte para los marcadores de sepsis neonatal según las horas de vida del neonato. Por ejemplo, Chiesa et al27 identificaron diferentes puntos de corte para la PCR en función de las horas de vida: 4 mg/l al nacer y 10 mg/l a las 24 h y 48 h de vida. Este hallazgo es consistente con el valor óptimo de la PCR para el diagnóstico de la sepsis neonatal precoz de 5 mg/l observado en nuestro estudio (antes de las primeras 72 h de vida, resultados no mostrados), y 10 mg/l para la sepsis neonatal tardía (después de las primeras 72 h de vida).
Hodge et al28 publicaron que un conjunto de marcadores (CD69 en la superficie de las células NK, y CD45RA, CD45RO, CD25 y CD69 en la superficie de los linfocitos T de sangre periférica) es la combinación más sensible y específica para el diagnóstico de sepsis neonatal. Al igual que nosotros, propusieron que los marcadores de activación estudiados en la superficie de los linfocitos se estudian más fácilmente que los marcadores en la superficie de los neutrófilos, puesto que estos últimos se alteran más por la apoptosis y por los medios de conservación (heparina, EDTA).
Ng et al29 rechazaron el uso de CD45RO como marcador de sepsis nosocomial en su estudio con una población de neonatos de muy bajo peso al nacer al no alcanzar dicho marcador una sensibilidad y una especificidad del 75 %. De todas formas, estos autores también sugirieron el uso de una combinación de marcadores (CD64, PCR, interleucina 6 [IL-6]), al no encontrar ningún marcador válido por sí solo para el diagnóstico de la sepsis neonatal.
Por el momento, ningún autor ha determinado el punto de corte diferenciador de sepsis para la PCR, cuenta leucocitaria, NI/NT o cualquier otro marcador, usando los criterios de selección universalmente aceptados aplicados a las diferentes edades gestacionales y edades posconcepcionales30,31.
En el medio hospitalario, la determinación de CD45RO puede obtenerse en 120 min y su coste en nuestro centro equivale a 2,5 veces la determinación de las concentraciones de PCR.
Nuestros hallazgos observados en neonatos de 37 semanas de edad gestacional o menos sugieren la validez de la subpoblación de linfocitos T CD4+/CD45RO+/CD45RA como marcador de sepsis neonatal de comienzo tardío. El desarrollo de un método automatizado, reproducible y de bajo coste para la determinación de este marcador permitiría su uso en hospitales de cualquier nivel.
Dado el escaso tamaño de la muestra es necesario un estudio más amplio para comprobar estos resultados. También es necesario para determinar si es un marcador diagnóstico válido para la sepsis precoz, e independiente del peso al nacer, edad gestacional, microorganismo causante y tratamiento antibiótico o corticoideo en la madre o en el recién nacido.
Correspondencia: Dra. M.ªJ. Dorado Moles.
Servicio de Neonatología. Hospital Clínico San Carlos.
Martín Lago, s/n. 28040 Madrid. España.
Correo electrónico: mjdmoles@yahoo.es
Recibido en octubre de 2007.
Aceptado para su publicación en octubre de 2007.