Introducción
La linfadenitis es la forma clínica más frecuente de infección por micobacterias no tuberculosas en la infancia. Su incidencia parece estar aumentando en los últimos años1,2, representando aproximadamente el 10-20 % de las adenitis cervicales en niños en edad preescolar3. Sin embargo, aún son muy pocas las publicaciones sobre estas infecciones pediátricas en nuestro país4-9.
El objetivo de ese estudio es describir las características clínicas, epidemiológicas y evolutivas de las adenitis por micobacterias no tuberculosas.
Material y métodos
Se realiza un estudio retrospectivo desde 1987 hasta 2004, recogiéndose todos los casos de adenitis por micobacterias no tuberculosas en niños menores de 14 años diagnosticados en el Servicio de Pediatría del Hospital Infantil La Paz (Madrid).
Se incluyen en el estudio aquellos pacientes con linfadenitis que presenten:
1.Cultivo o reacción en cadena de la polimerasa (PCR) positivos para micobacterias no tuberculosas.
2.Pruebas de sensitinas para micobacterias atípicas positivas, con valor superior en 6 mm al Mantoux realizado simultáneamente.
3.Baciloscopia positiva y/o estudio histológico compatible cumpliendo todos los siguientes criterios: a) Mantoux negativo o menor de 15 mm, b) radiografía de tórax normal, c) ausencia de contacto tuberculoso, d) Mantoux negativo en familiares directos, y e) exclusión de otras causas de adenitis granulomatosa10,11.
El diagnóstico microbiológico se realizó mediante cultivo, PCR y visualización de bacilos ácido alcohol-resistentes tras tinción de Ziehl-Neelsen y/o auramina; las muestras se cultivaron en medios líquidos (MB/BacT/Alert .3D System) y/o sólidos (Coletsos-Biomedics) específicos para micobacterias, durante 4-8 semanas; los aislamientos se identificaron mediante estudios de hibridación con sondas de ADN específicas (Accuprobe®, BioMérieux) y estudios bioquímicos, completándose la identificación definitiva, cuando fue necesario, en el Centro Nacional de Microbiología de Majadahonda.
Para la determinación de la presencia de micobaterias mediante estudio molecular en una muestra fijada en formol e incluida en parafina, y tras la extracción del ADN, se realizan dos PCR con primers externos (59-ACC AAC GAT GGT GTG TCC AT-39; 59-CCT GTC GAA CCG CAT ACC CT-39) y una segunda PCR con los primers internos (59-GAG ATC GAG CTG GAG GAT CC-39 y 59-AGC TGC AGC CCA AAG GTG TT-39). En ambos casos las condiciones de amplificación incluyen primers a una concentración 1 μM, dNTPs a 0,2 mM, Cl2 Mg a 1,5 mM y Taq Polimerasa (2 U por reacción de 50 μl). Tras el proceso de ciclo térmico (1.º- 94 °C - 5′; 2.º- [94 °C - 1′30″, 60 °C - 1′30″, 72 °C - 2′] × 40 ciclos; 3.º- 72 °C - 59) se obtiene un producto de 383 pares de bases en gel de agarosa, que demuestra la presencia de una micobacteria. Este producto de la PCR se corta con una enzima de restricción (NAR-1) obteniéndose diferentes productos según el tipo de micobacteria: Mycobacterium avium (dos bandas de 121 y 230 pb) o Mycobacterium tuberculosis (dos bandas de 121 y 150 pb). Si hallamos material genético de micobacteria pero no identificamos M. avium o M. tuberculosis, asumimos la presencia de otra micobacteria no específica.
Los pacientes recibieron distintos tratamientos inicialmente (antibioterapia, exéresis quirúrgica e incisión y drenaje). En algunos pacientes no se administró tratamiento inicialmente ante la negativa familiar al mismo.
Resultados
Se estudiaron un total de 54 pacientes. Todos los niños estaban previamente sanos. Ningún paciente refería haber tenido contacto con enfermos tuberculosos. Un total de 22 pacientes eran niños (40,7 %) y 32 niñas (59,2 %). La edad media de presentación fue de 35 meses (rango: 14 meses-6 años). El 66,7 % de los pacientes (36/54) habían recibido tratamiento antibiótico previo (cloxacilina, amoxicilina o amoxicilina-ácido clavulánico), ante la sospecha inicial de adenitis bacteriana.
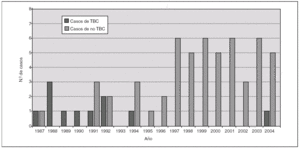
Entre 1987 y 1996 encontramos pocos casos de adenitis no tuberculosa (1,2 casos/año).
Desde 1997 se observó un aumento llamativo en la aparición de adenitis no tuberculosas, encontrando desde 1997 a 2004 un total de 5,25 casos/año. Se recogió también el número de adenitis tuberculosas desde 1987 en nuestro hospital, observándose una práctica desaparición de las mismas desde 1994 (fig. 1).
Figura 1. Distribución anual de los casos de adenitis por micobacteria tuberculosa y no tuberculosa diagnosticadas en nuestro hospital entre 1987 y 2004.
El tiempo de evolución desde el inicio del cuadro hasta la primera consulta fue de 1,79 ± 1,61 meses. La mayor parte de los pacientes no refería otra sintomatología que la presencia de una adenopatía no dolorosa, aunque 9 pacientes (16,7 %) habían presentado picos febriles coincidiendo con la aparición de la misma. No se observó ningún otro síntoma.
La mayor parte de los pacientes (45/54) presentaba una adenopatía única (83,3 %), siete presentaban más de una adenopatía unilateralmente (12,9 %), y sólo dos bilaterales. Se estudiaron por tanto 63 adenopatías en 54 pacientes, siendo 22 submaxilares (34,9 %), 21 laterocervicales (33,3 %), 10 preauriculares (15,8 %), 8 maxilares (12,6 %) y 2 axilares (3,1 %). El tamaño medio de la adenopatía fue de 2,46 ± 0,9 cmLa piel adyacente a las adenopatías mostró alteraciones en el momento del diagnóstico en 34 casos (62,9 %), con coloración violácea en la mayoría. El 48,1 % de los niños (26/54) presentó fistulización, bien de manera espontánea, tras iniciar tratamiento médico o realizar drenaje quirúrgico. Ningún paciente presentó fistulización tras la exéresis quirúrgica de la adenopatía. La fistulización se observó a los 3,46 ± 3,4 meses de la aparición de la adenopatía. La duración media de la fistulización fue de 3,14 ± 3,18 meses, presentándose un caso con fistulización intermitente muy prolongada (20 meses).
Se realizó ecografía de la lesión en 28 casos (51,8 %). A pesar de que el 83,3 % de los pacientes presentaba una única adenopatía en la exploración clínica, en el 60,7 % de las ecografías realizadas (17/28) se constataron múltiples adenopatías adyacentes más pequeñas. En 44 de los 54 pacientes (81,4 %) se obtuvo radiografía de tórax, no observándose alteraciones significativas en ninguna.
En 51 pacientes se realizó estudio histológico, obteniéndose 52 muestras para estudio bien por punción-aspiración (39), biopsia (5) o muestra de exéresis quirúrgica (8). El 71,4 % de las muestras presentaron granulomas (37/52), el 34,6 % necrosis (18/52), observándose en el 9,6 % de los casos células gigantes (5/52).
Se realizó Mantoux a 42 pacientes, resultando negativo (induración < 5 mm) en 27 casos (64,2 %) y presentando un valor entre 5 y 10 mm en 7 pacientes (16,6 %) y superior a 10 mm en 8 (19 %). Se realizó prueba de sensitinas en 8 pacientes para M. avium y Mycobacterium scrofulaceum, presentando todos valores superiores en 6 mm al Mantoux realizado.
La presencia de bacilos ácido-alcohol resistentes tras tinción de la muestra se constató sólo en el 19,4 % de los casos realizados (7/36). En 43 pacientes (79,6 %) se obtuvieron muestras para cultivo y/o estudio molecular (PCR). El cultivo fue positivo paramicobacteria no tuberculosa en el 52,9 % de los casos (18/34) y la PCR detectó material genético micobacteriano en el 53,3 % de los casos en los que se realizó (8/15), pudiendo identificar la especie M. avium en el 37 % de las muestras positivas (3/8). La micobacteria más frecuentemente aislada en el cultivo fue M. avium en 14 casos (61 %), aislándose también otras micobacterias: M. scrofulaceum (1), Mycobacterium chelonae (1), Mycobacterium simiae (1) y Mycobacterium lentiflavum (1).
Los pacientes recibieron distintos tipos de tratamiento inicialmente: antibióticos (21 pacientes), drenaje (13) y exéresis (8). Seis pacientes no recibieron tratamiento inicialmente ante la negativa familiar al mismo. Seis pacientes no volvieron para revisión clínica, tres de los cuales habían recibido antibioterapia, dos exéresis y uno drenaje.De los 21 pacientes que recibieron terapia antibiótica exclusiva inicialmente, 12 recibieron macrólidos en monoterapia y nueve claritromicina o azitromicina en asociación con etambutol (5), ciprofloxacino (2) o rifabutina (2). En 6 pacientes se administró inicialmente rifampicina, isoniazida y pirazinamida ante la sospecha de infección tuberculosa. La duración media del tratamiento fue de 3,28 ± 2,66 meses. Un total de 12 pacientes (57,1 %) curaron tras el tratamiento médico. Ocho pacientes (38,1 %) no mostraron involución de la adenopatía tras al menos 2 meses de tratamiento, realizándose en todos los casos exéresis quirúrgica y curando definitivamente tras la intervención.
La realización de drenaje como primera opción terapéutica ocurrió en 13 pacientes. Sólo en tres fue efectivo (23 %), mientras que en los 10 restantes (76,9 %) se produjo fistulización crónica tras su realización, precisando la asociación de antibióticos. En dos de estos pacientes, la adenitis recurrió a pesar del tratamiento médico, precisando exéresis quirúrgica.
En 8 casos se realizó exéresis de la adenopatía al inicio del cuadro. En el 100 % de los casos se consiguió la curación definitiva.
En 6 pacientes no se instauró inicialmente ningún tratamiento. En 3 casos se produjo curación espontánea a los 2, 5 y 6 meses del inicio del cuadro, en dos de ellos con fistulización previa. Otro precisó antibióticos, otro antibióticos y drenaje y el último exéresis.
En 4 de los 18 niños que precisaron exéresis de las lesiones aparecieron secuelas posquirúrgicas. Tres (16,6 %) presentaron una paresia mínima y transitoria de la rama mandibular del nervio facial. El otro caso refirió notar episodios espontáneos de sudoración hemifacial tras la cirugía. En este caso la intervención realizada fue compleja, ya que se trataba de una adenitis de evolución tórpida y prolongada, con múltiples recurrencias y fistulizaciones.
Discusión
La linfadenitis es la manifestación más frecuente de la infección por micobacterias no tuberculosas en el niño. En los últimos años se ha observado un aumento de las mismas1, coincidiendo con un descenso llamativo en el número de adenitis tuberculosas, lo cual se confirma en nuestro estudio. Es posible que la supresión de la vacunación con bacilo de Calmette-Guérin (BCG) y el mejor control de la infección tuberculosa en nuestro país puedan favorecer la infección por estas micobacterias en el niño12.
Suelen presentarse en niños inmunocompetentes, generalmente menores de 5 años11. El hallazgo clínico más frecuente es la aparición de una masa indolora, única en la mayor parte de los casos13, en la región submaxilar, cervical anterior o preauricular. La presencia de adenitis en otras localizaciones como axilar o inguinal, aunque rara es posible13. La piel adyacente a la lesión suele mostrar cambios de coloración, tornándose violácea con frecuencia. Generalmente no existe otra sintomatología acompañante, aunque se ha descrito la aparición de fiebre coincidiendo con la aparición de la adenopatía en un bajo porcentaje de casos11,14. Pueden encontrarse varias adenopatías en la misma cadena ganglionar, pero la afectación bilateral es muy poco frecuente (5 % aproximadamente)13.
En algunos casos pueden involucionar espontáneamente, aunque lo habitual es que presenten un curso crónico7,15, con fistulizaciones recurrentes y que curen finalmente tras un largo período presentando una cicatriz hipertrófica antiestética.
Existen muchas especies de micobacterias capaces de producir adenitis cervicales. Hasta 1970 la principal micobacteria implicada era M. scrofulaceum10. Sin embargo, actualmente M. avium representa hasta el 70-80 % de los cultivos positivos11.
El hallazgo histológico descrito en la mayor parte de las muestras es la presencia de granulomas13, aunque también pueden observarse necrosis, microabscesos y fibrosis. La aparición de bacilos ácido-alcohol resistentes se constata sólo en el 20-50 % de los casos11,16 (19,4 % de baciloscopias positivas en nuestro estudio). El Mantoux puede ser positivo en un 20-60 % de los niños según series11 (en nuestra serie el 35,6 % de los pacientes presentaba induración > 5 mm), aunque esta induración suele ser menor de 10 mm. Sin embargo, algún estudio muestra que hasta un 50 % de adenitis por micobacterias no tuberculosas pueden presentar induraciones superiores o iguales a 15 mm17. Parece por tanto existir reactividad cruzada entre el PPD-RT23 y los antígenos de otras micobacterias, por lo que debemos ser cautos a la hora de interpretar el Mantoux en estos niños11. Utilizando el test tuberculínico doble o dual skin testing se ha comprobado que la induración cutánea producida por la sensitina de M. avium es mayor que la obtenida simultáneamente con la prueba de la tuberculina PPD-RT23 en pacientes infectados por M. avium complex18. La especificidad de este test es muy elevada, pero las sensitinas son muy difíciles de conseguir y en la actualidad no se encuentran disponibles en nuestro medio.
El diagnóstico definitivo con aislamiento por cultivo no siempre es posible, y la rentabilidad del mismo varía según distintas series entre 31-88 %11, siendo positivos el 52,9 % de los cultivos obtenidos en nuestro estudio. Cuando la muestra para cultivo se obtiene por punción-aspiración la rentabilidad de la prueba es aún menor, por la escasa densidad de bacilos10.
Con las nuevas técnicas de amplificación genética en material de biopsia podemos realizar un diagnóstico precoz, permitiendo la diferenciación de M. tuberculosis del resto de las micobacterias19. Además, la realización de PCR en muestra histológica parece conseguir una mayor tasa de identificación de micobacterias que los cultivos20,21, pero esta técnica sólo está al alcance de algunos laboratorios. Por todo ello, debemos subrayar la importancia de realizar diagnóstico microbiológico en todos aquellos casos en los que se obtengan muestras para estudio histológico, ya que en algunos de nuestros casos la muestra no fue remitida para cultivo de micobacterias o realización de PCR.
El diagnóstico diferencial lo deberemos hacer principalmente con las adenitis tuberculosas11. Éstas suelen aparecer en niños mayores, acompañándose de síntomas constitucionales, son con frecuencia bilaterales y pueden afectar a cadenas cervicales posteriores, axilares o supraclaviculares. Debemos sospechar igualmente que la etiología es tuberculosa cuando observemos alteraciones en la radiografía de tórax y antecedente de contacto con enfermos tuberculosos. En ausencia de estos factores y ante una adenitis de evolución subaguda-crónica en un niño pequeño, que presente hallazgos histológicos compatibles con infección micobacteriana y/o baciloscopia positiva, podemos presumir la presencia de una micobacteria no tuberculosa10,11 e iniciar tratamiento específico.
A pesar de que la exéresis quirúrgica se considera el tratamiento de elección, el temor al daño de estructuras vasculonerviosas, especialmente a ramas del nervio facial, ha hecho que se ensayen tratamientos alternativos menos agresivos como el drenaje de la adenopatía o el tratamiento farmacológico. La baja incidencia de adenitis por micobacterias atípicas hasta esta última década no ha permitido la realización de estudios amplios que comparen la eficacia de estas opciones terapéuticas12,22.
En nuestro trabajo la exéresis quirúrgica no presentó fracasos terapéuticos. Los estudios que comparan la exéresis con otros tratamientos quirúrgicos encuentran mayor tasa de curación y menor número de recurrencias en el grupo tratado mediante exéresis15. La exéresis debe realizarse lo más precozmente posible, porque la adenitis puede fistulizar espontáneamente, dificultando la intervención y asociando mayor morbilidad quirúrgica y peor resultado estético13. La mayoría de los autores recomiendan la realización de la exéresis dentro del primer mes de evolución13,14, no sólo para favorecer la curación precoz y facilitar el acto quirúrgico, sino para permitir obtener material para estudio microbiológico e histológico10. Como hemos comprobado en nuestro estudio, en muchas ocasiones existe afectación múltiple, con adenopatías reactivas cercanas a la adenopatía principal. En estos casos, sólo se deben extraer los ganglios de mayor tamaño, los fluctuantes y los necróticos, ya que la exéresis completa no disminuye las tasas de recurrencia y aumenta la posibilidad de complicaciones11,15. Entre estas últimas, la paresia de la rama mandibular del nervio facial fue la que hallamos con mayor frecuencia, aunque en los 3 casos desapareció precozmente. La tasas de aparición de secuelas posquirúrgicas varía de unas series a otras, entre el 2-17 %15,23, si bien parece que cuando la cirugía se realiza de forma precoz la aparición de paresias faciales es menor, lo cual apoya la realización de exéresis en el primer mes de evolución.
El tratamiento médico como terapia de inicio tiene la ventaja de su instauración precoz, pero no parece claro el beneficio clínico. Además el régimen terapéutico más adecuado y la duración del mismo no están claramente definidos. Diversos autores han publicado pequeñas series de casos de pacientes tratados con antibioterapia en los que se observó una disminución de la adenitis que favoreció una exéresis posterior9,24, e incluso casos que presentaron resolución completa tras instaurar tratamiento médico24-26. Sin embargo, este hallazgo puede deberse a la evolución espontánea de algunas adenitis por micobacterias no tuberculosas25,26.
Hasta disponer de ensayos clínicos controlados que comprueben mayores ventajas de la antibioterapia sobre la exéresis, pensamos que el tratamiento farmacológico debe reservarse para los casos en los que la exéresis completa no sea posible por su localización anatómica o su extensión, aparezcan recurrencias tras cirugía, o exista negativa familiar a someterse a la intervención27.
Se recomienda la utilización de estos fármacos en politerapia, por haberse observado la aparición de resistencias rápidamente cuando se utilizan de manera aislada10,24. El régimen terapéutico más adecuado y la duración del mismo no está claramente definido. Se aconseja un tratamiento combinado con macrólidos asociados a etambutol28,29, rifabutina7,13 o ciprofloxacino9,30 durante 3 a 6 meses. Sin embargo, debemos tener en cuenta que a pesar de la infrecuente aparición de complicaciones musculoesqueléticas, el ciprofloxacino no debería ser utilizado en niños mientras se disponga de otros antimicrobianos efectivos y seguros31.
Por estos motivos consideramos que el tratamiento de elección debe ser la exéresis precoz de la adenitis. Sin embargo, existen determinadas circunstancias en las que la exéresis no es posible (negativa familiar a la cirugía; adenitis extensas con afectación bilateral o localización anatómica de difícil abordaje quirúrgico; adenitis muy evolucionadas, que presentan múltiples fistulizaciones que dificultan enormemente el acto quirúrgico). En estos casos, se puede demorar la exéresis, realizando punción del ganglio para obtener material para estudio histológico y cultivo, e iniciar posteriormente un tratamiento antibiótico en politerapia que permita disminuir el tamaño de la adenitis y favorecer una posible exéresis posterior de la misma.
Correspondencia: Dra. A. Méndez Echevarría.
Unidad de Infectología Pediátrica. Hospital Infantil la Paz.
P.º de la Castellana, 261. 28046 Madrid. España.
Correo electrónico: amendezes@yahoo.es
Recibido en enero de 2006.
Aceptado para su publicación en mayo de 2006.