No disponemos de datos poblacionales en España sobre la aplicación de la hipotermia terapéutica (HT). El objetivo fue examinar la adherencia a los estándares de manejo durante la HT de los recién nacidos (RN) con encefalopatía hipóxico-isquémica (EHI).
MétodoEstudio observacional de cohortes, multicéntrico desde el inicio de la HT (2010) en una región extensa española, hasta el año 2019.
ResultadosSe incluyeron 133 pacientes, el 72% con EHI moderada y el resto con EHI grave. En el 84% se inició hipotermia pasiva en paritorio. La HT activa comenzó a las 5h de vida (RIC: 3,3-6,3), si bien, la temperatura diana central (33-34°C) se alcanzó a una edad de 3,5h (1;6). Los nacidos extramuros iniciaron la HT activa 3,3h de media más tarde que los intramuros, pero sin diferencias en la edad a la que se alcanzó la temperatura diana.
El 96% recibió sedoanalgesia. El 100% fue monitorizado con electroencefalografía integrada por amplitud y el 59% con oximetría cerebral. La RM se realizó en el 94% con EHI moderada vs. el 65% con grave; p<0,001. Se determinó enolasa neuronal-específica en LCR en el 42% de los pacientes. La duración media del recalentamiento fue de 10h (RIC: 8-12), sin diferencias según el grado de EHI (p=0,57).
ConclusionesLa aplicación de la HT cumplió satisfactoriamente con los estándares. No obstante, se detectaron aspectos de la atención mejorables. Auditar la atención al recién nacido con EHI es crucial para conseguir programas con una alta calidad asistencial en cada región.
We do not have population data in Spain on the application of therapeutic hypothermia (TH). The objective was to examine adherence to management standards during TH of infants with hypoxic-ischemic encephalopathy (HIE).
MethodMulticenter observational cohort study from the beginning of TH (year 2010) in 5 hospitals in a Spanish region, until year 2019.
Results133 patients were recruited, 72% diagnosed with moderate HIE and the rest of them with severe HIE. In 84% of infants, passive hypothermia was started at birth. Active TH was started at a median age of 5hours of life (IQR: 3.3-6.3), although the central targeted temperature (33-34°C) was reached at a median age of 3.5hours (IQR: 1-6). Those born extramural, initiated active TH 3.3hours on average later than those born intramural, but without differences in the age at which the targeted temperature was reached.
Sedoanalgesia was used in 97%. The 100% were monitored with amplitude-integrated EEG and 59% with cerebral oxymetry. MRI was performed in 94% with moderate HIE vs. 65% with severe; P<.001. Neuron-specific enolase in cerebrospinal fluid was determined in 42%. The average duration of rewarming was median 10hours (IQR: 8-12), with no differences depending on the degree of HIE (P=.57).
ConclusionsThe implementation of TH successfully met the standards. However, aspects of care that could be improved were detected. Auditing newborn care with HIE is crucial to achieving programs with a high quality of care in each region.
En la última década, numerosas sociedades pediátricas han elaborado guías y recomendaciones para ayudar en la implementación de la hipotermia terapéutica (HT) en el recién nacido (RN) con encefalopatía hipóxico-isquémica (EHI)1–4. Sin embargo, su aplicación ha sido dispar en nuestro entorno5–9, con diferencias incluso entre las regiones de un mismo país5,10,11.
Desde que en 2011 la Sociedad Española de Neonatología (SENeo) publicase las recomendaciones para facilitar su aplicación clínica12, el número de centros en España que ofrecen HT ha venido incrementándose, si bien un estudio alertó que su aplicación era dispar entre regiones, y que existían aspectos de mejora11,13. Sin embargo, al contrario que otros países5–7,10, no existen datos poblacionales publicados en España que examinen los estándares de aplicación de esta terapia en orden a auditar la calidad asistencial de los programas14.
Realizamos un estudio observacional de cohortes multicéntrico con el propósito de examinar: 1) la adherencia a los estándares de manejo de los RN con EHI durante el tratamiento con HT desde su implantación en la región en 2010 hasta 2019, y 2) diferencias en la aplicación de la HT acorde a la gravedad de la EHI y su procedencia.
MetodologíaEstudio observacional de cohortes que incluyó consecutivamente a los RN con diagnóstico de EHI desde julio 2010 a agosto 2019 en los 5 hospitales con unidades neonatales nivel III que ofrecen HT en la Comunidad autónoma (CC. AA.) de Castilla y León, y que reciben pacientes de la misma comunidad (94.226km2; 2 408 millones de habitantes) y de la CC. AA. de La Rioja (5.045km2; 315.675 habitantes). Los 5 hospitales utilizan dispositivos servocontrolados de enfriamiento corporal total: CritiCool® System (MTRE, Yavne, Israel) en 4 centros y Tecotherm Neo (Inspiration Healthcare Ltd) en un centro. Dos hospitales iniciaron la HT en julio 2010 (Hospital Universitario de Burgos y Universitario Río Hortega de Valladolid), uno en 2012 (Hospital Clínico Universitario de Valladolid), uno en 2014 (Complejo Asistencial Universitario de León) y uno en 2015 (Hospital Clínico Universitario de Salamanca).
Todos los hospitales disponían de protocolos de actuación similares siguiendo las recomendaciones nacionales de la SENeo12; y 4 de los 5 participaron en un programa asistencial dirigido a identificar y monitorizar al RN con EHI en las primeras horas de vida15,16.
La graduación de la gravedad de la encefalopatía se realizó en las primeras 6h de vida siguiendo las escalas de García-Alix et al. en 4 centros y Sarnat en otro centro17,18. Se definió EHI moderada-grave perinatal al RN que presentó alteración de la conciencia (letargia, estupor o coma) después de un parto con antecedentes sugestivos de agresión hipóxico-isquémica perinatal. Esta fue definida por al menos uno de los siguientes: 1) pH de cordón o a la hora de vida ≤7,00; 2) Apgar a los 5min ≤5, y/o 3) necesidad de reanimación con ventilación con presión positiva intermitente más de 5min, intubación con/sin masaje cardiaco.
El traslado del RN con EHI se realizó a través de un transporte no especializado en el paciente pediátrico en el que participa un médico, una enfermera y un técnico.
Una parte del registro de pacientes se realizó de forma prospectiva dentro del programa de identificación precoz señalado anteriormente. En el resto, la información se recogió de forma retrospectiva a partir de las historias clínicas, incluyendo: edad de inicio, duración y complicaciones del tratamiento con HT, neuromonitorización y pruebas de neuroimagen, uso de sedoanalgesia, soporte respiratorio, nutrición, uso de antibióticos, afectación multiorgánica y desenlace vital neonatal.
Los trazados de electroencefalografía integrada por amplitud (aEEG) se categorizaron siguiendo la clasificación de patrones19.
Análisis estadísticoLos datos descriptivos son expresados como porcentajes en las variables cualitativas, y de tendencia central y dispersión en las variables cuantitativas. Para la comparación de grupos se utilizaron la prueba de χ2 y la t de Student o sus correspondientes pruebas no paramétricas (test de Wilcoxon o la U de Mann-Whitney) cuando las distribuciones no cumplían la normalidad. Se consideró estadísticamente significativa una p<0,05. El programa utilizado para el análisis estadístico fue SPSS® Stadistics v.20.
La realización de este estudio fue aprobada por el comité de investigación y ética del hospital coordinador (CEIC 2298).
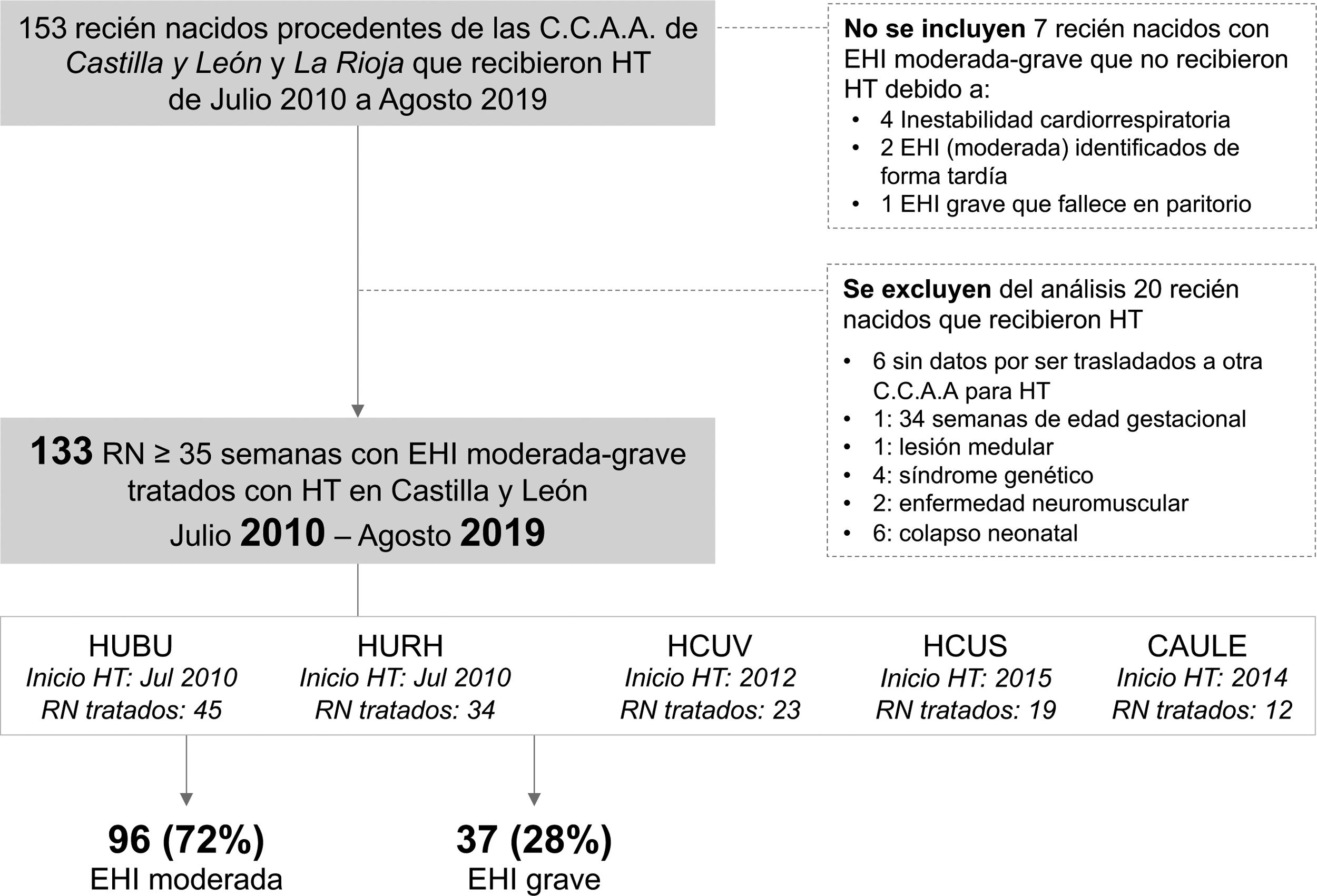
ResultadosDurante el periodo de estudio, 153 RN recibieron HT; 7 RN no se incluyeron por no recibir HT. En el análisis de este estudio se excluyeron 14 RN que recibieron HT en el contexto de otra enfermedad de base, y a 6 RN que recibieron HT en otra CC. AA. (fig. 1).
Algoritmo de inclusión y exclusión de los pacientes incluidos en el estudio
CAULE: Complejo Asistencial Universitario de León; HCUS: Hospital Clínico Universitario de Salamanca; HCUV: Hospital Clínico Universitario de Valladolid; HUBU: Hospital Universitario de Burgos; HURH: Hospital Universitario Río Hortega de Valladolid.
De los 133 RN incluidos, 96 RN (72%) se diagnosticaron de EHI moderada y 37 RN (28%) de EHI grave. Aquellos con EHI grave tuvieron datos perinatales de mayor gravedad, así como mayor frecuencia de crisis, aEEG patológico y afectación multiorgánica (p<0,001). Veintidós de los 28 RN (79%) fallecidos tuvieron EHI grave, y de ellos, el 86% lo hicieron en el contexto de decisiones de adecuación del esfuerzo terapéutico (tablas 1 y 2).
Características perinatales de la cohorte de estudio
| TotalN=133 | EHI moderadaN=96 | EHI graveN=37 | Valor de p | |
|---|---|---|---|---|
| Extramuros | 57/133 (43) | 37/96 (39) | 20/37 (54) | 0,105 |
| Sexo, varón | 81/133 (61) | 62/96 (65) | 19/37 (51) | 0,161 |
| Edad gestacional, semanas | 39 (37-40) | 39 (37-40) | 39 (37-40) | 0,467 |
| Peso nacimiento, gramos | 3.117 (2.675-3.460) | 3.200 (2.700-3.500) | 3.030 (2.500-3.275) | 0,036 |
| Parto eutócico | 18/133 (14) | 16/96 (17) | 2/37 (5) | 0,089 |
| Presentación cefálica | 118/125 (94) | 87/92 (95) | 31/33 (94) | 1,000 |
| Evento centinela | 58/131 (44) | 39/94 (41) | 19/37 (51) | 0,306 |
| Apgar 1mina | 2 (1-3) | 2 (1-3) | 0 (0-1) | 0,000 |
| Apgar 5minb | 4 (2-6) | 5 (3-6) | 2 (0-4) | 0,000 |
| Apgar 10minc | 5 (4-7) | 6 (5-8) | 3 (2-4) | 0,000 |
| pH cordónd | 6,97 (6,80-7,18) | 7,02 (6,87-7,20) | 6,8 (6,79-6,99) | 0,001 |
| Reanimación avanzada | 102/133 (77) | 67/96 (70) | 35/37 (95) | 0,002 |
Las variables categóricas se expresan en n/N (%) y las variables continuas en mediana (rango intercuartil).
EHI: encefalopatía hipóxico-isquémica; Reanimación avanzada: intubación y/o masaje cardiaco y/o fármacos.
No se dispuso de datos de 1a, 1b, 27c y 31d pacientes.
Características de la afectación neurológica y sistémica de la cohorte de estudio
| TotalN=133 | EHI moderadaN=96 | EHI graveN=37 | Valor de p | |
|---|---|---|---|---|
| Trazado aEEG patológicoa | 116/133 (87) | 79/96 (82) | 37/37 (100) | 0,000 |
| Pre-inicio de hipotermia | 82/120 (68) | 49/87 (56) | 33/33 (100) | 0,000 |
| Durante la hipotermia | 114/133 (96) | 78/96 (81) | 36/37 (97) | 0,000 |
| Crisis clínico y/o eléctricas | 50/133 (38) | 22/96 (23) | 28/37 (76) | 0,000 |
| Pre-inicio de hipotermia | 29/133 (22) | 14/96 (15) | 15/37 (41) | 0,001 |
| Durante la hipotermia | 38/133 (29) | 16/96 (17) | 22/37 (59) | 0,000 |
| Afectación pulmonar | 81/133 (61) | 52/96 (54) | 29/37 (78) | 0,010 |
| Hipertensión pulmonar con uso de óxido nítrico | 18/133 (14) | 12/96 (13) | 6/37 (16) | 0,575 |
| Ventilación mecánica | 126/133 (95) | 89/96 (93) | 37/37 (100) | 0,190 |
| Uso de fármacos inotrópicos | 100/133 (75) | 66/96 (69) | 34/37 (92) | 0,006 |
| Afectación renal | 20/133 (15) | 10/96 (10) | 10/37 (27) | 0,016 |
| Afectación hepática | 87/133 (65) | 58/96 (60) | 29/37 (78) | 0,051 |
| Coagulopatía | 61/133 (46) | 32/96 (33) | 29/37 (78) | 0,000 |
| Trombocitopenia | 27/133 (20) | 17/96 (18) | 10/37 (27) | 0,231 |
| Afectación gastrointestinal | 16/133 (12) | 8/96 (8) | 8/37 (22) | 0,070 |
| Sepsis | 6/133 (5) | 5/96 (5) | 1/37 (3) | 1,000 |
| Fallecimiento | 28/133 (21) | 6/96 (6) | 22/37 (59) | 0,000 |
| Edad fallecimiento, h | 38 (20,5-87,5) | 61 (24-227) | 34 (19-85,75) | 0,372 |
| Adecuación esfuerzo terapéutico | 20/27 (74) | 2/6 (33) | 18/21 (86) | 0,024 |
Las variables categóricas se expresan en n/N (%) y las variables continuas en mediana (rango intercuartil).
Definiciones: Afectación pulmonar: necesidad de O2 suplementario y/o hipertensión pulmonar y/o utilización de óxido nítrico. Afectación renal: creatinina >1,5mg/dl. Afectación hepática: hipertransaminasemia AST y/o ALT>100U/l. Afectación gastrointestinal: hemorragia y/o enterocolitis necrotizante. Coagulopatía: parámetros de coagulación alterados que requiere trasfusión de plasma fresco congelado y/o factores de coagulación. EHI: encefalopatía hipóxico-isquémica; Plaquetopenia: plaquetopenia que requiere trasfusión de plaquetas. Sepsis: infección con hemocultivo positivo.
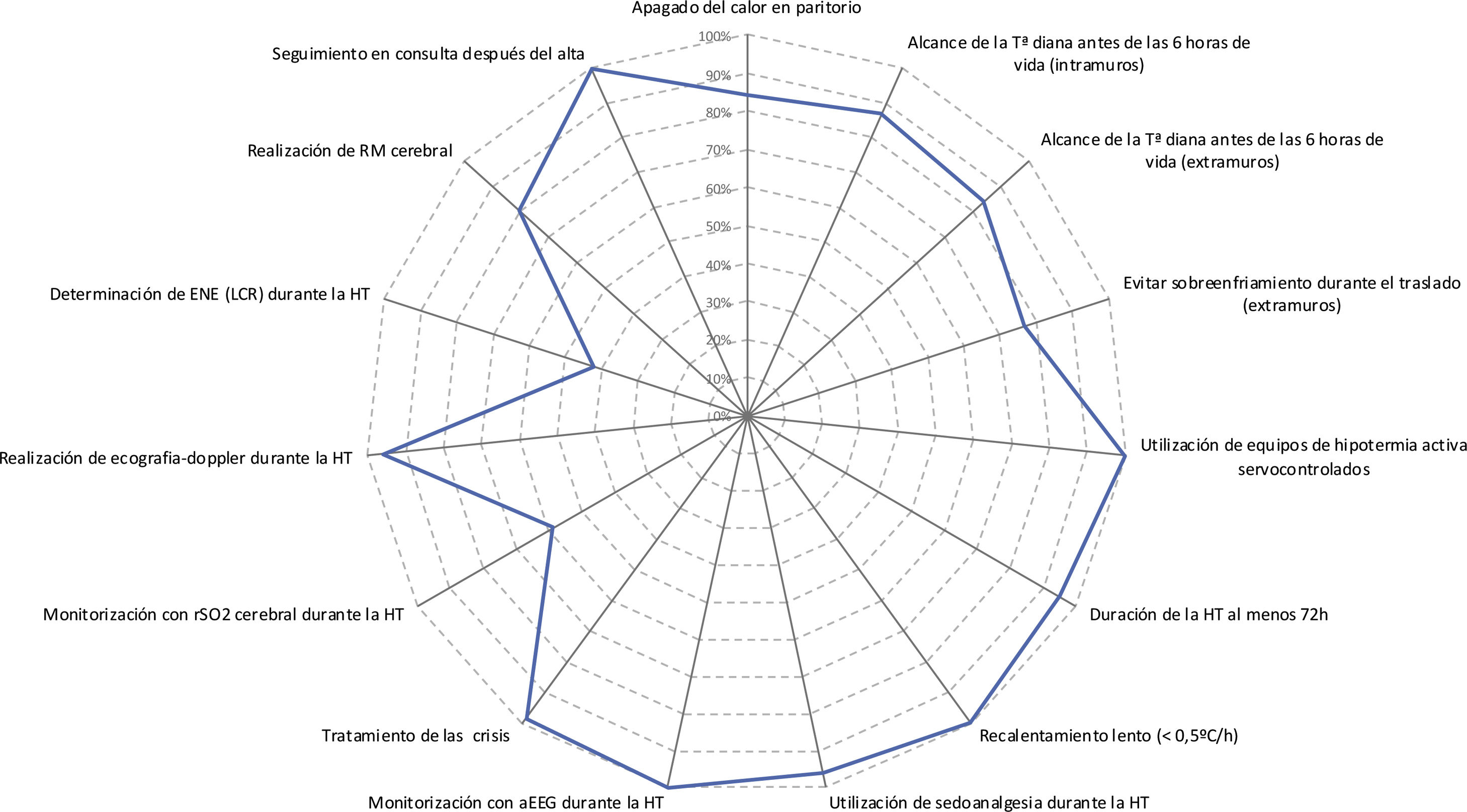
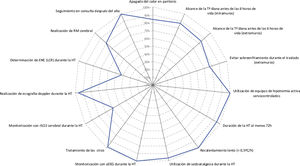
En la figura 3 se resume la adherencia de los principales aspectos del manejo recogidos en este estudio acorde a la guía de recomendaciones de la SENeo. Se hace referencia, además, a 2 aspectos que no se recogen en dicha guía: la monitorización con saturación de O2 cerebral (rScO2) y la determinación de enolasa neuronal específica (ENE) en LCR.
Características del manejo de los pacientes tratados con hipotermia incluidos en el estudio acorde a la guía de recomendaciones de la SENeo, de forma conjunta (A) y estratificado por hospital (B)
aEEG: electroencefalograma integrado por amplitud; Eco-doppler: ecografía doppler cerebral; ENE en LCR: enolasa neuronal específica determinada en líquido cefalorraquídeo; HT: hipotermia terapéutica; rSO2 cerebral: saturación regional de oxígeno cerebral.
En las características de «duración al menos 72h» y «duración del recalentamiento al menos 8h» no se incluyen los pacientes fallecidos antes de las 72h de vida, al igual que tampoco se incluyen los fallecidos en el «seguimiento en consulta».
En el 84% de los RN se apagó el lecho de calor radiante en paritorio. La edad de inicio de la hipotermia corporal total servocontrolada (HT activa) fue de 5h de vida (rango intercuartil [RIC]: 3,3-6,3), con una mediana de 4h (RIC: 1-6) en aquellos con EHI grave vs. 5h (RIC: 4-7) en los RN con EHI moderada (p=0,018). Sin embargo, la temperatura diana central (33-34°C) se alcanzó a una edad de 3,5h (RIC: 1-6), ya que el 72 y 56% de los RN con EHI grave y moderada, respectivamente, alcanzaron la temperatura diana con las medidas pasivas iniciales, antes de iniciar la HT activa (tabla 3).
Variables relacionadas con la aplicación del tratamiento con hipotermia
| TotalN=133 | EHI moderadaN=96 | EHI graveN=37 | Valor de p | |
|---|---|---|---|---|
| Apagado de calor en paritorio | 97/115 (84) | 70/82 (85) | 27/33 (82) | 0,636 |
| Alcance de la temperatura central diana (33-34°C) con hipotermia pasiva | 79/131 (60) | 53/95 (56) | 26/36 (72) | 0,086 |
| Inicio de hipotermia activa, hdv | 5 (3,3-6,3) | 5 (4-7) | 4 (1-6) | 0,018 |
| Duración del recalentamiento, h | 10 (8-12) | 9,5 (8-12) | 10 (8-10,5) | 0,567 |
| Temperatura de llegada al hospital receptor (extramuros), °C | 33 (33-34,5) | 34 (33-34,6) | 33 (32,8-34) | 0,036 |
| Modificación de la temperatura diana | 27/133 (20) | 14/96 (15) | 13/37 (35) | 0,008 |
| 2ario a hipertensión pulmonar | 5/133 (4) | 5/96 (5) | 0/37 (0) | |
| 2ario a coagulopatía refractaria | 4/133 (3) | 3/96 (3) | 1/37 (3) | |
| 2ario a shock hemodinámico | 6/133 (5) | 3/96 (3) | 3/37 (8) | |
| 2ario a varios de los anteriores | 12/133 (9) | 3/96 (3) | 9/37 (24) | |
| Retirada de la HT antes de las 72 hdv | 8/133 (6) | 7/96 (7) | 1/37 (3) | 0,442 |
| Sedación | 128/133 (96) | 95/96 (99) | 33/37 (89) | 0,021 |
| Bolos | 7/133 (5) | 5/96 (5) | 2/37 (5) | |
| Perfusión | 62/133 (47) | 42/96 (44) | 20/37 (54) | |
| Perfusión y bolos | 59/133 (44) | 48/96 (50) | 11/37 (30) | |
| Fármacos | ||||
| Fentanilo | 54/133 (41) | 38/96 (40) | 16/37(43) | 0,368 |
| Mórfico | 1/133 (1) | 1/96 (1) | 0/37 (0) | |
| Fentanilo y mórfico | 3/133 (2) | 1/96 (1) | 2/37 (5) | |
| Fentanilo y/o mórfico+midazolam | 70/133 (53) | 55/96 (57) | 15/37 (41) | |
| Nutrición parenteral | 81/133 (61) | 64/96 (67) | 17/37 (46) | 0,028 |
| Nutrición enteral | 13/133 (10) | 12/96 (13) | 1/37 (3) | 0,111 |
| Uso de antibióticos | 132/133 (99) | 95/96 (99) | 37/37 (100) | 1,000 |
Las variables categóricas se expresan en n (%) y las continuas en mediana (rango intercuartil).
EHI: encefalopatía hipóxico-isquémica; hdv: horas de vida; HT: hipotermia terapéutica activa.
El 57% de los pacientes nació en uno de los hospitales con HT (intramuros), iniciándose en estos la HT activa de forma más precoz que en los nacidos extramuros: mediana de 4h de vida (RIC: 2-5) vs. 6h (RIC: 5-8); p<0,001. Ajustando por la gravedad de la EHI, los RN nacidos extramuros iniciaron la HT activa 3,3h más tarde de media (IC 95%: 2,5-4,1) que los intramuros. Sin embargo, no hubo diferencias entre extramuros e intramuros en la mediana de edad a la que alcanzaron la temperatura central diana: 3h de vida (RIC: 1-5) vs. 4h de vida (RIC: 1-6); p=0,21, respectivamente.
Treinta y tres pacientes nacieron extramuros y requirieron traslado. La temperatura central a la llegada al hospital receptor en los que tuvieron EHI grave fue de 33°C de mediana (RIC: 32,8-34) vs. 34°C (RIC: 33-34,7) en los que tenían EHI moderada; p=0,04. El sobreenfriamiento (temperatura <33°C) fue más frecuente en aquellos con EHI grave vs. aquellos con EHI moderada: 6/19 (32%) vs. 7/37 (19%); p=0,33.
Duración del tratamiento y complicacionesEl tratamiento con HT se completó en 125 (94%) de los pacientes, y el recalentamiento duró 10h de mediana (RIC: 8-12), sin diferencias según el grado de EHI; p=0,57. En 27 (20%) de los 133 pacientes fue preciso incrementar la temperatura diana por hipertensión pulmonar, coagulopatía, y/o shock hemodinámico graves; con mayor frecuencia en los RN con EHI grave; p=0,008. De ellos, se llegó a retirar completamente la HT en 8 de los 27 RN antes de cumplir las 72h (tabla 3).
Dos niños tuvieron necrosis grasa subcutánea. Se utilizó antibioterapia en todos menos en un RN, incluyendose un aminoglucósido como parte del tratamiento en 114 (86%). Seis pacientes (5%) presentaron sepsis precoz con hemocultivo positivo. Durante la HT, el 61% de los RN recibieron nutrición parenteral, y el 10% enteral (11/13 con enteral trófica).
Utilización de sedoanalgesiaEl 96% de los pacientes recibió sedoanalgesia; el 47% en perfusión. La sedación más utilizada fue la combinación de opiáceo y midazolam en el 53%, seguido de fentanilo en monoterapia (41%). De los 5 niños que no recibieron sedoanalgesia, cuatro tuvieron EHI grave (coma). Todos los pacientes menos uno (127/128) precisaron soporte respiratorio, de los cuáles 121 (94%) tuvieron ventilación mecánica (tabla 3).
Estudios complementarios para evaluar la afectación neurológicaTodos los pacientes fueron monitorizados con aEEG y el 72% con rScO2. La RM se realizó en el 80% de los pacientes; en el 94% de los que tuvieron EHI moderada y en el 46% de los RN con EHI grave; p<0,001. La mediana de edad de realización fue de 11 días (RIC: 8-15). De los 22 con EHI grave que fallecieron, solo en 3 se realizó RM.
En el 42% de los RN se determinó ENE en LCR durante la HT, estando el resultado disponible antes de las 24h solo en 7 de los 56 pacientes.
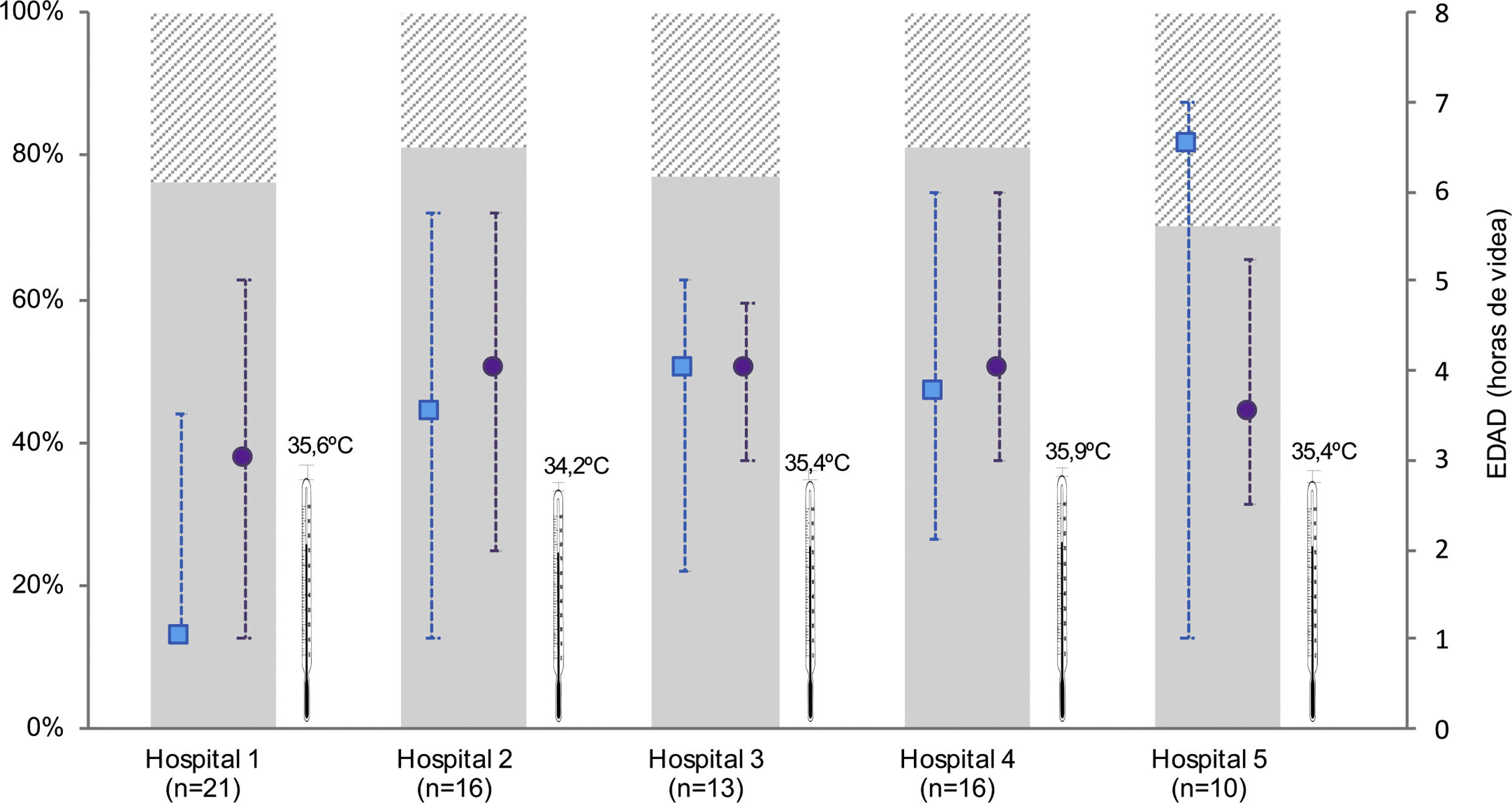
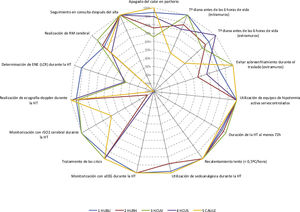
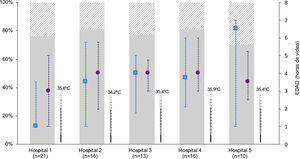
Diferencias entre los hospitales participantes en el estudioEl número de RN tratados fue diferente entre los hospitales (tablas suplementarias 1 y 2). Aunque no encontramos diferencias en la edad de inicio de la HT activa, la mediana de edad a la que se alcanzó la temperatura central diana, varió entre 1h de vida (RIC: 1-4) en el HUBU y 6,5h (RIC: 1,3-7) en el CAULE; p=0,001. En este último, la mayoría de los pacientes alcanzó la temperatura diana una vez iniciado el enfriamiento activo (69%). Por el contrario, en el HUBU, el 77% de los RN alcanzaron la temperatura diana con medidas pasivas, antes de iniciar la HT activa (fig. 2, tabla suplementaria 2). Al considerar los estudios complementarios encontramos variabilidad entre centros en la utilización de la rScO2 y en la determinación de ENE (fig. 3, tabla suplementaria 2).
Características del inicio de la hipotermia de los pacientes intramuros estratificados por hospital.
En la figura se muestran solo los pacientes intramuros, para evitar el sesgo de la distribución asimétrica de intramuros-extramuros entre hospitales. Se representa la temperatura al ingreso (mediana) en la unidad neonatal una vez se traslada al recién nacido de paritorio (símbolo termómetro), la edad (mediana, rango intercuartílico) a la que se alcanza la temperatura diana central de 33-34°C (símbolo cuadrado azul), y a la edad a la que se inicia la hipotermia activa (símbolo círculo morado). Las barras representan la distribución de los RN en EHI moderada (gris sólido) y grave (gris rallado). Hospitales: 1 (HUBU), 2 (HURH), 3 (HCUV), 4 (HCUS), 5 (CAULE).
Por primera vez se ofrecen datos poblacionales en España respecto a la adherencia a los estándares clínicos en el tratamiento con HT del RN con EHI. Se ofrecen, además, datos no bien reflejados en otras series, acerca de las características de los RN según la gravedad de la EHI moderada o grave.
Este estudio multicéntrico muestra que un elevado porcentaje de RN con EHI moderada-grave recibe HT, reflejando un acceso muy satisfactorio a esta terapia en esta región. Es probable que estos buenos datos, que mejoran el 86% referido en un estudio realizado en España para el periodo 2012-2013, estén en relación con la existencia de un programa en nuestra región dirigido a mejorar la identificación de los RN candidatos a recibir HT15,16. Desconocemos si existen otros programas similares en nuestro país, pero su difusión puede favorecer la homogeneización de la atención que reciben estos RN14,20.
Alcanzar la temperatura diana antes de las 6h de vidaUn aspecto relevante de este estudio es la temprana edad a la que se alcanzó la temperatura diana de 33-34°C. Una mediana de 3,5h es inferior a la referida en los primeros ensayos clínicos y en otras series publicadas en los que la temperatura diana se alcanzó mayoritariamente después de las 4h de vida5,7,21–23. Esta precocidad, reiteradamente demandada como una estrategia potencial para mejorar los resultados de la HT, está favorecida por el programa de detección precoz de EHI en nuestro ámbito14,22,24.
El inicio de las medidas de enfriamiento ya en la sala de partos fue universal y acorde a las recomendaciones internacionales ILCOR25. Ello, junto con el inicio de medidas pasivas de enfriamiento en el hospital emisor y durante el transporte, explica que los pacientes nacidos extramuros alcanzasen la temperatura diana a una edad similar a los nacidos intramuros, a pesar de que la HT activa se iniciase en el hospital receptor más tarde23. Es necesario, sin embargo, un control estricto de la temperatura, como muestra el hecho que el 23% de los RN trasladados llegasen con sobreenfriamiento a pesar de existir un protocolo de recomendaciones para el transporte15. En la mayoría de las regiones españolas existen deficiencias tanto en la disponibilidad de un equipo de transporte neonatal especializado, así como de sistemas de enfriamiento servocontrolados para el traslado26.
Las recomendaciones internacionales, incluyendo la SENeo, recuerdan la importancia de hacer un recalentamiento lento cuando se necesite volver a la normotermia o al finalizar las 72h regladas de HT12. Nuestro estudio mostró que el recalentamiento es realizado lentamente, cumpliendo ampliamente con la recomendación de realizarlo a una velocidad inferior o igual a 0,5°C a la hora12,25.
Sedación y neuromonitorización continuaLa adherencia a los estándares establecidos fue muy satisfactoria en la utilización de la sedación y la neuromonitorización.
La sedoanalgesia fue utilizada en prácticamente todos los pacientes, y la gran mayoría precisó ventilación mecánica. Aunque en un porcentaje alto de los casos la necesidad del soporte respiratorio viene determinado por su enfermedad de base, la necesidad de intubación fue señalado en la encuesta nacional como el inconveniente de ofrecer sedación a estos pacientes, por lo que solo un 70% de centros refirieron utilizarla de forma habitual13. Un aspecto a resolver, por lo tanto, es qué fármaco o qué combinación de ellos sería la más adecuada acorde a su farmacocinética en HT, con el objetivo de minimizar el disconfort evitando la depresión respiratoria27.
Por otro lado, la neuromonitorización fue ampliamente utilizada, principalmente el aEEG y, en menor grado, la rScO2. Aunque no existen recomendaciones firmes sobre la monitorización necesaria para el adecuado manejo de estos pacientes, en el caso del aEEG existe amplia evidencia de su utilidad para apoyar a la identificación de los pacientes con EHI, detectar crisis epilépticas, y establecer el pronóstico en los primeros 3 días de vida28,29. La utilidad de la rScO2 en la EHI está aún por establecer, si bien existe creciente evidencia de que aporta información valiosa sobre el balance de aporte y demanda de oxígeno cerebral y sobre el estado y evolución hemodinámica30,31.
Estudios complementarios para establecer la extensión del daño neurológicoLa RM aporta información objetiva sobre la gravedad del daño y posee un gran valor pronóstico32. Disponer de esta información es especialmente relevante en el marco temporal de los primeros días de vida, cuando pueden considerarse decisiones de redirección del cuidado curativo al paliativo en los pacientes más graves33. Aunque la realización de RM fue universal en los pacientes que sobrevivieron, solo fue realizada en 3 de los 22 pacientes con EHI grave que fallecieron. Dado que en la mayoría de estos pacientes (86%) hubo redirección de los cuidados, es claro que el estudio de RM no fue incluido mayoritariamente en el proceso de toma de decisiones. Este es un aspecto de mejora, así como considerar en este contexto la determinación de marcadores neurobioquímicos de daño como la ENE en LCR34. Ambas herramientas son particularmente útiles en situaciones de incertidumbre pronóstica al no verse modificadas por la medicación sedante, como sí puede ocurrir con la clínica, el aEEG o la rScO2. Tienen como inconvenientes el traslado a la sala de radiología o la realización de una punción lumbar en pacientes graves e inestables, así como las limitaciones en muchos hospitales para disponer del resultado en el marco temporal adecuado13.
Nutrición enteral, antibioterapia y vínculo familiar en hipotermia terapéuticaEn nuestra serie, la nutrición enteral solo se utilizó en el 10% de los pacientes, hecho que contrasta con otros grupos35. Sin embargo, la evidencia disponible de cómo administrarla y en qué casos es escasa, aunque parece ser segura, y podría ayudar a adelantar la alimentación oral exclusiva y reducir el tiempo de estancia35.
La antibioterapia empírica se utilizó de forma universal en estos pacientes por el mayor riesgo de sepsis precoz36. Esta actitud es controvertida frente a la opción de monitorizar los parámetros analíticos e iniciar antibioterapia cuando existan indicios de sepsis, pero ha de tenerse en cuenta que aquellos pueden modificarse por la propia asfixia37. Por otro lado, el alto uso de aminoglucósidos es preocupante por cuanto estos han de utilizarse con cautela por el particular riesgo de toxicidad en los RN en HT38.
Solo el 6% los padres tuvieron a sus hijos en brazos durante el tratamiento. Se ha descrito estrés y sufrimiento en las familias de los RN que reciben HT, miedo a acercarse a ellos y a participar en sus cuidados39. Sin embargo, cuando los padres proporcionan cuidados básicos y de consuelo al RN con HT, experimentan bienestar, se sienten conectados con su hijo e incrementa su rol maternal-parental, siendo una práctica potencialmente segura39,40.
Nuestro estudio presenta algunas limitaciones. Una de ellas es su naturaleza ambispectiva que condiciona incertidumbre sobre la precisión de los datos registrados en las historias clínicas. Así mismo, la experiencia entre centros en la graduación de la EHI pudo no ser del todo homogénea16, si bien creemos que la existencia de un programa dirigido a la identificación de EHI minimiza este sesgo potencial, y es una de las fortalezas del estudio.
ConclusiónEste estudio pone de manifiesto una magnífica accesibilidad a la HT en esta región española y la precocidad en alcanzar la temperatura diana. También muestra que la aplicación de la HT es acorde a los estándares establecidos. Potenciales aspectos de mejora en nuestro entorno son: a) reducir las diferencias entre centros en la edad a la que se alcanza la temperatura diana; b) en aquellos con EHI grave, implementar el estudio de RM y de biomarcadores de daño en el intervalo temporal de la toma de decisiones sobre redirección del cuidado; c) reducir la utilización de aminoglucósidos, y d) mejorar la integración de la familia en los cuidados del RN con EHI en HT. Estudios similares que auditan la atención al RN con EHI son claves para detectar aspectos de mejora asistencial y conseguir programas con una alta calidad asistencial en cada región.
Agradecemos a Dña. Sara Calvo (Fundación Burgos por la Investigación de la Salud) por el soporte estadístico.
Inés Esteban. Departamento de Pediatría (Neonatología), Hospital San Pedro de Logroño, Logroño, España. Correo electrónico: iesteban@riojasalud.es
María del Pilar Jiménez. Departamento de Pediatría (Neonatología), Complejo Asistencial de Ávila, Ávila, España. Correo electrónico: mjimenezsau@saludcastillayleon.es
Marisa Serrano. Departamento de Pediatría, Complejo Asistencial de Soria, Soria, España. Correo electrónico: apenabu@saludcastillayleon.es
Natalio Hernández. Departamento de Pediatría (Neonatología), Complejo Asistencial de Zamora, Zamora, España. Correo electrónico: nhernandezg@saludcastillayleon.es
Myriam Hortelano. Departamento de Pediatría (Neonatología), Complejo Asistencial de Segovia, Segovia, España. Correo electrónico: mhortelano@saludcastillayleon.es
Maria Teresa Prada. Departamento de Pediatría, Hospital El Bierzo, Ponferrada, España. Correo electrónico: tprada@saludcastillayleon.es
Florentino Barbadillo. Departamento de Pediatría, Hospital Santos Reyes, Aranda de Duero, Burgos, España. Correo electrónico: sschuffelmann@saludcastillayleon.es
Pablo Diego Gayte. Departamento de Pediatría, Hospital Santiago Apóstol, Miranda de Ebro, Burgos, España. Correo electrónico: pdiego@saludcastillayleon.es