Gracias a las medidas de prevención de la transmission perinatal del virus de la inmunodeficiencia humana (VIH), la tasa de transmisión vertical actual se sitúa en torno al 1%. Los fármacos antirretrovirales usados no están exentos de efectos adversos, el más observado de los cuales es el efecto mielosupresor de la zidovudina (AZT). En este estudio pretendemos analizar la prevalencia de la anemia y la neutropenia en una cohorte de niños no infectados hijos de madres positivas para el virus de la inmunodeficiencia humana (VIH).
Material y métodosSe analizaron según protocolo estandarizado 623 niños no infectados controlados prospectivamente en la cohorte FIPSE (Fundación para la Investigación y la Prevención del Sida en España), que agrupa a 8 hospitales de la Comunidad de Madrid, así como las características y el tratamiento de las madres positivas para el VIH. Se definieron la anemia y la neutropenia según las tablas de toxicidad de los ACTG (AIDS Clinical Trails Group). Se clasificó a los niños según prematuridad, peso, origen étnico, presencia de syndrome de abstinencia y tratamiento recibido intraútero y como profilaxis en las primeras 4-6 semanas de vida. Se compararon las variables categóricas usando el test de chi al cuadrado o el test exacto de Fisher.
ResultadosUn total de 188 niños (30,1 %) presentaron anemia, y 161 (25,8 %) tuvieron anemia de toxicidad de grado 2 o superior. La prematuridad (p<0,001), el bajo peso al nacer (p=0,005) y el tratamiento antirretroviral de gran actividad (TARGA) con inhibidores de la proteasa (p=0,016) se asociaron con una mayor proporción de anemia. Las cifras de hemoglobina alcanzaron un nadir a las 6 semanas y se normalizaron en torno a los 6 meses. La prevalencia de neutropenia fue del 41,9 % (261 niños), y la de neutropenia moderada-grave fue del 22,7 %. La prematuridad (p=0,01) se asoció con riesgo de neutropenia y el bajo peso influyó en la proporción de lactantes con neutropenia moderada-grave (p=0,023). Existe una tendencia a una mayor proporción de neutropenia en los lactantes subsaharianos (el 50 % frente al 44 %), aunque esto no fue estadísticamente significativo (p=0,12). El tipo de tratamiento recibido intraútero no influyó en el desarrollo de neutropenia. El 12,5 % de los lactantes aún presentaron neutropenia a los 18 meses de vida. El desarrollo de citopenias no se asoció con el tipo de profilaxis recibida (monoterapia, doble terapia o triple terapia).
ConclusiónEn nuestra serie de hijos de madres positivas para el VIH, expuestos a antirretrovirales intraútero, la proporción de casos de anemia es elevada, del 30,1 %. La prematuridad, el bajo peso al nacer y el TARGA se asociaron con una mayor proporción de anemia, que es transitoria y clínicamente poco relevante. La tasa de niños con neutropenia fue mayor (41,9 %), y se asocia con prematuridad, bajo peso y origen subsahariano. El tipo de profilaxis de la transmisión vertical empleada en los neonatos no parece influir en el desarrollo de anemia ni de neutropenia. Se observó la persistencia de la neutropenia a los 18 meses de edad, sin relevancia clínica, en un pequeño porcentaje de los niños (12,5%)
Mother-to-child HIV transmission is currently around 1% in western countries, due to prevention measures. Antiretroviral drugs do have adverse effects, anaemia and myelosupression caused by AZT being the most observed effects. In the present study, we analyse the prevalence of anaemia and neutropenia in an uninfected children cohort born to HIV-infected women.
Material and methodsWe followed up 623 uninfected children belonging to the FIPSE cohort according to standardised protocols. This cohort groups 8 hospitals from Madrid and follows up HIV infected pregnant women and their children. Anaemia and neutropenia were defined according to the ACTG (AIDS Clinical Trails Group) toxicity tables. Children were classified according to prematurity, ethnic origin, birth weight, withdrawal syndrome, in-utero treatment and neonatal prophylaxis. Categorical variables were compared with the χ2 or the Fisher tests.
ResultsAnaemia was observed in 188 (30.1 %) children during follow-up and 161 (25.8 %) had anaemia grade 2 or higher. Prematurity (p<0.001), low birth weight (p=0.005) and Highly Active Antiretroviral Treatment (HAART) with Protease Inhibitors (p=0.016) were associated with higher percentages of anaemia in children. Nadir haemoglobin values were reached by 6 weeks of life and anaemia was transient and disappeared by six months of age. Neutropenia was present in 41.9 % (261 children) and 22.7% of the children had moderate-severe neutropenia. Prematurity was again associated with neutropenia (p=0.01) and low birth weigh was associated only with moderatesevere neutropenia (p=0.023). African infants had a higher percentage of neutropenia than the rest of the children (50 % vs. 44 %), although the differences were not significant. The type of in-utero treatment did not appear to influence the neutropenia. Neutropenia was still present in 12.5 % of infants at 18 months of age. The type of neonatal prophylaxis to prevent mother-to-child transmission (monotherapy, dual therapy or triple therapy) did not influence either cytopenia.
ConclusionIn our series, the proportion of children with anaemia is high: 30.1 % Prematurity, low birth weight and HAART with IP were associated with a higher proportion of anaemia, which was transient and had little clinical relevance. The proportion of children with neutropenia was higher (41.9 %) and was associated with prematurity, low birth weight and African origin. The type of neonatal prophylaxis does not seem to influence the development of cytopenias. Persistence of neutropenia (without clinical significance) was observed in a small percentage of the children 12.5 %, at 18 months of age.
La transmisión vertical del virus de la inmunodeficiencia humana tipo 1 (VIH-1) de madre a hijo puede prevenirse en la mayoría de los casos mediante el empleo de un tratamiento antirretroviral (TAR) en la gestante, el empleo de zidovudina (AZT) durante el parto, la realización de una cesárea programada y el tratamiento del recién nacido con uno, dos o tres fármacos antirretrovirales1. El empleo de estas medidas, incluyendo el uso de tres o más fármacos durante la gestación (tratamiento antirretroviral de gran actividad [TARGA]) en los países desarrollados, ha logrado una cifra de transmisión vertical cercana al 1 %1–4. La eficacia del AZT en la prevención de la transmisión vertical ha quedado demostrada5–9, y su tolerancia a corto y medio plazo se considera adecuada10, aunque se ha asociado con anemia transitoria de leve a moderada, tanto en la gestante como en el recién nacido11–18, así como con neutropenia15,17,18, pero se desconocen aún los efectos adversos a largo plazo. Algunos fármacos análogos de nucleósidos, como AZT, son mutagénicos in vitro15,17 y también se ha comprobado que el AZT es mielosupresor in vitro de las líneas celulares hematopoyéticas19 y que, intraútero, se incorpora al ADN de los leucocitos del feto20, aunque se desconoce la persistencia, y su significado biológico no está claro. Por otro lado, la infección por el VIH en la gestante puede afectar a los precursores hematopoyéticos fetales y potenciar el efecto mielosupresor del AZT10,14,15. El TARGA es el tratamiento indicado actualmente en la gestante7–9 y puede emplearse o no un inhibidor de la proteasa (IP). Aún existen pocos datos sobre los efectos adversos en el niño no infectado, hijo de madre positiva para el VIH que recibe TARGA durante la gestación, pero existen estudios con resultados variables que asocian el TARGA con la prematuridad21,22. Asimismo, y además de los fármacos que recibe intraútero, el recién nacido no infectado está expuesto a la profilaxis que recibirá durante 4 o 6 semanas para reducir el riesgo de transmisión perinatal, con monoterapia con AZT, doble terapia o triple terapia según el riesgo de transmisión6–10.
Desde la implementación de estos tratamientos combinados, tanto durante la gestación como durante el período neonatal, existe preocupación sobre los efectos adversos en el recién nacido y en el lactante. En el presente estudio se pretende analizar la prevalencia de efectos adversos hematológicos en niños, no infectados, hijos de gestantes seropositivas, que han recibido TAR intraútero (AZT exclusivamente, doble terapia o TARGA) y durante el período neonatal con monoterapia, doble terapia o triple terapia.
MATERIAL Y MÉTODOSPoblación de estudio. La base FIPSEEn el año 2000 se inició el proyecto FIPSE 3699 (Fundación para la Investigación y la Prevención del Sida en España, Proyecto 3699) para la creación de una cohorte de seguimiento prospectivo de madres gestantes infectadas por el VIH y sus hijos hasta la edad de 3 años, que determinara la tasa de transmisión vertical dentro de la cohorte y evaluara los efectos adversos del TAR tanto en la madre como en el feto, el recién nacido y el lactante. Las características basales de la cohorte y los datos de transmisión vertical han sido descritos previamente4,23. Hoy día están incluidos más de 700 parejas madre-niño, aunque para el presente estudio se seleccionaron los 623 niños no infectados, nacidos desde el inicio de la base en mayo de 2000 hasta diciembre de 2005 en 8 hospitales de la Comunidad de Madrid (Hospital 12 de Octubre, Hospital La Paz, Hospital Gregorio Marañón, Hospital Universitario de Getafe, Hospital Severo Ochoa, Hospital de Móstoles, Hospital Príncipe de Asturias y Hospital Fundación Alcorcón). Se incluyeron en la base a las gestantes positivas para el VIH identificadas antes de la gestación, durante su transcurso o en las 48h posteriores al parto. Las parejas de madres-niños se controlaron de manera prospectiva, y ninguno de los niños estaba siendo alimentado con lactancia materna.
VariablesEn el seguimiento de las madres se recogieron datos sobre el control de la gestación, los datos demográficos personalizados de cada gestante, TAR recibido, datos físicos, analíticos y carga viral correspondientes a cada visita programada, los efectos adversos observados y las características del parto. En el seguimiento de los niños se realizó una exploración física, se registraron las características antropométricas, el tratamiento recibido, así como los datos clínicos y analíticos correspondientes a cada visita (que comprendió hemograma, bioquímica con perfil hepatorrenal, ácido láctico, y proteína C reactiva [PCR] para el VIH) que se efectúa al nacimiento, a las 2-3 semanas, a las 6 semanas, y a los 3, 6, 12, 18, 24 y 36 meses. Se consideró “no infectado” al niño que presentaba al menos dos PCR negativas, una de ellas realizada después de los 3 meses de edad. Se consideró parto prematuro si el nacimiento se producía antes de las 37 semanas de gestación. Se consideró como de bajo peso al nacer a los nacidos con un peso comprendido entre 1.500 y 2.500g, y de muy bajo peso a los niños nacidos con un peso igual o inferior a 1.499g. Se definió como anemia con toxicidad de grado 1 (según la puntuación del ACTG [AIDS Clinical Trails Group] modificada24) al menos una cifra de hemoglobina comprendida entre 8,0 y 9,4g/dl y toxicidad de grado 2 o superior cuando se observó al menos en una ocasión una cifra de hemoglobina inferior a 8g/dl. Se consideró neutropenia si las cifras de neutrófilos totales eran inferiores a 1.500 céls./μl; se establecieron como neutropenia leve valores de 1.000-1.500μl (toxicidad de grado 1 según el ACTG), neutropenia moderada 500-999μl (toxicidad 2 y 3) y neutropenia grave, valores inferiores a 500μl (toxicidad 4). La anemia materna se definió, siempre según las tablas de toxicidad de los ACTG24, como una cifra de hemoglobina en el tercer trimestre igual o inferior a 10g/dl. La carga viral materna de definió como indetectable si presentaba menos de 200 copias/ml (Amplicor®, Roche). En la mayoría de los hospitales se usaron técnicas de detección con límite inferior a menos de 50 copias/ml.
Tratamiento y profilaxis antirretroviralEl TAR en la embarazada se clasificó según las siguientes categorías: “en no tratamiento”, monoterapia (AZT), doble terapia (AZT + 3TC o NPV), TARGA con IP y TARGA sin IP (dos análogos de nucleósidos más un no análogo). En estos dos últimos grupos se controló el empleo de AZT, dado su potencial para producir anemia. El tratamiento profiláctico en el recién nacido se clasificó en monoterapia durante 6 semanas (AZT), doble terapia (AZT + 3TC o NVP) durante 4 semanas, y triple terapia (AZT y 3TC durante 4 semanas y NVP durante 15 días). En situaciones de bajo riesgo sólo está indicado tratamiento con AZT durante 6 semanas5–8. Sin embargo, en situaciones de riesgo alto, o cuando no se realizó ninguna medida preventiva en la gestación o el parto, se indica por protocolo tratamiento con triple terapia para el recién nacido6–8. La doble terapia con AZT + 3TC está indicada en los casos en los que exista un mal control virológico, pero sin otros factores de riesgo añadidos7; 40 niños (6,4 %) recibieron, además, cotrimoxazol al inicio del seguimiento (años 2000-2001), como profilaxis de la neumonía por Pneumocystis jiroveci. Para el análisis de los efectos secundarios hematológicos no se ha tenido en cuenta el uso de AZT intraparto. Al valorar la anemia potencialmente producida por el tratamiento profiláctico pautado al lactante, no se tuvo en cuenta la cifra de hemoglobina al nacer, por ser la cifra que presenta el recién nacido habitualmente antes de empezar a recibir la profilaxis.
Análisis estadísticoLas variables categóricas se expresaron como frecuencias y porcentajes, mientras que las variables numéricas se presentan como medias, medianas, desviación estandar (DE) y rango intercuartílico (RIC). Se compararon las variables categóricas usando el test de la χ2, y de la χ2 de tendencia lineal o el test exacto de Fischer cuando se consideró apropiado. Todos los valores de p son bilaterales y se consideró estadísticamente significativo un valor de p < 0,05. Los intervalos de confianza (IC) se fijaron en el 95 %. Para el análisis de los datos se empleó el programa SPSS (Chicago, IL) para Windows, versión 15.0.
RESULTADOSPoblación estudiadaLa cohorte se compone de 632 niños, de quienes nueve se infectaron. La transmisión vertical fue del 1,42 % (IC 95 %, 0,71-2,68). La población de estudio comprende 623 niños no infectados, el 52,2 % varones y el 78 % de etnia blanca. Las características basales de las madres figuran en la tabla 1; 55 madres (8,8 %) no recibieron tratamiento durante la gestación; 10 (1,6 %) recibieron monoterapia con AZT exclusivamente; 20 (3,2 %) recibieron doble terapia (AZT + 3TC o NVP), y 494 (79,3 %) recibieron TARGA; de éstas, 307 (49,3 %) recibieron TARGA con IP. El número de madres que recibió AZT fue de 393. En total, 131 madres recibieron TARGA sin AZT. Las características basales de los recién nacidos se exponen en la tabla 2; 140 niños (23,5 %) fueron prematuros, 161 (25,8 %) presentaron bajo peso al nacer, de los cuales 19 (3 %) presentaron muy bajo peso. El modo del parto fue cesárea en 411 niños (65,9 %); de éstas 340 (54,5 %) fueron programadas y 71 urgentes (11,4 %). Presentaron síndrome de abstinencia 95 niños (15,3 %). La media de seguimiento fue de 5,8 meses y la mediana de 6 meses (RIC, 0,5-12 meses). Se realizó una mediana de 4 analíticas por niño (RIC, 2-5). Los niños de origen subsahariano tienen una tasa de abandono de seguimiento mayor (del 59 % al año frente al 43 % del resto de niños), y no obtuvimos suficientes analíticas en este grupo como para presentar conclusiones por encima de los 12 meses de vida.
Características de las madres de la población estudiada
| Características | Número | Porcentaje |
| N.o de madres | 623 | |
| Edad, mediana (RIC) | 32 (28-35) | |
| Etnia | ||
| Blanca | 486 | 78,0 |
| Subsahariana | 81 | 13,0 |
| Latina | 42 | 6,7 |
| Norteafricana | 9 | 1,4 |
| Otras | 5 | 0,8 |
| Uso de drogas (metadona, cocaína, heroína) | ||
| Sí | 117 | 18,8 |
| No | 498 | 79,9 |
| Desconocido | 8 | 1,3 |
| Estadio de las madres | ||
| A | 284 | 45,6 |
| B | 92 | 14,7 |
| C | 98 | 15,7 |
| Desconocido | 149 | 23,9 |
| Carga viral indetectable previa al parto | ||
| Sí | 314 | 50,4 |
| No | 122 | 19,6 |
| Desconocido | 187 | 30,0 |
| Carga viral | ||
| Primer trimestre (media; mediana [RIC]) | 88.158; 800 (50-9.500) | |
| Tercer trimestre (media; mediana [RIC]) | 3.708; 50 (50-352) | |
| CD4 | ||
| Primer trimestre (media [DE]; mediana [RIC]) | 492 (281); 452 (281-650) | |
| Tercer trimestre (media [DE]; mediana [RIC]) | 541 (218); 498 (356-691) | |
| Modo de transmisión a las madres | ||
| Heterosexual | 301 | 48,3 |
| Parenteral | 215 | 34,5 |
| UDVP | 210 | 33,7 |
| Transfusión | 5 | 0,8 |
| Mixta | 29 | 4,6 |
| Vertical | 5 | 0,8 |
| Desconocida | 73 | 11,8 |
| Tratamiento antirretroviral | ||
| No tratamiento | 55 | 8,8 |
| Monoterapia | 10 | 1,6 |
| Biterapia | 20 | 3,2 |
| TARGA | 494 | 79,3 |
| TARGA sin IP | 187 | 30,0 |
| Sin AZT | 53 | 8,5 |
| Con AZT | 134 | 21,5 |
| TARGA con IP | 307 | 49,3 |
| Sin AZT | 78 | 12,5 |
| Con AZT | 229 | 36,7 |
| Desconocido | 44 | 7,1 |
AZT: zidovudina; IP: inhibidores de la proteasa; RIC: rango intercuartílico; TARGA: tratamiento antirretroviral de gran actividad; UDVP: usuaria de drogas por vía parenteral.
Características basales de los niños del estudio
| Características | Número | Porcentaje |
| Número de niños | 623 | |
| Sexo | ||
| Varón | 325 | 52,2 |
| Mujer | 318 | 47,8 |
| Vía del parto | ||
| Cesárea | 411 | 65,9 |
| Programada | 340 | 54,4 |
| Urgente | 71 | 11,4 |
| Vaginal | 191 | 30,6 |
| Eutócico | 171 | 27,4 |
| Instrumental | 20 | 3,2 |
| Desconocido | 21 | 3,4 |
| Pares de gemelos | 12 | |
| Edad gestacional | ||
| Media (DE) | 37,6 (0,6) | |
| Mediana (RIC) | 38 (37-39) | |
| Prematuros (< 37 semanas) | 140 | 23,5 |
| Peso al nacer | ||
| Media (DE) | 2.766 (590) | |
| Mediana (RIC) | 2.815 (2.430-3.157) | |
| Peso al nacer | ||
| > 2.500 | 439 | 70,5 |
| < 2.500 | 161 | 25,8 |
| 1.500-2.500 | 142 | 22,8 |
| < 1.500 | 19 | 3 |
| Desconocido | 23 | 3,7 |
| Tratamiento del recién nacido | ||
| AZT | 567 | 90,8 |
| AZT + 3TC | 17 | 2,8 |
| AZT + NVP | 8 | 1,3 |
| AZT + 3TC + NVP | 32 | 5,1 |
| Síndrome de abstinencia | ||
| Sí | 95 | 15,3 |
| No | 520 | 83,5 |
| Desconocido | 8 | 1,3 |
| Transfusión | 14 | 2,1 |
AZT: zidovudina; NVP: nevirapina; RIC: rango intercuartílico; 3TC: lamivudina.
Presentaron anemia 188 niños (30,2 %; IC 95 %, 26,7-33,9); de ellos, 161 (25,8 %; IC 95 %, 22,6-29,4) presentaron anemia de grado 1 y 27 (4,3 %; IC 95 %, 2,9-6,3) presentaron anemia de grado 2 o superior (tabla 3). La tasa de prematuros con anemia de cualquier grado fue mayor (el 47,7 % frente al 28 % en no prematuros; p < 0,001), y también fue mayor la proporción de prematuros con anemia de grado 2 o superior: el 9,1 % frente al 3,5 % (p < 0,001). La anemia fue más prevalente en el grupo de los menores de 1.500g respecto al grupo de bajo peso y al grupo de peso normal al nacer (el 47,1 % frente al 40,4 % frente al 29 %; p = 0,005). El origen étnico (el 35,0 % en subsaharianos frente al 31,5 % en el resto) y el síndrome de abstinencia no influyeron en la proporción de lactantes con anemia. Al clasificar a los lactantes según el tratamiento recibido intraútero, se observó en el análisis univariante que el grupo de los niños cuya madre tomó TARGA sin IP y sin AZT presentaron la menor tasa de anemia (18,9 %), seguidos por el grupo que recibió monoterapia (20,0 %), del grupo que recibió TARGA sin IP pero con AZT (24,8 %) y del grupo de lactantes que recibió intraútero TARGA con IP (el 37,5 % en los niños del grupo sin AZT y el 36,1 % en el grupo con AZT; p = 0,016). El grupo que mayor proporción de anemia presentó fue el grupo de los que recibieron doble terapia (52,9 %), seguidos del grupo cuyas madres no fueron tratadas (41,0 %). Estas diferencias fueron también significativas al estratificar la proporción de anemia en toxicidad de grados 1 o 2. Al analizar el tratamiento profiláctico recibido por el niño, no se observaron diferencias significativas dependiendo de si el niño había recibido monoterapia (31,5 %); doble terapia con AZT + 3TC (37,5 %); doble terapia con AZT + NVP (12,5 %), o triple terapia con AZT + 3TC + NVP (37,5 %), aunque parece existir un cierto efecto protector en la doble terapia con AZT + NVP, ya que la prevalencia de anemia en este grupo es la menor (12,5 %) (tabla 3). Los niños cuyas madres tuvieron anemia en el tercer trimestre presentaron más anemia (el 40,0 % frente al 30,5 %), aunque sin significación estadística (p = 0,24). La cifra de CD4 maternos y la carga viral en el último trimestre no influyeron en el desarrollo de anemia en el lactante.
Factores de riesgo para anemia (análisis univariante)
| Factores de riesgo | Anemia | p | Anemia de grado 2 o superior | p |
| Total/n.° (%)IC 95 % | 188/623 (30,2)26,1-33,9 % | 21 (4,3)2,9-6,3 % | ||
| Prematuridad, n.° (%)NoSí | 121/432 (28,0)63/132 (41,1) | < 0,001 | 15/432 (3,5)12/132 (9,1) | < 0,001 |
| Peso del recién nacido, n.° (%)> 2.500g1.500-2.500g< 1.500g | 122/420 (29,0)55/136 (40,4)8/11 (41,1) | 0,005 | 14/420 (3,3)11/136 (8,1)2/11 (11,8) | 0,001 |
| Origen étnico, n.° (%)OtroSubsahariano | 159/505 (31,5)28/80 (35,0) | 0,43 | 25/490 (4,9)2/80 (2,5) | 0,33 |
| Síndrome de abstinencia, n.° (%)NoSí | 159/490 (32,4)28/93 (30,1) | 0,11 | 24/490 (4,9)3/93 (3,2) | 0,74 |
| Tratamiento de la madreNo tratamientoAZTDoble terapiaTARGATARGA sin IP sin AZTTARGA sin IP con AZTTARGA con IP sin AZTTARGA con IP con AZT | 21/51 (41,0)2/10 (20,0)9/11 (52,9)10/53 (18,9)31/125 (24,8)21/12 (31,5)19/219 (36,1) | 0,044 | 3/51 (5,9)0/10 (0,0)1/11 (5,9)3/53 (5,7)1/125 (0,8)4/12 (5,6)14/219 (6,4) | 0,025 |
| Profilaxis del recién nacidoMonoterapia (AZT)AZT + 3TCAZT + NVPAZT + 3TC + NPV | 168/533 (31,5)6/16 (31,5)1/8 (12,5)12/32 (31,5) | 0,5 | 25/533 (4,7)1/16 (6,3)0/8 (0,0)1/32 (3,1) | 0,79 |
| Anemia materna en el tercer trimestreSíNo | 14/35 (40,0)103/338 (30,5) | 0,24 | 1/35 (2,9)16/338 (4,7) | 0,33 |
| Carga viral en el tercer trimestreIndetectableDetectable | 98/314 (31,2)46/122 (31,1) | 0,19 | 14/314 (4,5)1/122 (5,7) | 0,21 |
| CD4 maternos en el tercer trimestre> 500 500-200< 200 | 54/115 (30,9)52/141 (35,4)9/31 (29,0) | 0,74 | 9/175 (5,1)8/147 (5,4)2/31 (6,5) | 0,71 |
AZT: zidovudina; IC 95 %: intervalo de confianza del 95 %; IP: inhibidor de proteasa; NVP: nevirapina; TARGA: tratamiento antirretroviral de gran actividad; 3TC: lamivudina.
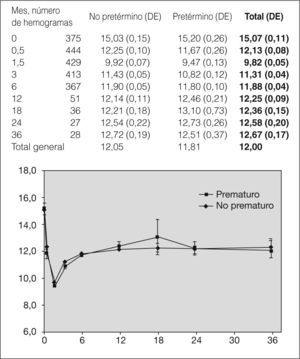
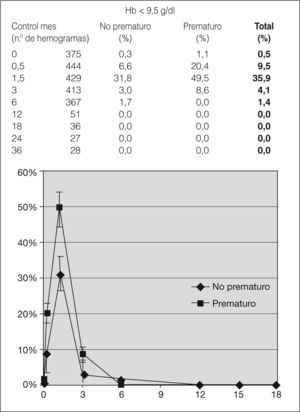
Se observa un nadir en las cifras de hemoglobina en los controles realizados al mes y medio (9,9g/dl [DE = 0,07] en no prematuros y 9,5g/dl [DE = 0,13] en prematuros), sin diferencias significativas, aunque la cifra se normaliza a partir de los 6 meses (11,9 y 11,8mg/dl, respectivamente) (fig. 1). Asimismo, la proporción de lactantes con anemia es mayor al mes y medio de vida, tanto en prematuros como en no prematuros (49,5 frente a 31,8, siendo estas diferencias significativas). No se ha observado que la anemia se prolongue más allá del sexto mes de vida (fig. 2). Un total de 14 niños precisaron transfusión de concentrado de hematíes, y de ellos 12 eran prematuros, con enfermedades concomitantes.
Se observó neutropenia en 261 niños (41,9 %; IC 95 %, 38,1-45,8); de ellos, 159 (25,5 %; IC 95 %, 22,2-29,1) presentaron neutropenia leve y 102 (16,4 %; IC 95 %, 13,7-19,5), neutropenia moderada-grave. La prevalencia de neutropenia en prematuros fue superior (el 54,5 % frente al 42,1 %; p = 0,013), y esta diferencia se mantiene en la proporción de neutropenia moderada-grave (el 22,7 % frente al 15,5 %; p = 0,007). También se encontraron diferencias, aunque no significativas, en la tasa de neutropenia cuando se comparó por grupos de peso al nacimiento, que fue del 42,1 % en los mayores de 2.500g frente al 50 % entre los de bajo peso y frente al 52,9 % en los nacidos con muy bajo peso (p = 0,11). Sí existieron diferencias en la proporción de lactantes con neutropenia moderada-grave al estratificar por peso (el 15,4 % en los de peso normal frente al 22,1 % en los de muy bajo peso y al 35,3 % en los de muy bajo peso; p = 0,023). Existe una tendencia a una mayor proporción de neutropenia entre los lactantes de origen subsahariano (el 50,0 % frente al 44 %; p = 0,31) y hay más neutropenia moderada-grave entre los lactantes de dicho origen (el 21,3 % frente al 16,9 %; p = 0,19). El empleo por parte de la gestante de metadona no influyó en el desarrollo de neutropenia. Según el tratamiento recibido intraútero, se observó que el grupo de niños cuya madre tomó exclusivamente AZT presentaron la menor tasa de neutropenia (0 %), seguidos del grupo que recibió doble terapia intraútero (29,4 %) y del grupo que recibió TARGA (del 36,1 al 49,1 %, según contuviese IP o no). Las diferencias entre estos grupos fueron significativas (p = 0,028), pero no se mantuvieron al estratificar la proporción de afectados de neutropenia en leve o moderada-grave. No se observaron diferencias significativas dependiendo de si el niño recibió como profilaxis neonatal monoterapia (43,4 %); doble terapia con AZT + 3TC (37,5 %); doble terapia con AZT + NVP (37,5 %), o triple terapia con AZT, 3TC + NVP (53,1 %) (tabla 4). Se observó una mayor proporción de neutropenia entre los hijos de madres que presentaron anemia en el tercer trimestre (el 54,3 % frente al 42,0 %; p = 0,16). Se observó que la cifra de CD4 maternos no influyó en la aparición de neutropenia en los niños (el 42,3 % en los hijos de madres con CD4 > 500/ml frente al 44,9% en los hijos de madres con CD4 entre 200 y 500/ml frente al 45,2 % en los hijos de madres con CD4 < 200/ml; p = 0,64). De igual manera, la carga viral materna del último trimestre no influyó en el desarrollo de neutropenia en el niño (el 46,2 % en los hijos de madre con carga viral indetectable frente al 42,6 % en los hijos de madres con carga viral detectable). En todos los casos, la neutropenia no tuvo repercusión clínica.
Factores de riesgo para neutropenia (análisis univariante)
| Factores de riesgo | Neutropenia | p | Neutropenia moderada-grave | p |
| Total/n.° (%)IC 95 % | 261/623 (41,9)38,1-45,8 % | 102 (16,4)13,7-19,5 % | ||
| Prematuridad, n.° (%)NoSí | 182/432 (42,1)72/132 (54,5) | 0,013 | 67/432 (15,5)30/132 (22,7) | 0,007 |
| Peso del recién nacido, n.° (%)> 2.500g1.500-2.500g< 1.500g | 180/432 (42,1)68/136 (50,0)9/17 (52,9) | 0,11 | 65/420 (15,4)30/135 (22,1)6/17 (35,3) | 0,023 |
| Origen étnico, n.° (%)OtroSubsahariano | 222/505 (44,0)40/80 (50,0) | 0,31 | 85/505 (16,9)17/80 (21,3) | 0,19 |
| Síndrome de abstinencia, n.° (%)NoSí | 225/491 (45,8)36/93 (38,7) | 0,21 | 86/491 (17,5)16/93 (17,2) | 0,50 |
| Tratamiento de la madreNo tratamientoAZTDoble terapiaTARGATARGA sin IP sin AZTTARGA sin IP con AZTTARGA con IP sin AZTTARGA con IP con AZT | 27/51 (52,9)0/10 (0)5/17 (29,4)26/53 (49,1)56/125 (44,8)26/72 (36,1)103/219 (47,0) | 0,028 | 12/51 (23,6)0/10 (0,0)1/17 (5,9)9/53 (17,0)24/125 (19,2)10/72 (13,9)39/219 (11,8) | 0,31 |
| Profilaxis del recién nacidoMonoterapia (AZT)AZT + 3TCAZT + NVPAZT + 3TC + NPV | 232/534 (43,4)6/16 (37,5)3/8 (37,5)17/32 (53,1) | 0,67 | 94/534 (17,6)2/16 (12,5)0/8 (0,0)3/32 (9,4) | 0,50 |
| Anemia materna en el tercer trimestreSíNo | 19/35 (54,3)142/338 (42) | 0,16 | 8/35 (22,9)53/338 (12,3) | 0,14 |
| Carga viral indetectableSíNo | 145/314 (46,2)52/122 (42,6) | 0,50 | 29/314 (18,2)15/122 (12,3) | 0,33 |
| CD4 maternos en el tercer trimestre> 500500-200< 200 | 74/115 (42,3)66/147 (44,9)14/31 (45,2) | 0,64 | 29/175 (16,6)23/141 (15,6)1/31 (22,6) | 0,55 |
AZT: zidovudina; IC 95 %: intervalo de confianza del 95 %; IP: inhibidor de proteasa; NVP: nevirapina; TARGA: tratamiento antirretroviral de gran actividad; 3TC: lamivudina.
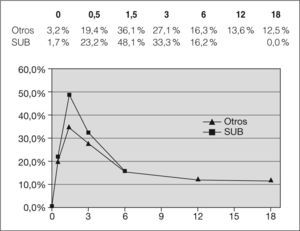
En la figura 3 se observan las diferencias entre la proporción de lactantes con neutropenia, según su origen étnico (subsaharianos/otros), que fue mayor, a grandes rasgos, entre los lactantes de origen subsahariano. Se observa, además, cómo la neutropenia continúa en un 12,5 % de los lactantes a los 18 meses de vida.
DISCUSIÓNEn esta cohorte, similar a otras europeas en aspectos como el uso de antirretrovirales, características maternas, características de los lactantes, tasa de prematuridad (23,5 %) y tasa de transmisión vertical (1,42 %)1–3,23,25, hemos observado una alta prevalencia de anemia, un 30,2 %, similar a las descritas en otras series recientes, cuyas tasas oscilan entre el 24 y el 53,8 %25–29. La tasa de anemia de grado 2 o superior (moderada o grave) fue del 4,3 % (27 niños), y 14 niños precisaron transfusiones. Una vez llevada a cabo la revisión de dichos pacientes, se observó que todos menos dos eran prematuros, que precisaban asistencia ventilatoria o que tenían alguna enfermedad grave, en la que estaba indicada la transfusión, con lo que en el presente estudio no existen datos que asocien el uso de AZT con el riesgo de anemia grave y la necesidad de transfusión. La proporción de anemia en prematuros fue mayor, del 47,7 % frente al 28 % en no prematuros, así como la prevalencia de anemia grado 2 o mayor. Dos hechos justifican estas diferencias: por un lado, la mayor prevalencia global de anemia en el niño prematuro y, por otro lado, debido a la dificultad para la metabolización y eliminación de fármacos en este grupo de lactantes, las concentraciones plasmáticas de antirretrovirales podrían continuar elevadas durante más tiempo, lo que puede provocar efectos adversos más importantes o más duraderos. Los lactantes con bajo peso al nacer y los que tienen un peso muy bajo al nacer presentaron también mayores tasas de anemia de cualquier grado, aunque no se ha controlado para prematuridad en los menores de 1.500g. No se ha observado que el origen subsahariano del niño y el empleo de metadona por parte de la madre supongan un aumento de riesgo para presentar anemia. En el presente estudio, hemos observado que el tratamiento materno durante la gestación con TARGA más IP supone un aumento de riesgo para que el lactante presente anemia de cualquier grado, con independencia de si se ha usado AZT como parte del régimen del TARGA o no lo ha utilizado (p = 0,016). Dicho aumento de riesgo de anemia en el lactante con el empleo de TARGA en la mujer embarazada se ha observado en otra cohorte alemana26, aunque en dicha población no se detectó un aumento del riesgo con el empleo de IP durante el embarazo. Por otra parte, en una cohorte latinoamericana27 se observó, sin embargo, un efecto protector en el desarrollo de anemia con el empleo de TARGA por parte de la madre gestante. La patogenia de la anemia producida por el AZT ha sido ya estudiada1,12–20, aunque los efectos hematológicos (y la farmacodinamia en la circulación maternofetal) de la combinación de distintos antirretrovirales, entre ellos los IP, en el feto y en el lactante, aún son materia de estudio. Sin embargo, el grupo que presentó una mayor proporción de anemia fue el de los lactantes cuyas madres recibieron doble terapia (52,9 %), aunque debido al reducido tamaño de este grupo (17 niños), sólo podemos indicar el dato sin aportar ninguna conclusión. Otro grupo con alta prevalencia de anemia fue el de los lactantes cuyas madres no recibieron tratamiento durante la gestación (41 %). Esto puede deberse a que se trata, en su totalidad, de gestaciones no controladas, con una elevada tasa de prematuridad y de bajo peso, lo que actúa como factor de confusión.
Por otro lado, el empleo cada vez mayor de triple terapia profiláctica en el recién nacido de riesgo no parece aumentar de forma significativa el riesgo de anemia de cualquier grado en el lactante.
La anemia materna en el tercer trimestre podría influir en el desarrollo de anemia en el lactante, pero no hemos encontrado diferencias estadísticamente significativas. Presentar una carga viral indetectable en el tercer trimestre de la gestación no influyó en el desarrollo de anemia en el lactante. De igual manera, las proporciones de niños con anemia fueron similares al estratificar a las madres según sus CD4 en el tercer trimestre.
Las cifras nadir de hemoglobina coinciden con la suspensión del tratamiento profiláctico al mes y medio de vida. En el presente estudio no se ha observado que la anemia persista más allá de los 6 meses de vida, al igual que en otras cohortes25,27,29,30, y frente a lo que ocurría en la cohorte perinatal francesa28, en la que las cifras de hemoglobina permanecen disminuidas en los niños expuestos hasta la edad de 18 meses.
Los efectos hematológicos del AZT en la gestante no se ciñen exclusivamente a la serie roja, sino que afectan a plaquetas y leucocitos, como ya ponían de manifiesto series realizadas en países africanos30,31, y posteriormente en países europeos y americanos25–29,32. Con el uso de otros tratamientos combinados, la proporción de lactantes con neutropenia es mayor: la prevalencia en nuestro estudio fue del 41,9 %, también similar a la encontrada en la serie alemana (48 %)26. La prevalencia de neutropenia moderada-grave fue del 16,4 %. En el seguimiento de la cohorte, no se describieron infecciones bacterianas graves, bacteriemias o sepsis secundarias a neutropenias graves. El grado de neutropenia fue mayor en prematuros, probablemente porque su capacidad para metabolizar los fármacos es menor y es, en esta población, en la que se ven potenciados habitualmente los efectos adversos. Esta diferencia se mantuvo también al analizar la neutropenia moderada-grave. Los lactantes de peso bajo y muy bajo al nacer tuvieron más riesgo de presentar neutropenia. Los lactantes de etnia negra presentaron una mayor prevalencia de neutropenia de cualquier grado (el 50 % frente al 44 %), aunque tampoco se encontraron diferencias significativas, probablemente debido al pequeño tamaño de la población subsahariana en este estudio y al reducido número de datos analíticos en el seguimiento de este subgrupo. En otras series más amplias28,29,32 se observa este mismo fenómeno, comprobándose algo que, aunque no ha sido estudiado en toda su extensión, ya fue observado a principios de la última década del siglo pasado: la población de origen subsahariano presenta cifras de neutrófilos menores a la población de otras razas33. Por otro lado, el empleo de metadona por parte de la madre gestante no influyó en la prevalencia de neutropenia. Al estratificar por grupos de TAR materno, encontramos la menor prevalencia de neutropenia en los niños que recibieron monoterapia o doble terapia, y la mayor, en los niños que recibieron TARGA intraútero o ningún tratamiento, pero no se obtuvo significación estadística. Al analizar las características clínicas de las madres, se observa que existe una tendencia a presentar una mayor proporción de neutropenia en los hijos de madres que presentaron anemia en el último trimestre respecto a los hijos de madres que no presentaron anemia. La carga viral materna y los CD4 maternos no influyeron. El tipo de profilaxis recibida por el recién nacido tampoco influyó en la prevalencia de neutropenia. En el seguimiento de estos niños se observa que la mayor prevalencia de neutropenia ocurre a las 6 semanas, momento de la interrupción de la profilaxis y, que, al contrario que en el caso de la anemia, esta neutropenia puede continuar hasta en el 12,5 % de los lactantes a los 18 meses. Ese dato se correlaciona con los resultados de otras series europeas28,32, pero no se encuentra en la cohorte WITS (Women and Infant Transmission Study)29 ni en un estudio realizado en Malawi30. En el seguimiento del estudio colaborativo europeo se observó, además, una disminución de las cifras totales de neutrófilos incluso hasta la edad de 8 años en los niños no infectados expuestos a antirretrovirales, frente a lo que ocurría en niños no expuestos32.
Las citopenias estudiadas, en definitiva, cursan en su mayoría de manera asintomática y los factores de riesgo más significativamente relacionados con éstas en los hijos no infectados de madres positivas para el VIH son, de acuerdo con estos resultados, la prematuridad, el bajo peso al nacer y el tratamiento intraútero con TARGA e IP. La anemia es ciertamente transitoria, pero la granulocitopenia puede durar, en una proporción considerable de lactantes, hasta los 18 meses.
Entre las limitaciones de nuestro estudio figuran, en primer lugar, las propias de los estudios de cohortes. Estos estudios observacionales sobre los efectos de un fármaco no tienen el mismo rigor que un estudio aleatorizado, con grupo control, que es el único que puede atribuir al fármaco en estudio los efectos adversos observados. En las cohortes prospectivas, como es la cohorte FIPSE, los factores de confusión no están lo suficientemente controlados y pueden derivar en sesgos debido a la interpretación de los resultados, pero es indudable que proporcionan la base para realizar estudios aleatorizados. Un grupo control de niños cuyas madres seropositivas no hubieran estado expuestas a fármacos antirretrovirales mejoraría ampliamente la interpretación de resultados, lo que no es posible dada la necesidad de tratamiento durante la gestación para prevenir la transmisión vertical. Asimismo, no hemos contado con un grupo control de lactantes cuyas madres fueran seronegativas, y nos hemos guiado por los parámetros de normalidad en poblaciones estándar y las guías de toxicidad de los ACTG. Además, debemos remarcar que en nuestra serie existe un 23,5 % de prematuridad, lo que puede suponer un sesgo, puesto que las cifras de hemoglobina en prematuros son menores. Hemos intentado eliminar este probable factor de confusión estratificando para prematuridad las cifras globales de anemia y neutropenia.
Por otro lado, la frecuente pérdida de pacientes a lo largo del seguimiento hace que las conclusiones sobre la persistencia de los efectos observados sean menos rigurosas. Otra limitación en el seguimiento de la base es el hecho de que muchos de los datos, sobre todo aquellos relacionados con la duración y el cumplimiento del tratamiento, provienen de encuestas realizadas a las madres a lo largo de las visitas sucesivas. Por otro lado, en el presente análisis no se ha tenido en cuenta la duración del tratamiento materno, lo que sí podría ser un factor importante para el desarrollo de citopenias en el lactante.
A pesar de las citadas limitaciones, creemos que al tratarse de un estudio de cohortes prospectivo, con un elevado número de parejas madre-niño, basado en la práctica clínica habitual, posee un alto grado de validez tanto interna como externa, en poblaciones similares a la nuestra, por lo que los resultados observados no indican, de momento, que deba cambiarse la actitud terapéutica en los lactantes expuestos intraútero al VIH.