Es importante conocer si en la reanimación neonatal el uso de diversas herramientas de calidad tiene impacto en la preparación del puesto de estabilización, correcto desarrollo del procedimiento y evolución clínica de aquellos neonatos más vulnerables.
Material y métodosEstudio de intervención cuasiexperimental, prospectivo y multicéntrico en 5 unidades neonatales iii-A. En las fases pre y postintervención, ambas de un año de duración, se realizaron auditorías aleatorias semanales de los puestos de estabilización en el paritorio para comprobar su preparación. En la fase postintervención se usaron checklists, briefings y debriefings en las reanimaciones de los neonatos menores de 32 semanas. Se compararon el desarrollo del procedimiento y la evolución inicial posreanimación entre ambos periodos.
ResultadosSe realizaron 852 auditorías en el periodo preintervención y 877 en el postintervención. El porcentaje de auditorías sin defecto fue superior en la segunda fase (63% vs. 81% p<0,001). Se incluyeron 75 reanimaciones en la fase inicial y 48 en la segunda, de las cuales en 36 (75%) se habían utilizado todas las herramientas de calidad. No existieron diferencias en las principales variables clínicas durante la estabilización, aunque se objetivó una tendencia a menores problemas técnicos durante el procedimiento en el segundo periodo.
ConclusionesLa utilización de auditorías aleatorias, checklists, briefings y debriefings en la reanimación de los menores de 32 semanas es factible, pero no tiene impacto en los resultados clínicos a corto plazo ni en la correcta ejecución del procedimiento. Las auditorías de los puestos de reanimación neonatal mejoran significativamente su preparación.
In neonatal resuscitation, it is important to know whether the use of a combination of quality assessment tools has an impact on the preparation of the resuscitation bed and equipment, the correct performance of the procedure and the clinical outcomes of the most vulnerable neonates.
Material and methodsMulticentre, prospective, quasi-experimental interventional study in five level III-A neonatal units. In the pre- and post-intervention phases, both of which lasted 1 year, there were weekly random audits of the stabilization beds in the delivery room to assess their preparation. In the post-intervention phase, checklists, briefings and debriefings were used in the resuscitation of neonates delivered before 32 weeks. We compared the performance of the procedure and early post-resuscitation outcomes in the 2 periods.
Results852 audits were carried out in the pre-intervention period and 877 in the post-intervention period. There was a greater percentage of audits that did not identify defects in the second phase (63% vs 81%; P<.001). The first phase included 75 resuscitations and the second 48, out of which all the quality assessment tools had been used in 36 (75%). We did not find any differences in the main clinical variables during stabilization, although we observed a trend towards fewer technical problems during the procedure in the second period.
ConclusionsThe use of random audits, checklists, briefings and debriefings in the resuscitation of newborns delivered before 32 weeks is feasible but has no impact on short-term clinical outcomes or correct performance of the procedure. Audits of neonatal resuscitation beds significantly improved their preparation.
Los eventos adversos debidos a incidentes de seguridad asistencial son una causa importante de morbimortalidad, y diversos trabajos han demostrado que en recién nacidos su frecuencia y gravedad puede ser superior a la estimada en adultos hospitalizados1–3. En el ámbito de la reanimación cardiopulmonar (RCP) neonatal, como en cualquier otro procedimiento, también existen incidentes asistenciales que pueden tener consecuencias potencialmente graves, sobre todo en aquellos neonatos más inmaduros4–6. Para minimizarlos y mejorar el desarrollo del procedimiento existen diferentes herramientas que evalúan y/o mejoran la calidad asistencial y que se pueden utilizar, como son el uso de listas de comprobación (checklists) y las reuniones breves pre-posreanimación (briefings y debriefings). Estas herramientas pueden mejorar la preparación y la adherencia a los pasos iniciales de la RCP neonatal, así como la función y la comunicación del equipo reanimador7,8. Recientemente la Sociedad Española de Neonatología (SENeo) ha recomendado la implementación de reuniones previas a las RCP neonatales y la realización de sesiones cortas tras el procedimiento9.
Las auditorías aleatorias de seguridad en tiempo real (AASTR) son otra herramienta de seguridad capaz de identificar errores y situaciones asistenciales potencialmente peligrosas. Mediante una lista de comprobación aplicada aleatoriamente se realiza una verificación, en tiempo real, de un determinado equipamiento o procedimiento para detectar puntos débiles de seguridad. Son baratas y fáciles de realizar. Su desarrollo en el ámbito asistencial neonatal todavía no está muy extendido10-14.
Dada la trascendencia de realizar una RCP neonatal segura y de calidad, y la necesidad de mejorar la morbilidad de aquellos neonatos más inmaduros, se efectuó el presente estudio para determinar el impacto clínico del establecimiento de AASTR de los puestos de estabilización neonatal, junto con la realización de checklists, briefings y debriefings durante el procedimiento de la RCP al nacimiento de los neonatos menores de 32 semanas de edad gestacional (<32sEG) nacidos en diferentes unidades neonatales de tercer nivel de nuestro medio.
Material y métodosEstudio de intervención, cuasi-experimental, prospectivo y multicéntrico, en 5 unidades neonatales (UCIN) de la Comunidad de Madrid, todas ellas nivel iii-A según estándares de la SENeo15. Previo a su realización el estudio fue aprobado por los comités éticos de investigación de cada uno de los centros participantes.
En los 36 puestos de estabilización neonatal presentes en el área de partos de las 5 unidades se realizaron, durante un año, AASTR semanales de al menos 3 puestos por centro (fase preintervención, octubre 2018-septiembre 2019). En cada auditoría se hizo un análisis pormenorizado del montaje de la cuna de reanimación y del material y medicación necesarios para la estabilización neonatal (ver la documentación complementaria en el anexo). Para confirmar la idoneidad de la preparación y la dotación de cada puesto se siguieron las recomendaciones realizadas por el Grupo de Reanimación Neonatal de la SENeo16. Una vez realizada la auditoría se obtuvo un resultado global en cada puesto: auditoría sin defecto (preparación totalmente correcta), auditoría con defectos leves (fácilmente detectables y subsanables —incluso en el momento de la reanimación— y con poca capacidad de producir eventos adversos en el recién nacido) o auditoría con defectos graves (con algún error no fácilmente detectable o subsanable y capaz de producir eventos adversos graves durante el procedimiento). Las AASTR fueron llevadas a cabo por el investigador principal de cada centro, siempre el mismo a lo largo del desarrollo del estudio.
Durante este periodo se recogieron de forma prospectiva distintas variables demográficas, clínicas y de la RCP de los neonatos<32sEG, nacidos en cada uno de los centros y susceptibles de reanimación neonatal, incluidos en el estudio tras la firma del consentimiento informado por parte de sus padres. Se excluyeron del análisis aquellos recién nacidos<32sEG con signos biológicos de muerte fetal intraútero, con malformaciones incompatibles con la vida que no fueran susceptibles de reanimación en el momento del nacimiento o cuyos padres denegaran el consentimiento para su inclusión. También se consignó la posible presencia de problemas durante su estabilización, clasificando estos problemas en 2 categorías: problemas técnicos (contratiempos debidos a dificultades en el uso de material, aparataje o mala disponibilidad de este) o problemas de procedimiento (por errores de comisión u omisión en alguna de las fases de la reanimación por parte de los miembros del equipo reanimador).
La asistencia a los<32sEG durante la reanimación fue llevada a cabo por el equipo habitual de cada centro, formado habitualmente por 3-4 reanimadores (neonatólogos, residentes de pediatría, enfermera neonatal o matrona), todos formados en reanimación neonatal y con capacitación para la estabilización del recién nacido prematuro al nacimiento. Durante el desarrollo del estudio todas las unidades participantes realizaron el procedimiento de RCP siguiendo las guías nacionales e internacionales vigentes en el momento de llevar a cabo cada una de las fases de investigación9,17. La recogida de datos durante la reanimación fue realizada por un observador externo (habitualmente un neonatólogo o enfermera con experiencia en RCP neonatal), siguiendo un formulario escrito previamente establecido (anexo del material suplementario).
Se consideraron 3 objetivos principales en el estudio: mejora de la temperatura axilar al ingreso del recién nacido en la UCIN, mayor obtención de una lectura de pulsioxímetro fiable en los 3 primeros minutos de vida y disminución de la necesidad de intubación y administración de surfactante en el paritorio. Estos criterios son marcadores específicos de calidad de la reanimación neonatal y, con algunas variaciones, han sido analizados en otros estudios similares18-20. En concreto la temperatura axilar al ingreso se considera un parámetro de calidad dada su objetividad, facilidad de medición y la conocida asociación entre hipotermia y morbimortalidad neonatal7,21. Por otra parte, el conocimiento de la saturación de oxígeno a los 3minutos de vida es clave para poder guiar las decisiones de manejo de oxigenación en este grupo de niños9. Por último, la no intubación de los recién nacidos pretérmino en el paritorio tiene como objetivo favorecer el uso de ventilación no invasiva (CPAP) y la administración posterior, si fuera preciso, de surfactante con otros métodos menos invasivos y potencialmente con menores efectos secundarios22. La presencia de problemas técnicos o de procedimiento durante la reanimación, la mejora en otras variables clínicas durante la estabilización del recién nacido y la factibilidad de introducción de estas herramientas de calidad fueron definidos como objetivos secundarios de la investigación.
Tras esta primera fase, en un periodo de 8 meses (octubre 2019-mayo 2020), se estableció en todas las unidades el uso sistemático de listas de comprobación estructuradas del procedimiento y reuniones del equipo reanimador (checklists y briefings) previas a la estabilización de los prematuros<32sEG, con el objetivo de hacer una revisión sistemática del material, medicación, asignación de roles y secuencia de actuación antes del procedimiento. También se implementaron reuniones breves posreanimación (debriefings), en donde el equipo reanimador repasaba su actuación y establecía puntos fuertes y posibles áreas de mejora (anexos del material suplementario). Estos debriefing eran dirigidos por el líder del equipo reanimador. Previamente a este periodo de intervención en ninguna de las unidades del estudio se realizaban checklists escritos estructurados ni existía una sistematización para realizar reuniones previas o posteriores al procedimiento de estabilización neonatal.
Dada la ausencia de datos publicados previos sobre el impacto en las RCP neonatales de la aplicación del conjunto de herramientas de calidad como el sujeto a estudio, se hizo inviable una estimación sensata del tamaño muestral necesario basada en un contraste de hipótesis formal. Por ello se optó por un diseño del trabajo con recogida de muestras de conveniencia dentro de un estudio de intervención con fase previa y posterior de la misma duración para evitar posibles sesgos estacionales. Así, en el periodo postintervención se efectuaron de nuevo durante un año (junio 2020-mayo 2021) AASTR de los puestos de estabilización neonatal y recogida de variables clínicas y de reanimación en estos prematuros con la misma metodología que la llevada a cabo previamente.
Se llevó a cabo una estadística descriptiva y una comparación univariante para muestras independientes pre/postintervención. En el caso de contrastar variables categóricas se realizaron las pruebas de Chi-cuadrado de Pearson o el estadístico exacto de Fisher y en variables numéricas la prueba U Mann-Whitney, Kruskall-Wallis o «t» de Student, según cumplimiento de las asunciones correspondientes, fijándose un nivel de significación p<0,05. Para el análisis estadístico se utilizó el paquete informático Stata v.15.1.
ResultadosEn el periodo preintervención se realizaron 852 AASTR de los puestos de reanimación, considerándose de manera global como sin defecto 534 (62,7%). Estos resultados mostraron diferencias estadísticamente significativas (p<0,001) con respecto a los obtenidos en el periodo postintervención —877 auditorías realizadas, 711 sin defecto (81,1%)— (tabla 1).
Comparativa de AASTR de puestos de reanimación en los 2 periodos del estudio
| Resultado globalPeriodo preintervenciónN=852N (%) | Resultado globalPeriodo postintervenciónN=877N (%) | Valor p | |
|---|---|---|---|
| Sin defecto | 534 (62,7) | 711 (81,1) | <0,001 |
| Defecto leve | 98 (11,5) | 115 (13,1) | |
| Defecto grave | 220 (25,8) | 51 (5,8) |
Con respecto a las variables clínicas, demográficas o la enfermedad materno-fetal de los recién nacidos incluidos en el estudio, no se encontraron diferencias en los 2 periodos de tiempo del estudio (tabla 2). De los 79<32sEG nacidos en la fase preintervención se recogieron datos de 75 (en 3 casos los padres declinaron participar y en otro no se recogieron los datos de la reanimación). En la fase postintervención se incluyeron datos de 48 de los 51 prematuros nacidos. En este periodo, en 2 casos los padres rehusaron participar, y en otro tampoco se recogieron datos de la reanimación. Durante la fase postintervención las herramientas de calidad se realizaron en un alto porcentaje de reanimaciones con un uso conjunto de briefings, debriefings y checklists en 36 reanimaciones (75% del total) (tabla 3).
Comparativa de variables demográficas pre y perinatales de los recién nacidos menores de 32 semanas de edad gestacional incluidos en el estudio en ambos periodos
| Variable | Resultados | Resultados | Valor p |
|---|---|---|---|
| Periodo preintervención | Periodo postintervención | ||
| N=75 | N=48 | ||
| N (%) | N (%) | ||
| Sexo | Varón: 39 (52) | Varón: 27 (56,3) | 0,645 |
| Etnia | Caucásica: 54 (72) | Caucásica: 29 (60,4) | 0,088 |
| Hispana: 13 (17,3) | Hispana: 8 (16,7) | ||
| Africana: 6 (8) | Africana: 3 (6,3) | ||
| Árabe: 1 (1,3) | Árabe: 6 (12,5) | ||
| Gitana: 1 (1,3) | Gitana: 2 (4,1) | ||
| Tipo de gestación | Única: 56 (74,7) | Única: 33 (68,7) | 0,474 |
| Tipo de parto | Cesárea: 45 (60) | Cesárea: 32 (66,7) | 0,684 |
| Vaginal: 29 (38,7) | Vaginal: 15 (31,3) | ||
| Instrum.: 1 (1,3) | Instrum.: 1 (2) | ||
| Corticoides prenatales | Completos: 62 (82,7) | Completos: 34 (70,8) | 0,237 |
| Parcial: 11 (14,7) | Parcial: 13 (27,1) | ||
| No: 2 (2,6) | No: 1 (2,1) | ||
| Sulfato de magnesio prenatal | Sí: 63 (84) | Si: 36 (75) | 0,219 |
| Edad gestacional (semanas) | Mediana: 30+5 | Mediana: 30+4 | 0,208 |
| RIQ: 29+6-31+3 | RIQ: 29+2-31 | ||
| Peso al nacimiento (gramos) | Media: 1423,3 | Media: 1375,6 | 0,357 |
| DS: 288,8 | DS: 262,9 | ||
| Percentil de peso al nacimiento | Media: 47 | Media: 47 | 0,975 |
| DS: 23,1 | DS: 24,3 | ||
| ¿Enfermedad materno o fetal conocida? | Sí: 51 (68%) | Sí: 36 (75%) | 0,405 |
| Tipo de enfermedad materno fetal | |||
| Amniorrexis prolongada | 9 (12) | 5 (10,4) | 0,780 |
| Corioamnionitis | 11 (14,7) | 8 (16,7) | 0,765 |
| Preeclampsia | 14 (18,7) | 10 (20,8) | 0,767 |
| Afectación funicular o placentaria | 6 (8) | 4 (8,3) | 0,947 |
| Crecimiento intrauterino retardado | 7 (9,3) | 4 (8,3) | 0,850 |
| Otra enfermedad materna durante la gestación | Sí: 5 (6,7%) | Sí: 7 (14,6%) | 0,149 |
| Colestasis: 3; hipertransaminasemia: 1; hipotiroidismo sin tto: 1 | COVID-19: 4Aplasia medular: Sepsis urinaria:1 Sífilis: 1 | ||
| Otra enfermedad materna previa a la gestación | Sí: 3 (4%) | Sí: 0 | 0,161 |
| Drogodependencia: 2; malformación uterina: 1 | |||
| Otra enfermedad fetal | Sí: 1 (1,3%) | Sí: 0 | 0,142 |
| Oligoamnios |
DS: desviación estándar; Instrum.: instrumental; máx: máximo; mín: mínimo. RIQ: rango intercuartílico; tto: tratamiento.
Utilización de herramientas de calidad asistencial en las reanimaciones de los menores de 32 semanas de edad gestacional en el periodo postintervención
| Herramientas utilizadas | RCP realizadas en periodo postintervenciónN=48n (%) |
|---|---|
| Ninguna | 5 (10,4) |
| Solo briefings | 3 (6,2) |
| Briefings+checklists | 4 (8,3) |
| Briefings+debriefings+checklists | 36 (75) |
En relación con las variables recogidas durante la RCP los resultados fueron similares en las 2 fases del estudio. Específicamente, en las 3 variables definidas como objetivos principales del estudio no se hallaron diferencias estadísticamente significativas. Las únicas variables en las que se encontraron diferencias fueron los segundos de vida necesarios para alcanzar una lectura fiable del pulsioxímetro en caso de no haberla obtenido a los 3minutos de vida, la necesidad de adrenalina durante la reanimación y los minutos de vida necesarios para dar la primera información a la familia (tabla 4).
Comparación de variables de RCP en los 2 periodos estudiados
| Variable RCP | Resultados preintervención | Resultados postintervención | Valor p |
|---|---|---|---|
| N=75 | N=48 | ||
| n (%) | n (%) | ||
| Información prenatal | 56 (74,7) | 40 (83,3%) | 0,257 |
| Soporte térmico correcto (cuna precalentada+bolsa polietileno en el primer minuto de vida) | 68 (90,7) | 46 (95.8%) | 0,283 |
| FiO2 21-30% al inicio de RCP | 75 (100) | 47 (97,9%) | 0,209 |
| SatO2 a los 3min. de vida | Desconocida: 16 (21,3) <60: 13 (17,3) | Desconocida: 10 (20,8)<60: 14 (29,1) | 0,468 |
| 60-80: 35 (46,7) | 60-80: 18 (37,5) | ||
| >80: 11 (14,7) | >80: 6 (12,5%) | ||
| Segundos de vida lectura SatO2 (si no había lectura a los 3minutos de vida) | Mediana:300 | Mediana: 240 | 0,039 |
| (RIQ 251,5-460) n=16 | (RIQ 240-300) n=10 | ||
| FiO2 máxima alcanzada | Mediana: 35 (RIQ 30-40) | Mediana: 40 (RIQ 30-50) | 0,093 |
| Segundos de vida FiO2 máxima | Mediana: 180 | Mediana: 225 | 0,493 |
| (RIQ 1-300) | (RIQ 125-300) | ||
| Soporte respiratorio máximo | Ninguno: 6 (8%) | Ninguno: 4 (8,3%) | 0,612 |
| CPAP: 27 (36%) | CPAP: 14 (29,1%) | ||
| PPI: 34 (45,3%) | PPI: 21 (43,7%) | ||
| Intubación: 8 (10,7%) | Intubación: 9 (18,75%) | ||
| Necesidad de surfactante | 2 (2,7%) | 2 (4,2%) | 0,647 |
| Compresiones torácicas | 2 (2,7%) | 3 (6,3%) | 0,326 |
| Necesidad de medicación | 0 (0%) | 4 (8,4%) | 0,011 |
| Soporte respiratorio al ingreso | Ninguno: 7 (9,3%) | Ninguno: 5 (10,4%) | 0,579 |
| CPAP: 58 (77,3%). | CPAP: 34 (70,8%) | ||
| Intubación: 7 (9,3) | Intubación: 8 (16,6) | ||
| Oxíg. indirecto: 2 (2,7) | PPI (no intub.): 1 (2) | ||
| PPI (no intub.): 1 (1,3) | |||
| SatO2 a los 5min. de vida | Desconocida: 8 (10,7) | Desconocida: 6 (12,5) | 0,701 |
| <75: 14 (18,7) | <75: 12 (25) | ||
| 75-85: 20 (26,6) | 75-85: 9 (18,8) | ||
| >85: 33 (44) | >85: 21 (43,7) | ||
| Minutos de vida al ingreso | Mediana: 17 | Mediana 20 | 0,089 |
| (RIQ 10-30) | (RIQ 14-30) | ||
| Temperatura al ingreso (°C) | Mediana: 36,5 (RIQ 36,3-37) | Mediana 36,4 (RIQ 36-36,8) | 0,799 |
| <32: 0 | <32:0 | ||
| 32-35,9: 8 (10,7) | 32-35,9: 11(22,9) | ||
| 36-36,4: 25 (33,3) | 36-36,4: 14 (29,1) | ||
| 36,5-37,5: 41 (54,7) | 36,5-37,5: 22 (45,8) | ||
| >37,5: 1 (1,3) | >37,5: 1 (2) | ||
| Minutos de vida información familia | Mediana: 17 | Mediana: 30 | 0,002 |
| (RIQ 10-30) | (RIQ 12,5-45) | ||
| Test de Apgar al minuto | Mediana: 7 (RIQ 6-8) | Mediana: 7 (RIQ 5-8) | 0,223 |
| Test de Apgar 5minutos | Mediana: 9 (RIQ 8-9) | Mediana: 8 (RIQ 7-9) | 0,073 |
| Índice CRIB (12horas de vida) | Mediana: 0 (RIQ 0-1) | Mediana: 1 (RIQ 0-2) | 0,146 |
°C: grados Celsius; FiO2: fracción inspiratoria de oxígeno; Intub.:intubado; Min.: minutos; Oxíg.: oxígeno; RCP: reanimación cardiopulmonar; RIQ: rango intercuartílico; SatO2: Saturación de oxígeno.
En negrita, valores estadísticamente significativos.
Al comparar los problemas acontecidos durante la estabilización tampoco existieron diferencias entre los 2 periodos, aunque la tendencia fue a una mayor cantidad de problemas técnicos en la fase preintervención frente al periodo postintervención (14,7% vs. 6,2%, p=0,151). Los problemas de procedimiento tuvieron una incidencia similar en ambos periodos (10,7% vs. 12,5% p=0,754), siendo el más repetido la necesidad de varios intentos de intubación (tabla 5).
Comparación de problemas en la RCP en los 2 periodos estudiados
| Variable RCP | Resultados preintervención | Resultados postintervención | Valor p |
|---|---|---|---|
| N=75 | N=48 | ||
| n (%) | n (%) | ||
| Problemas durante la RCP | 18 (24) | 9 (18,7) | 0,492 |
| Problema técnico | 11 (14,7) | 3 (6,2) | 0,151 |
| Tipo de problema técnico | Pulsioxímetro: 6 | No preparación puesto:1 | |
| No preparación puesto:1 | Temperatura: 1 | ||
| Temperatura: 1 | Pulsioxímetro: 1 | ||
| Gases: 1 | |||
| Tubuladoras: 1 | |||
| CPAP sin presión: 1 | |||
| Problema de procedimiento | 8 (10,7) | 6 (12,5) | 0,754 |
| Tipo de problema de procedimiento | Pulsioxímetros: 4 | Intubación>1 intento: 3 | |
| Intubación>1 intento: 3 | Fijación catéter: 1 | ||
| Extubación accidental:1 | Extubación accidental: 1 | ||
| No bolsa polietileno:1 | FiO2 100% inadvertida: 1 | ||
| (coexisten 2 errores en una RCP) |
FiO2: fracción inspiratoria de oxígeno; RCP: reanimación cardiopulmonar.
En el momento actual existe una evidencia limitada que sugiere una mejora del rendimiento a corto plazo en las RCP neonatales tras el uso de briefings y debriefings, sin que haya datos sobre repercusión clínica en la evolución del paciente7,9. En nuestra investigación hemos podido verificar que su uso, unido a la realización de checklists y AASTR de los puestos de estabilización, fue factible en distintas unidades de tercer nivel, pero que no tuvo un impacto clínico en las principales variables estudiadas durante la reanimación y al ingreso de los recién nacidos<32sEG. En contraposición, Sauer et al. apreciaron una mejoría en el porcentaje de recién nacidos con temperatura axilar normal al ingreso tras aplicar diversas herramientas similares a las nuestras18. Sin embargo, en dicha investigación se incluyeron neonatos de todas las edades gestacionales, lo que puede explicar los valores relativamente altos de normotermia comparados con nuestro grupo de estudio. Otros trabajos que han analizado específicamente el valor de checklists y debriefings en las RCP de niños prematuros han demostrado también un aumento de la temperatura al ingreso de estos recién nacidos, aunque en algunos casos han tenido que pasar 5 años desde la utilización de esas herramientas para poder encontrar mejoras significativas20. Este es un aspecto que creemos debe ser tenido en cuenta: todas las herramientas de calidad precisan un cierto tiempo de aprendizaje para implementarlas de manera satisfactoria, y es posible que, a pesar del tiempo prolongado de duración de nuestra investigación, todavía nos hallemos en fases iniciales de la curva de aprendizaje de su utilización.
Por otra parte, no hemos encontrado diferencias en cuanto a la rapidez en la valoración de oxigenación en los recién nacidos incluidos en el estudio en ambos periodos. Sin embargo, en el periodo postintervención, en aquellos neonatos que no tenían lectura de saturación a los 3minutos de vida, sí hallamos valores con significación estadística en el tiempo necesario hasta obtener una adecuada información del pulsioxímetro, con una reducción de un minuto con respecto a la fase preintervención. Esta diferencia puede ser un indicador indirecto de una mejor coordinación por parte de los miembros del equipo asistencial y ha sido descrita en otros trabajos similares19.
Otra de las variables clínicas en la que no encontramos diferencias fue la necesidad de intubación en este grupo de niños en los 2 periodos estudiados. Paradójicamente, el porcentaje de recién nacidos intubados y que requirió surfactante fue superior en el grupo postintervención, aunque sin significación estadística. De todas formas, tanto la necesidad de adrenalina (en 4 reanimaciones de la fase postintervención), como los minutos de vida en los que se informó a la familia (superior en este segundo periodo), son indicadores indirectos de una mayor complejidad en el procedimiento que puede justificar estos resultados. También lo son la tendencia (sin significación estadística) a una puntuación del test de Apgar a los 5minutos menor, y a un mayor demora en su ingreso en UCIN en el periodo postintervención. Además, a pesar de la aparente homogeneidad de los prematuros incluidos en el estudio en ambos periodos, el uso de corticoides prenatales en pauta completa fue inferior en la fase postintervención, sin significación estadística pero con el suficiente impacto clínico para condicionar una mayor inmadurez respiratoria en los niños de esta fase del estudio y, por ende, una mayor necesidad de intubación en la sala de partos.
Los problemas técnicos o de procedimiento ocurrieron en un porcentaje relativamente alto de las RCP estudiadas en ambos periodos: un 24% en el periodo preintervención y un 18,7% en el postintervención. Hay que tener en cuenta que este tipo de problemas, debidos en general a una mala preparación del puesto de reanimación, pueden ser solventados con un checklist reglado de estos puestos y con la realización de AASTR. El hecho de haber objetivado con las AASTR del periodo postintervención una mejor preparación de los puestos, y de haberse realizado listas de comprobación estructuradas previas al procedimiento en un alto porcentaje de las reanimaciones, nos hace pensar que ambas medidas repercuten en la menor cantidad de problemas técnicos encontrados en esa fase del estudio, y que no se alcanzan diferencias significativas debido al tamaño muestral. Por tanto, aunque solo se puede hablar de tendencias, creemos que la repercusión en la práctica clínica del descenso en el número de problemas técnicos sí es lo suficientemente relevante como para ser tenida en cuenta.
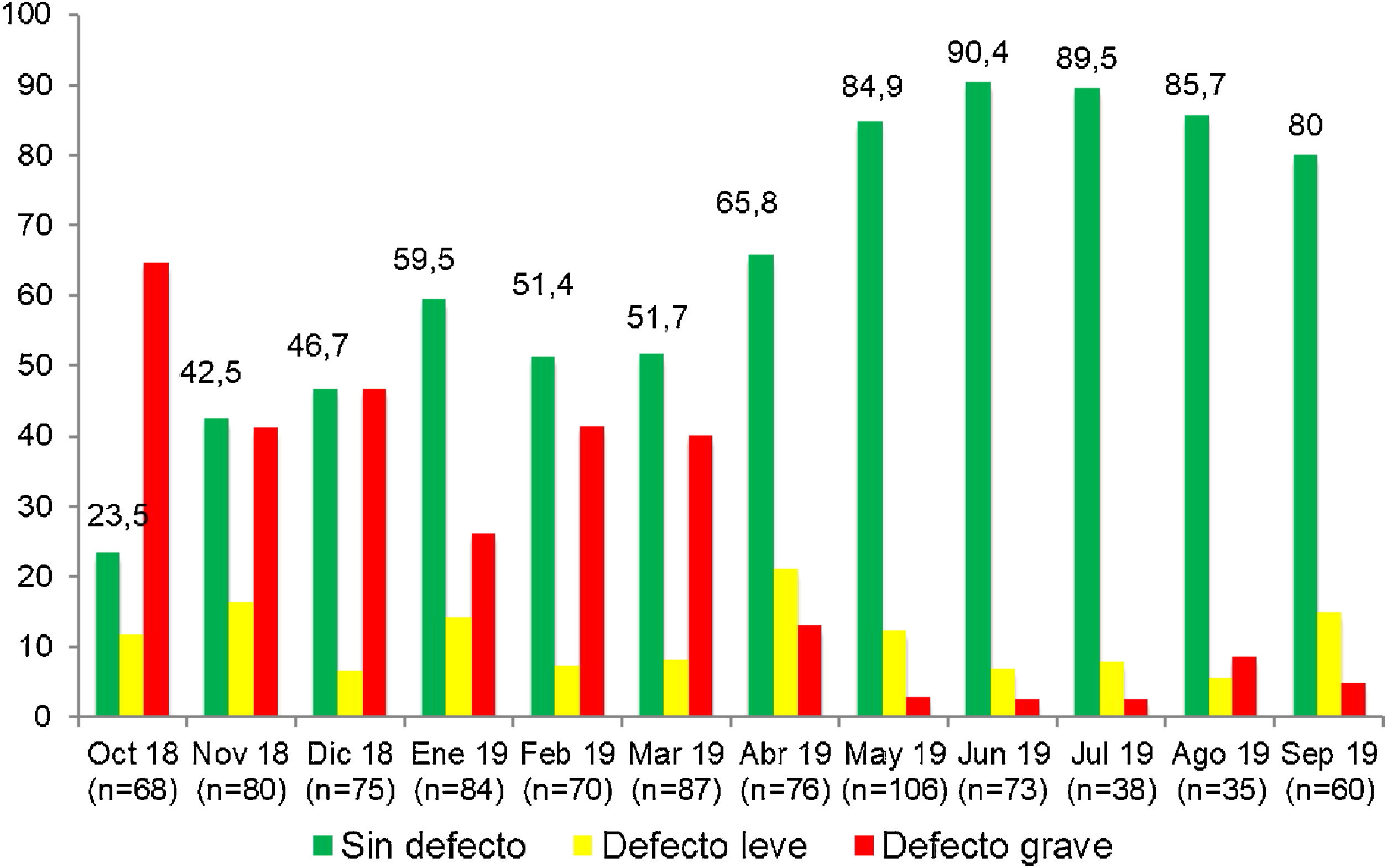
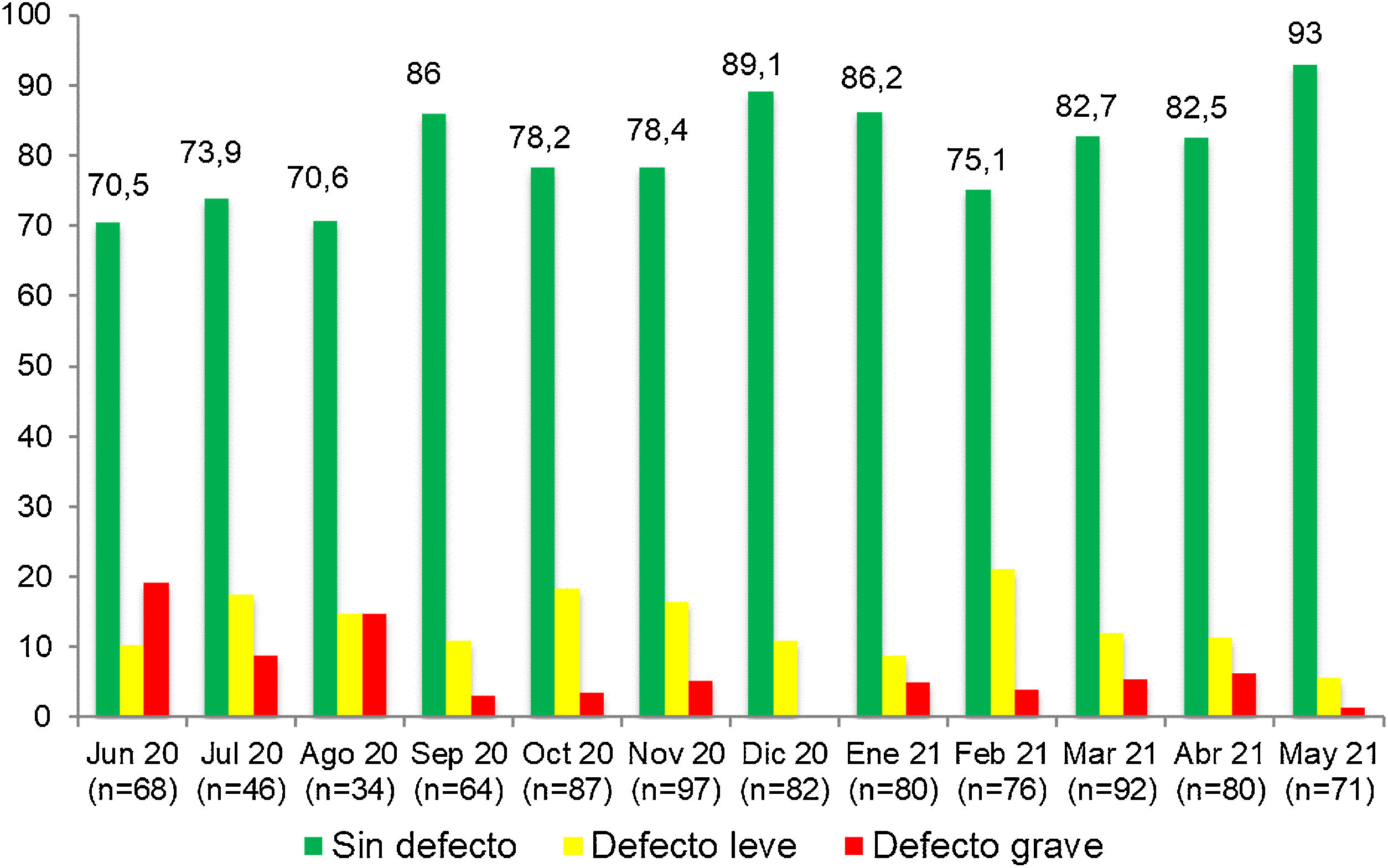
En nuestro trabajo hemos introducido las AASTR de los puestos de reanimación como una de las herramientas de calidad a utilizar en sala de partos, lo que supone un hecho novedoso. En el periodo preintervención solo un 62,7% de los puestos de RCP estaban total, completa y correctamente preparados para atender a una situación crítica. En este periodo la mayoría de los defectos leves encontrados tenían que ver con problemas en la preparación del puesto de reanimación (preajustes de ventilación, oxigenación o aspiración incorrectos), y como contraposición los defectos graves tuvieron que ver con la ausencia de material o medicación específica y necesaria para la reanimación23. En otros trabajos neonatales que realizaron AASTR en diferentes áreas o procedimientos dentro de las UCIN también se detectaron porcentajes de auditorías satisfactorias sorprendentemente bajos, y en consonancia con nuestros resultados12-14. Como contraste a estos datos, en el periodo postintervención el porcentaje de AASTR sin defecto aumentó considerablemente: un 80,1% no mostraron ningún tipo de error, evidenciándose también un ascenso progresivo de las AASTR sin defecto a lo largo del desarrollo del estudio. Estas auditorías permiten, por tanto, detectar problemas en procedimientos y equipos que una vez subsanados no se perpetúan en el tiempo, como se puede observar en las figuras 1 y 2 que recogen gráficamente la evolución de los resultados de las AASTR de los puestos de reanimación a lo largo del desarrollo del estudio.
Basándonos en el alto porcentaje de reanimaciones de la fase postintervención, en el que se aplicaron la totalidad de las herramientas asistenciales a estudio, hemos podido comprobar que su uso es, en general, bien aceptado por los equipos donde se instauran, tal y como ha sido descrito en otras publicaciones24,25. Al igual que en estos trabajos hemos encontrado una mayor dificultad para hacer los debriefings24. Ello puede deberse a varias barreras ya conocidas26,27: falta de tiempo, ausencia de personal moderador cualificado, no existencia de un lugar adecuado para desarrollarlos o miedo a posibles consecuencias legales. Sin embargo, es fundamental realizarlos, eliminando algunas de estas barreras, ya que hay publicaciones que indican que el uso de debriefings efectivos puede mejorar las habilidades individuales y de los equipos asistenciales hasta un 25% después de su uso28.
LimitacionesA pesar de su carácter multicéntrico, los resultados obtenidos en nuestra investigación pueden no tener extrapolación en otras unidades de niveles asistenciales diferentes a las que participaron en el trabajo, en especial aquellas que atienden a recién nacidos todavía más vulnerables, con menor edad gestacional y en las que los procedimientos de trabajo pueden ser diferentes. Sin embargo, en 2020, último año del que existen datos publicados, del total de niños nacidos en la Comunidad de Madrid un 64% lo hicieron en hospitales del mismo o menor nivel asistencial que las unidades participantes en este trabajo29. Creemos que en estos centros los resultados de este trabajo sí que pueden tener una extrapolación a la práctica clínica habitual, ya que los protocolos de preparación y revisión de los puestos de estabilización en la sala de partos y la propia dotación humana y material de estas áreas son similares a los expuestos en este estudio. Por otra parte, la no inclusión de RCP de niños menores de 28 semanas de edad gestacional que son atendidos en unidades con mayor categorización asistencial, y que son más vulnerables a problemas durante la estabilización, ha podido tener como consecuencia que la mejora de la preparación de los puestos de reanimación objetivada en el periodo postintervención, y el uso mayoritario del resto de herramientas asistenciales no haya tenido la repercusión clínica esperada en nuestros neonatos.
Otro aspecto para considerar es el descenso del número de prematuros nacidos en la segunda fase del estudio (un 36% menos), de forma generalizada y en todos los centros, posiblemente reflejo de un decremento en la natalidad tras la pandemia por la COVID-19 vivida en nuestro país desde marzo de 2020. Este descenso ha hecho que el número de neonatos incluidos en las 2 fases del estudio hayan sido dispares, lo que sin duda dificulta la extracción de conclusiones sólidas en su comparación.
Hay que señalar que no se realizó una comparación específica entre las reanimaciones del periodo preintervención con aquellas otras realizadas en la fase postintervención en las que se hubieran aplicado todas las herramientas de mejora de calidad asistencial. Aunque poco probable por la diferencia en el tamaño muestral de las reanimaciones incluidas en el segundo periodo, este hecho hubiera podido modificar la significación estadística de los distintos parámetros clínicos estudiados, lo que puede suponer un sesgo de selección.
Con respecto a la mejoría de los porcentajes de AASTR sin defecto a lo largo de ambos periodos del estudio, hay que referir que, aunque el personal del paritorio desconocía la existencia del trabajo, el hecho de que en algunas ocasiones los investigadores de cada centro detectaran errores y los corrigieran con el fin de evitar o perpetuar incidentes asistenciales graves, puede suponer también un sesgo a la hora de explicar estos resultados.
Por último, otra limitación de nuestra investigación es la ausencia de videograbación de las reanimaciones incluidas en el desarrollo del estudio. Para la recogida de datos de estas reanimaciones se optó porque uno de los miembros del equipo asistencial se encargara específicamente de anotar los tiempos en los que se llevaban a cabo los diversos pasos de la estabilización neonatal. Este hecho puede suponer un sesgo a la hora de la captación de estos datos, pues no es tan objetivo ni preciso como una videograbación donde se analiza en profundidad el procedimiento y se obtienen los datos de manera más fiable, más aún en una actuación tan compleja como es la RCP neonatal, en la que diversos trabajos han incidido en la dificultad de recoger datos y documentar su desarrollo de forma precisa30,31.
ConclusionesLa introducción de un conjunto de herramientas de calidad asistencial consistente en AASTR de puestos de reanimación neonatal, y realización de checklists estructurados, briefings y debriefings en la estabilización del prematuro<32sEG al nacimiento es factible en unidades nivel iii-A, aunque no tiene una influencia clara en la mejor ejecución del procedimiento ni en la temperatura al ingreso o manejo respiratorio durante la estabilización de estos neonatos. El uso de AASTR de los puestos de reanimación en el paritorio mejora significativamente su preparación. Se necesitan más estudios que determinen el impacto clínico, a corto y largo plazo, del uso de estas herramientas en la reanimación de aquellos recién nacidos más vulnerables.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.