La enfermedad celíaca es un proceso sistémico de carácter inmunológico, desencadenado por el consumo de gluten, que se da en sujetos genéticamente predispuestos. Se expresa con una gran variedad de síntomas clínicos, marcadores serológicos específicos, haplotipo HLA-DQ2/DQ8 y enteropatía. El tratamiento consiste en eliminar de por vida el gluten de la dieta, por lo que es fundamental un diagnóstico adecuado. Los criterios seguidos para ello han sido habitualmente los establecidos por la European Society for Paediatric Gastroenterology, Hepatology and Nutrition (ESPGHAN) desde 1969. Estos criterios han ido evolucionando desde la necesidad de varias biopsias intestinales para el diagnóstico a, gracias al desarrollo de pruebas serológicas de alta sensibilidad y especificidad, considerar la enteropatía como un elemento más en este diagnóstico y posibilitar en determinadas circunstancias realizarlo sin necesidad de biopsia intestinal. La revisión actualizada en 2019 de los criterios 2012 aporta nueva evidencia sobre algunos aspectos, como el papel del HLA, el diagnóstico de los pacientes asintomáticos y la eficacia de los marcadores serológicos. Estos aspectos se revisan en detalle, con el objetivo de facilitar la aplicación de los nuevos criterios 2020 de una forma racional en todos los niveles asistenciales. En este sentido el pediatra de Atención Primaria es fundamental para la búsqueda activa de casos y realizar un primer estudio serológico, recomendándose que el diagnóstico sea siempre establecido por un pediatra gastroenterólogo.
Coeliac disease is a systemic immune-mediated disorder triggered by the ingestion of gluten, which is given in genetically predisposed subjects. It manifests with a wide variety of clinical symptoms, specific serological markers, HLA-DQ2/DQ8 haplotype and enteropathy. The criteria followed for this have usually been those established by the European Society for Paediatric Gastroenterology, Hepatology and Nutrition (ESPGHAN) since 1969. These criteria have advanced from the need of several intestinal biopsies to, thanks to the development of serological tests of high sensitivity and specificity, considering the enteropathy as one more element in this diagnosis and makes it possible to perform a diagnosis without the need of an intestinal biopsy in certain circumstances. The updated review of the 2012 criteria in 2019 provides new evidence on some aspects, such as the role of HLA, the diagnosis of asymptomatic patients, and the effectiveness of the serological markers. These aspects are reviewed in detail, with the aim of facilitating the rational application of the new 2020 criteria at all care levels. In this sense, Paediatric Primary Care is fundamental in the search for active cases and to perform a first serological study, being recommended that the diagnosis is always established by a Paediatric Gastroenterologist.
Según la reciente definición de la European Society for Paediatric Gastroenterology, Hepatology and Nutrition (ESPGHAN)1, la enfermedad celíaca (EC) es un proceso sistémico de carácter inmunológico, desencadenado por el consumo de gluten y de otras prolaminas relacionadas (secalinas, hordeínas y, posiblemente, aveninas) que se da en sujetos genéticamente predispuestos (sistema HLA). Cursa con una combinación variable de síntomas clínicos, marcadores serológicos específicos, haplotipo HLA-DQ2/DQ8 y enteropatía.
El tratamiento consiste en eliminar de por vida y de forma estricta el gluten de la dieta, consiguiéndose con ello la normalización clínica, la negativización de autoanticuerpos y la recuperación histológica de la mucosa intestinal.
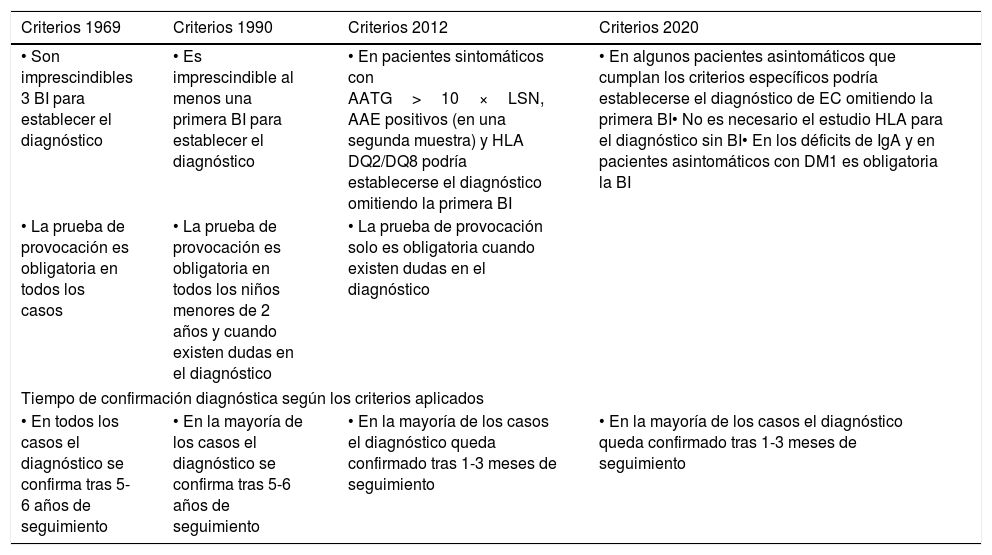
Evolución de los criterios para el diagnósticoEn 1969, ESPGHAN estableció por primera vez unos criterios estrictos para el diagnóstico de EC en población pediátrica: los llamados criterios de Interlaken2 (tabla 1). Establecían como obligatorio la demostración de atrofia de las vellosidades intestinales en una primera biopsia intestinal (BI) consumiendo gluten, normalización histológica tras la retirada del gluten y reaparición de la lesión tras su reintroducción (prueba de provocación) para diferenciar la EC de otras causas de enteropatía.
Evolución de los criterios ESPGHAN para el diagnóstico de la EC
| Criterios 1969 | Criterios 1990 | Criterios 2012 | Criterios 2020 |
|---|---|---|---|
| • Son imprescindibles 3 BI para establecer el diagnóstico | • Es imprescindible al menos una primera BI para establecer el diagnóstico | • En pacientes sintomáticos con AATG>10×LSN, AAE positivos (en una segunda muestra) y HLA DQ2/DQ8 podría establecerse el diagnóstico omitiendo la primera BI | • En algunos pacientes asintomáticos que cumplan los criterios específicos podría establecerse el diagnóstico de EC omitiendo la primera BI• No es necesario el estudio HLA para el diagnóstico sin BI• En los déficits de IgA y en pacientes asintomáticos con DM1 es obligatoria la BI |
| • La prueba de provocación es obligatoria en todos los casos | • La prueba de provocación es obligatoria en todos los niños menores de 2 años y cuando existen dudas en el diagnóstico | • La prueba de provocación solo es obligatoria cuando existen dudas en el diagnóstico | |
| Tiempo de confirmación diagnóstica según los criterios aplicados | |||
| • En todos los casos el diagnóstico se confirma tras 5-6 años de seguimiento | • En la mayoría de los casos el diagnóstico se confirma tras 5-6 años de seguimiento | • En la mayoría de los casos el diagnóstico queda confirmado tras 1-3 meses de seguimiento | • En la mayoría de los casos el diagnóstico queda confirmado tras 1-3 meses de seguimiento |
AAE: anticuerpos antiendomisio; AATG: anticuerpos antitransglutaminasa; BI: biopsia intestinal; DM1: diabetes mellitus 1; EC: enfermedad celíaca; ESPGHAN: European Society for Paediatric Gastroenterology, Hepatology and Nutrition; LSN: límite superior de la normalidad.
Fuente: ESPGHAN 20121; Meeuwisse2; ESPGHAN 19904; ESPGHAN 202013.
La aplicación de estos criterios junto con el hallazgo a principio de los años 80 de un marcador de EC activa, los anticuerpos antigliadina (AAG)3, propició su revisión, estableciéndose los nuevos «Criterios ESPGHAN 1990 para el diagnóstico de la EC»4. Estos criterios permitían, en niños mayores con síntomas sugestivos de EC, establecer el diagnóstico tras una única BI consumiendo gluten con lesiones histológicas características (aunque no específicas) y respuesta clínica a la exclusión del gluten de la dieta. La prueba de provocación se reservaba para menores de 2 años en el momento de la primera BI, diagnóstico realizado sin BI y ante cualquier duda diagnóstica.
A mitad de los años 80 se objetivaron los anticuerpos antiendomisio (AAE)5 y en 1997 se identificó la transglutaminasa tisular (TG) como el autoantígeno en la EC y posteriormente la presencia de anticuerpos antitransglutaminasa tisular 2 (AATG) circulantes. Ambos tipos de anticuerpos mostraban una sensibilidad y especificidad similares y una mayor eficacia que los AAG como marcador de EC activa6.
El siglo XXI: un nuevo escenarioLos criterios ESPGHAN 1990 siguieron en vigor hasta que numerosos estudios demostraron la excelente correlación entre niveles elevados de AATG y grado de atrofia vellositaria6,7 y el valor de los AAE como predictores de lesión8. Se cuestionó la evaluación histológica convencional como patrón oro para el diagnóstico de EC8,9 y la necesidad de prueba de provocación en menores de 2 años, dado que la mayoría de estos con atrofia vellositaria y AAE positivos recaían al realizarla9.
Como consecuencia de la evidencia acumulada, se publicaron en 2012 las nuevas «ESPGHANguidelinesforthediagnosisforcoeliacdiseaseinchildrenandadolescents. Anevidence-basedapproach»1, con una innovadora definición de EC que considera la enteropatía como un elemento más del diagnóstico, no como un criterio indispensable. Se plantea la posibilidad de diagnóstico sin BI en determinados casos (clínica sugestiva, AATG positivos a títulos altos, AAE positivos en una segunda muestra y HLA compatible). Tras confirmarse en los años siguientes que el diagnóstico sin biopsia era seguro en esos casos10–12, la revisión actualizada en 2020 de los criterios 2012 aporta nueva evidencia sobre algunos aspectos, como el papel del HLA, el diagnóstico de los asintomáticos y la eficacia de los marcadores serológicos13. Estos aspectos se revisan a continuación en detalle, con el objetivo de facilitar la aplicación de los nuevos criterios 2020 de una forma racional, tanto en Atención Primaria como Hospitalaria.
Papel de la clínicaLos síntomas y signos clínicos relacionados con la EC (tabla 2) son los que en su momento hacen sospechar la existencia de la enfermedad y obligan a descartarla.
Cuándo valorar el diagnóstico de EC
| En niños y adolescentes que presenten los siguientes síntomas de etiología en principio no filiada |
| Síntomas gastrointestinales |
| Diarrea crónica o intermitente |
| Distensión abdominal |
| Náuseas o vómitos de repetición |
| Dolor abdominal crónico |
| Estreñimiento crónico |
| Síntomas extraintestinales |
| Fallo de medro, pérdida de peso, estancamiento en el crecimiento |
| Anemia por déficit de hierro |
| Alteración en las pruebas de función hepática |
| Aftosis bucal recurrente |
| Talla corta |
| Retraso puberal, amenorrea |
| Dermatitis herpetiforme |
| Fatiga crónica, irritabilidad |
| Fracturas óseas ante traumatismos banales/osteopenia/osteoporosis |
| Neuropatía |
| Artritis, artralgias |
| Defectos del esmalte dental |
| En niños y adolescentes que pertenecen a alguno de los siguientes grupos de riesgo |
| Familiares en 1.ergrado de individuos con EC |
| Diabetes mellitus tipo 1 |
| Enfermedad tiroidea autoinmune |
| Enfermedad hepática autoinmune |
| Síndrome de Down |
| Síndrome de Turner |
| Síndrome de Williams |
EC: enfermedad celíaca.
Fuente: Adaptado de ESPGHAN 202013.
La información disponible sobre la presentación clínica de la EC ha experimentado un cambio drástico con el desarrollo de pruebas serológicas de alta sensibilidad y especificidad. Se han identificado nuevos pacientes con síntomas digestivos leves, síntomas considerados como no clásicos (síntomas extradigestivos) o casos asintomáticos, así como situaciones asociadas a un aumento de riesgo de la EC, lo que ha llevado a un cambio en las formas clínicas diagnosticadas, con un aumento de las no clásicas y asintomáticas. La EC ha pasado de considerarse una enfermedad pediátrica a ser una enfermedad diagnosticada en todas las edades de la vida14.
Respecto a la especificidad de la clínica, en un reciente estudio sobre una cohorte de pacientes con serología positiva para EC, el cuadro de malabsorción (diarrea crónica, pérdida de peso, fallo de medro y anemia), añadido a unos altos niveles de anticuerpos específicos (AATG>10 veces el límite superior de la normalidad [LSN] y AAE positivos), confería un valor predictivo positivo de un 100% para lesión intestinal frente a un valor algo menor si se trataba de cualquier otro síntoma12.
También es obligado estudiar la enfermedad en determinadas situaciones con un aumento de riesgo para la misma, como son las enfermedades autoinmunes, algunas cromosomopatías, déficit de IgA y la familiaridad de primer grado (tabla 2)13.
Por otra parte, todavía es un tema controvertido la indicación de cribado en población general, ya que la EC no cumple los criterios establecidos para ello por la OMS. Diferentes grupos de expertos mantienen la recomendación de la búsqueda activa de casos establecida por ESPGHAN, dada la falta de evidencia sobre la evolución de los pacientes asintomáticos no diagnosticados15,16.
Papel de la serologíaLa elevada precisión de los test utilizados para la determinación de estos anticuerpos ha hecho que la serología sea la primera línea de investigación en pacientes con sospecha de EC.
Anticuerpos antitransglutaminasaLos AATG IgA son los que deben determinarse en primer lugar en el diagnóstico de la EC por su elevada sensibilidad y especificidad, añadido a su disponibilidad y su realización por un método automatizado y objetivo (enzimoinmunoanálisis). En un metaanálisis reciente16 estos valores fueron del 92,8% (IC 95%, 90,3-94,8%) y 97,9% (IC 95%, 96,4-98,8%) respectivamente. Los títulos elevados de AATG IgA, superiores a 10 veces el LSN, predicen la existencia de lesión de las vellosidades intestinales con gran especificidad17. En algunas ocasiones se han descrito valores falsos positivos, habitualmente a títulos bajos, por reacción cruzada con anticuerpos en otras situaciones clínicas, como enfermedades autoinmunes, enfermedades hepáticas e infecciones18.
Anticuerpos antiendomisioLos AAE reaccionan con el endomisio, tejido conectivo perivascular entre las fibras musculares lisas. Actúan frente a la transglutaminasa en tejidos como el esófago de mono y el cordón umbilical, utilizados como substratos en los test desarrollados para su determinación. La precisión diagnóstica de los AAE IgA es muy elevada19, por una alta sensibilidad y especificidad13. Su mayor inconveniente radica en que se realizan mediante inmunofluorescencia indirecta, técnica semicuantitativa y subjetiva, más cara, que precisa de personal experto y de más tiempo que la determinación de AATG.
Anticuerpos antipéptidos desamidados de gliadinaLos péptidos de gliadina son desamidados por la transglutaminasa tisular, produciéndose un aumento importante de su inmunogenicidad, por lo que se han desarrollado métodos que detectan anticuerpos antipéptidos desamidados de gliadina (AAPDG), que han sustituido a los antiguos AAG. Tienen la ventaja de determinarse mediante técnica objetiva de enzimoinmunoanálisis. La sensibilidad y especificidad de los AAPDG IgA e IgG es del 87,8% (IC 95%, 85,6-89,9%) y 94,1% (IC 95%, 92,5-95,5%), respectivamente16. Los AAPDG IgG son útiles para el estudio de la EC en pacientes con déficit selectivo de IgA20. Sin embargo, no han conseguido superar a los AATG IgA y la positividad aislada de estos anticuerpos da lugar a resultados falsos positivos que aumentan el número de endoscopias innecesarias21–23.
Test de lectura rápidaSe realizan mediante inmunocromatografía, por lo que no son cuantitativos. Utilizan unas gotas de sangre capilar que difunden sobre un soporte sólido, apareciendo una línea en la ventana del test si es positivo. Detectan AATG, AAPDG, AAG o combinaciones de varios. Han sido utilizados como cribado no invasivo de la EC con buena correlación con la serología estándar, siempre que la lectura sea realizada por personal entrenado. La sensibilidad y especificidad de estos test es del 94,0% (IC 95%, 89,9-96,5%) y 94,4% (IC 95%, 90,9-96,5%) respectivamente, aunque la experiencia es aún limitada para poder ser usados en la práctica clínica habitual y los resultados deben confirmarse siempre mediante serología estándar24.
Limitaciones de los test serológicosAunque la determinación de los AATG IgA no está estandarizada, la mayoría de los test comerciales muestran una elevada precisión, sobre todo a títulos altos25. Sin embargo, se han observado variaciones entre diferentes test y entre laboratorios usando el mismo test en niveles de AATG leves-moderados12. Los laboratorios deben extremar las medidas internas de control de calidad, con cálculo adecuado de la curva de calibración que incluya el valor de 10 veces el LSN13.
El estudio serológico debe efectuarse mientras el paciente consume gluten, ya que el nivel de anticuerpos disminuye tras iniciar una dieta sin o baja en gluten. En opinión de expertos, si durante el proceso diagnóstico el paciente ha retirado el gluten, se recomienda realizar una dieta normal, de al menos 3 rebanadas de pan al día durante 1 a 3 meses, y repetir los AATG26.
Con la primera determinación de AATG IgA debe realizarse siempre una cuantificación de IgA sérica total, ya que, en caso de déficit selectivo de IgA, deben usarse los AATG IgG, AAE IgG o AAPDG IgG1,13. A diferencia de los AATG IgA, no hay estudios que hayan valorado que niveles de AATG IgG pueden predecir con fiabilidad la existencia de lesión intestinal. Por tanto, en estos niños, la realización de BI es obligatoria para confirmar el diagnóstico13. Otras causas de falsos negativos son el tratamiento con inmunosupresores y la dermatitis herpetiforme, frecuentemente seronegativa. También la determinación en muestras de sangre hemolizada puede dar lugar a un falso descenso de niveles de anticuerpos27.
Tampoco hay estudios suficientes que relacionen los títulos elevados de AATG con la existencia de lesión intestinal en niños con diabetes mellitus tipo 1 (DM1). Además, se han descrito títulos elevados de AATG en la fase de inicio de la DM1 y negativización espontánea posterior de títulos moderados28,29, por lo que en estos pacientes recomendamos la realización de BI para confirmar el diagnóstico de EC.
Papel del estudio genéticoLa EC se asocia a un HLA específico de riesgo localizado en la región HLA de clase II, cuyos alelos codifican moléculas implicadas en la presentación de péptidos de gluten a los linfocitos T específicos, participando así en la cascada inmunológica del proceso de pérdida de tolerancia al gluten. Más del 90% de pacientes con EC son portadores de una o 2 copias de HLA DQ2.5 codificado por el gen DQA1*05 (cadena alfa) y el gen DQB1*02 (cadena beta). Ser portador de HLA-DQ2.2 (DQA1*02-DQB1*02) de forma aislada confiere mucho menor riesgo, ya que, aunque es homólogo al DQ2.5, tiene menor estabilidad en la unión peptídica. Aquellos pacientes que no portan DQ2 son DQ8, codificado por DQA1*0301-DQB1*03021. Existen diversas combinaciones de los 2 alelos relacionados con estos genes que infieren en el individuo un determinado riesgo de tener EC30. El HLA de clase II representa el 40% del riesgo genético, mientras que otras zonas del genoma solo han demostrado una influencia menor del 10%31. La complejidad en la interpretación del HLA ha llevado a lo largo de los últimos años a diversos esfuerzos en la unificación de la nomenclatura32 (Anexo: Propuesta de informe de HLA clase II).
Los HLA de riesgo son relativamente frecuentes en algunas poblaciones, lo que se asocia a mayor tasa de incidencia de EC si en esa población el consumo de trigo y gramíneas es habitual, como es el caso de la población española30. En este sentido la tipificación HLA es de baja utilidad para el diagnóstico, dado su bajo valor predictivo positivo. Sin embargo, su alto valor predictivo negativo le confiere gran utilidad para descartar EC en casos de dudas diagnósticas, así como para establecer el riesgo de desarrollar EC en grupos de mayor prevalencia12,19,33,34.
Estudios recientes han documentado que prácticamente el 100% de casos con un título de AATG superior a 10 veces el LSN, AAE positivos y lesión histológica son DQ2/DQ8, por lo cual el estudio HLA no sería imprescindible para confirmar el diagnóstico sin BI12,19, ya que solo los individuos DQ2/DQ8 pueden producir estos anticuerpos35.
Por todo lo anterior, se puede establecer que la interpretación del HLA y su riesgo es una herramienta más en el manejo de la EC y debería ser realizada por pediatras especialistas en Gastroenterología Pediátrica con experiencia clínica en EC1,13, por lo que no recomendamos el estudio HLA como prueba inicial de cribado en Atención Primaria.
Papel de la biopsia intestinalLa BI ha dejado de ser imprescindible para el diagnóstico de todos los casos de EC1, pero es indiscutible que sigue siendo un pilar fundamental.
Existen ciertas dificultades en su interpretación histológica y, como consecuencia, resultados discordantes entre patólogos. Para optimizar el estudio de la mucosa intestinal, se recomienda la toma de múltiples biopsias mediante endoscopio, obteniendo al menos 4 biopsias a nivel duodenal y una en bulbo, ya que, en ocasiones, esta localización es la única con lesión1,13.
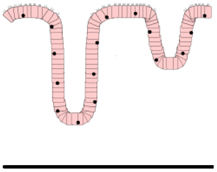
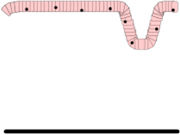
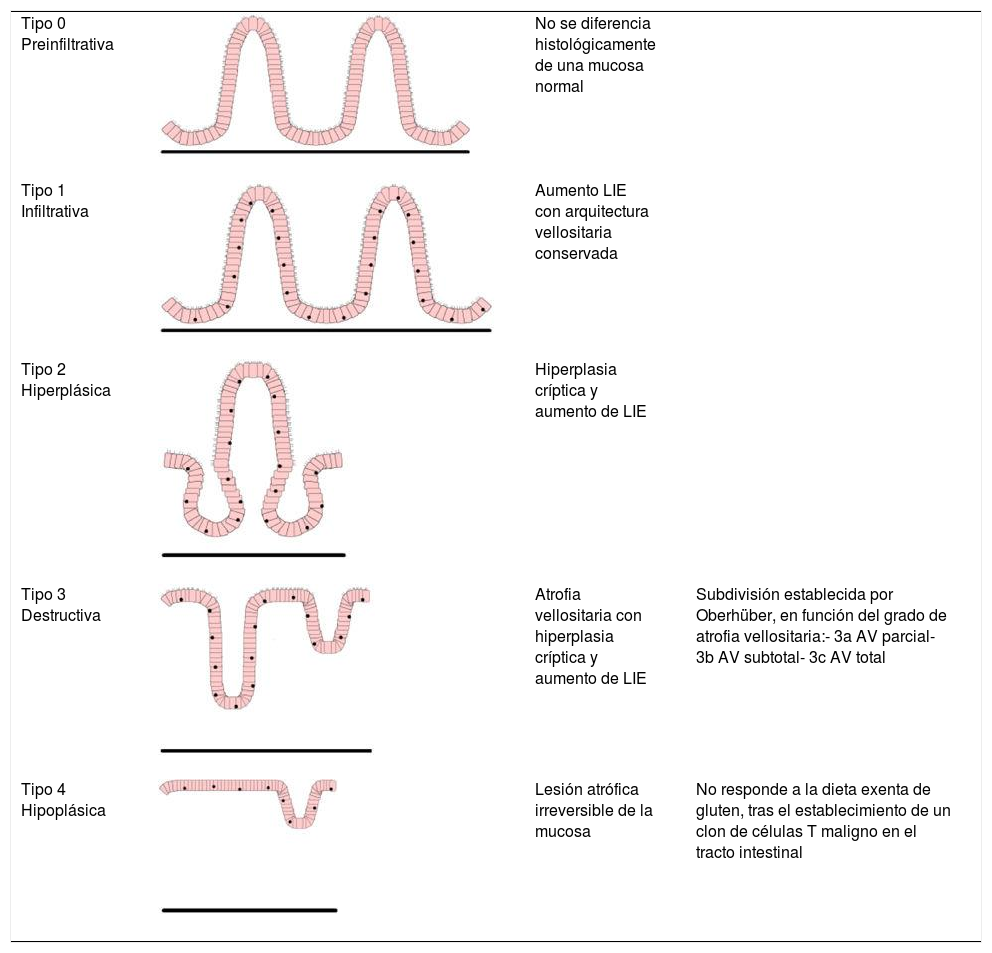
Es necesario emplear métodos estandarizados para la correcta orientación y corte de la biopsia duodenal. Se considera diagnóstico de EC una relación inferior a 2 entre la altura de la vellosidad y la profundidad de la cripta, al menos en una de las BI36. Generalmente, se emplea la clasificación de Marsh modificada por Oberhüber37 para categorizar las distintas lesiones histológicas (tabla 3). Para el diagnóstico de EC se requiere la presencia de lesión Marsh 2 o 3, aunque ninguna lesión es patognomónica.
Clasificación de Marsh-Oberhüber
| Tipo 0 Preinfiltrativa | No se diferencia histológicamente de una mucosa normal | ||
| Tipo 1 Infiltrativa | Aumento LIE con arquitectura vellositaria conservada | ||
| Tipo 2 Hiperplásica | Hiperplasia críptica y aumento de LIE | ||
| Tipo 3 Destructiva | Atrofia vellositaria con hiperplasia críptica y aumento de LIE | Subdivisión establecida por Oberhüber, en función del grado de atrofia vellositaria:- 3a AV parcial- 3b AV subtotal- 3c AV total | |
| Tipo 4 Hipoplásica | Lesión atrófica irreversible de la mucosa | No responde a la dieta exenta de gluten, tras el establecimiento de un clon de células T maligno en el tracto intestinal |
AV: atrofia vellositaria; LIE: linfocitos intraepiteliales.
Fuente: Oberhüber et al.37.
Es importante que en el informe del patólogo conste:
- •
Si la muestra es suficiente.
- •
Si está bien orientada para valorar la altura de las vellosidades.
- •
Porcentaje de linfocitos intraepiteliales (LIE) en relación a células epiteliales.
- •
Si existe hiperplasia de criptas (presencia de mitosis).
- •
Grado de atrofia vellositaria.
El hallazgo de lesión Marsh 1 (recuento superior a 25 LIE por 100 células epiteliales) no es suficiente para confirmar el diagnóstico de EC, ya que esta lesión puede ser debida a otras etiologías como alergia alimentaria, infecciones (virus, Giardia, Cryptosporidium, Helicobacter pylori), fármacos, enfermedades autoinmunes, enfermedad inflamatoria intestinal, etc.38. También puede observarse en la EC potencial (pacientes con lesión intestinal leve Marsh 0 o 1 y AATG y AAE positivos, junto a HLA de riesgo), en los que es controvertido recomendar una dieta exenta de gluten39. En estos casos puede ser de ayuda el patrón citométrico de subpoblaciones de linfocitos intraepiteliales (aumento de células T CD3+ TCR gamma delta acompañadas de una disminución de las células NK-like) o la presencia de depósitos de anticuerpos frente a transglutaminasa tisular a nivel intestinal13,39.
A pesar de todo esto, en ocasiones, se encuentran discordancias entre los resultados de los AATG y la histopatología. En estos casos se recomienda reevaluar la biopsia mediante nuevos cortes de la pieza o con una segunda opinión de un patólogo experto13.
Criterios European Society for Paediatric Gastroenterology, Hepatology and Nutrition 2012Teniendo en cuenta la excelente correlación de los AATG IgA y los AAE IgA con la presencia de lesión intestinal, las Guías ESPGHAN 20121 contemplaron la posibilidad de efectuar el diagnóstico de EC sin necesidad de BI solo y exclusivamente en pacientes con:
- •
Sintomatología sugestiva.
- •
Títulos de AATG IgA superiores a 10 veces el LSN.
- •
AAE IgA positivos como test de mayor especificidad, efectuados en una muestra posterior, para confirmar y minimizar la posibilidad de error de la técnica o del etiquetado en la determinación de los AATG.
- •
HLA-DQ compatible (DQ2 y/o DQ8).
La precisión de este modelo se confirmó en 2 amplios estudios publicados en 201712,19. Aplicado en la práctica clínica habitual se evitan al menos un 35% de las BI, fundamentalmente en niños con edad inferior a 5 años, habitualmente los más sintomáticos40.
En los últimos años se ha valorado el papel de la serología y los criterios ESPGHAN 2012 en otros escenarios diagnósticos diferentes al del paciente sintomático. Se ha observado que niveles de AATG IgA superiores a 10 veces el LSN también predicen la existencia de lesión intestinal en pacientes asintomáticos, aunque el valor predictivo positivo puede ser menor que en pacientes sintomáticos12,13.
Actualización criterios 2020Por todo lo anterior, las Guías 202013:
- •
Confirman que los AATG IgA deben determinarse en primer lugar en el estudio de la EC junto con la cuantificación de IgA sérica. Si existe déficit de IgA, en un segundo paso hay que estudiar los anticuerpos isotipo IgG.
- •
Plantean la posibilidad de realizar el diagnóstico de EC en pacientes asintomáticos sin necesidad de realizar una BI, siguiendo los mismos pasos que en los casos sintomáticos. No obstante, al ser menor el valor predictivo positivo de los niveles altos de AATG, la decisión de no realizar la BI debe ser evaluada de forma individualizada y consensuada con los padres y el paciente, si este tiene la edad adecuada.
- •
No consideran la posibilidad de diagnóstico de EC sin BI en los pacientes con DM1 asintomáticos, puesto que la evidencia científica en este grupo de pacientes no es suficiente.
- •
Mantienen la necesidad de diagnóstico con BI en los casos de déficit de IgA, por la falta de datos sobre el valor predictivo de lesión intestinal de los anticuerpos IgG.
- •
Establecen que el estudio de HLA no es necesario en aquellos pacientes en los que hay que realizar biopsia o los AATG son más de 10 veces el LSN. Estaría indicado solo para cribado de población de riesgo y en casos dudosos.
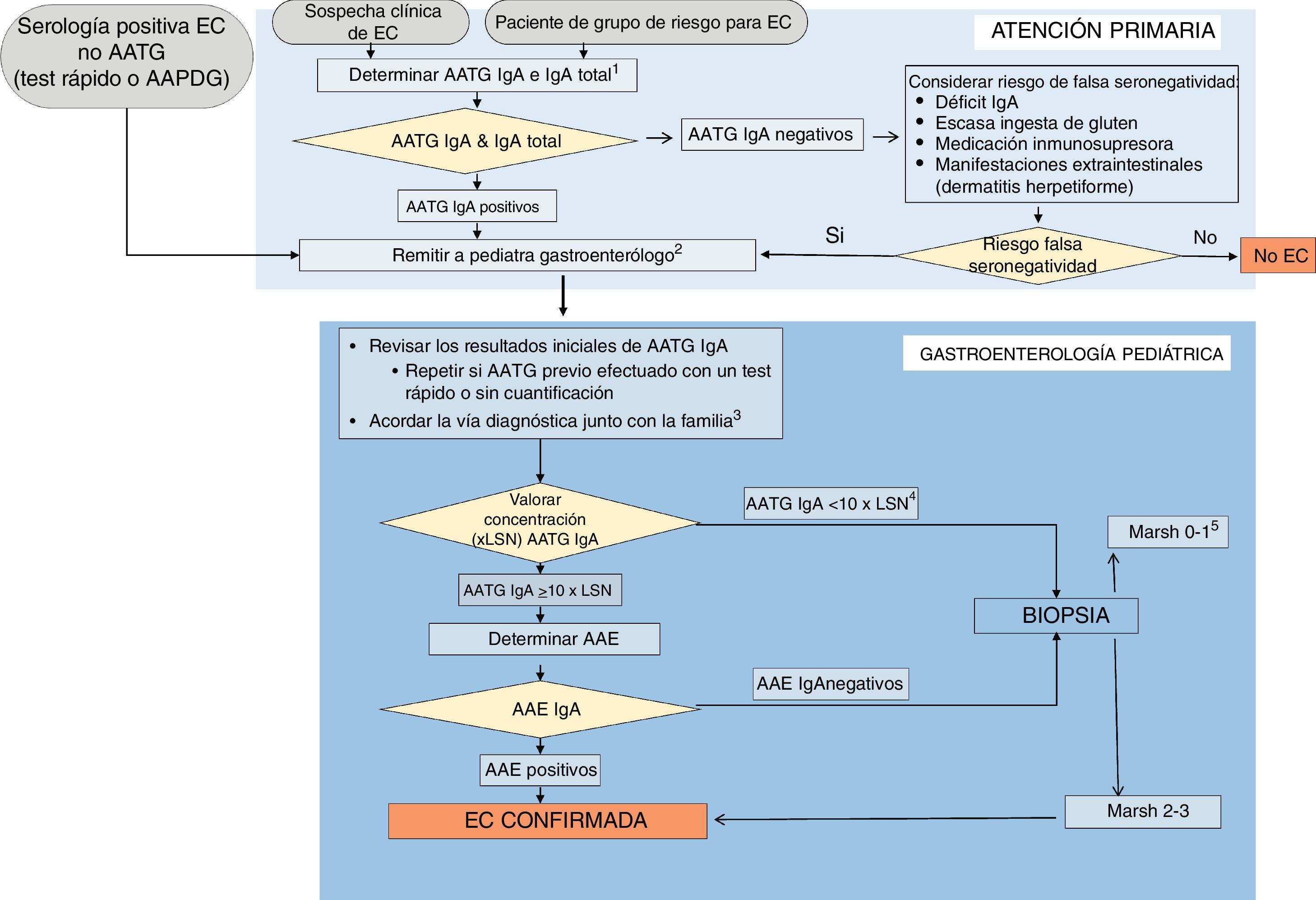
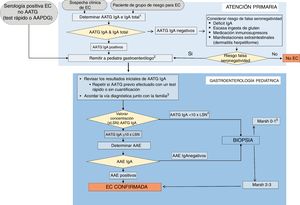
La evolución de los criterios diagnósticos ESPGHAN de EC a lo largo de 50 años ha llevado a las actuales recomendaciones expuestas como 7 pilares (tabla 4). El proceso a realizar ante toda sospecha diagnóstica o situación de riesgo se expone en un algoritmo (fig. 1). El pediatra de Atención Primaria es fundamental para plantear esa sospecha diagnóstica y realizar un primer estudio serológico. ESPGHAN recomienda que el diagnóstico sea siempre establecido por un pediatra gastroenterólogo1,13, habida cuenta de que dicho diagnóstico implica una indicación de dieta sin gluten de por vida y, en la mayoría de los casos, la confirmación diagnóstica se realiza en un breve periodo de tiempo; todo ello con objeto de evitar tanto el sobre- como el infradiagnóstico, con las consecuencias que ambos tienen (tabla 5)41. Ello implica por parte de Atención Primaria mantener la dieta con gluten hasta la confirmación del diagnóstico.
Pilares de las recomendaciones ESPGHAN 2012 y ESPGHAN 2020 para el diagnóstico de la EC en niños y adolescentes
| • Se debe sospechar la EC en niños que presenten alguno de los signos, síntomas o situación de riesgo referidos en la tabla 2 |
| • El primer eslabón en el proceso diagnóstico debe ser la determinación de niveles séricos de IgA total y de anticuerpos antitrasnglutaminasa (AATG) IgA. |
| • En ausencia de anticuerpos de EC (AATG o AAE), el diagnóstico en niños es muy improbable |
| • Se podría establecer el diagnóstico de EC sin BI en niños y adolescentes con síntomas sugestivos de EC con AATG IgA>10×LSN, confirmados por AAE (en una 2.a muestra) en una Unidad de Gastroenterología Pediátrica |
| • Se podría aplicar el mismo protocolo de diagnóstico sin BI a niños asintomáticos, pero cada caso debe ser evaluado de forma individual en una Unidad de Gastroenterología Pediátrica |
| • En los casos de déficit de IgA o niños con DM1 asintomáticos es obligatorio realizar la BI para confirmar el diagnóstico |
| • Los individuos no DQ2/DQ8 tienen muy poca probabilidad de desarrollar una EC. El estudio HLA no es imprescindible para el diagnóstico sin biopsia en los casos con AATG IgA>10×LSN, confirmados por AAE. Estaría indicado para cribado de población de riesgo y en casos dudosos |
AAE: anticuerpos antiendomisio; AATG: anticuerpos antitransglutaminasa tisular 2; BI: biopsia intestinal; DM1: diabetes mellitus 1; EC: enfermedad celíaca; ESPGHAN: European Society for Paediatric Gastroenterology, Hepatology and Nutrition; LSN: límite superior de la normalidad.
Algoritmo diagnóstico.
AAE: anticuerpos antiendomisio; AAPDG: anticuerpos antipéptidos desamidados de gliadina; AATG: anticuerpos antitransglutaminasa; EC: enfermedad celíaca; LSN: límite superior de la normalidad.
1Déficit de IgA: valores por debajo de los que el laboratorio determine para la edad o <0,2g/l en mayores de 3 años.
2Evitar que la familia inicie una dieta baja o sin gluten antes de ser valorado en una Unidad de Gastroenterología Pediátrica.
3Confirmar el mensaje de que, independientemente de cómo se haga el diagnóstico, el tratamiento con dieta sin gluten es de por vida.
4Si AATG IgA positivos pero con valores bajos, confirmar ingesta suficiente de gluten. Valorar repetirlos añadiendo los AAE.
5Considerar: a) revisión de la biopsia; b) resultado AATG falso positivo y determinar AAE (si positivo=EC potencial); c) estudios adicionales (HLA, depósitos de transglutaminasa, citometría, etc.); d) plantear seguimiento y repetir estudios asegurando ingesta normal de gluten; e) valorar la importancia de los síntomas.
Fuente: Adaptado de ESPGHAN 202013.
Consecuencias de errores en el diagnóstico de EC
| Infradiagnóstico | Sobrediagnóstico |
|---|---|
| (mantenimiento de dieta con gluten) | (restricción innecesaria de gluten) |
| — Afectación de la calidad de vida por persistencia de sintomatología | — Afectación de la calidad de vida de pacientes y familia |
| — Riesgo de alteración del crecimiento y desarrollo | — Repercusión económica |
| — Complicaciones a largo plazo | — Riesgo de dieta desequilibrada: posible déficit de vitaminas y oligoelementos |
| – Problemas de esterilidad/osteopenia | — Riesgo de estreñimiento y sobrepeso |
| – Neoplasias gastrointestinales | |
| – Enfermedades autoinmunes |
EC: enfermedad celíaca.
Fuente: Lerner et al.41.
Los autores declaran no tener ningún conflicto de intereses.
Cómo citar este artículo: Román Riechmann E, Gemma Castillejo de Villasante, M. Luz Cilleruelo Pascual, EsterDonat Aliaga, Isabel Polanco Allué, Félix Sánchez-Valverde, Carmen Ribes Koninckx, Aplicación racional de los nuevos criteriosde la European Society for Paediatric Gastroenterology, Hepatology and Nutrition (ESPGHAN) 2020 para el diagnóstico de laenfermedad celíaca, An Pediatr (Barc). 2020;xxx:xxx.e1—xxx.e9 [https://doi.org/10.1016/j.anpedi.2019.12.001].