Comunicamos la detección de botulismo en un lactante de 40 días que presentó parálisis flácida descendente con insuficiencia respiratoria grave que requirió ventilación mecánica durante 12 días. Se le administró inmunoglobulina humana específica (IHE) para el botulismo del lactante, y es el primer caso europeo que recibe esta medicación.
Unas semanas más tarde se ha detectado un segundo caso en nuestra comunidad autónoma. Destacamos la importancia del diagnóstico e indicación precoz del tratamiento con IHE, lo que disminuye la morbilidad.
We report a case of botulism in a 40 day old infant. The patient presented a descending flaccid paralysis requiring mechanical ventilation for 12 days. She is the first European patient treated with Human Botulism Immune Globulin. A few weeks later a second case of infant botulism was detected in our geographical region in Southern Spain. We emphasise the importance of an early diagnosis and treatment with Human Botulism Immune Globulin to decrease morbidity.
El botulismo del lactante es una enfermedad infecciosa rara que se debe a la colonización intestinal por Clostridium botulinum1,2, bacteria que produce toxina botulínica in situ con la consiguiente absorción de ésta al torrente circulatorio, lo que origina bloqueo de la liberación de acetilcolina en las terminales presinápticas de la unión neuromuscular y del sistema nervioso autónomo.
Desde el año 1998 no se tenía constancia de casos de botulismo del lactante en la Red Nacional de Vigilancia Epidemiológica, hasta que detectamos a una paciente con esta enfermedad en julio de 2007 en nuestro centro. Ha suscitado alarma el hecho de que 2 meses más tarde se diagnosticase un segundo caso en la provincia de Huelva. Como antecedente epidemiológico común a ambos lactantes se registró la ingesta, en los días previos a comenzar la sintomatología, de una infusión comercializada a base de manzanilla e hinojo. Los pacientes registrados con anterioridad en España habían sido detectados en Cádiz (1997) y Ciudad Real (1998)3. Estos casos se asociaron a la ingesta de miel, hecho que no se documentó en los pacientes de este año.
En el año 2003 la Food and Drug Administration (FDA) de EE.UU. aprobó el empleo de inmunoglobulina humana específica (IHE) (BabyBIG®) para el tratamiento de aquellos lactantes en los que se sospeche esta enfermedad, que afecta a unos 80-100 niños cada año en EE.UU.4. Actualmente, más de 800 niños han sido tratados con IHE en ese país; sin embargo, ningún lactante europeo había recibido esta medicación antes de nuestra paciente. Por este motivo, y por la posibilidad de que asistamos a la aparición de nuevos casos en los próximos meses, comunicamos nuestra experiencia.
CASO CLÍNICOMujer de 40 días que ingresó en nuestro centro por rechazo de las tomas, decaimiento, llanto débil, somnolencia e hipotonía de 48h de evolución. El embarazo, parto y período neonatal fureron normales, y no había antecedentes familiares de interés. Como antecedentes epidemiológicos, la lactante era alimentada con fórmula de inicio correctamente preparada, y recibía la infusión mencionada, sin otros datos destacables. En la exploración física al ingresar presentaba somnolencia, hipotonía moderada, llanto y succión débil y rechazo de las tomas. Las exploraciones cardiorrespiratoria y abdominal eran normales. Ante la sospecha de encefalopatía aguda, ingresó en la Unidad de Cuidados Intensivos Pediátricos (UCIP). En los exámenes complementarios realizados en las primeras horas, que incluyeron bioquímica sérica básica, equilibrio acidobásico, amonio, lactato, sistemático de orina, ecografía cerebral y abdominal, ecocardiograma, tomografía computarizada (TC) craneal y citoquímica de líquido cefalorraquídeo (LCR), no se objetivaron alteraciones, salvo anemia con reticulocitosis regenerativa sin datos de hemólisis.
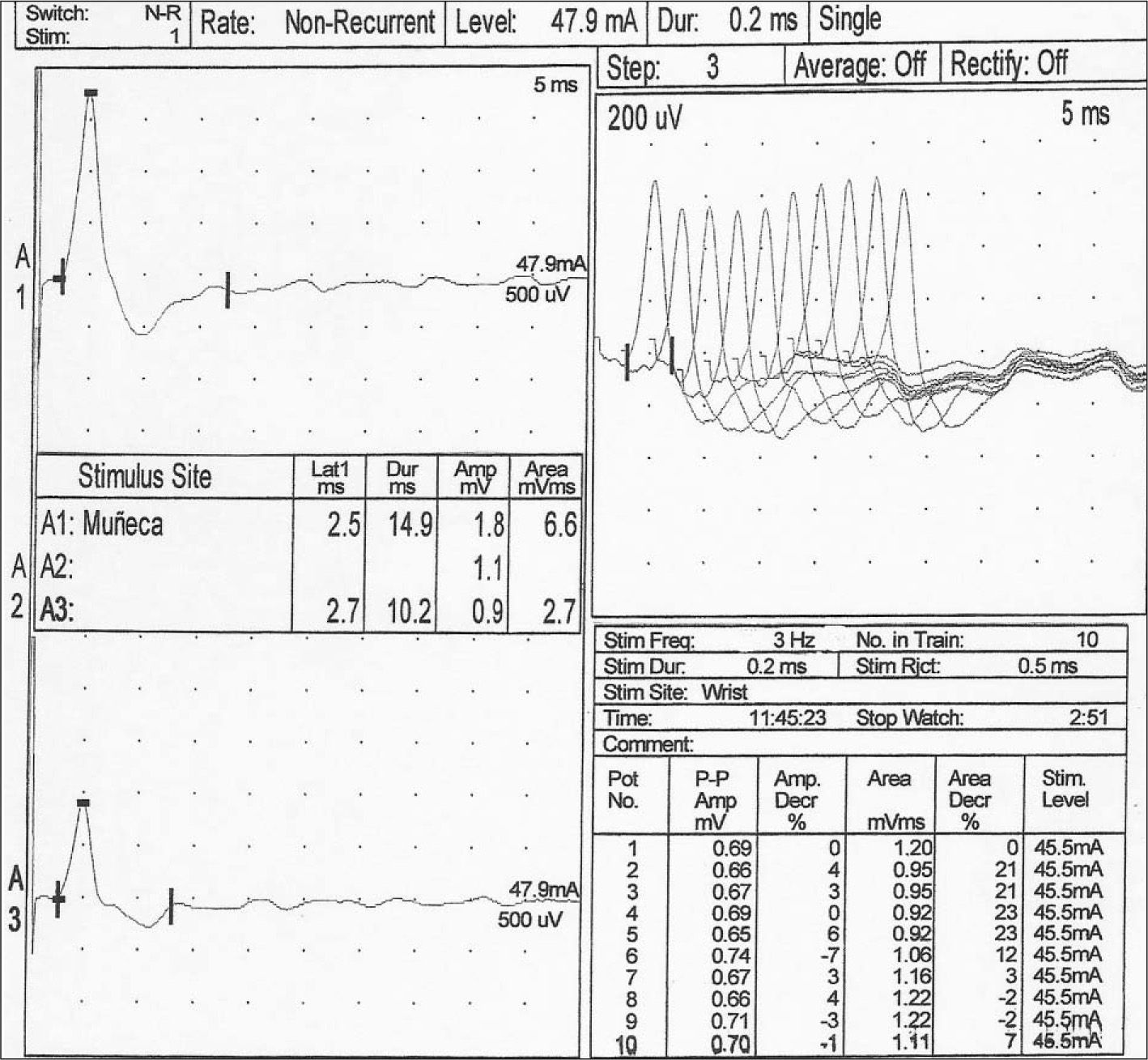
En los siguientes 2 días presentó estreñimiento, ptosis bilateral, pupilas dilatadas fijas, oftalmoplejía, facies hipomímica, agravamiento de la debilidad bulbar, empeoramiento de la hipotonía y de la debilidad, con desaparición de los movimientos antigravitatorios y reflejos miotáticos hipoactivos. Se realizaron: resonancia magnética (RM) craneal, que fue normal; varios electroencefalogramas (EEG) que mostraron actividad cerebral normal, y perfil urgente de aminoácidos y ácidos orgánicos, también normales. A las 72h del ingreso se sospechó patología de la unión neuromuscular, bien botulismo del lactante o un síndrome miasténico congénito, por lo que se notificó a la Red Nacional de Vigilancia Epidemiológica. Se recogieron muestras de heces, de la fórmula de inicio y de la infusión consumidas por la lactante para la detección de toxina botulínica y la realización de cultivos, y se iniciaron los trámites para conseguir IHE. En las siguientes horas precisó ventilación mecánica por fallo de bomba respiratoria y la parálisis flácida descendente alcanzó su máxima expresión. El estudio neurofisiológico (fig. 1) mostró defecto de la transmisión neuromuscular presináptica y un patrón miopático, muy sugerentes de botulismo del lactante. El test de edrofonio fue negativo.
Estudio del nervio cubital derecho. En el canal A1 se registra el potencial de acción motor compuesto (CMAP) pasados 10min de la tetanización. El incremento tan significativo de la amplitud y el área (> 100 %), con respecto al valor basal previo (canal A3), mostró facilitación posactivación. La parte derecha de la gráfica indicó decremento del área del cuarta potencial de acción durante la estimulación repetitiva de baja frecuencia.
La paciente precisó ventilación asistida. A partir del séptimo día experimentó mejoría, con recuperación progresiva de la motilidad y menor necesidad de ventilación mecánica. Esto permitió instaurar asistencia respiratoria no invasiva (presión positiva continua en la vía respiratoria [CPAP] nasal) el día 13; a los 14 días recibimos informe de la presencia de toxina botulínica en heces. El Ministerio de Sanidad autorizó el empleo de IHE. Se administró el día 20 de ingreso, a pesar de estar en fase de recuperación de la debilidad neuromuscular.
Siguiendo el protocolo de la FDA se remitieron muestras de heces, de la fórmula de inicio y de la infusión consumidas por la lactante a EE.UU., y se confirmó la presencia de toxina botulínica tipo B, así como de esporas de Clostridium botulinum tipo B en las heces. Por otro lado, los resultados analíticos de las muestras de fórmula de inicio y de la infusión consumidas por la lactante han sido negativos, tanto en España como en EE.UU.
En los siguientes días continuó la recuperación progresiva, permitiendo la retirada del soporte ventilatorio y el inicio de la alimentación oral. Se le dio el alta a los 33 días de su ingreso, con una exploración neurológica normal, salvo una discreta hipotonía axial.
DISCUSIÓNSe trata del primer paciente que recibe IHE en el continente europeo. Sin embargo, lo más destacable es que desde que se diagnosticó a nuestra paciente se ha diagnosticado a otra lactante en Huelva. Por todo ello, hemos querido comunicar nuestro caso, ya que puede ser de ayuda ante este brote de botulismo3.
Esta enfermedad se describió por primera vez en 19761,2. Se presenta en lactantes menores de 1 año, a una edad media de 10 semanas, como consecuencia de la ingesta de esporas de Clostridium botulinum. Existen otras especies de Clostridium que producen una neurotoxina responsable de una sintomatología similar, como Clostridium baratii y butyricum5,6.
Tradicionalmente, el botulismo del lactante se ha asociado a la ingesta de miel. Por otro lado, las esporas de Clostridium botulinum son muy resistentes y se vehiculizan por el aire, conservando su capacidad infectiva, por lo que lugares próximos a zonas de de construcción y de agricultura, polvorientos y ventosos, aumentan el riesgo de infección. El tipo de suelo y el clima son responsables de diferencias epidemiológicas entre regiones7. En EE.UU. el botulismo del lactante tiene una incidencia superior al botulismo del adulto, mientras que en Europa se produce lo contrario. Debe tenerse presente que la sintomatología puede ser muy variada, desde hipotonía con fallo de medro hasta síndrome de muerte súbita del lactante (SMSL), por lo que probablemente se trate de una entidad infradiagnosticada. Bohnel et al8 encontraron toxina botulínica en el intestino de más del 20 % de una serie de 72 lactantes fallecidos por SMSL en Alemania. Sin embargo, Byard et al9 en Australia, no encontraron toxina botulínica en 248 lactantes fallecidos por esta misma causa. Probablemente estas diferencias sean explicables por los factores geoclimáticos reseñados.
El diagnóstico diferencial incluye, entre otros, enfermedades neurometabólicas como las mitocondriales, enfermedades neuromusculares como los síndromes miasténicos congénitos y enfermedades por otros agentes infecciosos, como enterovirus6,10,11.
El tratamiento del botulismo del lactante ha sido tradicionalmente de soporte, hasta el desarrollo de la terapia específica con IHE, que neutraliza la toxina botulínica circulante. Su seguridad y eficacia fue demostrada mediante un ensayo clínico4 desarrollado en California, entre 1992 y 1997, que incluyó a 122 lactantes con botulismo. El tratamiento se aplicó en las primeras 72h del ingreso. A continuación, la FDA permitió que la IHE se aplicara en un estudio abierto a pacientes de toda la nación, que concluyó con la autorización del fármaco. En el ensayo clínico se encontró que, en comparación con el grupo control, los lactantes tratados con IHE mostraron una significativa reducción en la duración de la estancia en UCIP, en el tiempo de ventilación mecánica y en la duración de la alimentación parenteral o enteral por sonda. No se registraron efectos adversos graves.
En nuestro caso, indicamos la administración de IHE a los 20 días, a pesar de estar en fase de recuperación, para prevenir daños adicionales derivados de la absorción de toxina por el intestino, hecho que se produce hasta que el lactante es capaz de eliminar las esporas. Los anticuerpos bloquean la neurotoxina circulante durante un período de 6 meses, lo que previene las recaídas4, que pueden favorecerse por el empleo de antibióticos. Se recomienda evitar los aminoglucósidos por su efecto en la transmisión neuromuscular. En el caso de precisar antibióticos la elección menos desfavorable sería trimetoprim-sulfametoxazol. Consideramos que en nuestro caso la administración de IHE probablemente no influyó en la evolución de la enfermedad.
Creemos que sería útil el diseño de un protocolo de actuación ante la sospecha de esta enfermedad que permitiera disponer del tratamiento con IHE en el plazo más breve posible. Adjuntamos direcciones y recursos web que podrían ser de utilidad ante la sospecha de botulismo del lactante (tabla 1).
Direcciones y recursos web que hay que tener en cuenta ante una sospecha de botulismo del lactante
|
A la doctora Jessica Khouri del Infant Botulism Treatment and Prevention Program, California Department of Health Services, por su colaboración para hacernos llegar con la mayor celeridad posible el fármaco BabyBIG®.