El Comité Asesor de Vacunas de la Asociación Española de Pediatría (CAV-AEP) actualiza anualmente el calendario de vacunaciones teniendo en cuenta tanto aspectos epidemiológicos, como de efectividad y eficiencia de las vacunas.
El presente calendario incluye grados de recomendación. Se han considerado como vacunas sistemáticas aquellas que el CAV-AEP estima que todos los niños deberían recibir; como recomendadas las que presentan un perfil de vacuna sistemática en la edad pediátrica y que es deseable que los niños reciban, pero que pueden ser priorizadas en función de los recursos para su financiación pública; y dirigidas a grupos de riesgo aquellas con indicación preferente para personas en situaciones de riesgo. Los calendarios de vacunaciones tienen que ser dinámicos y adaptarse a los cambios epidemiológicos que vayan surgiendo, pero el CAV-AEP considera como objetivo prioritario la consecución de un calendario de vacunación único para toda España.
Teniendo en cuenta los últimos cambios en la epidemiología de las enfermedades, las principales novedades propuestas en este calendario son la administración de la primera dosis de las vacunas triple vírica y varicela a los 12 meses (12-15 meses) y la segunda dosis a los 2-3 años, así como la administración de la vacuna Tdpa a los 4-6 años siempre acompañada de otra dosis a los 11-14 años.
El CAV-AEP estima que deben incrementarse las coberturas de vacunación frente al papilomavirus humano en las niñas de 11 a 14 años. Se reafirma en la recomendación de incluir la vacunación frente al neumococo en el calendario de vacunación sistemática. La vacunación universal frente a la varicela en el segundo año de vida es una estrategia efectiva y por tanto un objetivo deseable. La vacunación frente al rotavirus, dada la morbilidad y la elevada carga sanitaria, es recomendable en todos los lactantes. Se insiste en la necesidad de vacunar frente a la gripe y la hepatitis A a todos los que presenten factores de riesgo para dichas enfermedades. Finalmente, se insiste en la necesidad de actualizar las vacunaciones incompletas con las pautas de vacunación acelerada.
The Advisory Committee on Vaccines of the Spanish Association of Pediatrics (CAV-AEP) updates the immunization schedule every year, taking into account epidemiological data as well as evidence on the effectiveness and efficency of vaccines.
The present schedule includes grades of recommendation. We have graded as routine vaccinations those that the CAV-AEP believes all children should receive; as recommended those that fit the profile for universal childhood immunization and would ideally be given to all children, but that can be prioritized according to the resources available for their public funding; and as risk group vaccinations those that specifically target individuals in situations of risk. Immunization schedules tend to be dynamic and adaptable to ongoing epidemiological changes. Nevertheless, the achievement of a unified immunization schedule in all regions of Spain is a top priority for the CAV-AEP.
Based on the latest epidemiological trends, the main changes introduced to the schedule are the administration of the first dose of the MMR and the varicella vaccines at age 12 months (12–15 months) and the second dose at age 2–3 years, as well as the administration of the Tdap vaccine at age 4–6 years, always followed by another dose at 11–14 years of age.
The CAV-AEP believes that the coverage of vaccination against human papillomavirus in girls aged 11–14 years must increase. It reasserts its recommendation to include vaccination against pneumococcal disease in the routine immunization schedule. Universal vaccination against varicella in the second year of life is an effective strategy and therefore a desirable objective. Vaccination against rotavirus is recommended in all infants due to the morbidity and elevated healthcare burden of the virus. The Committee stresses the need to vaccinate population groups considered at risk against influenza and hepatitis A. Finally, it emphasizes the need to bring incomplete vaccinations up to date following the catch-up immunization schedule.
Como en años anteriores, el Comité Asesor de Vacunas de la Asociación Española de Pediatría (CAV-AEP) actualiza el calendario de vacunaciones, teniendo en cuenta la evidencia disponible sobre la efectividad y la eficiencia de las vacunas infantiles, así como la epidemiología de las enfermedades inmunoprevenibles en nuestro medio.
Estas recomendaciones van dirigidas a pediatras, médicos de familia, personal de enfermería, familiares de los niños y, en general, a todas aquellas personas interesadas en disponer de una información actualizada sobre la vacunación en la edad pediátrica.
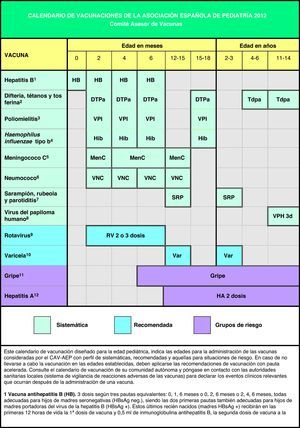
Teniendo en cuenta que en España los calendarios oficiales de vacunación son sufragados en su totalidad por los servicios públicos de salud, desde 2010 el calendario de este comité incluye grados de recomendación para las diferentes vacunas, con el objeto de establecer niveles de prioridad en la financiación pública de las mismas, considerando no solo su efectividad y seguridad, sino la carga de enfermedad en nuestro medio y, cuando sea posible, también criterios de eficiencia. Este mismo criterio pretende orientar al pediatra sobre las recomendaciones dirigidas a los padres acerca de las vacunas contempladas en este calendario, pero no incluidas en los calendarios oficiales. En la figura 1 se muestra el calendario de vacunaciones recomendado por el CAV-AEP para 2012, clasificando las vacunas en sistemáticas, recomendadas y las dirigidas a grupos de riesgo. Se han considerado como vacunas sistemáticas aquellas que el CAV-AEP estima que todos los niños en España deberían recibir de forma universal; como recomendadas las que presentan un perfil de vacuna sistemática en la edad pediátrica y que el CAV-AEP considera deseable que todos los niños reciban, pero que por razones de coste-efectividad su prioridad se establece en función de las posibilidades económicas de su financiación pública; y dirigidas a grupos de riesgo aquellas que se consideran indicadas para personas en situaciones ambientales o personales que incrementen el riesgo de padecer las enfermedades para las que van dirigidas o de presentar formas más graves si las padeciesen o bien porque tengan una patología de base que pueda agravarse o desestabilizarse si contraen la enfermedad infecciosa.
Se sigue haciendo hincapié en la necesidad de que las inmunizaciones sistemáticas alcancen a todos los niños, eliminando las disparidades étnicas, territoriales, sociales y económicas. Se considera un objetivo primordial poner al día el calendario de vacunación en los niños inmigrantes y en aquellos cuyo calendario de vacunación esté incompleto, no solo para lograr su protección individual ante las enfermedades inmunoprevenibles, sino también para evitar grupos de población susceptible que puedan dar lugar a la aparición de brotes epidémicos, como los sucedidos de sarampión muy recientemente en España. Los contactos esporádicos que algunos niños tienen con los servicios de salud (urgencias, ingreso hospitalario, pediatra, médico de cabecera o enfermera) deben ser aprovechados para la actualización de su calendario de vacunación.
Teniendo en cuenta los últimos cambios epidemiológicos, las principales novedades en las recomendaciones para el año 2012, respecto a las emitidas por este comité hace un año1, son las siguientes:
- -
Las primeras dosis de las vacunas triple vírica (TV) y de la varicela se recomiendan preferentemente a los 12 meses, aunque se considera aceptable entre los 12 y 15 meses.
- -
Las segundas dosis de las vacunas TV y de la varicela se recomiendan entre los 2 y 3 años, con preferencia por los 2 años.
- -
La nueva horquilla de administración recomendada de las dosis de refuerzo de las vacunas frente al meningococo C y al neumococo es de 12 a 15 meses.
- -
Si las circunstancias epidemiológicas lo requieren, se recomienda una dosis de refuerzo frente al meningococo C a aquellos niños que hayan recibido una serie primaria en el primer año de vida sin refuerzo a partir de los 12 meses de vida.
- -
Se recomienda la vacuna combinada de baja carga antigénica frente al tétanos, la difteria y la tos ferina (Tdpa) a los 4-6 años, siempre acompañada de otra dosis de Tdpa a los 11-14 años (en 2011 a los 14-16 años).
Los calendarios de vacunaciones tienen que ser dinámicos y adaptarse a los cambios epidemiológicos que vayan surgiendo, así como a la incorporación de nuevas vacunas o novedades relacionadas con las vacunas ya existentes. Algunas modificaciones sugeridas en este nuevo calendario ya están siendo aplicadas en algunas comunidades del territorio español. El CAV-AEP sigue considerando un objetivo primordial la consecución de un calendario único de vacunación, de forma que se mantenga el principio de equidad en la prevención de la salud y el principio de racionalidad que facilite el cumplimento de las inmunizaciones en los niños que cambien de comunidad autónoma como lugar de residencia. En la actualidad no hay diferencias epidemiológicas en las enfermedades inmunoprevenibles entre las diferentes comunidades autónomas (CC. AA.), con la posible excepción de la hepatitis A en Ceuta y Melilla, que justifiquen la existencia de calendarios de vacunaciones distintos2. El CAV-AEP estima que es necesario un esfuerzo colectivo de todos los agentes sanitarios y políticos implicados en la toma de decisiones sobre el diseño del calendario de vacunaciones para los niños españoles y sigue ofreciendo su colaboración para la consecución de este sensato objetivo.
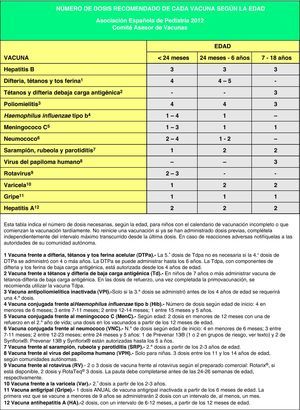
Vacunación frente a la hepatitis BLa vacunación frente a la hepatitis B requiere 3 dosis que pueden administrarse según pautas equivalentes: 0, 1 y 6 meses; 0, 2 y 6 meses; 2, 4 y 6 meses. Los 3 esquemas son adecuados para hijos de madres seronegativas (HBsAg [del inglés Hepatitis B surface Antigen] negativo), y las 2 primeras pautas son también correctas para hijos de madres portadoras del virus de la hepatitis B (HBsAg positivo). Estos últimos deben recibir, además, 0,5ml de inmunoglobulina específica antihepatitis B, preferiblemente en las primeras 12 horas de vida en un lugar anatómico diferente del de la vacuna. La vacunación en el primer año con 4 dosis de vacuna es aceptable si se utiliza la vacuna combinada hexavalente (DTPa-VPI-Hib-HB [difteria, tétanos, tos ferina-vacuna antipoliomielítica inactivada-Haemophilus influenzae tipo b-hepatitis B]) a los 2, 4 y 6 meses de vida para aquellas CC. AA. donde se vacuna frente a la hepatitis B al nacimiento con preparado monocomponente2. Otra opción, en caso de vacunación sistemática neonatal, es la administración alternante de vacuna hexavalente a los 2 y 6 meses y pentavalente (DTPa-VPI-Hib) a los 4 meses3,4.
La vacunación de rescate frente a la hepatitis B en niños mayores y adolescentes no vacunados con anterioridad se realizará siguiendo la pauta 0, 1 y 6 meses4.
Vacunación frente a la difteria, el tétanos, la tos ferina, la poliomielitis y el Haemophilus influenzae tipo bEl uso de vacunas combinadas facilita la administración conjunta de varias vacunas en el mismo momento y lugar anatómico, al tiempo que reduce el número de inyecciones y las molestias al niño, evita errores, acorta los tiempos de administración y simplifica el calendario de vacunación. Por todas estas razones, el CAV-AEP continúa recomendando el uso de la vacuna hexavalente (DTPa-VPI-Hib-HB) durante la primovacunación a los 2, 4 y 6 meses.
Por cuestiones económicas o por problemas de abastecimiento de vacuna hexavalente se puede recurrir al preparado pentavalente (DTPa-VPI-Hib), completándose el calendario sistemático con una o varias dosis frente a hepatitis B (monocomponente) según el esquema recomendado para esta vacunación. La evidencia científica adquirida a través de amplios ensayos clínicos apoya el uso de estas vacunas combinadas, sin que exista incompatibilidad con otras inmunizaciones, ni interferencias antigénicas importantes3,5,6. Es importante señalar que la vacuna pentavalente es la idónea para inmunizar como dosis de refuerzo a los 15-18 meses (cuarta dosis de DTPa, VPI y Hib).
En España, la administración de la quinta dosis de DTPa correspondiente a los 4-6 años se ha venido realizando con DTPa (Infanrix®). Sin embargo, desde el año 2010, la tendencia es a sustituirla por la vacuna Tdpa (con baja carga antigénica de difteria y tos ferina) y así se ha realizado ya en 13 CC. AA. y en las 2 ciudades autónomas2, basándose en la información disponible3,7–9 y en la recomendación de la Ponencia de Registro y Programa de Vacunaciones del Sistema Nacional de Salud (CISNS 2010)10, que propuso a la Comisión Nacional de Salud Pública la sustitución de la DTPa por Tdpa, cambio que fue validado por esta última comisión. La razón fundamental para el empleo de la vacuna Tdpa en esta edad es su menor reactogenicidad debido al contenido antigénico reducido en comparación con la DTPa, sin menoscabo de la inmunogenicidad frente a los 3 componentes antigénicos incluidos (difteria, tétanos y tos ferina)11–13.
El CAV-AEP comparte esta recomendación, pero además considera que la quinta dosis con la vacuna Tdpa debería ser complementada forzosamente con una sexta dosis con esta misma vacuna en la adolescencia3,8,14, estrategia que actualmente realizan la Comunidad de Madrid y las ciudades autónomas de Ceuta y Melilla2, dada la disminución de la inmunidad frente a la tos ferina que se produce con el paso de los años. El CAV-AEP estima que la edad óptima para esta dosis es de los 11 a los 14 años. En otros países se recomienda posteriormente una dosis de refuerzo cada 10 años (Td o preferible Tdpa)15. En España, las recomendaciones oficiales del Ministerio consideran que los niños que completan su calendario de vacunación a los 14-16 años no precisarán otra dosis hasta los 60-65 años de edad y que un adulto está bien vacunado con 5 dosis de tétanos recibidas a lo largo de su vida16. Actualmente, en España, existen dos preparados comerciales disponibles de Tdpa de características similares, Boostrix® (GlaxoSmithKline) y Triaxis® (Sanofi Pasteur MSD), que fueron autorizados en 2001 y 2010, respectivamente. Ambos productos están registrados por la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) y en su ficha técnica se contempla el uso en niños a partir de los 4 años de edad.
El CAV-AEP considera muy recomendable la vacunación frente a la tos ferina con Tdpa de los adultos y adolescentes que convivan con recién nacidos, para crear un ambiente inmune, siguiendo la pauta conocida como «estrategia del nido», que ha ofrecido buenos resultados17,18 e incluso está comenzando a practicarse en algunos países de forma rutinaria19.
En cuanto a la vacuna frente al Hib, en España se dispone de una presentación conjugada en forma monocomponente frente al mismo en la que el polisacárido capsular se conjuga con la proteína del toxoide tetánico (PRP-T) que le sirve como transportador, como así sucede en los preparados combinados pentavalente (DTPa-VPI-Hib) y hexavalente (DTPa-VPI-Hib-HB). La pauta de vacunación sistemática recomendada por el CAV-AEP no ha cambiado sustancialmente con relación a los años anteriores, comenzando su administración a partir de las 6 semanas de edad. Se recomiendan 3 dosis en el primer año de vida, con intervalos de 4-8 semanas entre ellas (2, 4 y 6 meses de edad); en las vacunas Hib monocomponentes, para niños entre 6 y 12 meses son suficientes dos dosis con el mismo intervalo de tiempo. A los 15-18 meses de edad, es obligada la dosis de refuerzo, quedando el sujeto inmunizado con niveles de eficacia próximos al 100%. En los niños de entre 12 y 14 meses no inmunizados previamente se recomiendan 2 dosis y a partir de los 15 meses una dosis, no siendo necesaria la vacunación en niños mayores de 59 meses inmunocompetentes3. Por encima de esta edad, la indicación de una dosis de vacuna se llevaría a cabo en individuos sin antecedentes de vacunación con factores de riesgo de infección invasora por Hib: anemia de células falciformes, leucemia, inmunodeficiencias adquiridas, trasplante de médula ósea y asplenia anatómica o funcional3.
La VPI se encuentra formando parte de las vacunas hexavalente y pentavalente. La pauta de administración en la primovacunación durante la primera infancia es de 3 dosis de VPI en los meses 2, 4 y 6, y una cuarta de refuerzo a los 15-18 meses de edad que debe administrarse con un intervalo mínimo de 6 meses respecto a la dosis previa3. Por otro lado, existe un preparado monocomponente, con una formulación frente a la poliomielitis de virus inactivados de potencia aumentada (VPIa, tipo Salk), pero actualmente solo es accesible como «medicación extranjera», por lo que se reserva especialmente para personas no inmunizadas que vayan a viajar a zonas endémicas de poliomielitis.
Vacunación frente al meningococo CRespecto a las vacunas conjugadas monocomponente frente al meningococo C, el CAV-AEP recomienda realizar la primovacunación con 2 dosis en el primer año (a los 2 y a los 4-6 meses de edad) y una dosis de refuerzo en el segundo año de vida, preferentemente entre los 12 y los 15 meses. La primovacunación en los primeros meses de vida con 3 dosis de la vacuna conjugada de meningococo C con la proteína CRM197, cuando no se administra una dosis de refuerzo en el segundo año de vida, se acompaña de una pérdida progresiva de anticuerpos y de capacidad bactericida a partir del año de la vacunación. De forma paralela se produce una pérdida de efectividad vacunal y la aparición de casos de enfermedad en los niños vacunados que no recibieron una dosis a partir de los 12 meses, que se ha constatado no solo en España20–23 sino en otros países, como el Reino Unido24,25. El CAV-AEP considera que muchos niños que recibieron aquella pauta de vacunación (sin dosis de refuerzo en el segundo año de vida), y que cumplen ahora 11 años de edad, pueden ser susceptibles a las infecciones por meningococo C. Por tanto, teniendo en cuenta, además, que la mayor carga de enfermedad por meningococo C ocurre en la actualidad en adolescentes y adultos jóvenes y la elevada letalidad de esta infección, que durante el año 2011ha alcanzado el 37,7% en el conjunto del territorio nacional26, el CAV-AEP estima que en aquellas cohortes de niños primovacunados y que no han recibido una dosis de refuerzo de vacuna contra el meningococo C a partir de los 12 meses de vida, estaría recomendada una dosis de refuerzo adicional si las condiciones epidemiológicas así lo justifican. Actualmente, solo Asturias tiene contemplada en su calendario a los 14 años, la administración de una dosis de vacuna antimeningocócica C a aquellos niños que no tengan una dosis aplicada después de los 12 meses de edad2.
Desde el año 2010 hay disponible en España una vacuna conjugada tetravalente frente a meningococos de los serogrupos A, C, W135 e Y. Es de uso hospitalario y actualmente está autorizada a partir de los 11 años de edad en caso de viaje a zonas endémicas de meningitis, el conocido como «el cinturón africano de la meningitis»27.
Vacunación frente al sarampión, la rubeola y la parotiditis (vacuna triple vírica)El CAV-AEP mantiene la norma general de vacunación que consiste en la administración de 2 dosis de la vacuna TV después de los 12 meses de edad separadas por un intervalo mínimo de, al menos, 4 semanas1,3.
En los últimos años se están produciendo brotes de sarampión en toda la Región Europea28 y también en España, especialmente en adultos jóvenes con baja cobertura de vacunación y en niños menores de 15 meses que aún no han recibido la primera dosis de la vacuna TV, al no haber alcanzado la edad de la primovacunación. Teniendo en cuenta estos cambios epidemiológicos, el CAV-AEP considera que la primera dosis debería administrarse a los 12 meses de vida, aunque su aplicación entre los 12 y los 15 meses es una alternativa aceptable. En 8 CC. AA. y en las 2 ciudades autónomas ya se adoptó esta pauta, considerando que esta dosis es válida, en sustitución de la de los 15 meses2.
La vacuna TV es un preparado de virus hiperatenuados frente al sarampión, rubeola y parotiditis, muy inmunógeno, que alcanza porcentajes altos de seroconversión (95-98%) después de la administración de la primera dosis y casi el 100% con la segunda. Son necesarias 2 dosis para lograr una adecuada inmunidad de grupo29,30, porque con una sola dosis existe un 5-10% de niños vacunados que no tienen protección. La segunda dosis de la vacuna TV persigue la inmunización tanto de los niños que no han recibido la primera dosis de vacuna como de aquellos que no han seroconvertido a la misma (fallo primario). Por tanto, el CAV-AEP considera que la segunda dosis de la vacuna TV debería administrarse entre los 2 y los 3 años, preferentemente a los 2 años. Adelantando esta segunda dosis, se mejora el cumplimiento y asimismo se disminuye el riesgo de contraer la enfermedad a esos niños en riesgo y también reduce la circulación del virus en la comunidad.
En nuestro país no se dispone de la vacuna monocomponente frente al sarampión, por lo que, en todos los casos (incluida la vacunación puntual en menores de 12 meses), deberá administrarse como vacuna TV. La población infantil inmigrante no vacunada frente a la rubeola y a la parotiditis debe vacunarse con la vacuna TV.
Las acciones a realizar en caso de alerta epidemiológica por brote de sarampión son las siguientes28,29,31:
- -
En niños menores de 6 meses se administrarán 0,25ml/kg de inmunoglobulina polivalente en dosis única en los primeros 6 días postexposición. No está indicada la administración de la vacuna TV.
- -
A los niños de entre 6 y 12 meses se les administrará una dosis de la vacuna TV (dosis no computable) y se les volverá a vacunar a los 12-15 meses con, al menos, un mes de intervalo, considerándose esta última como la primera dosis. Si hubiesen transcurrido más de 72 horas y menos de 2 semanas desde la posible exposición, a los menores de 12 meses se les administrará inmunoglobulina polivalente en lugar de la vacuna. Posteriormente, 5 o 6 meses más tarde, deben recibir la vacuna TV.
- -
Se consideran personas susceptibles a aquellas menores de 40 años sin evidencia de haber padecido la enfermedad y que no acrediten antecedentes de vacunación correcta con la vacuna TV según la edad. Se asume que las personas mayores de 40 años presentan susceptibilidad muy baja, por ser inmunes frente al sarampión al haber padecido la enfermedad.
- -
Aquellas personas no vacunadas menores de 40 años que hayan tenido contacto con los casos desde 4 días antes a 4 días después del inicio del exantema se les administrará una dosis de la vacuna TV en las primeras 72 horas tras la exposición.
- -
En los niños mayores de 3 años se revisará su situación vacunal y se actualizará en caso necesario.
- -
A los niños inmunodeprimidos que han tenido contacto con sarampión se les administrará gammaglobulina intramuscular polivalente a dosis de 0,5ml/kg (dosis máxima 15ml).
El CAV-AEP se adhiere a las recomendaciones del Consejo Interterritorial del Sistema Nacional de Salud en referencia a la vacunación sistemática frente al virus del papiloma humano (VPH) de todas las niñas de 11 a 14 años, como forma de prevención del cáncer cervical y de lesiones precancerosas del tracto genital en la mujer32. Además, el CAV-AEP recomienda la vacunación de todas las adolescentes que no hubiesen recibido la vacuna por superar la edad fijada por cada comunidad autónoma para la vacunación sistemática.
Recientemente, en agosto de 2011, se han producido cambios en las fichas técnicas aprobadas por la Agencia Europea de Medicamentos (EMA) de las 2 vacunas comercializadas, la vacuna tetravalente Gardasil® (Sanofi Pasteur MSD)33 y la bivalente Cervarix® (GlaxoSmithKline)34.
Gardasil® es actualmente una vacuna indicada en mujeres a partir de los 9 años de edad para la prevención de las lesiones genitales precancerosas (cervicales, vulvares y vaginales) y del cáncer cervical relacionadas causalmente con ciertos tipos oncogénicos del VPH, además de verrugas genitales relacionadas causalmente con tipos específicos del VPH33. Además, se ha autorizado recientemente en Europa el uso de Gardasil® en varones de 9 a 26 años para la prevención de dichas verrugas genitales externas33. Se convierte así en la primera vacuna contra este virus aprobada para ambos sexos. Estas indicaciones están basadas en la demostración de la eficacia de Gardasil® en mujeres de 16 a 45 años de edad y en varones de 16 a 26 años, y en la demostración de la inmunogenicidad de Gardasil® en niños/niñas y adolescentes de 9 a 15 años de edad33. Por otro lado, aunque la ficha técnica aprobada por la Food and Drug Administration (FDA) contempla la indicación de Gardasil® para la prevención de cáncer anal causado por VPH 16 y 18 y la prevención de neoplasia anal intraepitelial de cualquier grado causada por VPH 6, 11, 16 y 18 en hombres y mujeres de 9 a 26 años de edad35,36, la EMA aún no las ha incluido, probablemente a la espera de más datos.
Cervarix® es una vacuna indicada en mujeres de 10 a 25 años para la prevención de lesiones premalignas y del cáncer del cuello uterino relacionadas causalmente con ciertos tipos oncogénicos del VPH34. La indicación está basada en la demostración de la eficacia en mujeres de 15 a 25 años de edad después de la vacunación con Cervarix® y de la inmunogenicidad de la vacuna en niñas y mujeres de 10 a 25 años de edad.
Se ha incluido en la ficha técnica de Cervarix® la indicación frente a serotipos no incluidos en la vacuna, como son los serotipos 31, 33 y 45, a partir de los datos de eficacia protectora cruzada frente a la neoplasia intraepitelial cervical (CIN), procedentes del estudio PATRICIA, tras un seguimiento de 4 años37. En este trabajo se ha constatado un impacto de la vacuna del 93% de eficacia global frente al carcinoma in situ (CIN 3+), independientemente del tipo de VPH37. La eficacia frente a CIN 2+ para los tipos oncogénicos no vacunales fue de 87,5% (intervalo de confianza del 95% [IC95%]: 68,3-96,1) para VPH-31; 68,3% (IC95%: 39,7-84,4) para VPH-33; y de 81,9% (IC95%: 17-98,1) para VPH-4537. Estos datos son de gran relevancia, ya que permiten obtener una eficacia protectora global frente a lesiones preneoplásicas por VPH superior a la esperada.
La posología de las vacunas frente a VPH es de 3 dosis (figura 1), a los 0, 2 y 6 meses con la tetravalente33 y a los 0, 1 y 6 meses con la bivalente34, para garantizar la máxima eficacia vacunal esperable. En caso de variaciones de estas pautas deben respetarse los intervalos mínimos entre dosis. En cuanto a Gardasil®, la segunda dosis debe ser administrada, al menos, un mes después de la primera dosis y la tercera dosis, al menos, 3 meses después de la segunda. Las 3 dosis deben ser administradas dentro de un periodo de un año. Con relación a la vacuna Cervarix®, la segunda dosis puede administrarse entre 1 y 2,5 meses después de la primera, y la tercera dosis entre 5 y 12 meses tras la primera.
No hay datos que documenten la intercambiabilidad entre ambas vacunas frente al VPH, por lo que se recomienda utilizar el mismo preparado comercial para toda la pauta de vacunación33,34.
Se ha comprobado la ausencia de interferencia inmunológica o variaciones significativas de la reactogenicidad cuando se administran simultáneamente con otras vacunas aplicables durante la adolescencia, como la Tdpa38,39.
Tanto los ensayos clínicos realizados40 como el seguimiento poscomercialización41, con más de 14 millones de dosis distribuidas de la vacuna bivalente y más de 60 millones de la tetravalente, permiten confirmar la seguridad de estas vacunas y su adecuado balance beneficio/riesgo. En junio de 2009, la Organización Mundial de la Salud (OMS) reafirmó su adecuado perfil de seguridad, tras revisar todos los datos existentes42. Constataron que los efectos adversos más frecuentes son la reactogenicidad local y el dolor muscular generalizado. Se han comunicado algunas reacciones alérgicas en pacientes sensibilizados a alguno de los componentes y se evidencia un incremento de declaraciones de síncopes tras la administración de vacunas en adolescentes y jóvenes, que se consideran debidos a reacciones vagales que son más frecuentes en este grupo de edad41,42.
Dada la nueva aprobación de la vacuna tetravalente para varones de 9 a 26 años35, este tema debe ser analizado y comentado. Se ha documentado el papel de los varones en la transmisión del VPH, constatándose tasas de infección superiores a las de las mujeres y más mantenidas a lo largo de la vida, aunque la carga de enfermedad neoplásica en el varón es mucho menor43. No obstante, la prevalencia de las verrugas genitales en el varón es similar o algo superior a la observada en la mujer, y es también debida a los VPH 6 y 11 en más del 90% de los casos43. Con la vacuna tetravalente se ha confirmado una eficacia del 90% en la prevención de las verrugas genitales en el varón; sin embargo, se dispone de datos limitados acerca de la prevención de lesiones precancerosas y de cáncer de ano y del área oro-faringo-laríngea, aunque parece existir una tendencia hacia la prevención35. La recomendación de la inclusión de los varones en los programas de vacunación ya se ha comenzado a valorar por algunos estamentos, como los Centers for Disease Control and Prevention (CDC)36, y se deberá seguir analizando en estos próximos años, a la espera de que los datos disponibles de la carga global de enfermedad43 y de la eficacia de la vacuna tetravalente en varones33 se sumen a los modelos de eficiencia. Los primeros análisis demuestran que la vacunación en varones podría ser coste-efectiva en situaciones de baja cobertura vacunal en niñas adolescentes, pero es más coste-efectiva aún la estrategia basada en incrementar la cobertura de estas44.
Vacunación frente al neumococoComo en años anteriores, el CAV-AEP mantiene la recomendación de la vacunación sistemática frente al neumococo como la mejor medida para la prevención de la enfermedad neumocócica en la infancia.
Tras la retirada comercial de la vacuna antineumocócica conjugada heptavalente (VNC7, Prevenar®, Pfizer), actualmente se encuentran disponibles 2 vacunas antineumocócicas conjugadas: la vacuna decavalente o VNC10 (Synflorix®, GlaxoSmithKline) y la tridecavalente o VNC13 (Prevenar 13®, Pfizer).
La VNC10, además de los serotipos contenidos en la VNC7, incorpora otros 3: el 1, el 5 y el 7F. En esta vacuna los polisacáridos capsulares de 8 serotipos se conjugan con la proteína D, una forma no lipídica recombinante de una proteína altamente conservada en la membrana externa de Haemophilus influenzae no tipable, mientras que los polisacáridos de los serotipos 18C y 19F están conjugados con el toxoide tetánico y el toxoide diftérico, respectivamente. Está aprobada por la EMA para la prevención de la enfermedad neumocócica invasora (ENI) y de la otitis media aguda por neumococo en niños de 6 semanas a 5 años de edad45.
La VNC13 contiene los 7 serotipos de Prevenar® y los 6 serotipos adicionales siguientes: 1, 3, 5, 6A, 7F y 19A. Todos ellos están conjugados con la proteína CRM197, una mutante atóxica de la toxina diftérica. Esta vacuna está aprobada por la EMA para la prevención de la ENI, la neumonía y la otitis media aguda causadas por neumococo en niños de entre 6 semanas y 5 años de edad46.
Desde el punto de vista epidemiológico, los cambios ocurridos en los últimos años en España en cuanto a la distribución de los serotipos que causan la ENI se han consolidado. En la actualidad, en España, los serotipos contenidos en la VNC7 causan menos del 10% de la ENI de los niños menores de 5 años47,48. Una vez que ha disminuido la incidencia de casos producidos por el serotipo 5 (que se caracteriza por producir brotes cortos de unos meses de duración) en algunas regiones, como la Comunidad de Madrid, y con pequeñas diferencias de unas CC. AA. a otras, los serotipos causantes de la ENI más prevalentes en los niños menores de 14 años son el 1, el 19A y el 7F, seguidos por otros, como el 3, el 6A y el 19F48–50. Los serotipos 1 y 19A están implicados en el 60% de todos los casos de la ENI en los niños en Madrid, pero su prevalencia es diferente según la edad51. El serotipo 1 afecta preferentemente a niños mayores de 24 meses de edad48,52,53 y causa sobre todo neumonía bacteriémica y empiema pleural54. El serotipo 19A se distribuye en todas las edades, pero afecta sobre todo a niños menores de 5 años55 y tiende a causar diferentes formas de ENI, dependiendo de la edad: en los menores de 24 meses produce, sobre todo, bacteriemia y meningitis, mientras que en los mayores de esta edad causa un número significativo de casos de neumonía bacteriémica y empiema pleural47,49,54. Un estudio reciente realizado por el Laboratorio Español de Referencia de Neumococo del Instituto Carlos III ha demostrado que el 85% de los empiemas pleurales de los niños en nuestro medio está producido por los serotipos 1, 19A y 356. El incremento de los serotipos 1, 19A y 7F no solo tiene lugar en España, sino que ocurre, también, en otros países europeos. Se ha estimado que el serotipo 1 supone el 50% de las ENI de niños entre 5 y 14 años de edad en Francia, Bélgica y España55.
El cambio epidemiológico más llamativo en los últimos años ha sido el incremento del 19A47,51,55,57–59, un serotipo al que, en la actualidad, van ligadas, de forma mayoritaria, las multirresistencias (resistencias a 3 o más familias de antibióticos), siendo responsable de casi todas las resistencias de alto nivel a cefalosporinas de tercera generación en las meningitis48,57–59.
Todavía hay pocos datos sobre la efectividad de la VNC10 y la VCN13, dado el corto periodo de tiempo transcurrido desde el inicio del uso de estas vacunas. El seguimiento de casi 3.000 niños vacunados con la VNC13 en una región de Alaska ha mostrado, un año después de la vacunación, una efectividad del 85% en la reducción de la ENI por cualquier serotipo, no habiéndose registrado ningún caso producido por los serotipos contenidos en la vacuna60. En el Reino Unido, la eficacia de la VCN13 frente a los serotipos adicionales (1, 3, 5, 6A, 7F y 19A) ha sido mayor del 50% en niños menores de dos años, al cabo de un año de iniciar la vacunación61. En los EE. UU. también se ha constatado una disminución de más del 50% en los casos de la ENI por cualquier serotipo y del 70% en los casos producidos por los serotipos de la VNC13, comparando los periodos anterior y posterior a la introducción de esta vacuna62. En otro estudio del mismo país no se ha apreciado hasta el momento disminución de los serotipos contenidos en la VNC13, pero sí en la VNC7, con la excepción del serotipo 19A, que ha presentado una disminución del 30%63. En Francia, un año después de la introducción de la VNC13, el estado de portador nasofaríngeo de los serotipos 19A, 7F y 6C ha disminuido más del 50% en los niños vacunados, sin que se haya producido un incremento significativo de otros serotipos64.
La prevención directa, sin tener en cuenta el efecto de la inmunidad de grupo y asumiendo los parámetros inmunológicos de protección definidos por la OMS para las vacunas neumocócicas conjugadas, de la ENI por los serotipos 1, 19A, 7F y 3, supondría una reducción de la carga global de la ENI de entre el 50% y el 60%, y una disminución marcada de los empiemas, neumonías bacteriémicas y bacteriemias ocultas y, en menor grado, de los casos de meningitis y otras formas de ENI. La prevención de las infecciones por el 19A contribuirá, sin duda, a una disminución de las resistencias antibióticas frente al neumococo.
A la luz de todos los datos epidemiológicos expuestos, la VNC13 cubre hasta el 80% de los serotipos responsables de la ENI en los niños de nuestro país47,48,51, por lo que en la actualidad es la vacuna que proporciona una mayor cobertura de serotipos en nuestro medio.
En situaciones de vacunación no sistemática, en los lactantes que inicien la vacunación antineumocócica a los 2 meses de edad, debe seguir utilizándose el esquema de inmunización de 3 dosis de primovacunación en el primer año de vida, más una dosis de refuerzo en el segundo año (esquema 3+1). La primovacunación con 2 dosis, en ausencia de suficiente inmunidad de grupo, puede dejar al niño en situación de riesgo frente a algunos serotipos neumocócicos menos inmunógenos, como el 6B y el 23F65,66, hasta que no se administre la dosis de refuerzo. Por tanto, en la práctica individual, en un escenario sin vacunación universal, la pauta 2+1 no es aceptable por las razones expuestas.
Desde las recomendaciones del calendario de vacunaciones de este comité para el año 20111 se ha producido un cambio relevante en la ficha técnica de la VNC10, ya que ha visto ampliada la edad aprobada para su aplicación hasta los 5 años45, una franja de edad igual a la de la VNC13. Para aquellos niños de 2 a 5 años que no tengan antecedente de vacunación antineumocócica, es posible vacunarlos con VNC10, si bien precisan 2 dosis con una separación de, al menos, 2 meses45.
Los niños que han comenzado una pauta con una de las dos vacunas deberían finalizarla con la misma. Ambos preparados contienen distinta proteína de conjugación y, además, no existen datos de intercambiabilidad durante el esquema de vacunación.
En la Comunidad de Madrid se ha seguido observando cierto desplazamiento de la ENI a edades superiores: 39% en menores de 24 meses; 37% en 24-59 meses y 23% en mayores de 59 meses52. En niños de 24 a 59 meses, la cobertura de la VNC13 para casos de ENI llega a ser de hasta el 87% en nuestro medio, siendo los más frecuentes el serotipo 19A (34%) y el 1 (23%)52. Por todo esto, en niños de hasta 59 meses sin antecedentes de vacunación con VNC13, aunque hayan sido previamente vacunados con VNC7 o hayan recibido una pauta completa con VNC10, el CAV-AEP recomienda la administración de una dosis de VNC13, con un intervalo de, al menos, 2 meses desde la última dosis de vacunación antineumocócica, si la hubiere.
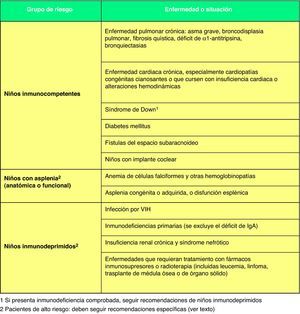
En cuanto a los pacientes con alto riesgo de padecer una ENI (fig. 2)67, como inmunodeprimidos o niños con asplenia orgánica o funcional, se establecen las siguientes recomendaciones: 1) debe utilizarse siempre una pauta 3+1; 2) es preceptivo que reciban 2 dosis de VNC13 en el segundo año de vida si no han recibido, al menos, 2 dosis en el primer año; 3) los niños de 2 a 5 años sin ninguna dosis previa de VNC13 deben recibir 2 dosis separadas por un intervalo mínimo de 2 meses. Además, en estos niños debe completarse la inmunización frente a esta bacteria con la administración, a partir de los 2 años de edad, de la vacuna antineumocócica polisacarídica de 23 serotipos (VNP23), con un intervalo mínimo de 2 meses tras la última dosis recibida de VNC1368. Al cabo de 5 años recibirán la segunda y última dosis de la VNP23. En otros niños no inmunodeprimidos (fig. 2)67, pero con riesgo alto de padecer enfermedad neumocócica grave o frecuente, puede optarse por seguir o bien las mismas recomendaciones dirigidas a los pacientes de alto riesgo o bien las recomendadas a los niños sanos de su propia comunidad autónoma, y se recomienda que reciban una única dosis de VNP23 a partir de los 2 años de edad, con un intervalo mínimo de 2 meses tras la última dosis recibida de VNC1368.
Vacunación frente a la varicelaEl CAV-AEP recomienda la vacunación frente a la varicela para todos los niños, con una primera dosis de la vacuna entre los 12 y 15 meses, preferentemente a los 12 meses, y una segunda dosis a los 2-3 años de edad, a ser posible a los 2 años. La estrategia alternativa de vacunación sistemática en niños susceptibles a los 10-14 años, recomendada por el Consejo Interterritorial del Sistema Nacional de Salud español, desde 2005 y vigente en la actualidad32, permite evitar formas graves de la enfermedad, más frecuentes en adolescentes y adultos, pero no previene la mayoría de los casos de varicela, ni la mayoría de las complicaciones y hospitalizaciones, que son más frecuentes, en números absolutos, en la primera infancia.
En cuanto a la efectividad de la vacunación, el seguimiento activo de diferentes regiones de los EE. UU., donde está instaurada la vacunación universal desde 1995, demostró una disminución sostenida de casos en todos los grupos de edad menores de 45 años, observándose la mayor reducción en el grupo de niños de 0 a 4 años (98%)69. Dicha reducción afectó también a personas no vacunadas, lo que demuestra que esta estrategia de vacunación induce inmunidad de grupo69. De una forma paralela descendieron las hospitalizaciones (hasta un 53%), sobre todo en menores de 14 años69, así como las complicaciones (algunas de las cuales, como las infecciones invasoras por Streptococcus pyogenes, se asocian, en niños, casi exclusivamente a la varicela)70,71. En EE. UU. también se documentó recientemente un descenso de la mortalidad en los 12 años siguientes al comienzo de la vacunación universal (1995-2007), ya que la tasa de mortalidad por varicela disminuyó un 88%, desde 0,41/millón de personas entre 1990 y 1994 a 0,05/millón entre 2005 y 200772. La reducción se produjo en todos los grupos de edad, pero la más acentuada tuvo lugar en los menores de 20 años72.
En la Comunidad de Madrid, donde la vacunación universal a los 15 meses de edad se instauró en 2006, se constató una reducción entre 2006 y 2009 del 66% de los casos, así como del 50% de las hospitalizaciones relacionadas con la varicela. La vacunación sistemática demostró inducir inmunidad de grupo, ya que, aunque el mayor porcentaje de reducción de la enfermedad se produjo en el grupo de niños de 0-4 años (86%), también tuvo lugar en niños mayores (5-9 años, 53%; 10-14 años, 73%) y adultos jóvenes (20-24 años, 56%). Hasta el momento no se ha producido un desplazamiento de la enfermedad a la edad adulta73.
En la comunidad autónoma de Navarra se introdujo en 2007 la vacunación universal de la varicela con una triple estrategia: a los 15 meses, a los 3 años y manteniéndose además la vacunación a los 10 años de edad para individuos susceptibles. En el año 2009 se incorporó además una segunda dosis a la edad de los 3 años. La incidencia de varicela disminuyó un 93,0%, desde 8,04 casos por 1.000 habitantes en 2006 a 0,56 por 1.000 habitantes en 2010 (p<0,0001). En niños de 1 a 6 años (cohortes vacunadas), la incidencia de la varicela disminuyó un 96,3%. En las cohortes vacunadas a los 10 y 14 años también se observa un descenso del 93,6% y en los de 15 a 19 años de un 85,0%. En los grupos de edad no vacunados se aprecian descensos del 88,2% en los menores de un año, del 73,3% en los de 7 a 9, y del 84,6% en personas mayores de 20 años. En 2006 se produjeron 25 ingresos hospitalarios por varicela en Navarra y en 2009 esta cifra descendió a 7. La tasa de ingresos descendió un 73%. Como conclusión, puede afirmarse que la introducción de la vacunación universal de la varicela en Navarra ha llevado a una disminución rápida y muy pronunciada de la incidencia de la varicela, tanto en vacunados como en no vacunados74.
En EE. UU., con una sola dosis de vacuna, se comunicaron brotes o un número más o menos elevado de casos de varicela, incluso en áreas con coberturas de vacunación superiores al 90%, conforme aumentaba el número de años desde que la vacunación tuvo lugar75–77. En este sentido, se estima que a los 10 años de la vacunación la efectividad de una sola dosis puede ser tan baja como del 72% y que 1 de cada 5 niños vacunados será susceptible de padecer la enfermedad77–79. Además, se observó que los casos de varicela en niños vacunados con una sola dosis suelen ser formas leves de la misma, con escasos o nulos síntomas sistémicos, confirmando que la efectividad de la vacuna frente a las formas graves de la enfermedad es superior al 95%. Sin embargo, a medida que aumenta el tiempo desde la vacunación, se aprecia que no solo crece el número de casos de la enfermedad en niños vacunados, sino que además hay casos más graves que incluso pueden necesitar hospitalización. Los casos de varicela en niños vacunados obedecen tanto a la pérdida de la inmunidad conferida por la vacuna con el paso del tiempo como a fallos primarios de la vacunación, que en algunos estudios se produjeron hasta en un 24% de los vacunados77,80.
Por las razones expuestas, desde el año 2006, el Advisory Committee on Immunization Practices y la American Academy of Pediatrics recomiendan una pauta de vacunación con 2 dosis de vacuna frente a la varicela, la primera entre los 12 y 15 meses de edad y la segunda a los 4-6 años81,82, dado que con la segunda dosis de la vacuna se alcanzan niveles de seroprotección superiores al 95% y una respuesta de anticuerpos que multiplica por más de 15 los obtenidos con la primera83. De esta forma se obtiene una respuesta inmunológica más parecida a la de la infección natural que la que se consigue con una sola dosis, se hace mucho más infrecuente la varicela en niños vacunados por pérdida de la inmunidad y se corrigen los posibles fallos primarios de vacunación que se producen con una dosis única81,83.
Algunos modelos matemáticos estiman que con una dosis de vacuna y coberturas de vacunación del 90% se obtendría una disminución aproximada del 65% de casos en los años siguientes a la introducción de la vacuna, y que la adición de una segunda dosis aumentaría en un 22% la efectividad de la vacuna84. A este respecto, es importante resaltar la importancia de obtener una cobertura de vacunación superior al 90% con las 2 dosis en los primeros años, pues de lo contrario se corre el riesgo de que se origine una bolsa de sujetos susceptibles, que aumentará considerablemente la carga de la enfermedad en la edad adulta. Para conseguir estas coberturas es indudable que sería deseable que la vacuna estuviera financiada por la Sanidad Pública, como lo está en las comunidades de Madrid y de Navarra y en las ciudades autónomas de Ceuta y Melilla.En un contexto de vacunación universal frente a la varicela incluida en el calendario sistemático en el segundo año de vida, podría considerarse, por razones de estrategia, la vacunación de todos los niños, independientemente del antecedente de haber pasado o no la enfermedad durante el primer año.
Con respecto al coste-efectividad de la estrategia con 2 dosis, los estudios realizados en EE. UU. en este sentido se muestran favorables a la vacunación82. Sin embargo, dado que los estudios coste-efectividad no son extrapolables totalmente de un país a otro, es deseable la realización en nuestro medio de estudios en relación con este parámetro, para confirmar, al igual que con los realizados con una dosis, los beneficios que respecto al gasto sanitario supondría esta estrategia de vacunación en nuestro medio.
El posible aumento en el futuro de la incidencia del herpes zóster en los individuos que pasaron la varicela durante su infancia es sin duda un aspecto de interés y se basa en la hipótesis de que las altas coberturas de vacunación reducirían al mínimo o eliminarían la circulación del virus salvaje y con ello el refuerzo exógeno necesario para el mantenimiento de la latencia del virus en las personas que presentaron la enfermedad durante su infancia. Este hecho, que por el momento es hipotético, podría determinar en teoría un aumento significativo del herpes zóster que se mantendría hasta que la población adulta llegase a estar compuesta predominantemente por individuos con inmunidad inducida por la vacuna y que no albergasen el virus salvaje. En cualquier caso, ya se propone en algunas publicaciones donde se recoge un cierto aumento del herpes zóster relacionado con la vacunación frente a la varicela, la vacunación contra el mismo a partir de los 50 años85–88.
Analizando todos estos hechos y a la luz de los datos epidemiológicos de las CC. AA. españolas y de los países en los que se ha introducido la vacunación universal contra la varicela, el CAV-AEP considera que esta estrategia de vacunación universal con una primera dosis a los 12-15 meses, preferiblemente a los 12 meses, y la segunda dosis a los 2-3 años, a ser posible a los 2 años, es la más adecuada. En ambos momentos se recomienda que se administre a la vez que la vacuna TV (ver apartado de TV anteriormente). Se debe recordar que, al ser 2 vacunas vivas, es recomendable que se administren en sitios anatómicos diferentes y el mismo día, pero si esto no es posible, deben separarse, al menos, un mes entre sí. La segunda dosis es la más efectiva, no solo para evitar el mayor número de casos y sus complicaciones en niños, sino también para asegurar unas coberturas de vacunación superiores al 90%, capaces de prevenir los casos de varicela en adolescentes y adultos.
La vacunación en la primera infancia solo de los niños con riesgo de varicela grave y de sus contactos próximos sanos y la posterior vacunación universal de los adolescentes susceptibles se asocia tradicionalmente a bajas coberturas y podría acentuar el desplazamiento de la enfermedad a la edad adulta.
No obstante, es de interés señalar que en niños con riesgo de varicela grave y en sus contactos próximos sanos, las 2 dosis de la vacuna deben administrarse con un intervalo más corto que el propuesto de forma general, con objeto de proporcionarles una protección rápida y evitar los posibles fallos primarios de vacunación. A este respecto, se recomienda que en los menores de 13 años en estas circunstancias, la segunda dosis, si bien puede administrarse al mes de la primera, se administre a partir de los 3 meses de esta y en los mayores de esa edad la segunda dosis se administre a partir de 1 mes de la anterior.
Actualmente, en España, hay disponibles 2 vacunas frente a la varicela: Varivax® (Sanofi Pasteur MSD) y Varilrix® (GlaxoSmithkline). Esta última, desde septiembre de 2009, está autorizada por la AEMPS solo como medicamento de uso hospitalario y por tanto no está disponible en el canal farmacéutico extrahospitalario, con lo que su administración queda restringida a los servicios de farmacia de los hospitales. Este cambio de las condiciones de dispensación no fue consecuencia de ninguna variación de la eficacia, la inmunogenicidad o la seguridad de esta vacuna. De ahí que, aunque lo deseable es que las 2 dosis de vacuna, en el hospital o fuera de él, para un paciente determinado, sean del mismo preparado comercial, por las circunstancias antes señaladas, si un niño recibió una primera dosis de Varilrix® en el medio extrahospitalario, dado que no es posible administrar la segunda dosis con el mismo preparado, es aconsejable completar la pauta (segunda dosis) con Varivax®.
Vacunación frente al rotavirusEl rotavirus ha sido identificado como el principal agente causal de gastroenteritis aguda (GEA) en la infancia a nivel mundial, particularmente en los niños menores de 5 años. Se acompaña de una alta morbilidad en todos los países y de elevada mortalidad en los de bajo nivel de ingresos89,90. En los países industrializados, la infección por rotavirus representa un alto coste, debido a la elevada frecuentación de los servicios sanitarios, lo que provoca un importante número de ingresos hospitalarios y visitas médicas.
La mejor estrategia preventiva contra la enfermedad es la vacunación universal91–93. El objetivo fundamental es proteger frente a las formas graves de GEA, reduciendo la carga de la enfermedad y la utilización de recursos. En países en los que se ha llevado a cabo la vacunación se observa una circulación disminuida del rotavirus y una reducción de los ingresos hospitalarios esperados como consecuencia de la infección por este germen94–97, e incluso una reducción de la mortalidad por GEA de cualquier etiología en niños de 0 a 59 meses de edad98.
Existen dos vacunas frente al rotavirus cuyos ensayos clínicos han demostrado su eficacia, inmunogenicidad, seguridad y escasa reactogenicidad: RotaTeq® (Sanofi Pasteur MSD) y Rotarix® (GlaxoSmithKline).
RotaTeq® es una vacuna pentavalente de cepas bovino-humanas atenuadas reordenadas. La pauta de inmunización consta de 3 dosis orales, la primera entre las 6 y 12 semanas de vida, con un intervalo mínimo de separación de 4 semanas entre dosis. La edad máxima recomendada para iniciar la primera dosis es de 12 semanas y para aplicar la última dosis es de 26 semanas (6 meses y medio).
Rotarix® es una vacuna monovalente de virus atenuados, obtenida de una cepa de virus de origen humano. Se administra de forma oral, la primera dosis entre las 6-12 semanas de edad, en 2 dosis separadas por un intervalo mínimo de 4 semanas, debiéndose iniciar la pauta como máximo a las 12 semanas y completarla antes de las 24 semanas de edad (6 meses).
En los países desarrollados en los que se ha introducido la vacunación frente al rotavirus de forma sistemática, se ha evidenciado una importante disminución de las hospitalizaciones debidas a este virus en niños menores de 5 años99,100. En EE. UU. se ha observado un retraso en la aparición de casos de GEA por rotavirus en los niños de 2-4 meses en la temporada 2007-2010 respecto a la de 1991-2006, sin pico de actividad en 2010, con una disminución en su magnitud de más de un 50%, así como en la tasa de detección de rotavirus de más del 80%95. En otro estudio reciente llevado a cabo en el mismo país, se han demostrado reducciones de las hospitalizaciones por diarrea tras la introducción de la vacuna, que oscilan entre el 25 y el 33%. Las disminuciones de hospitalizaciones debidas a diarrea por rotavirus han fluctuado entre el 60 y el 75%101.
En estudios publicados recientemente en España también se confirma una reducción significativa de las hospitalizaciones debidas a infección por rotavirus desde la comercialización de la vacuna en el año 2006, con una relación directa entre el grado de cobertura y la reducción de ingresos hospitalarios102.
En Austria (primer país de Europa en introducir la vacunación frente al rotavirus en su calendario sistemático) se produjo una reducción de casos del 96,6% desde su introducción, con una cobertura estimada del 74%103. Destaca la disminución del número de casos de GEA por rotavirus en lactantes menores de 3 meses que aún no habían sido vacunados o solo habían recibido una dosis de vacuna, sugiriendo este dato un cierto grado de protección de grupo103. En Europa, tanto la Sociedad Europea de Gastroenterología, Hepatología y Nutrición Pediátrica, como la Sociedad Europea de Infectología Pediátrica recomiendan la vacunación frente a rotavirus de forma universal en todos los niños europeos sanos desde el año 2008104.
Los CDC de Estados Unidos también incluyen esta vacuna como vacunación sistemática en sus recomendaciones desde 200692. En nuestro país, las vacunas frente a rotavirus no están incluidas en el calendario propuesto por el Consejo Interterritorial del Sistema Nacional de Salud32, sin embargo, el CAV-AEP las incluye en sus recomendaciones desde 2008.
En los países latinoamericanos se ha descrito una disminución del 60-80% en ingresos por GEA por rotavirus y del 30-40% en la mortalidad por diarrea de cualquier etiología en niños menores de 5 años105. En un estudio de casos y controles llevado a cabo en México y Brasil, se estimó que la vacunación frente a rotavirus ha evitado alrededor de 80.000 hospitalizaciones y 1.300 muertes por diarrea cada año106. El incremento de la invaginación intestinal fue de 1 por cada 51.000 y 1/80.000 dosis de vacuna, respectivamente106.
La OMS recomendó inicialmente su inclusión en los programas de inmunización de aquellos países en los que los datos de eficacia vacunal sugirieran un impacto significativo en términos de salud pública, pero posteriormente, una vez que estuvieron disponibles los resultados de los estudios de África y Asia, se amplió la recomendación a todos los países del mundo93. En una revisión actualizada sobre vacunación frente al rotavirus se observa una efectividad equiparable de estas vacunas a la de los ensayos clínicos precomercialización, con cifras de 80-98% en países industrializados y del 39-77% en países de África y Asia107.
A lo largo de 2010 surgió una alerta ante la información de la presencia de material genético de circovirus porcino en las vacunas frente al rotavirus (Rotarix® y RotaTeq®)108. La OMS y las agencias reguladoras de medicamentos de EE. UU. (FDA) y Europa (EMA) iniciaron un exhaustivo proceso de investigación, poniendo en marcha diversos estudios para evaluar las implicaciones de la presencia de partículas de circovirus porcino en estas vacunas y, de forma unánime, han concluido que no representan un problema para la salud humana, estableciendo que no existe ninguna razón para limitar el uso de las vacunas109–112. Estos circovirus no infectan ni producen patología en la especie humana y están muy presentes en los productos cárnicos y también en la tripsina utilizada en el desarrollo de vacunas. De hecho, recientemente se ha descartado que la presencia de circovirus en la vacuna Rotarix® sea infectiva en células humanas113.
En España, varias sociedades científicas, como la Asociación Española de Pediatría, la Asociación Española de Vacunología, la Sociedad Española de Infectología Pediátrica y la Sociedad Española de Gastroenterología, Hepatología y Nutrición Pediátrica, emitieron un primer documento de consenso en julio de 2010 y un segundo actualizado en diciembre de 2010, afirmando que todos los datos en ese momento disponibles confirman que los hallazgos de partículas de circovirus porcino en estas vacunas no representan un riesgo para la salud de los niños que las han recibido y no afectan a la seguridad ni a la eficacia de las mismas, y consideran que la vacunación frente al rotavirus constituye una medida preventiva recomendable para todos los niños114 de España.
Tras amplios ensayos clínicos precomercialización de las dos vacunas frente al rotavirus, en los que se implicaron a más de 120.000 niños, no se observó asociación con invaginación intestinal con ninguna de las dos vacunas ni tampoco se vieron otros efectos adversos clínicamente relevantes115,116. En la vigilancia poscomercialización de ambas vacunas, a lo largo de 2011, se han publicado algunos estudios en los que se pone de manifiesto que, en la primera semana tras la vacunación, hay algún caso más de invaginación intestinal de lo esperado, en función de las tasas basales de incidencia, aunque sin diferencias entre niños vacunados y no vacunados. En Australia, dentro del programa de vacunación a nivel nacional, se ha observado un discreto aumento de invaginación intestinal en relación con la primera dosis de ambas vacunas, aunque no se ha evidenciado un incremento en la incidencia de invaginación en el conjunto de niños vacunados117. Asimismo, en un estudio de seguridad poscomercialización realizado en México parece evidenciarse un incremento del riesgo de invaginación entre 2 y 6 veces en los 30 días siguientes a la primera dosis, con agrupamiento de casos en el período de 1 a 7 días después de la primera dosis106.
Estos últimos datos obligan a mantener la vigilancia poscomercialización de las vacunas frente al rotavirus. Sin embargo, los beneficios que se obtienen con la vacunación frente a este germen, tanto en descenso de morbilidad como de mortalidad, siguen siendo mucho mayores que los hipotéticos riesgos comentados, y así lo ha refrendado en diciembre de 2010 la OMS, manteniendo la recomendación de la vacunación universal frente al rotavirus118,119.
En España se encuentran registradas desde 2006 las dos vacunas frente al rotavirus. Ambas siguen estando autorizadas en nuestro país, con las mismas indicaciones y condiciones de uso, si bien tan solo RotaTeq® se encuentra actualmente disponible en los canales de distribución de farmacia, tras la decisión tomada en noviembre de 2010 por la AEMPS120.
Teniendo en cuenta la morbilidad y la elevada carga sanitaria que representa la enfermedad, este comité continúa considerando la vacunación de todos los lactantes frente al rotavirus como un incuestionable beneficio para su salud.
Vacunación frente a la gripe estacionalEl CAV-AEP considera que la vacunación antigripal es una estrategia especialmente beneficiosa cuando va dirigida a personas, niños y adultos, que se incluyen en los grupos de población considerados de riesgo. Pertenecen a estos grupos de riesgo aquellas personas que, debido a la enfermedad de base que padecen o por el tratamiento que reciben, en el caso de sufrir una infección por el virus de la gripe pueden padecer formas complicadas y más graves de la enfermedad, aumentando el riesgo de mortalidad, o la desestabilización de su enfermedad de base. La información ampliada para esta vacunación puede ser consultada en el documento que este comité elabora de forma anual antes del inicio de la temporada epidémica121.
Anualmente, la OMS decide las cepas del virus de la gripe que deben contener las vacunas estacionales. En la temporada 2011-2012 se empleará para el hemisferio norte una vacuna frente a la gripe con la misma composición de cepas que la de la campaña anterior, 2010-2011122. Esta coincidencia no supone ningún cambio en las recomendaciones de vacunación anual y por tanto, se debe recomendar la vacunación aunque la persona se haya vacunado en la temporada 2010-2011.
Con relación a la infancia y a la adolescencia, el CAV-AEP recomienda la vacunación antigripal en:
- 1)
Grupos de riesgo: niños mayores de 6 meses y adolescentes en las siguientes situaciones o enfermedades de base:
- -
Enfermedad respiratoria crónica (por ejemplo, fibrosis quística, displasia broncopulmonar, asma e hiperreactividad bronquial, etc.).
- -
Enfermedad cardiovascular grave (congénita o adquirida).
- -
Enfermedad metabólica crónica (por ejemplo, diabetes, errores congénitos del metabolismo, etc.).
- -
Enfermedad crónica renal (por ejemplo, insuficiencia renal, síndrome nefrótico, etc.) o hepática.
- -
Enfermedad inflamatoria intestinal crónica.
- -
Inmunodeficiencia congénita o adquirida.
- -
Asplenia funcional o anatómica.
- -
Enfermedad oncológica.
- -
Enfermedad hematológica moderada o grave (por ejemplo, hemoglobinopatía, leucemia, etc.).
- -
Enfermedad neuromuscular crónica y encefalopatía moderada-grave.
- -
Malnutrición moderada o grave.
- -
Obesidad mórbida (índice de masa corporal mayor o igual a 3 desviaciones estándar por encima de la media).
- -
Síndrome de Down y otras cromosomopatías graves.
- -
Tratamiento continuado con ácido acetilsalicílico (por riesgo de síndrome de Reye en caso de infección por virus gripal salvaje).
- -
Embarazo en adolescentes.
- -
- 2)
Niños sanos mayores de 6 meses y adolescentes sanos que convivan con pacientes de riesgo.
- -
Se recomienda la vacunación de aquellos niños sanos mayores de 6 meses y adolescentes sanos, sin patología de base, pero que son contactos domiciliarios (convivientes) de pacientes (niños o adultos) pertenecientes a los grupos de riesgo.
- -
- 3)
Adultos en contacto con niños y adolescentes pertenecientes a grupos de riesgo.
- -
Debe insistirse en la vacunación frente a la gripe estacional de todos los adultos que sean contactos domiciliarios (convivientes o cuidadores) de niños y adolescentes que pertenezcan a los grupos de riesgo. Se enfatiza la recomendación de la vacunación antigripal en el personal sanitario que trabaja con niños.
- -
Para el CAV-AEP, la vacunación antigripal en todos estos pacientes y en sus contactos domiciliarios representa un beneficio evidente y constituye una oferta de salud incuestionable.
Dado que los niños son la fuente principal de propagación del virus de la gripe en la comunidad (familia, escuela…)123, ya que eliminan una mayor carga viral y durante más tiempo que los adultos124, que las mayores tasas de incidencia se registran en la población menor de 15 años125 y que la tasa media de hospitalización en menores de 5 años es de alrededor de 1 por 1.000 niños sanos126, el CAV-AEP considera que los niños mayores de 6 meses sanos y no incluidos en los grupos de riesgo anteriormente mencionados pueden vacunarse frente a la gripe estacional si sus padres lo solicitan o su pediatra lo considera oportuno. Esta actitud preventiva constituye, sin duda, una oferta de salud que puede proporcionar al niño o adolescente vacunado una protección individual directa, además de favorecer una protección familiar y comunitaria indirecta.
La vacunación antigripal universal de todos los niños en el momento actual en nuestro medio y con las vacunas disponibles, plantea diversas dudas y algunos inconvenientes: 1) necesidad de añadir anualmente una inyección intramuscular al calendario de vacunaciones, con los problemas inherentes de implementación y aceptabilidad, 2) la efectividad de la vacuna antigripal trivalente inactivada en niños menores de 2 años es limitada y mejorable127, y 3) el coste sería elevado y no existen suficientes datos de eficiencia en la edad pediátrica.
En los niños menores de 9 años que se vacunan por vez primera, para la obtención de una protección óptima frente a la gripe son necesarias 2 dosis de la vacuna, separadas por, al menos, 4 semanas. La primera dosis debe administrarse tan pronto como la vacuna esté disponible, para asegurar que ambas dosis sean recibidas antes del inicio de la actividad gripal, ya que la protección es mayor cuando ambas dosis se administran durante la misma temporada de gripe. Si tienen el antecedente de vacunación antigripal correcta con 2 dosis en alguna temporada anterior, será suficiente entonces con una sola dosis en la temporada actual. Asimismo, si recibieron por primera vez una sola dosis de vacuna antigripal en la temporada anterior (2010-2011), deberán recibir solamente una dosis de vacuna antigripal en la temporada actual (2011-2012)128 por ser idéntica la composición vacunal en ambas campañas122. En niños de 9 años o más es suficiente con una dosis de vacuna antigripal cada temporada, si existe indicación para ello128.
En el momento actual, las únicas vacunas disponibles autorizadas para menores de 18 años en nuestro medio son las trivalentes inactivadas129, procedentes de cultivos en huevos de gallina embrionados, para su administración por vía intramuscular.
Nuevas vacunas antigripalesPara esta temporada 2011-2012 estarán disponibles numerosos preparados comerciales de vacuna frente a la gripe, todos con la misma composición antigénica. Se están incorporando de forma progresiva diversos preparados novedosos (vacunas vivas atenuadas, vacunas adyuvadas, tetravalentes, de cultivos celulares) y con vías de administración alternativas (vía intradérmica, intranasal, etc.). Cabe esperar que la futura disponibilidad de estos preparados en España abra nuevos horizontes en la vacunación antigripal en la edad pediátrica.
Vacunación frente a la hepatitis AEl CAV-AEP recomienda la vacunación frente a la hepatitis A, como profilaxis preexposición, a los niños mayores de 12 meses con elevado riesgo de infección:
- •
Viajeros a países con endemicidad intermedia o alta para la infección por el virus de la hepatitis A, especialmente si son niños inmigrantes que visitan sus países de origen.
- •
Residentes en instituciones cerradas y sus cuidadores.
- •
Síndrome de Down y sus cuidadores.
- •
Receptores de hemoderivados de forma reiterada.
- •
Especialmente indicada en niños y adolescentes con mayor riesgo de hepatitis fulminante en caso de infección por el virus de la hepatitis A, como son los siguientes:
- ∘
Pacientes en espera de trasplante hepático o enfermos con cualquier hepatopatía crónica.
- ∘
Pacientes con serología positiva para el virus de la hepatitis B o C o que estén en tratamiento mantenido con fármacos hepatotóxicos.
- ∘
Las indicaciones como profilaxis postexposición, en los 14 días siguientes a la misma, incluyen:
- •
Contacto domiciliario con un caso agudo de infección por virus de la hepatitis A.
- •
De forma preferente ante la presencia de brotes en guarderías.
La pauta de vacunación en ambos tipos de profilaxis consiste en 2 dosis, a partir de los 12 meses de edad, con un intervalo de, al menos, 6-12 meses entre dosis130. Para los viajeros se recomienda que la primera dosis se administre, al menos, un mes antes del viaje a la zona endémica.
En la mayoría de las CC. AA. de España la vacunación frente a la hepatitis A se recomienda solo de forma selectiva a los grupos de riesgo, excepto en Ceuta y Melilla que incorporaron la vacuna universal a sus calendarios de vacunación en el año 2000. Previamente, Cataluña instauró en 1998 la vacunación universal frente a la hepatitis A en los preadolescentes de 12 años, aplicándola en las escuelas en forma de vacuna combinada frente a hepatitis A y B. Con esta medida la efectividad frente a la hepatitis A ha sido muy importante, con una reducción del 97% en la incidencia de casos en las cohortes vacunadas y con disminuciones importantes en las no vacunadas, probablemente como consecuencia de la inmunidad de grupo, por lo que han decidido mantener el programa hasta el curso 2013-2014, año en el que las cohortes de niños vacunados frente a la hepatitis B en el primer año de vida llegarán al curso en el que se vacuna con el preparado combinado que incluye ambos virus131–134.
De la misma manera que ocurrió con la estrategia selectiva de la vacunación frente a la hepatitis B, la vacunación frente a la hepatitis A de la población de mayor riesgo tendrá muy poco impacto en la incidencia de la enfermedad, ya que solo se puede prevenir un pequeño porcentaje del total de casos. Únicamente la vacunación universal puede reducir de forma significativa el número de casos. Además, al no existir un reservorio no humano, ni infecciones crónicas por el virus de la hepatitis A, la vacunación universal tiene el potencial de la eliminación de la enfermedad de una comunidad o país.
En resumen, el CAV-AEP mantiene la recomendación de vacunar frente a la hepatitis A a las personas de riesgo citadas anteriormente, a la vez que considera que la vacunación de todos los niños podría ser la estrategia óptima para la eventual eliminación de esta enfermedad infecciosa.
Próximas vacunas: meningococo BDesde hace años se están llevando a cabo numerosos estudios para conseguir una vacuna eficaz frente al meningococo B. Las primeras vacunas desarrolladas mostraron una pobre respuesta inmunológica, baja eficacia, especialmente en niños menores de 4 años y escasa protección cruzada frente a cepas heterólogas, por lo que solo se han empleado de forma esporádica.
Las últimas líneas de investigación se basan en técnicas recombinantes y de «vacunología inversa»135. Basándose en estas nuevas tecnologías existen en la actualidad dos vacunas en diferentes fases de desarrollo:
- -
Vacuna antimeningocócica multicomponente del serogrupo B (rMenB-OMV o 4CMenB), del laboratorio Novartis. Tras la finalización de los ensayos clínicos esta vacuna fue presentada en diciembre de 2010 para su autorización en la EMA. Contiene varios antígenos relacionados con la patogenicidad (fHbp, NadA y NHBA), combinados con vesículas de membrana externa de la vacuna utilizada en Nueva Zelanda (cepa 98/254), como inmunomodulador. Los datos presentados se basan en diversos ensayos clínicos efectuados en más de 8.000 lactantes, niños pequeños, adolescentes y adultos. La pauta de primovacunación empleada consta de 3 dosis (2, 4, 6 meses). Los resultados de los ensayos muestran que la vacuna induce una buena respuesta inmunológica en lactantes, cuando se administra sola o en combinación con otras vacunas de calendario, con una tolerabilidad aceptable. Es igualmente inmunógena cuando se administra como refuerzo en el segundo año de vida a niños previamente vacunados o después de 2 dosis administradas entre los 12 y 15 meses con un intervalo de 2 meses entre ambas, en niños que no han recibido ninguna dosis previa. También genera una potente respuesta inmunológica en adolescentes y adultos. Datos recientes indirectos indican que esta vacuna puede proporcionar protección frente al 75-80% de las cepas del meningococo B causantes de enfermedad invasora en Europa136.
- -
La otra vacuna en desarrollo, de los laboratorios Pfizer, es un preparado bivalente compuesto por 2 variantes (A05 y B01) del grupo de lipoproteínas de membrana externa, designadas como LP2086. Los ensayos clínicos realizados en los adolescentes y adultos muestran una buena respuesta inmunológica tras la administración de 2 dosis. No se dispone todavía de los resultados de los ensayos clínicos con esta vacuna en la población pediátrica137.
En resumen, parece que puede estar próxima la aparición y comercialización de vacunas eficaces frente al meningococo B. Se trata de preparados con perfil de vacuna sistemática, aunque será preciso confirmar la cobertura de las cepas circulantes en nuestro medio.
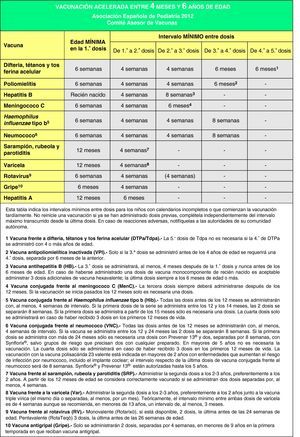
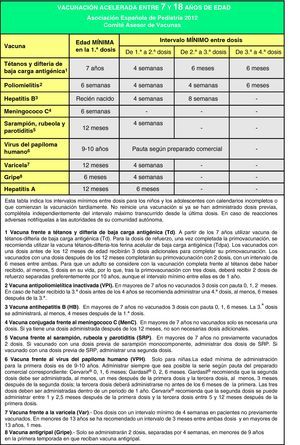
Calendarios acelerados de vacunación para niños y adolescentes con vacunación incompletaEn muchas ocasiones es necesario vacunar a niños que no han recibido vacunas previamente o que no han seguido un calendario de vacunaciones de forma regular, lo han iniciado tardíamente, lo han interrumpido o han sido vacunados en sus países de origen con una pauta diferente a la indicada en España. En todos estos niños se debe realizar una adaptación al calendario de vacunación vigente. Se han elaborado unas tablas para orientar en la realización de pautas de vacunación acelerada en niños y adolescentes con inmunización incompleta (figs. 3, 4 y 5).
El objetivo de estos calendarios acelerados es que sean un instrumento de ayuda para los pediatras en su práctica diaria. Se basan en recomendaciones de diversas sociedades científicas y de expertos, y para interpretarlos deben tenerse en cuenta las siguientes premisas138,139:
- •
Edad del niño y, en función de ella, el número de dosis necesarias para estar correctamente vacunado (fig. 3). Las dosis administradas previamente, si las hubiese, deben considerarse válidas siempre que respeten la edad mínima y el intervalo entre las dosis. No se reiniciará una pauta de vacunación si el niño ha recibido dosis previas válidas. Para actualizar el calendario se establecerán las dosis necesarias en función de la edad y se restarán las que ya hubiese recibido; el resultado serán las dosis necesarias para poner al día el calendario de vacunas.
- •
Se considerarán válidas las dosis que estén correctamente registradas o identificadas. En los casos en los que no hubiese ninguna prueba documentada de las vacunas administradas y por interrogatorio no se pudiese establecer fehacientemente qué vacunas ha recibido un individuo, podrá optarse por administrar todas las vacunas adecuadas a la edad, como si se tratase de un paciente no vacunado.
- •
Debe respetarse el intervalo mínimo entre dosis para obtener una adecuada respuesta inmunológica y considerar la vacunación como válida. La aplicación de estos intervalos permite completar cuanto antes el calendario de vacunación (pauta acelerada) y alcanzar rápidamente un estado de inmunización adecuado. A partir de ese momento será preferible no utilizar los intervalos mínimos para continuar la vacunación, respetando los intervalos habituales recomendados.
- •
Se administrarán de forma simultánea todas las vacunas posibles en lugares anatómicos distintos. Se utilizarán preferentemente vacunas combinadas (para disminuir el número de inyecciones). En caso de que, por distintos motivos, no se pudieran administrar todas las vacunas simultáneamente (reticencia del niño, sus padres o tutores, número elevado de dosis pendientes o no disponibilidad de algún preparado comercial) y se considere que el niño volverá a la consulta por tener un domicilio estable, se administrarán primero las vacunas que inmunicen frente a la patología de mayor riesgo con relación a la edad del niño y a la epidemiología de su entorno y las que lo inmunicen frente a enfermedades para las que no hubiese recibido ninguna dosis previa de vacuna.
En las figs. 4 y 5 se muestran los intervalos mínimos y el número de dosis necesarias de las vacunas recomendadas por el CAV-AEP para niños entre 4 meses y 6 años, y para niños y adolescentes entre los 7 y los 18 años de edad, respectivamente. Para una correcta comprensión de la figura es necesario leer el pie de la misma, ya que la información allí expresada aclara algunos aspectos que hacen referencia a situaciones específicas.
Conflicto de interesesD. Moreno-Pérez ha colaborado en actividades docentes subvencionadas por GlaxoSmithKline, Pfizer y Sanofi Pasteur MSD, como investigador en ensayos clínicos de GlaxoSmithKline y como consultor en un Advisory Board de Astra-Zeneca.
F. J. Álvarez García ha colaborado en actividades docentes subvencionadas por GlaxoSmithKline, Pfizer y Sanofi Pasteur MSD.
J. Arístegui Fernández ha colaborado en actividades docentes y como investigador en ensayos clínicos subvencionados por GlaxoSmithKline, Pfizer y Sanofi Pasteur MSD.
F. Barrio Corrales ha colaborado en actividades docentes subvencionadas por GlaxoSmithKline y Sanofi Pasteur MSD y como investigador en ensayos clínicos de GlaxoSmithKline y Baxter.
M. J. Cilleruelo Ortega ha colaborado en actividades docentes subvencionadas por GlaxoSmithKline, Pfizer y Sanofi Pasteur MSD y como investigadora en ensayos clínicos de Pfizer.
J. M. Corretger Rauet ha colaborado en actividades docentes subvencionadas por GlaxoSmithKline, Sanofi Pasteur MSD y Novartis.
J. González-Hachero ha colaborado en actividades docentes subvencionadas por GlaxoSmithKline, Pfizer, Sanofi Pasteur MSD.
T. Hernández-Sampelayo Matos ha colaborado en actividades docentes subvencionadas por Pfizer, Sanofi Pasteur MSD.
M. Merino Moína ha colaborado en actividades docentes subvencionadas por GlaxoSmithKline, Pfizer y Sanofi Pasteur MSD y como investigador en ensayos clínicos de GlaxoSmithKline, Pfizer y Sanofi Pasteur MSD.
L. Ortigosa del Castillo ha colaborado en actividades docentes subvencionadas por GlaxoSmithKline, Pfizer y Sanofi Pasteur MSD y como investigador en ensayos clínicos de GlaxoSmithKline.
J. Ruiz-Contreras ha colaborado en actividades docentes subvencionadas por GlaxoSmithKline, Pfizer y Sanofi Pasteur MSD y como investigador en ensayos clínicos de GlaxoSmithKline y Pfizer.
David Moreno-Pérez, Francisco José Álvarez García, Javier Arístegui Fernández, Francisco Barrio Corrales, M. José Cilleruelo Ortega, José María Corretger Rauet, José González-Hachero, Teresa Hernández-Sampelayo Matos, Manuel Merino Moína, Luis Ortigosa del Castillo y Jesús Ruiz-Contreras.
Composición del Comité Asesor de Vacunas de la Asociación Española de Pediatría.